2. 400038 重庆, 陆军军医大学(第三军医大学)军事预防医学系: 火箭军医学教研室;
3. 610041 成都, 四川省肿瘤医院.研究所, 四川省癌症防治中心, 电子科技大学医学院, 放射肿瘤学四川省重点实验室
2. Department of Rocket Force Medicine, College of Preventive Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Sichuan Provincial Key Laboratory of Radiation Oncology, Sichuan Cancer Hospital & Institute, Sichuan Provincial Cancer Center, School of Medicine, University of Electronic Science and Technology of China, Chengdu, Sichuan Province, 610041, China
肠道干细胞是哺乳动物肠上皮维持快速更新的细胞学基础,肠道干细胞稳态维持受到潘氏细胞、巨噬细胞等微环境细胞提供的多种分子信号调控[1]。电离辐射、炎症等因素很容易对肠道干细胞及其微环境细胞造成损伤,从而导致机体出现腹泻、感染等临床症状[2]。肿瘤能够对机体产生多方面的影响,包括对原发脏器、转移脏器的影响,此外肿瘤还可通过外泌体等多种生物活性物质作用于其他脏器[3-4]。肺癌是我国最常见的肿瘤类型,以往对肺癌的研究主要集中在肺癌发生和转移相关领域。随着系统生物学的发展,肺肠轴交互作用正成为近期肺癌研究的新热点[5]。如研究表明肠道菌群等肠道因素能够影响肺癌的临床治疗效果[6-7],但目前肺癌是否影响肠道干细胞及其微环境尚不清楚。因此,本研究建立稳定了Lewis肺腺癌(Lewis lung cancer,LLC)小鼠动物模型,并使用该模型和肠类器官培养技术观测Lewis肺腺癌对小鼠肠道组织形态、细胞增殖动力学、肠道干细胞及其微环境相关基因、细胞紧密连接和炎症因子表达的影响,探讨肺腺癌是否导致肠道干细胞及其微环境破坏,为深入认识肺癌进展过程中肺肠轴交互作用提供新的实验基础。
1 材料与方法 1.1 实验动物C57BL/6J雄性小鼠购自北京华阜康生物科技有限公司,8~12周龄,体质量18~22 g,于本实验室SPF动物房中饲养。动物实验符合陆军军医大学实验动物伦理委员会相关要求。按接种方式分为皮下接种组和静脉接种组,以未接种的小鼠作为正常对照组。
1.2 细胞系小鼠Lewis肺腺癌细胞株(LLC细胞)购自中科院上海细胞库(目录号:TCM 7),由本实验室保存。用高糖DMEM培养基(HyClone公司)并添加10%胎牛血清(BI公司)进行培养,同时加入1%青霉素-链霉素双抗(碧云天公司)防止细菌污染。大鼠空肠隐窝上皮细胞株IEC-6由本实验保存。每2天换液,保持细胞处于旺盛生长状态。
1.3 细胞培养及接种动物LLC细胞接种于10 cm平皿,生长至80%融合后收集细胞,调整细胞悬液体积使细胞数为1×107/mL。1%戊巴比妥钠麻醉小鼠,消毒后皮下接种组在小鼠右腋皮下注射0.1 mL细胞悬液,轻压进针处防止液体流出。静脉接种组向0.1 mL细胞悬液中加入0.2 mL无血清培养基并混匀,经小鼠尾静脉缓慢注入LLC细胞,按压进针处防止液体漏出。接种后21 d取材。
1.4 LLC细胞条件培养基制备与注射按1×106/孔接种LLC细胞,待LLC细胞生长至80%融合时,更换为含1% FBS的DMEM培养基(LLC组)。空白孔内加入同样培养基作为对照组(Control)。培养3 d后收集培养基。0.22 μm孔径针式滤器进行过滤后用1.5 mL离心管分装并于-20 ℃冰箱保存。小鼠每天经尾静脉注射0.3 mL LLC条件培养基(LLC-CM组)或对照培养基(对照组),连续注射5 d后取材。
1.5 肠类器官培养颈椎脱臼处死小鼠,酒精消毒腹部皮肤后分离中段小肠,使用预冷PBS冲洗肠腔内容物,纵向剖开肠管,将小肠剪成2~3 mm小块组织,加入5 mmol/L EDTA/PBS溶液后冰浴30 min。移去EDTA溶液,预冷PBS洗涤组织2次,用吸管吹打组织释放肠隐窝。70 μm孔径细胞筛过滤悬液,按照每10 μL Matrigel中100个隐窝进行重悬并接种。LLC共培养使用6孔板,板内或Transwell小室内接种1×106 LLC细胞。LLC-CM实验使用96孔板接种。分别加入正常(对照组)和含有25%、50% LLC-CM(LLC-CM组)的小鼠肠类器官培养基进行实验。
1.6 组织取材与染色取材前90 min腹腔注射BrdU。小肠组织经中性甲醛固定过夜,常规脱水石蜡包埋并切片。石蜡切片脱蜡至水后进行HE染色或免疫染色。pH=6.0枸橼酸盐缓冲液煮沸15 min进行抗原修复,含1% Triton X-100的封闭液室温封闭30 min,滴加大鼠抗BrdU抗体(1 :200,Abcam公司)、兔抗ZO-1抗体(1 :500,ProteinTech公司)、山羊抗Lysozyme抗体(1 :500,Santa Cruz公司),4 ℃孵育过夜。PBS洗去未结合一抗后加入AlexFluo 488或594荧光二抗(1 :1000),室温避光孵育30 min。洗去未结合二抗并复染DAPI封片。
1.7 EdU染色将盖玻片置于12孔板底部,接种IEC-6细胞到孔板内进行培养,待细胞生长至80%后用于实验。实验组在培养基中加入终浓度为25%的LLC-CM,对照组加入同等体积对照培养基,作用24 h后进行染色。EdU染色试剂盒购自广州锐博生物科技有限公司(C10310-1),具体染色流程按试剂盒操作说明进行。
1.8 定量PCR检测肠组织经液氮速冻后保存于-80 ℃冰箱。使用RNAiso裂解组织并提取RNA,经Nano2000测定RNA浓度与纯度。用TaKaRa公司PrimeScriptTM RT reagent Kit with ɡDNA Eraser进行反转录获取cDNA。引物由华大基因公司进行合成,序列见表 1。使用SYBRⓇ Premix Ex TaqTM Ⅱ配制反应液,Bio-Rad荧光定量PCR仪进行扩增和检测。PCR反应程序为:95 ℃预变性5 min,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40次循环。获取样本对应基因的Ct值,按照2-△△Ct法进行数据处理,使用β-actin作为内参基因。
| 基因名称 | 正义链(5′→3′) | 反义引物(5′→3′) | 产物/bp |
| Lgr5 | CTCCCAGGTCTGGTGTGTTG | GAGGTCTAGGTAGGAGGTGAAG | 149 |
| Olfm4 | ACTGTCCGAATTGACATCATGG | TTCTGAGCTTCCACCAAAACTC | 135 |
| Axin2 | AGTGCAAACTCTCACCCACC | TCGCTGGATAACTCGCTGTC | 196 |
| Mki67 | ACGCCTGGTTACTATCAAAAGG | CAGACCCATTTACTTGTGTTGGA | 208 |
| Tjp1 | GCCTTGGCCTAGCATACACA | GGTAAGGCATTCCTGCTGGT | 288 |
| Ocln | TCCGGCCGCCAAGGTTC | CATAGCCTCTGTCCCAAGCAA | 360 |
| Il1b | ACCTCACAAGCAGAGCACAA | TTGGCCGAGGACTAAGGAGT | 200 |
| Tnf-α | ATGGCCTCCCTCTCATCAGT | TTTGCTACGACGTGGGCTAC | 97 |
| Wnt3 | TGGAACTGTACCACCATAGATGAC | ACACCAGCCGAGGCGATG | 103 |
| Bhlha15 | GCTGACCGCCACCATACTTAC | TGTGTAGAGTAGCGTTGCAGG | 178 |
| Lyz1 | ATGGAATGGCTGGCTACTATGG | ACCAGTATCGGCTATTGATCTGA | 310 |
| β-actin | GGCTGTATTCCCCTCCATCG | CCAGTTGGTAACAATGCCATGT | 154 |
1.9 图像采集及数据统计学分析
使用Olympus BX51显微镜采集细胞和明场图像,使用Leica LSM SP5共聚焦显微镜采集荧光染色图像。使用Image J软件测定小肠组织形态学指标。使用GraphPad Prism 7.0进行数据统计分析,两组间数据比较采用t检验,检验水准α=0.05。
2 结果 2.1 静脉移植LLC细胞较皮下移植更容易形成肺腺癌LLC细胞对C57BL/6J小鼠进行右腋皮下荷瘤和尾静脉移植荷瘤21 d后取材。静脉接种组荷瘤小鼠在21 d时大体状况良好,体质量较正常对照组小鼠无明显差异,未见肿瘤所致恶病质样改变。取材时皮下接种组小鼠肿瘤直径可达1.5~2 cm,但肺部大体观察未见明显肿瘤,而静脉接种组小鼠肺部均可形成肿瘤组织,成瘤率达100%。HE染色可见静脉接种组荷瘤小鼠肺部有明显肿瘤生长(图 1)。证实静脉接种LLC细胞较皮下接种更容易形成肺腺癌,本课题后续实验均采用静脉接种荷瘤方式。

|
| ↑:示肺部肿瘤 图 1 皮下和静脉接种LLC细胞21d后小鼠肺大体形态和HE染色观察 |
2.2 肺腺癌促进肠隐窝细胞增殖但抑制肠道干细胞相关基因表达
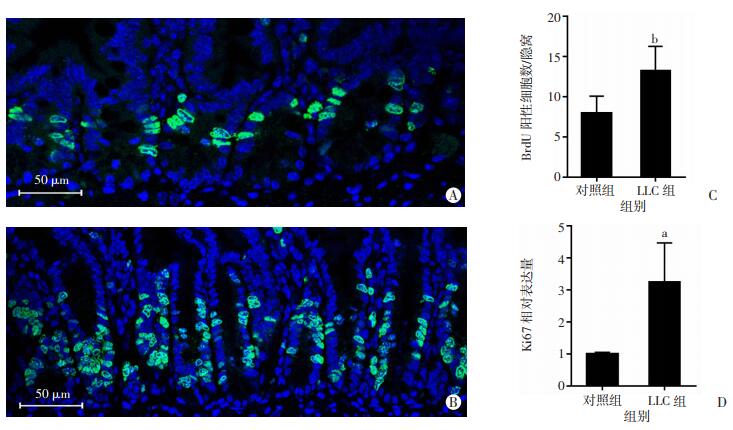
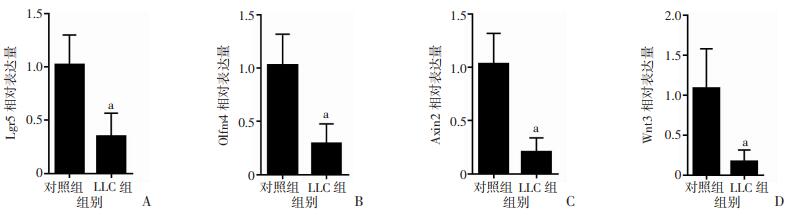
LLC组和对照组小肠HE染色见图 2A,两组肠隐窝密度差异无统计学意义(P>0.05,图 2B)。LLC组肠隐窝深度为(118.2±1.5)μm,显著高于对照组[(80.9±1.5)μm,P < 0.01,图 2C]。LLC组肠绒毛长度为(262.5±6.9)μm,显著长于对照组[(222.1±3.6)μm,P < 0.01,图 2D]。BrdU染色结果显示LLC组小鼠(图 3A)肠隐窝中BrdU阳性细胞多于对照组(图 3B),两组差异有统计学意义(P < 0.01,图 3C)。LLC组小肠增殖细胞标志物Ki67基因的mRNA水平显著高于对照组(P < 0.05,图 3D)。qPCR结果证实肺腺癌组肠道干细胞标志物基因Lgr5、Olfm4和Axin2较对照组明显降低,同时维持肠道干细胞所需的Wnt3基因mRNA含量也显著降低(P < 0.05,图 4)。结果证实肺腺癌导致小鼠肠隐窝细胞增殖水平增加,但肠道干细胞活性显著降低。

|
| A:HE染色观察小肠组织形态;B:肠隐窝密度分析;C:肠隐窝深度分析;D:肠绒毛长度分析 a: P < 0.01,与对照组比较 图 2 两组小肠组织形态和肠隐窝密度、深度及绒毛长度变化(n=3) |
|
| A:对照组BrdU染色;B:LLC组BrdU染色;C:BrdU阳性细胞数统计分析b:P < 0.01,与对照组比较;D:Ki67基因的mRNA含量 a: P < 0.05,与对照组比较 图 3 两组肠上皮细胞增殖能力比较 |
|
| A:Lgr5;B:Olfm4;C:Axin2;D:Wnt3 a: P < 0.05,与对照组比较 图 4 qPCR检测两组小鼠肠道干细胞及微环境相关基因表达 |
2.3 肺腺癌破坏肠上皮细胞紧密连接
ZO-1(TJP1)免疫荧光染色证实肺腺癌小鼠肠绒毛ZO-1染色强度较正常小鼠明显减弱,同时肠隐窝底部潘氏细胞溶菌酶(Lysozyme)的阳性信号也减弱(图 5A、B)。qPCR检测结果证实肺腺癌小鼠肠组织中的TJP1和OCLN基因的mRNA含量较对照组显著降低(图 5C、D,n=3)。本结果证实肺腺癌可引起小鼠肠上皮细胞间的紧密连接蛋白和其mRNA水平降低,提示肺腺癌可导致肠黏膜通透性降低。

|
| A:对照组ZO-1免疫荧光染色;B:LLC组ZO-1免疫荧光染色;C:TJP1基因mRNA含量 a: P < 0.05,与对照组比较;D:OCLN基因mRNA水平 b:P < 0.01,与对照组比较 图 5 两组小鼠肠黏膜通透性及肠组织中TJP1和OCLN mRNA水平(n=3) |
2.4 肺腺癌小鼠肠道炎症因子表达水平增加
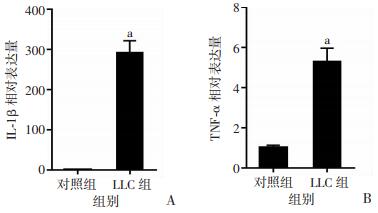
qPCR检测肺腺癌小鼠肠组织中促炎因子的表达情况,结果显示肺腺癌小鼠肠道内促炎因子IL-1β和TNF-α的mRNA含量显著增加(P < 0.01,图 6)。表明肺腺癌能够增加肠道炎症反应,这可能是肺腺癌损伤肠道干细胞微环境的机制之一。
|
| A:IL-1β;B:TNF-α a: P < 0.01,与对照组比较 图 6 肺腺癌小鼠肠组织中炎症因子mRNA水平增加(n=3) |
2.5 LLC细胞抑制肠类器官生长
肠类器官是研究肠道干细胞的理想体外模型,因此本课题使用LLC细胞与肠类器官共培养评价肺腺癌对肠道干细胞的影响。实验结果显示正常小鼠肠隐窝能够在培养后6 d形成肠类器官(图 7A),但在培养体系中加入LLC细胞会显著减少肠类器官形成(图 7B)。将LLC细胞接种到Transwell小室与肠隐窝进行共培养,同样发现肠类器官显著减少(图 7C)。统计结果显示LLC细胞直接共培养24 h可显著降低肠类器官形成效率(P < 0.01, 图 7D)。因此,LLC细胞对肠类器官生长具有抑制作用。

|
| A:肠隐窝单独培养6 d;B:肠隐窝与LLC细胞共培养6 d;C:肠隐窝与Transwell小室内LLC细胞共培养6 d;D: LLC直接与肠隐窝共培养24 h抑制肠类器官形成a: P < 0.01,与对照组比较 图 7 LLC肺腺癌细胞抑制肠类器官体形成 |
2.6 LLC-CM促进肠上皮细胞增殖并抑制肠类器官生长
对正常小鼠连续5 d经尾静脉分别注射LLC-CM和对照培养基,结果显示LLC-CM组肠隐窝平均深度为(88.7±0.9)μm,显著高于对照组[(74.6±0.7)μm,P < 0.01,图 8A]。向肠上皮细胞株IEC-6中加入25% LLC-CM培养24 h可显著增加EdU阳性细胞数量(P < 0.01,图 8B)。使用LLC-CM培养肠类器官细胞时,培养体系中加入25%和50% LLC-CM培养3 d后肠类器官体积明显减小(图 8C),接种后24 h形成肠类器官效率明显降低(P < 0.01,图 8D)。因此,LLC-CM与Lewis肺腺癌具有相同的体内体外效应。

|
| A: LLC-CM增加小鼠肠隐窝深度;B: LLC-CM作用24 h增加EdU阳性IEC-6细胞数量;C:LLC-CM中培养3 d肠类器官体积减小;D: LLC-CM作用24 h可降低肠类器官形成效率a: P < 0.01,与对照组比较 图 8 LLC-CM对小鼠肠道、IEC-6细胞和肠类器官生长的影响 |
3 讨论
肺癌是临床最常见的肿瘤,其中肺腺癌等非小细胞肺癌(non-small cell lung cancer, NSCLC)约占全部肺癌病例的80%。以往观点主要认为肺癌发生后会引起肺通气功能下降,进而引发机体多脏器处于缺氧状态[8]。最近研究提示肺癌与机体肠道之间存在复杂的相互作用,本研究主要探讨Lewis肺腺癌对肠道干细胞及其微环境的影响。
Lewis肺腺癌细胞株LLC细胞来源于C57BL/6J小鼠,是目前建立小鼠肺腺癌动物模型所使用的主要细胞类型[9]。多使用该细胞株进行右腋皮下接种来研究LLC细胞对机体的相应影响,本研究发现皮下接种LLC细胞后原位肿瘤生长速度很快,但小鼠肺部并不能形成明显肿瘤,不能很好地模拟肺腺癌对肠道的影响;而静脉接种的成瘤率达到100%,解剖后可见肺脏表面有明显肿瘤生长,部分呈亮泡状,HE染色可见典型的肿瘤组织。因此,本研究使用静脉接种LLC细胞建立肺腺癌动物模型。
肠上皮细胞始终处于快速更新状态,位于肠隐窝底部的Lgr5阳性活跃肠干细胞是正常肠上皮更新的主要动力来源。本研究发现,肺腺癌小鼠体内肠干细胞相关基因Lgr5、Olfm4、Axin2的mRNA水平明显下降。Wnt3是维持肠道干细胞的重要生长因子,其mRNA含量也显著降低,因此肺腺癌可抑制肠道干细胞及其微环境相关基因表达。肠类器官作为一种评估肠道干细胞功能的新方法目前已经广泛使用[10-11],本实验结果证实LLC细胞与肠类器官共培养时,肠类器官生长受到明显抑制。因此,体内和体外结果均支持肺腺癌能够抑制肠道干细胞活性这一结论。在肺腺癌抑制肠道干细胞活性的同时,Lewis肺腺癌小鼠和注射LLC-CM小鼠的肠隐窝中BrdU阳性细胞数量均明显增加。我们推测这可能是由于肿瘤导致肠道干细胞活性降低时,位于隐窝中上部的前体细胞通过增加自身增殖代偿性补充肠上皮细胞更新所致。
小肠上皮结构和功能的完整性是机体隔离肠腔内病原体的重要屏障,紧密连接是肠上皮细胞间的主要连接类型。组成紧密连接的两种主要成分是ZO-1和Occludin蛋白,本实验结果和文献[8]报道证实Lewis肺腺癌可导致ZO-1染色强度降低,qPCR结果证实TJP1和OCLN基因的mRNA表达水平下降。此外,我们还发现Lewis肺腺癌组肠道中促炎因子IL-1β和TNF-α较正常小鼠显著增加。肠上皮细胞间紧密连接的减少和炎症反应增加会引起肠黏膜通透性增加,肠道菌群及其代谢产物入血引发机体感染的概率随之上升[12-13]。目前肿瘤外分泌领域特别是肿瘤外泌体的研究报道越来越多[14],本研究使用LLC-CM处理小鼠、IEC-6肠上皮细胞株和肠类器官都取得和肺腺癌小鼠相似的实验结果。因此,我们推测肺腺癌细胞的外泌体可能是其引起肠道干细胞微环境效应的主要成分,本课题组将在后续研究中纯化LLC细胞外泌体并开展相关研究。
综上,本研究发现,Lewis肺腺癌可抑制肠道干细胞活性并引起肠黏膜屏障改变,为深入认识临床肺癌患者胃肠道症状提供了新的实验依据,并为通过改善胃肠道功能来辅助肿瘤患者临床治疗提供了新线索。
| [1] |
GEHART H, CLEVERS H. Tales from the crypt: new insights into intestinal stem cells[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(1): 19-34. DOI:10.1038/s41575-018-0081-y |
| [2] |
STACEY R, GREEN J T. Radiation-induced small bowel disease: latest developments and clinical guidance[J]. Ther Adv Chronic Dis, 2014, 5(1): 15-29. DOI:10.1177/2040622313510730 |
| [3] |
SAITO M, SUZUKI H, KONO K, et al. Treatment of lung adenocarcinoma by molecular-targeted therapy and immunotherapy[J]. Surg Today, 2018, 48(1): 1-8. DOI:10.1007/s00595-017-1497-7 |
| [4] |
SCHAAIJ-VISSER T B, DE WIT M, LAM S W, et al. The cancer secretome, current status and opportunities in the lung, breast and colorectal cancer context[J]. Biochim Biophys Acta, 2013, 1834(11): 2242-2258. DOI:10.1016/j.bbapap.2013.01.029 |
| [5] |
KNAPP S. Gut to lung[J]. Gut, 2016, 65(4): 544-545. DOI:10.1136/gutjnl-2015-310599 |
| [6] |
GUI Q F, LU H F, ZHANG C X, et al. Well-balanced commensal microbiota contributes to anti-cancer response in a lung cancer mouse model[J]. Genet Mol Res, 2015, 14(2): 5642-5651. DOI:10.4238/2015.May.25.16 |
| [7] |
JIN Y P, DONG H, XIA L L, et al. The diversity of gut microbiome is associated with favorable responses to anti-programmed death 1 immunotherapy in Chinese patients with NSCLC[J]. J Thorac Oncol, 2019, 14(8): 1378-1389. DOI:10.1016/j.jtho.2019.04.007 |
| [8] |
郭娜娜, 刘学军, 杜毓峰, 等. 肺癌对肠黏膜屏障的损伤机制[J]. 当代医学, 2018, 24(9): 11-13. GUO N N, LIU X J, DU Y F, et al. Damage mechanism of intestinal mucosal barrier in mouse lung cancer model[J]. Contemp Med, 2018, 24(9): 11-13. DOI:10.3969/j.issn.1009-4393.2018.09.004 |
| [9] |
韩潇, 刘登群, 罗丹, 等. 骨髓嵌合促进Lewis肺腺癌细胞体内生长及转移的实验研究[J]. 第三军医大学学报, 2018, 40(21): 1932-1935. HAN X, LIU D Q, LUO D, et al. Bone marrow transplantation promotes tumor growth and lung metastasis in C57BL/6 subcutaneouos tumor-bearing mice[J]. J Third Mil Med Univ, 2018, 40(21): 1932-1935. DOI:10.16016/j.1000-5404.201808111 |
| [10] |
SATO T, CLEVERS H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications[J]. Science, 2013, 340(6137): 1190-1194. DOI:10.1126/science.1234852 |
| [11] |
欧静, 徐珍妮, 刘登群, 等. 3D培养体系中不同肠上皮细胞株形成肠类器官潜能的比较及应用[J]. 第三军医大学学报, 2020, 42(1): 31-38. OU J, XU Z N, LIU D Q, et al. Potential capacities of different intestinal epithelial cell lines to form enteroids in 3D culture system: comparison and application[J]. J Third Mil Med Univ, 2020, 42(1): 31-38. DOI:10.16016/j.1000-5404.201907198 |
| [12] |
LYONS J D, MITTAL R, FAY K T, et al. Murine lung cancer increases CD4+ T cell apoptosis and decreases gut proliferative capacity in Sepsis[J]. PLoS ONE, 2016, 11(3): e0149069. DOI:10.1371/journal.pone.0149069 |
| [13] |
MITTAL R, CHEN C W, LYONS J D, et al. Murine lung cancer induces generalized T-cell exhaustion[J]. J Surg Res, 2015, 195(2): 541-549. DOI:10.1016/j.jss.2015.02.004 |
| [14] |
HESSVIK N P, LLORENTE A. Current knowledge on exosome biogenesis and release[J]. Cell Mol Life Sci, 2018, 75(2): 193-208. DOI:10.1007/s00018-017-2595-9 |



