2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院:生理学教研室,脑与智能研究院;
3. 400038 重庆,陆军军医大学(第三军医大学)基础医学院:学员2大队7营
2. Department of Physiology, Institute of Brain and Intelligence. College of Basic Medical Sciences, Army Medical University (Third Military Medical University),Chongqing, 400038, China;
3. Squadron 7, Battalion 2, Army Medical University, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
联合型学习是将不同时间发生的事件刺激联系起来,进而指导产生适应性行为反应的一种能力。这种联合型学习(associative learning)能力是人和动物生存所必需的脑高级功能。在精神分裂症、自闭症等疾病状态下,该学习功能会发生早期损害[1-2]。因此,对联合型学习行为的细胞和分子机制研究,将为上述疾病的早期诊断和治疗效果判断提供重要帮助。经典眨眼条件反射是研究联合型学习的一种常用行为模型[3]。该反射训练需要将条件刺激(conditioned stimulus, CS, 如闪光)和非条件刺激(unconditioned stimulus, US,如角膜吹气)反复强化配对,使动物学会一个针对CS的条件性眨眼反应(conditioned eyeblink response, CR),以躲避US产生的角膜伤害。根据CS和US的出现是否存在时间上的间隔,该反射可被进一步区分为延迟性眨眼条件反射(delay eyeblink conditioning,dEBC即CS和US之间有时间重叠)和痕迹性眨眼条件反射(trace eyeblink conditioning, tEBC即CS和US之间存在时间间隔)两种模式。既往研究认为,dEBC建立仅依赖小脑的参与[4],而tEBC的建立需要前额叶皮层[5]、海马[6]和小脑[7]的共同参与。本课题组前期工作发现:在tEBC训练中前额叶皮层与小脑之间的同步活动增强[5]。但小脑参与tEBC建立的神经机制目前仍不完全清楚。小脑皮层是整合外界刺激信息和输出运动指令的关键脑区[8]。因此,解析小脑皮层神经元在tEBC训练中的活动及其特征,将有助于全面揭示小脑皮层参与联合型学习的神经机制。而利用在体多通道记录技术检测和分析群体神经元的放电活动,则是实现高时间精度解析小脑皮层神经元网络活动特征的必备手段。同时,由于给予CS和US的需要,既往关于tEBC的研究多在头部固定的动物上开展,不可避免地会引起诸如应激等不可控效应[5-7]。因此,理想的情况是在自由活动的动物开展训练,并在此条件下研究tEBC发生的神经机制。本课题组近期实现了自由活动小鼠的tEBC行为训练和同步的在体多通道神经元放电记录[9]。在此基础上,本实验拟探究在tEBC建立的不同阶段中小脑皮层神经元群体放电活动的动态变化,并为后期全面揭示大脑-小脑相互作用在联合型学习中的作用及其机制奠定基础。
1 材料与方法 1.1 实验动物选用3~5月龄C57BL/6雄性小鼠8只,体质量23~30 g,由陆军军医大学实验动物中心提供。从手术前2 d起至全部实验完成期间,小鼠均单笼饲养在24 h循环灯照的室温条件下,自由进水和饮食。
1.2 手术流程用异氟烷(浓度:1.0%~1.5%,时间:10 min)诱导麻醉小鼠。诱导麻醉完成后,将动物固定于脑立体定位仪上。去除动物颅顶部皮肤上的毛发,并进行常规消毒。用眼科剪沿颅骨中线依次剪开皮肤以及皮下组织,暴露小脑至大脑前囟上方颅骨。用弹簧剪、尖镊分离颅骨表面软组织。将10%双氧水擦拭颅骨表面,充分显露颅骨骨性标志。利用脑立体定位仪测量前后囟高度,确保颅骨水平。在右侧小脑上方以及右侧大脑皮层上方,使用颅钻开2个直径为0.5 mm的圆形小孔,植入2颗已消毒的不锈钢螺钉,并焊接地线与参考线。从小鼠左侧上眼睑轮匝肌的中后部,等距离穿刺2根不锈钢钢丝(no. 791000, A-M Systems, 美国)作为肌电信号记录电极。配取Metabond水泥(Parkell, 日本)将不锈钢螺钉和肌电电极固定于颅骨表面,并将4张三角形铜网粘附于Metabond水泥上方。使用颅钻在左侧小脑上方(坐标:前囟后6.3 mm,左侧旁开1.7 mm)打磨出边长为1 mm的方形骨窗,挑开硬脑膜。利用脑立体定位臂,植入多通道记录电极至小脑皮层,初始深度为1.5 mm。使用牙科水泥固定电极底座,将低黏度硅胶覆于盖骨窗。收拢铜网,并将用于给予CS的LED光源以及通气管接口固定于铜网上。最后,用牙科水泥加固铜网底部。在手术过程中,全程使用恒温加热垫维持体温。术后小鼠需要5~7 d的恢复。在此期间,通过微推进器将记录电极尖端以70 μm/d的速度缓慢向目标区域推进,直到可以稳定地记录到小脑皮层神经元的放电活动。
1.3 行为训练训练周期包括2 d适应期和5 d的tEBC训练。在适应期间,将小鼠置于声光屏蔽的行为训练箱内(45 cm × 25 cm × 20 cm)。其头顶部连接16通道前置放大器和肌电记录线,铜网上连接LED光源和气管导管。受试小鼠在暗环境下自由探索训练环境,适应时长约为40 min/d,期间不给予任何刺激。
tEBC训练在适应期结束后开始。tEBC习得训练期间,将受试小鼠置于适应期间相同训练环境下。条件刺激(conditioned stimulus, CS)是1个持续150 ms的蓝光脉冲,非条件刺激(unconditioned stimulus, US)是一个压强0.6 psi,持续100 ms的气流。将一气管导管固定于受试动物左侧眼角膜前0.5~1.0 cm,用来释放US。从CS结束到US开始的刺激间期时长为250 ms。小鼠每天接受100次CS和US的配对训练,每次配对训练的时间间隔为18~23 s。
1.4 数据记录与分析在连续5 d的tEBC训练过程中,持续记录小鼠小脑皮层神经元的活动。主要记录方法和流程参照课题组近期工作[10]:采集的神经元放电信号通过前置放大器(C3334, Intan Technonlogies,美国)以20 kHz的采样频率传输至多道数据记录仪(RHD2000, Intan Technologies,美国)。反映上眼睑活动的肌电差分信号采集带宽为150~1 000 Hz,增益1 000倍。所有信号以数字信号形式进行储存。记录到的数据均使用NeuroScope软件实现可视化观察。
在离线(off-line)状态下对神经元单位放电原始信号进行高通滤波处理。根据不同的放电特征,利用KlustaKwik软件对每组记录电极上采集的峰电位信号数据进行自动甄选,并将它们归为相应的峰电位集群。自动甄选后的峰电位集群还需要进一步通过Kluster软件进行手动甄选,以筛除在自动甄选过程中误判的噪声信号和包含过多干扰型号的峰电位集群,最终获取单个神经元的峰电位信号。
针对行为学数据,将每天100次配对训练中CS开始前的300 ms信号作为基线,并将其信号的平均值+4倍标准差定义为条件反射的检测阈值。1次有效的条件反应必须满足2个条件:①眼睑活动的肌电信号大于阈值;②满足条件①的时间总和至少超过20 ms。
1.5 组织学定位所有记录完成后,受试动物将接受微电流损毁(30 μA直流电,持续10 s)。电损毁48 h后,给动物腹腔注射致死剂量戊巴比妥钠(0.3 mL,3%),经心脏灌注生理盐水50 mL和4%多聚甲醛溶液50 mL,取出小脑。在4%多聚甲醛溶液中固定12 h后,转移至30%蔗糖溶液中脱水24 h。脱水完成后的组织再通过冰冻切片机(CM1900, Leica, 德国)制成20 μm厚的连续冠状切片。经DAPI染色后,在荧光显微镜(BX53, Olympus, 日本)下观察并拍摄电极尖端的损毁位点。只有损毁位点确认在小脑皮层的电极记录信号数据才会被纳入到后续的分析。
1.6 统计学分析数据以x±s表示,使用SPSS 10.0软件进行统计分析。受试小鼠的CR发生率变化采用单因素方差分析。神经元活动模式比例的区别采用卡方检验。神经元放电的潜伏期和强度变化采用Wilcoxon秩和检验。检验水准α=0.05。
2 结果 2.1 自由活动小鼠痕迹性眨眼条件反射的建立根据动物是否习得tEBC,共计6只小鼠的行为学成绩纳入统计。如图 1A所示,在连续5 d CS和US配对刺激训练过程中,小鼠的CR逐渐出现, CR发生率从训练第1天的(35.3±10.5)%上升到第5天的(79.0±3.2)%(F(4, 20) =6.286, P=0.002,图 1B),幅度逐渐增加。根据CR发生率的水平,将训练第1、2天定义为条件反射建立早期阶段,该阶段CR发生率为(42.2±10.5)%;将训练的第4、5天定义为条件反射建立后期阶段,该阶段CR发生率为(72.8±3.8)%。统计学结果显示,CR发生率在后期阶段显著高于早期阶段(P < 0.01)。
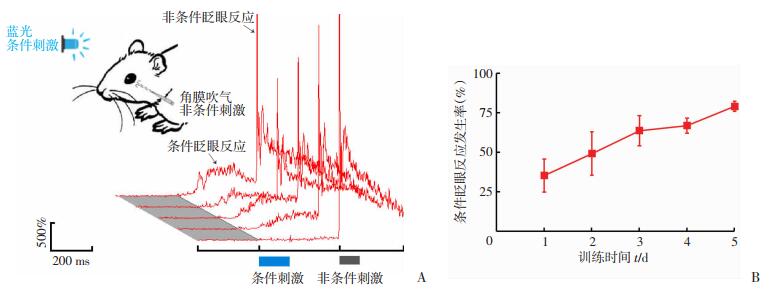
|
| A:痕迹性眨眼条件反射行为训练模式图(左)和训练1~5 d小鼠上眼睑肌电活动强度变化代表图(右); B:条件眨眼反应发生率随训练时间的变化 图 1 小鼠痕迹性眨眼条件反射的建立 |
2.2 痕迹性眨眼条件反射建立过程中小脑皮层神经元活动模式变化特征
根据电生理记录实验结束之后的组织学定位(图 2A),将6只小鼠的神经元记录结果纳入统计分析。在tEBC建立的早期和后期2个阶段,分别记录了66个和63个神经元的放电活动(图 2B)。结果表明:在tEBC建立的早期(第1、2天),44.0%(n=29)的神经元在给予CS后发生显著放电变化。其中,11个(16.7%)神经元在CS和US刺激间期放电活动减弱(图 2B和2C),18个(27.3%)神经元在刺激间期放电活动增强(图 2B和2D)。相比较而言,在tEBC建立后期(第4、5天),给予CS后发生放电活动变化的神经元比例未出现显著变化(47.7%,n=30,图 2B)。但其中有23个(36.5%)神经元在CS和US刺激间期放电活动减弱,而仅有7个(11.2%)神经元在刺激间期放电活动增强。统计结果显示:在tEBC建立早期与后期,小脑皮层放电减弱和增强模式神经元的比例组成存在显著差异(P < 0.01)。

|
| A:受试小鼠小脑皮层中记录位点(红色箭头示)图;B:不同阶段刺激间期不同放电模式神经元的比例组成;C:在条件刺激和非条件刺激间期放电活动减弱的小脑皮层神经元;D:在条件刺激和非条件刺激间期放电活动增强的小脑皮层神经元 图 2 痕迹性眨眼条件反射建立过程中小脑皮层神经元代表性放电活动 |
2.3 痕迹性眨眼条件反射建立过程中小脑皮层神经元活动强度和时间变化特征
进一步分析在tEBC建立的不同阶段,小脑皮层神经元群体放电的强度和潜伏期变化。神经元放电活动变化超过1.5倍基线期活动标准差值定义为放电变化起始潜伏期。如图 3A所示,对于刺激间期活动减弱类型的小脑皮层神经元,其在tEBC建立后期放电活动减弱的起始潜伏期显著后移(P < 0.01,图 3C、3E),但放电活动减弱的最大程度没有显著变化(P>0.05,图 3F)。对于刺激间期活动增强类型的小脑皮层神经元(图 3D),其在tEBC建立后期放电增强的起始潜伏期同样出现显著后移(P < 0.05,图 3G),而放电增强的最大程度也没有发生显著变化(P>0.05,图 3H)。
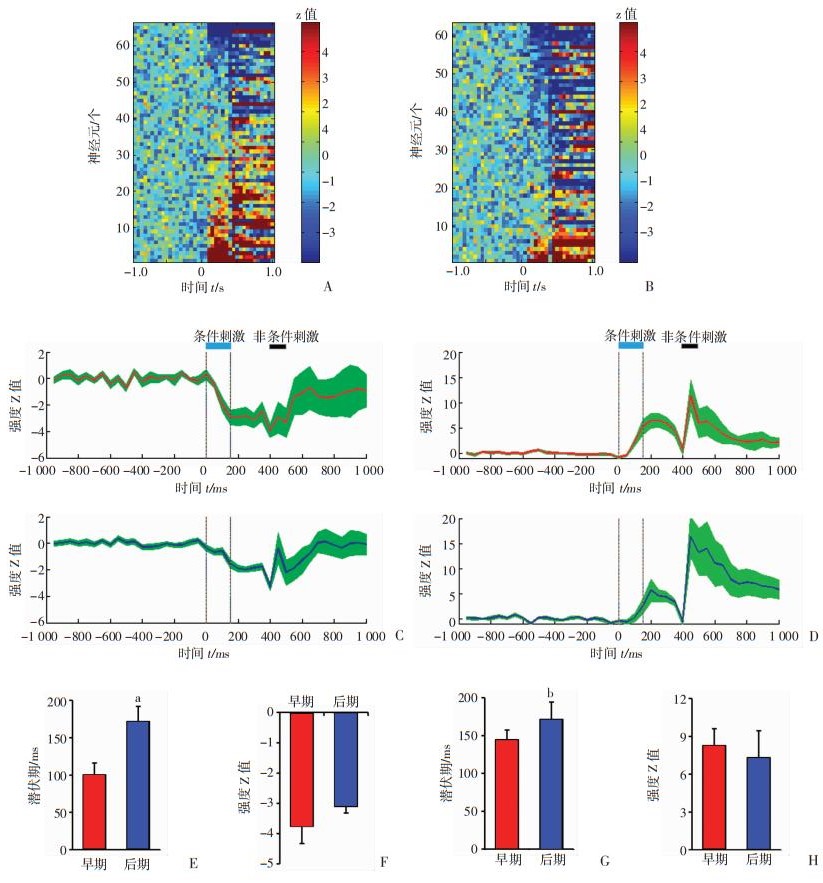
|
| A:痕迹性眨眼条件反射建立早期(第1、2天,n=66)小脑皮层神经元群体的放电活动;B:痕迹性眨眼条件反射建立后期(第4、5天,n=63)小脑皮层神经元群体的放电活动;C:刺激间期活动减弱类型的小脑皮层神经元在反射建立早期(上,n=11)和后期(下,n=23)的平均放电活动;D:刺激间期活动增强类型的小脑皮层神经元在反射建立早期(上,n=18)和后期(下,n=9)的平均放电活动;E:刺激间期减弱类型的小脑皮层神经元在反射建立早期(红)和后期(蓝)的放电潜伏期比较;F:刺激间期减弱型的小脑皮层神经元在反射建立早期(红)和后期(蓝)的放电变化强度比较;G:刺激间期增强类型的小脑皮层神经元在反射建立早期(红)和后期(蓝)的放电潜伏期比较;H:刺激间期增强类型的小脑皮层神经元在反射建立早期(红)和后期(蓝)的放电变化强度比较a: P < 0.01, b: P < 0.05,与早期比较 图 3 痕迹性眨眼条件反射建立过程小脑皮层神经元活动特征的动态变化 |
3 讨论
联合型学习可将两个在时间上很靠近的事件通过重复配对学习的过程联系起来。诸如精神分裂症、自闭症等疾病状态下,该学习功能会发生早期损害[1-2]。因此,对联合型学习行为改变的细胞和分子机制研究,将为上述疾病的早期诊断和治疗效果判断提供重要的帮助。
tEBC是研究联合型学习神经机制的经典行为模型[3]。利用家兔和大鼠等模式动物的研究中发现:小脑皮层在该反射中发挥了重要作用,如参与控制条件眨眼反应的幅度和定时功能[8, 11]。相对于既往所用模式动物,小鼠具有转(敲)基因品系丰富的优越性,更加适于联合型学习细胞和分子机制的研究[12]。近年来,部分研究者开始尝试在小鼠上开展以tEBC为代表的联合型学习神经机制的探索[13-14]。由于给予CS和US、以及检测眼睑闭合反应需要,目前的小鼠实验需要对其进行头部固定,仅允许其躯干和四肢在滚轮上进行运动。但新近研究表明:小鼠的运动状态会影响联合型学习的效率[14]。因此,理想的情况是,小鼠能够在自由活动的状态下接受tEBC训练,并在此条件下观察和研究联合型学习发生的神经机制。
本研究成功地在自由活动小鼠上开展了tEBC训练,并可以对其相关脑区的神经元活动进行同步的监测和光遗传控制[9]。而为了验证开展tEBC训练的有效性,不仅需要观察小鼠的行为学变化,还必须检验该行为建立的细胞活动基础。在此,本研究观察了自由活动小鼠小脑皮层神经元在tEBC建立过程中的放电活动。结果显示:在tEBC行为的CS和US刺激间期,单个的小脑皮层神经元放电活动可以表现为减弱型、增强型和无反应3种类型。与既往研究一致的是:本研究观察到大约30%的小脑皮层神经元在CS给予之后放电活动显著减低。此外,随tEBC训练的进行,小脑皮层神经元放电减弱的潜伏期会向US靠近,提示该模式放电可以随学习发生可塑性改变。研究已证实:来自前脑结构的CS相关信息经苔藓纤维传递至小脑皮层的颗粒细胞,再通过后者发出的平行纤维传递至浦肯野细胞;而US信息则通过下橄榄核所发出的爬行纤维传递至浦肯野细胞[15]。CS和US信号同时到达浦肯野细胞,引起其细胞膜发生AMPA受体内吞,从而产生对CS反应性的长时程抑制[16],这被认为是tEBC建立的关键机制之一。因此,本研究观察到的小脑皮层神经元减弱型放电支持现有关于tEBC建立机制的假说。由于在自由活动小鼠上建立tEBC的行为学特征及其细胞活动基础与既往报道相一致,这证明了该模型使用的有效性。
除观察到减弱型放电的小脑皮层神经元,本研究还发现:在神经元群体的水平上,不同活动模式小脑皮层神经元的组成比例会随着学习发生显著变化,表现为减弱型放电神经元比例显著增加,提示小脑皮层可能需通过募集更多数量的减弱活动型小脑皮层细胞来参与tEBC建立。同时,由于增强型活动细胞比例显著减少,且无反应细胞比例没有变化,因此减弱型活动神经元的比例增高反映了该类细胞可能是由增强型活动向减弱型活动的放电模式转换而来。与既往文献报道不同的是,本研究发现:单个小脑皮层神经元活动减弱的强度并没有随着训练出现显著变化。综上提示:在自由活动小鼠,其小脑皮层中神经元由增强型向减弱型放电模式的转化,以及具有这种转换模式的细胞比例增加,可能是小脑皮层参与tEBC建立更为关键的机制。这补充和完善了现有关于小脑皮层参与tEBC机制的相关认识。需要指出的是,一定比例的小脑皮层神经元在CS后始终保持增强型放电活动。这可能是由于我们在小脑皮层区记录到了颗粒细胞,它们主要接受CS相关信息的传入刺激,而不产生之前所述的长时程抑制现象[16]。
综上,本研究不仅在细胞活动水平验证了自由活动小鼠tEBC建立模型的有效性,还对小脑皮层神经元活动可塑性变化介导联合型学习记忆形成的假说进行了补充和完善。这为下一步研究疾病状态下联合型学习的变化及相关机制奠定了基础。
| [1] |
SATHYANESAN A, ZHOU J, SCAFIDI J, et al. Emerging connections between cerebellar development, behaviour and complex brain disorders[J]. Nat Rev Neurosci, 2019, 20(5): 298-313. DOI:10.1038/s41583-019-0152-2 |
| [2] |
ORLOV N D, O'DALY O, TRACY D K, et al. Stimulating thought: a functional MRI study of transcranial direct current stimulation in schizophrenia[J]. Brain, 2017, 140(9): 2490-2497. DOI:10.1093/brain/awx170 |
| [3] |
TAKEHARA-NISHIUCHI K. The anatomy and physiology of eyeblink classical conditioning[J]. Curr Top Behav Neurosci, 2018, 37: 297-323. DOI:10.1007/7854_2016_455 |
| [4] |
HALVERSON H E, KHILKEVICH A, MAUK M D. Cerebellar processing common to delay and trace eyelid conditioning[J]. J Neurosci, 2018, 38(33): 7221-7236. DOI:10.1523/JNEUROSCI.0430-18.2018 |
| [5] |
CHEN H, WANG Y J, YANG L, et al. Theta synchronization between medial prefrontal cortex and cerebellum is associated with adaptive performance of associative learning behavior[J]. Sci Rep, 2016, 6: 20960. DOI:10.1038/srep20960 |
| [6] |
SUTER E E, WEISS C, DISTERHOFT J F. Differential responsivity of neurons in perirhinal cortex, lateral entorhinal cortex, and dentate gyrus during time-bridging learning[J]. Hippocampus, 2019, 29(6): 511-526. DOI:10.1002/hipo.23041 |
| [7] |
LI D B, YAO J, SUN L, et al. Reevaluating the ability of cerebellum in associative motor learning[J]. Sci Rep, 2019, 9(1): 6029. DOI:10.1038/s41598-019-42413-5 |
| [8] |
SCHREURS B G. Changes in cerebellar intrinsic neuronal excitability and synaptic plasticity result from eyeblink conditioning[J]. Neurobiol Learn Mem, 2019, 166: 107094. DOI:10.1016/j.nlm.2019.107094 |
| [9] |
ZHANG J, ZHANG K Y, ZHANG L B, et al. A method for combining multiple-units readout of optogenetic control with natural stimulation-evoked eyeblink conditioning in freely-moving mice[J]. Sci Rep, 2019, 9(1): 1857. DOI:10.1038/s41598-018-37885-w |
| [10] |
QIN H, FU L, HU B, et al. A visual-cue-dependent memory circuit for place navigation[J]. Neuron, 2018, 99(1): 47-55. DOI:10.1016/j.neuron.2018.05.021 |
| [11] |
HALVERSON H E, KHILKEVICH A, MAUK M D. Relating cerebellar Purkinje cell activity to the timing and amplitude of conditioned eyelid responses[J]. J Neurosci, 2015, 35(20): 7813-7832. DOI:10.1523/JNEUROSCI.3663-14.2015 |
| [12] |
ANIKEEVA P, ANDALMAN A S, WITTEN I, et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice[J]. Nat Neurosci, 2011, 15(1): 163-170. DOI:10.1038/nn.2992 |
| [13] |
TEN BRINKE M M, BOELE H J, SPANKE J K, et al. Evolving models of Pavlovian conditioning: cerebellar cortical dynamics in awake behaving mice[J]. Cell Rep, 2015, 13(9): 1977-1988. DOI:10.1016/j.celrep.2015.10.057 |
| [14] |
ALBERGARIA C, SILVA N T, PRITCHETT D L, et al. Locomotor activity modulates associative learning in mouse cerebellum[J]. Nat Neurosci, 2018, 21(5): 725-735. DOI:10.1038/s41593-018-0129-x |
| [15] |
KHILKEVICH A, ZAMBRANO J, RICHARDS M M, et al. Cerebellar implementation of movement sequences through feedback[J]. Elife, 2018, 7: e37443. DOI:10.7554/eLife.37443 |
| [16] |
GAO Z Y, VAN BEUGEN B J, DE ZEEUW C I. Distributed synergistic plasticity and cerebellar learning[J]. Nat Rev Neurosci, 2012, 13(9): 619-635. DOI:10.1038/nrn3312 |



