阿尔茨海默病(Alzheimer’s disease, AD)是一种以进行性认知障碍和记忆力损害为特征的中枢神经系统退行性疾病,已成为影响老年人群健康的主要疾病[1]。AD的发病机制尚不清,缺乏有效的干预药物。因此, 探究AD发病机制和筛选防治药物是亟待解决的重要科学问题。AD病理变化主要包括脑内β淀粉样蛋白(amyloid-beta,Aβ)沉积形成的老年斑、Tau蛋白异常磷酸化形成的神经纤维缠结以及选择性神经元丢失。其中,Aβ沉积是AD早期的重要病理改变[2-3]。Aβ的前体蛋白(amyloid-beta precursor protein, APP)具有两种代谢途径,即α-分泌酶途径和β-分泌酶途径[4]。Aβ过度产生是AD发生的一个重要病理机制。
胰岛素作为一种重要的神经调节剂,参与代谢调控、神经营养和神经内分泌过程,其中对能量稳态和认知功能的影响较大[5-7]。近年来研究表明胰岛素与AD发生关系密切,但是胰岛素对Aβ代谢的调控作用和相关机制不清。为此,本研究探讨胰岛素对APP代谢和Aβ生成的调控作用,从而更好地理解AD的病理过程,探寻AD的病因。
1 材料与方法 1.1 材料胰岛素(insulin)购自德国Sigma公司,用二甲基亚砜(DMSO)溶解后,于4 ℃避光保存待用。实验所用细胞株SH-SY5Y、HEK293为实验室常用细胞,2EB2为本实验室构建;胎牛血清、DMEM高糖培养基和青霉素链霉素双抗购自美国Gibco公司;蛋白酶抑制剂购自瑞士Roch公司;CCK-8细胞活性检测试剂盒购自南京凯基生物科技有限公司;BCA kit、蛋白Maker购自美国Thermo公司;兔抗人ADAM10单克隆抗体购自美国Abcam公司;AKT、GSK3β、p-GSK3β、p-AKT单克隆抗体均购自美国CST公司;PVDF膜购自美国Millipore公司。
1.2 细胞培养用含10%胎牛血清及适量青/链霉素的DMEM高糖培养基对HEK293、SH-SY5Y和2EB2细胞进行培养,将其置于37 ℃、5% CO2的细胞培养箱中生长,待细胞生长至80%~90%密度时,用胰蛋白酶消化细胞并进行传代后,取对数生长期的细胞进行后续实验。
1.3 胰岛素溶液的配置和分组将胰岛素溶解于稀盐酸中配置成储存浓度为100 μmol/L的母液,避光保存于-20 ℃冰箱。在进行实验时,用DMEM培养基分别进行稀释,将处于对数生长期的实验所用细胞分为空白对照组和胰岛素0.01 μmol/L组、胰岛素0.10 μmol/L组、胰岛素1.00 μmol/L组和胰岛素10.00 μmol/L组。
1.4 细胞活性的检测采取CCK-8进行检测。收集处于对数生长期的HEK293及SH-SY5Y细胞,按1×104/mL接种于96孔板(100 μL/孔),置于37 ℃、5% CO2的孵箱中培养。待细胞生长12 h后,配置浓度分别为0、0.01、0.10、1.00、10.00 mg/mL的胰岛素溶液,对细胞进行干预,各浓度组共设立5个复孔,将细胞放入细胞培育箱中继续培养44 h后每孔加入10 μL CCK-8, 继续将细胞放在孵箱中孵育4 h,用酶标仪检测450 nm波长处各孔的光密度值[D(450)],根据D(450)值计算细胞活性,计算公式为:细胞存活率=[实验孔D(450)值-空白孔D(450)值] /[对照孔D(450)值-空白孔D(450)值]×100%。
1.5 Western blot检测APP、BACE1、CTF、PS1和ADAM10蛋白表达将处于对数生长期的HEK293及SH- SY5Y细胞稀释至1×105/mL,接种至6孔板,待其长到60%~70%时,分别用0、0.01、0.10、1.00、10.00 mg/mL的胰岛素对细胞进行干预,48 h后提取细胞蛋白,采用蛋白浓度测定试剂盒测定蛋白浓度,取蛋白总量相同的样品,进行10% SDS-PAGE凝胶电泳,然后经转膜和封闭,孵入一抗4 ℃过夜,第2天加入二抗后室温孵育1 h,1‰TBST洗膜5 min×3次,最后ECL发光显影,最后采用Image J软件分析目的蛋白条带灰度值。
1.6 Aβ相关蛋白的检测采取ELISA进行检测。标准品用NaHCO3溶液将其溶解至10 ng/mL,再将其按照说明书配制成1 000 pg/mL标准品,进行浓度梯度稀释,配置成浓度为500.00、250.00、125.00、62.50、31.25、15.63、7.81、0 pg/mL的标准品。收集经胰岛素干预48 h后的2EB2细胞上清液,将标准品及50 μL待测本加到相应检测管孔中,留有1个空白对照孔。随后在除空白对照孔外的每个检测孔中分别加入50 μL抗Aβ40或Aβ42检测抗体,室温孵育3 h,清洗液洗板3 min×4次。除空白对照孔外的每个检测孔中加入100 μL的HRP二抗,室温孵育30 min,清洗液洗板3 min×4次。每孔加入100 μL显影液,室温避光孵育30 min后每孔中加入100 μL的终止液。用酶标仪检测450 nm波长处各孔光密度值[D(450)],计算相应的浓度。
1.7 Aβ代谢相关信号通路的筛选采用信号通路磷酸化广谱筛选抗体芯片。收集胰岛素干预后细胞裂解物;按照说明书将试剂盒内20×洗涤缓冲液、10×抗体检测液和10× HRP连接的链霉抗生物素蛋白分别稀释成1×洗涤缓冲液、1×抗体和1×链霉抗生物素蛋白;取出载玻片与多孔垫圈,将载玻片放置于多孔垫圈的顶部;将金属夹固定于垫圈的凹槽中;每孔加入100 μL阵列阻断缓冲液并密封反应孔,室温孵育15 min,后加入50 μL细胞裂解产物并密封反应孔,4 ℃孵育过夜,1×洗涤缓冲液5 min×3次;每孔加入75 μL 1×抗体检测液,室温孵育1 h,随后清洗5 min×3次;每孔加入75 μL 1×HRP连接的链霉抗生物素蛋白并密封反应孔,室温孵育30 min,清洗5 min×3次;载玻片拆下后,清洗3次,按照说明书用Lumi GLOⒸ/过氧化物试剂覆盖载玻片。最后,使用化学发光信号的数字成像系统捕获载玻片的图像。
1.8 统计学分析采用SPSS 18.0统计软件,多组间数据比较采用单因素方差分析,检验水准α=0.05,图像处理采用GraphPad Prism 6,图像编辑采用Canvas软件。
2 结果 2.1 胰岛素对细胞活性的影响CCK-8检测结果显示,与对照组相比,不同浓度的胰岛素处理HEK293后,细胞活性组间差异无统计学意义(P>0.05, 图 1A)。不同浓度胰岛素处理SH-SY5Y细胞,细胞活性也无明显差异(P>0.05, 图 1B)。基于该结果,选用0~10.00 μmol/L胰岛素浓度进行后续实验。
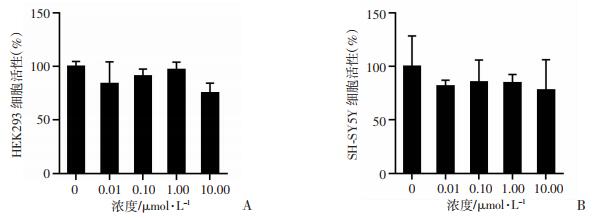
|
| A:HEK293细胞的活性水平;B:SH-SY5Y细胞的活性水平 图 1 CCK-8法检测不同浓度胰岛素处理48 h后对HEK293细胞和SH-SY5Y细胞活性的影响 |
2.2 胰岛素增加细胞APP和CTF表达
胰岛素处理SH-SY5Y细胞48 h后,与对照组(0 μmol/L)相比,1.00、10.00 μmol/L浓度处理组细胞APP及CTF蛋白表达增高(P < 0.05),0.01和0.10 μmol/L浓度处理组则无明显变化(P>0.05,图 2A~C)。
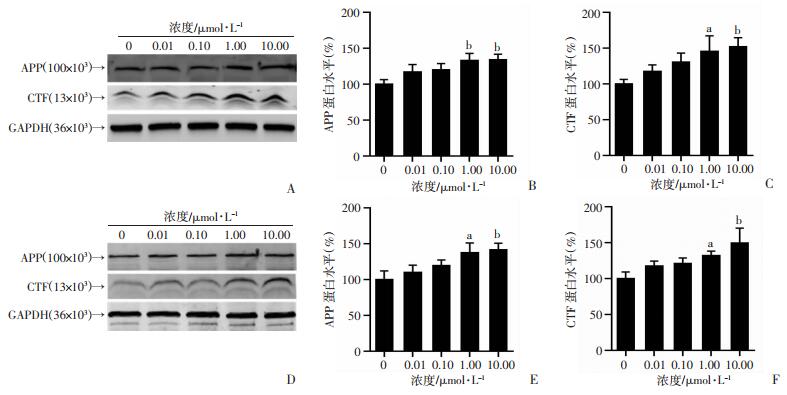
|
| A~C:SH-SY5Y细胞中APP、CTF蛋白表达水平;D~F: 2EB2细胞中APP、CTF蛋白表达水平 a: P < 0.05, b: P < 0.01, 与0 μmol/L比较 图 2 Western blot检测不同浓度胰岛素对SH-SY5Y细胞和2EB2细胞APP、CTF蛋白的影响(n=3) |
进一步在AD细胞模型2EB2细胞进行连续48 h的胰岛素干预,与对照组相比,1.00和10.00 μmol/L胰岛素处理组中APP及CTF蛋白的表达均明显升高(P < 0.05,图 2D~F)。
2.3 胰岛素促进BACE1对APP的切割胰岛素处理SH-SY5Y细胞及2EB2细48 h后,与对照组相比,细胞中BACE1蛋白表达在0.10、1.00、10.00 μmol/L胰岛素处理组中明显增高(P < 0.05, 图 3A、E、D、H);PS1和ADAM10在两种细胞的不同处理组间差异无统计学意义(P>0.05,图 3B、C、F、G)。
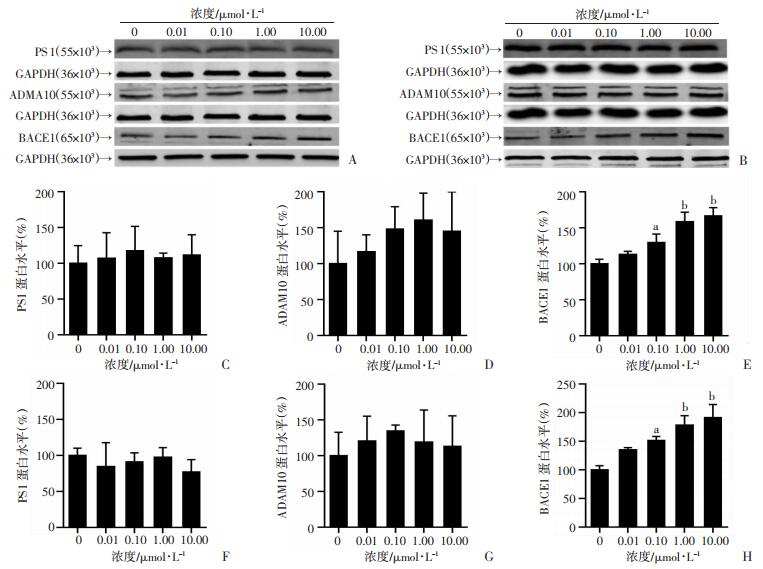
|
| A, C~E:SH-SY5Y细胞中PS1、ADAM10、BACE1蛋白表达水平;B, F~H:2EB2细胞中PS1、ADAM10、BACE1蛋白表达水平 a: P < 0.05, b: P < 0.01, 与0 μmol/L比较 图 3 Western blot检测不同浓度胰岛素对SH-SY5Y细胞和2EB2细胞PS1、ADAM10、BACE1蛋白的影响(n=3) |
2.4 胰岛素增加细胞Aβ42蛋白的表达
ELISA检测结果显示,与对照组相比,在1.00、10.00 μmol/L胰岛素处理2EB2细胞48 h后,细胞中Aβ42蛋白表达水平明显升高(P < 0.01,图 4A),而Aβ40蛋白水平差异则无统计学意义(P>0.05,图 4B)。

|
| A:Aβ42蛋白水平;B:Aβ40蛋白水平 a: P < 0.05, b: P < 0.01, 与0 μmol/L比较 图 4 ELISA检测胰岛素对2EB2细胞中Aβ42、Aβ40蛋白表达的影响(n=3) |
2.5 GSK3β为胰岛素作用的潜在靶点
使用蛋白芯片技术来筛选胰岛素可能影响的信号通路,实验结果显示,胰岛素处理后蛋白量增高的前两位蛋白是Bad(Ser112)和GSK3β(Ser9) (图 5)。
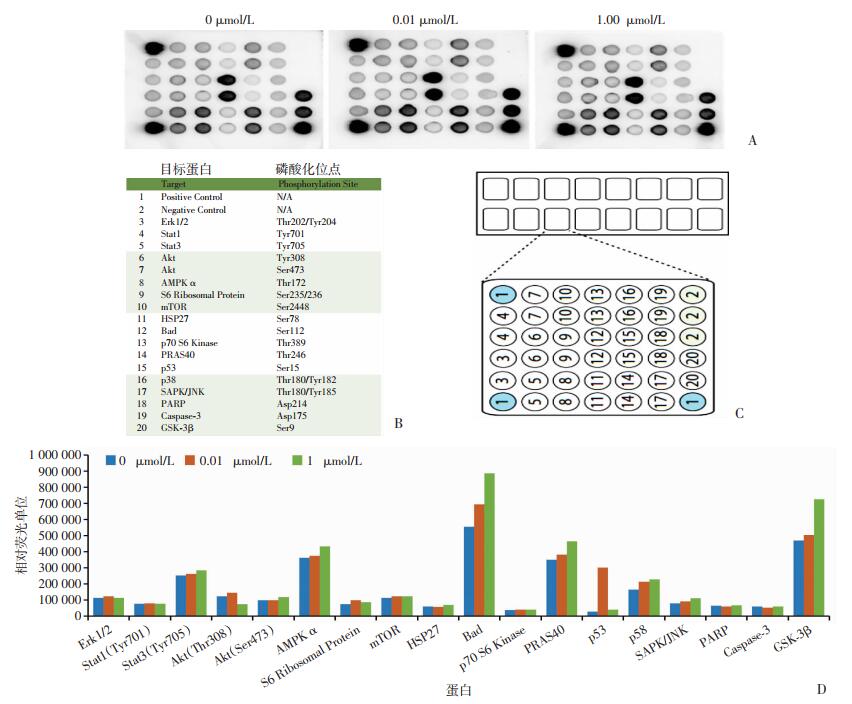
|
| A:不同浓度胰岛素作用下细胞蛋白在芯片上的分布图;B、C:实验中每张膜对应孔检测的蛋白;D:蛋白芯片数据分析 图 5 基因芯片技术检测不同蛋白的表达 |
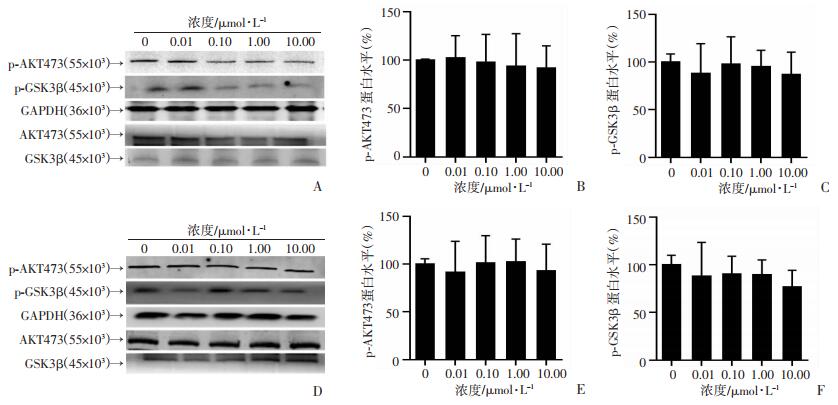
2.6 胰岛素对AKT/GSK3β信号通路的影响
Western blot检测经胰岛素干预的2EB2细胞和SH-SY5Y细胞中AKT和GSK3β的磷酸化蛋白的水平,实验结果显示,不同浓度胰岛素处理两种细胞48 h后,磷酸化AKT和磷酸化GSK3β蛋白的表达均下调,但差异无统计学意义(P>0.05, 图 6)。
|
| A~C:SH-SY5Y细胞中p-AKT、p-GSK3β蛋白表达水平; D~F:2EB2细胞中p-AKT、p-GSK3β蛋白表达水平 图 6 Western blot检测不同浓度胰岛素对PI3K/Akt信号通路中p-AKT及p-GSK3β蛋白的影响 |
3 讨论
既往研究表明胰岛素可以促进AD的病理过程[8-11]。有临床研究表明胰岛素治疗增加糖尿病患者AD风险[8]; 在链脲佐菌素诱导的糖尿病AD小鼠模型中,胰岛素与其同源受体的结合影响APP代谢,促进Aβ产生[9-10]。胰岛素可通过刺激其在神经元细胞内运输,直接增加Aβ分泌[11]。在这个过程中,可能涉及Aβ的产生和清除的机制。
本研究在SH-SY5Y细胞和2EB2细胞中初步探索胰岛素对Aβ代谢的影响及其可能的机制。SH-SY5Y为人神经母细胞瘤细胞系,被广泛用于建立神经退行性疾病的体外模型[12-13]。2EB2细胞是本实验室构建的稳定高表达人APP和BACE1蛋白的细胞系,是较好的AD体外模型。我们发现高浓度(1.00、10.00 μmol/L)胰岛素干预能够增加APP、APP病理性代谢产物CTF蛋白以及Aβ的表达,这与一项研究结果一致[14]。本研究进一步发现:胰岛素对ADAM10及PS1蛋白表达水平无明显影响,但增加了BACE1的蛋白水平,表明高浓度胰岛素通过增加BACE1的表达来促进CTF及Aβ的产生,即胰岛素对AD致病性产物的产生有增强作用。既往研究表明鼻内胰岛素给药可使AD大鼠模型的Aβ生成减少,并改善其记忆障碍[15],这与本研究结果不一致。由于对大鼠进行鼻内胰岛素给药与本实验体外对细胞给药不同,我们推测给药方式及实验对象的不同可能是导致不同研究结果的原因,但这需要进一步探讨。
近年来研究表明在AD患者中存在胰岛素信号传导缺陷[16-22]。胰岛素有3条主要的信号传导通路:磷脂酰肌醇3-蛋白激酶(PI3K)、丝裂原活化蛋白激酶(MAPK)以及磷脂酶C(PLC)信号传导通路[16]。其中PI3K途径是主要的信号传导通路[17-22]。胰岛素可通过PI3K / PKB途径调节GSK3β的磷酸化状态及其活性,即活化的PKB可引起GSK3β的Ser位点(Ser396,Ser9)磷酸化而失活[18-22]。而GSK3β是一种不仅能调节葡萄糖代谢,而且在AD发展中起重要作用的酶[22]。研究表明,AD患者中大脑胰岛素的信号通路PI3K / AKT受损,使GSK3β(Ser9)磷酸化水平减低,从而导致GSK3β的异常激活,进而影响APP代谢,加速AD病理过程,如淀粉样蛋白斑块沉积和神经元纤维缠结[17-20]。因此,本研究采用了蛋白芯片的方法来探讨胰岛素对AD病理过程的影响与该通路之间的关系。由于蛋白芯片是一种高通量手段,其效率虽高,但其准确性较低,所以我们参考了蛋白芯片统计结果,并用蛋白质印迹分析来检测了AKT相关信号通路的AKT以及GSK3β的蛋白表达。结果提示胰岛素可能是通过AKT相关信号通路来影响APP的代谢。
在本研究中,胰岛素干预后BACE1表达增加,而γ-分泌酶PS1则无明显变化。但同时使用ELISA方法检测到胰岛素干预后Aβ40未出现明显变化,但是Aβ42水平增加。我们观察到胰岛素处理对PS1无明显影响,因此Aβ42增多的可能性之一是由于Aβ42的清除减少所致。胰岛素对Aβ降解的影响是通过胰岛素的降解酶来作用的,IDE能够特异性地结合Aβ从而使其形成稳定的复合物,使其降解减少,Aβ的沉积也减少。由于IDE的底物是胰岛素和Aβ,当胰岛素过量时,可与Aβ竞争结合IDE使其活性降低,从而减缓了Aβ的降解及清除[23]。同时Aβ42和Aβ40虽然都是Aβ的两种成分,但细胞内产生的Aβ40远比Aβ42多,所以,我们猜测胰岛素过量后Aβ的降解及清除减少,而Aβ40远比Aβ42多,所以并未检测到Aβ40水平的变化。可能性之二是胰岛素处理使γ-分泌酶对切点的偏好从Aβ40转向Aβ42,此种偏向正如前所述,或许对Aβ40影响不大,但却可显著增加Aβ42产生。这两种可能性需进一步证实。另外,本研究仅从体外细胞水平证明高浓度胰岛素可能通过AKT信号通路来调节APP代谢,从而促进Aβ的产生,后续研究将在动物模型中进行验证。
综上,本研究结果提示胰岛素可以通过调节APP代谢来促进AD的发生。该发现为胰岛素促进AD的发生提供了新的证据,表明胰岛素代谢是AD防治的潜在靶点。
| [1] |
DARTIGUES J F. Alzheimer's disease: a global challenge for the 21st century[J]. Lancet Neurol, 2009, 8(12): 1082-1083. DOI:10.1016/S1474-4422(09)70298-4 |
| [2] |
ZHANG X J, SONG W H. The role of APP and BACE1 trafficking in APP processing and amyloid-β generation[J]. Alzheimers Res Ther, 2013, 5(5): 46. DOI:10.1186/alzrt211 |
| [3] |
SUN X L, BROMLEY-BRITS K, SONG W H. Regulation of β-site APP-cleaving enzyme 1 gene expression and its role in Alzheimer's disease[J]. J Neurochem, 2012, 120(Suppl 1): 62-70. DOI:10.1111/j.1471-4159.2011.07515.x |
| [4] |
SINHA S, ANDERSON J P, BARBOUR R, et al. Purification and cloning of amyloid precursor protein beta-secretase from human brain[J]. Nature, 1999, 402(6761): 537-540. DOI:10.1038/990114 |
| [5] |
GASPARINI L, NETZER W J, GREENGARD P, et al. Does insulin dysfunction play a role in Alzheimer's disease?[J]. Trends Pharmacol Sci, 2002, 23(6): 288-293. DOI:10.1016/s0165-6147(02)02037-0 |
| [6] |
GASPARINI L, XU H X. Potential roles of insulin and IGF-1 in Alzheimer's disease[J]. Trends Neurosci, 2003, 26(8): 404-406. DOI:10.1016/S0166-2236(03)00163-2 |
| [7] |
STEEN E, TERRY B M, RIVERA E J, et al. Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease: is This type 3 diabetes?[J]. J Alzheimers Dis, 2005, 7(1): 63-80. DOI:10.3233/jad-2005-7107 |
| [8] |
LEBOUVIER T, SCALES T M E, HANGER D P, et al. The microtubule-associated protein tau is phosphorylated by Syk[J]. Biochim Et Biophys Acta BBA - Mol Cell Res, 2008, 1783(2): 188-192. DOI:10.1016/j.bbamcr.2007.11.005 |
| [9] |
IWATSUBO T. Amyloid beta protein in plasma as a diagnostic marker for Alzheimer's disease[J]. Neurobiol Aging, 1998, 19(2): 161-163. DOI:10.1016/s0197-4580(98)00015-3 |
| [10] |
LANNERT H, HOYER S. Intracerebroventricular administration of streptozotocin causes long-term diminutions in learning and memory abilities and in cerebral energy metabolism in adult rats[J]. Behav Neurosci, 1998, 112(5): 1199-1208. DOI:10.1037//0735-7044.112.5.1199 |
| [11] |
GASPARINI L, GOURAS G K, WANG R, et al. Stimulation of beta-amyloid precursor protein trafficking by insulin reduces intraneuronal beta-amyloid and requires mitogen-activated protein kinase signaling[J]. J Neurosci, 2001, 21(8): 2561-2570. DOI:10.1523/JNEUROSCI.21-08-02561.2001 |
| [12] |
BIEDLER J L, ROFFLER-TARLOV S, SCHACHNER M, et al. Multiple neurotransmitter synthesis by human neuroblastoma cell lines and clones[J]. Cancer Res, 1978, 38(11 Pt 1): 3751-3757. |
| [13] |
KOVALEVICH J, LANGFORD D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology[J]. Methods Mol Biol, 2013, 1078: 9-21. DOI:10.1007/978-1-62703-640-5_2 |
| [14] |
QIU W Q, WALSH D M, YE Z, et al. Insulin-degrading enzyme regulates extracellular levels of amyloid beta-protein by degradation[J]. J Biol Chem, 1998, 273(49): 32730-32738. DOI:10.1074/jbc.273.49.32730 |
| [15] |
RAJASEKAR N, NATH C, HANIF K, et al. Intranasal insulin administration ameliorates streptozotocin (ICV)-induced insulin receptor dysfunction, neuroinflammation, amyloidogenesis, and memory impairment in rats[J]. Mol Neurobiol, 2017, 54(8): 6507-6522. DOI:10.1007/s12035-016-0169-8 |
| [16] |
MIKLOSSY J, QING H, RADENOVIC A, et al. Beta amyloid and hyperphosphorylated tau deposits in the pancreas in type 2 diabetes[J]. Neurobiol Aging, 2010, 31(9): 1503-1515. DOI:10.1016/j.neurobiolaging.2008.08.019 |
| [17] |
SALTIEL A R, KAHN C R. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature, 2001, 414(6865): 799-806. DOI:10.1038/414799a |
| [18] |
ROHER A E, ESH C L, KOKJOHN T A, et al. Amyloid beta peptides in human plasma and tissues and their significance for Alzheimer's disease[J]. Alzheimers Dement, 2009, 5(1): 18-29. DOI:10.1016/j.jalz.2008.10.004 |
| [19] |
GASPARINI L, GOURAS G K, WANG R, et al. Stimulation of beta-amyloid precursor protein trafficking by insulin reduces intraneuronal beta-amyloid and requires mitogen-activated protein kinase signaling[J]. J Neurosci, 2001, 21(8): 2561-2570. DOI:10.1523/JNEUROSCI.21-08-02561.2001 |
| [20] |
TAKEDA S, SATO N, UCHIO-YAMADA K, et al. Elevation of plasma beta-amyloid level by glucose loading in Alzheimer mouse models[J]. Biochem Biophys Res Commun, 2009, 385(2): 193-197. DOI:10.1016/j.bbrc.2009.05.037 |
| [21] |
GASPARINI L, NETZER W J, GREENGARD P, et al. Does insulin dysfunction play a role in Alzheimer's disease?[J]. Trends Pharmacol Sci, 2002, 23(6): 288-293. DOI:10.1016/s0165-6147(02)02037-0 |
| [22] |
GASPARINI L, XU H X. Potential roles of insulin and IGF-1 in Alzheimer's disease[J]. Trends Neurosci, 2003, 26(8): 404-406. DOI:10.1016/S0166-2236(03)00163-2 |
| [23] |
QIU W Q, WALSH D M, YE Z, et al. Insulin-degrading enzyme regulates extracellular levels of amyloid beta-protein by degradation[J]. J Biol Chem, 1998, 273(49): 32730-32738. DOI:10.1074/jbc.273.49.32730 |



