2. 100048 北京,中国人民解放军总医院创新医学研究部组织修复与再生研究中心,皮肤损伤修复与再生北京市重点实验室
2. Research Center for Tissue Repair and Regeneration, Beijing Key Research Laboratory of Skin Injury, Repair and Regeneration, Division of innovative Medical Research, Chinese PLA General Hospital, Beijing, 100048, China
创面愈合是指由于致伤因子的作用造成组织缺失后,局部组织通过再生、修复、重建,进行修补的一系列病理生理过程。其中,人皮肤成纤维细胞(human dermal fibroblasts, HDFs)在创面修复过程中起重要作用,如分泌基质成分、胶原纤维,分泌多种细胞因子促进创面愈合。HDFs还与新生的毛细血管等共同构成肉芽组织,填补组织缺损。然而,糖尿病皮肤创面由于长期高糖环境的刺激导致HDFs功能发生改变,从而影响创面愈合速度,形成慢性难愈合创面[1]。因此改善高糖环境下HDFs的增殖、分化、迁移等功能状态是促进糖尿病创面愈合的关键。
Exos是一种大小为50~150 nm的膜性外分泌囊泡[2]。Exos内富含核酸、蛋白质、脂类等,因此在细胞间通讯、疾病诊断及组织修复和再生等方面发挥重要作用[3]。研究表明,Exos可以从体液和细胞培养上清液中获得,例如在脂肪来源干细胞[4]、骨髓间充质干细胞[5]、内皮祖细胞[6]等的上清中均分离到了外泌体。另外,不同细胞来源的Exos因含有的活性物质成分不同而具有不同的生物学功能,如骨髓间充质干细胞来源Exos可促进内皮细胞成管[7],诱导性多能干细胞来源的间充质干细胞来源的Exos可加速创面上皮形成并促进胶原蛋白成熟[8]等。PMSCs作为间充质干细胞的一员,其具有易获取、对母亲和新生儿无任何不良影响、免疫原性低、使用时不引起免疫排斥反应等优势,因此可以作为Exos的理想来源。据文献报道,从PMSCs培养上清中分离的外泌体可以促进内皮细胞的增殖和迁移,并增强血管生成相关基因Tie2和Ang2的表达[9],还可以促进创面愈合并抑制疤痕的形成[10]。但PMSCs来源的Exos是否能改善高糖环境下HDFs的功能状态国内外少见报道。
本研究首先建立HDFs的高糖老化模型并分离培养PMSCs,然后从PMSCs培养上清中分离Exos,将Exos用于处理高糖环境下HDFs,观察其对高糖培养的HDFs增殖、迁移和衰老的影响,并探寻其机制,检测衰老相关蛋白p53和p21的表达变化,从而为PMSCs来源的外泌体用于创面治疗提供理论依据。
1 材料与方法 1.1 主要试剂和仪器试剂:CCK-8试剂盒(同仁公司,日本);DNA含量检测试剂盒(索莱宝公司,中国);ROS试剂盒(索莱宝公司,中国);半乳糖苷酶试剂盒(Sigma公司,德国);胎牛血清(FBS,Gibco公司,美国);无Exos胎牛血清(无Exos-FBS,SBI公司,美国);0.25%胰蛋白酶(索莱宝公司,中国);10%青链霉素双抗(索莱宝公司,中国);DMEM低糖培养基(DMEM-LG,葡萄糖浓度为5.5 mmol/L,Gibco公司,美国);DMEM高糖培养基(DMEM-HG,葡萄糖浓度为26 mmol/L,Gibco公司,美国);葡萄糖溶液(200 g/L,Gibco公司,美国);DMEM/F12培养基(Gibco公司,美国);0.5%中性蛋白酶(Sigma公司,德国);Ⅰ型胶原酶(Sigma公司,德国);DNase I(索莱宝公司,中国);PKH-67(Sigma公司,德国);磷酸盐缓冲液(PBS,索莱宝公司,中国);BCA蛋白浓度测定试剂盒(索莱宝公司,中国)。仪器:流式细胞仪(BD公司,美国);倒置相差显微镜(Leica公司,德国);超高速离心机(日立,日本);超速低温离心机(Thermo公司,美国);透射电子显微镜(ZEISS公司,德国);纳米颗粒跟踪分析仪(Malvern公司,英国);多功能酶标仪(Thermo公司,美国);共聚焦荧光显微镜(Leica公司,德国)。
1.2 HDFs分离和培养本研究2018年3月获得中国人民解放军总医院伦理委员会批准。取得患者家属知情同意后,取18~22岁健康男性包皮环切术后包皮组织,PBS冲洗皮下血污,剪去皮下血管、脂肪组织,将包皮组织剪成1 cm2大小皮片,加入0.5%中性蛋白酶消化,置于4 ℃过夜。用眼科镊撕去表皮,保留真皮组织,然后用0.25%胰蛋白酶消化3 h。加入等体积无Exos-FBS中和胰蛋白酶,将上清液加入离心管中,离心(1 000 r/min,5 min)。弃上清液,将细胞沉淀重悬于含10% FBS的DMEM-LG培养基中,接种至细胞培养皿,置于37 ℃,5% CO2细胞培养箱培养,待细胞贴壁后,每隔48 h更换培养基。当细胞汇合约90%时,进行传代培养,取第3代(P3)细胞用于后续实验。
1.3 建立高糖模型的实验分组及处理将P3的HDFs分为3组:①正常对照组(5.5 mmol/L葡萄糖)用DMEM-LG培养;②HG1组(26 mmol/L葡萄糖)用DMEM-HG培养;③HG2组(35 mmol/L葡萄糖)用99.1% DMEM-HG+0.9%葡萄糖溶液(200 g/L)培养。
1.4 细胞增殖实验将8×104/mL的HDFs接种至96孔细胞培养板培养24 h,各组分别培养1、3、5、7 d(期间每隔48 h换液,不传代培养),按照CCK-8试剂说明书,每孔加入10 μL CCK-8试剂,置于37 ℃,5% CO2培养箱孵育3 h后,用酶标仪测量波长为450 nm的光密度值D(450)。按公式计算细胞增殖率[实验组D(450)值/对照组D(450)值×100%]。
1.5 细胞划痕实验将2×105/mL的HDFs接种至6孔细胞培养板培养24 h,各组培养7 d(期间每隔48 h换液,不传代培养),用1 000 μL枪头垂直在单层细胞上划线,更换相应培养基继续培养24 h后置于显微镜下拍照。用Image J软件测量划痕面积,计算细胞迁移率:细胞迁移率(%)=(0 h划痕区域面积-24 h划痕区域面积)/0 h划痕区域面积×100%。
1.6 细胞ROS检测细胞内活性氧(ROS)检测采用DCFH荧光探针检测。将2×105/mL的HDFs接种至6孔细胞培养板培养24 h,各组培养7 d(期间每隔48 h换液,不传代培养),除探针阴性对照组外,其余组加入20 μmol/mL DCFH荧光探针避光孵育45 min。PBS洗涤3次后置于荧光显微镜下观察并拍照。荧光强度经流式细胞仪检测。
1.7 细胞衰老β-半乳糖苷酶染色将2×105/mL的HDFs接种至6孔细胞培养板培养24 h,各组培养7 d(期间每隔48 h换液,不传代培养),按照衰老β半乳糖苷酶检测试剂盒说明书进行染色,倒置显微镜下观察细胞染色情况。老化细胞核周围呈蓝绿色,未老化细胞不着色。每组至少计数1 000个细胞,计算染色阳性细胞百分比的平均值为衰老β半乳糖苷酶染色阳性率。
1.8 PMSCs分离、培养及鉴定取得妇产科产妇和家属知情同意后,取25~30岁自然分娩女性胎盘组织,在无菌条件下,将胎盘组织剪成1 cm2小块,放入含10%青链霉素双抗的PBS中涮洗,直至PBS变清亮无色。然后将组织放入细胞培养皿中剔除结缔组织及血凝块,剪碎成芝麻大小。在培养皿中加入含100 U/mL Ⅰ型胶原酶和5 μg/mL DNase Ⅰ的DMEM/F12,置于37 ℃,5% CO2培养箱中消化3 h,然后加入等体积的无Exos-FBS终止消化,将上清液加入到离心管中,离心(1 000 r/min,5 min)。弃上清液,将细胞沉淀重悬于含10%无Exos-FBS的DMEM/F12中,接种在细胞培养皿中,置于37 ℃、5% CO2培养箱培养。原代培养前4 d不要移动细胞培养皿,自第5天起,每隔48 h更换培养基。大约第10天左右,可观察到有细胞爬出。
取P3的PMSCs用流式细胞仪检测细胞表面抗原CD90、CD105、CD73、CD34及CD45。同时取P3的PMSCs接种至6孔板进行成骨诱导及成脂诱导培养,然后分别用茜素红和油红O染色,鉴定PMSCs定向分化能力。
PMSCs传代培养至P5时,每隔48 h收集细胞培养上清液并更换培养基。将收集的培养上清液于-80 ℃低温冰箱保存备用。
1.9 Exos的分离及鉴定本研究采用差速高速离心法提取培养上清液中的Exos。将事先收集的细胞培养上清液复温融化后,进行2次离心(200 r/min,10 min;1 000 r/min,20 min)以去除死细胞及细胞碎片。将上清液加入至另一个离心管中,进行2次超速离心(10 000×g,2 h;10 000×g,70 min)。弃上清液,沉淀即为Exos,用PBS重悬Exos,置于-80 ℃低温冰箱保存。采用透射电子显微镜观察浓缩后的Exos并拍照。纳米颗粒跟踪分析仪检测其粒子直径及数量。Western blot法检测Exos表面抗原CD9、CD63和CD81表达情况。BCA蛋白浓度测定法检测Exos的蛋白浓度。
1.10 Exos内化实验取1×103/mL的HDFs接种至共聚焦荧光显微镜专用培养皿中培养24 h。取10 μL浓度为500 μg/mL的Exos原液重悬于1 mL的PBS中,加入5 μL PKH-67荧光染料,常温孵育5 min,然后加入1 mL无Exos-FBS中和染料,收集溶液至离心管离心(10 000×g,70 min)。弃上清液,将Exos重悬于DMEM-LG中,然后加入到共聚焦荧光显微镜专用培养皿中,与HDFs共培养12 h后PBS轻柔洗涤细胞,室温下4%多聚甲醛固定30 min,PE标记的鬼笔环肽染HDFs骨架,DAPI染核后,置于共聚焦荧光显微镜下观察PKH-67荧光标记的Exos是否进入HDFs内。
1.11 Exos对高糖培养HDFs影响的实验分组及处理将上述已用35 mmol/L葡萄糖培养基培养7 d的HDFs分为3组:HG2组(35 mmol/L葡萄糖)、HG2+低浓度Exos(5 μg/mL)组、HG2+高浓度Exos(50 μg/mL)组。培养3 d后,进行细胞增殖实验、细胞周期实验、细胞划痕实验、细胞ROS检测、细胞衰老β-半乳糖苷酶染色及Western blot,其中细胞增殖实验、细胞划痕实验、细胞ROS检测、细胞衰老β-半乳糖苷酶染色实验方法与1.4~1.7相同。
1.12 细胞周期实验收集各组细胞,用PBS洗涤3次,将细胞浓度调整为1×105/mL,加入70%预冷乙醇重悬固定,4 ℃过夜,离心(1 000 r/min,5 min),弃上清。将细胞沉淀用100 μL RNAase酶重悬,37 ℃孵育30 min。然后直接加入400 μL碘化丙锭(PI)染色液混匀后,4 ℃避光孵育1 h。流式细胞仪488 nm激发波长下测量细胞DNA的分布来估计3个细胞亚群(G0/G1、S和G2/M)。
1.13 Western blot用高浓度Exos(50 μg/mL)培养高糖诱导老化成纤维细胞3 d后,提取细胞蛋白检测p53和p21蛋白的表达水平。RIPA细胞裂解液提取HDFs总蛋白,用BCA法测定蛋白浓度。取20 μL蛋白经10% SDS-PAGE凝胶电泳后,转移至PVDF膜上,加5%脱脂牛奶封闭2 h后,分别加入一抗:小鼠抗人p53(1 :1 000,Abcam),小鼠抗人p21(1 :1 000,Abcam)及兔抗人GAPDH(1 :1 000,Abcam),4 ℃孵育过夜。次日TBST洗3次,以1 :5 000加入辣根过氧化物酶标记的二抗,室温孵育2 h,然后加入显影液后在LAS 4000图像分析系统进行采图,用Image J软件分析灰度值。
1.14 统计学方法使用SPSS 20.0软件和GraphPad Prism 7软件进行作图及统计分析。实验数据均为计量资料,以x±s表示,两组资料比较采用t检验,多组资料之间的比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 高糖环境抑制HDFs增殖能力、迁移能力并加速HDFs衰老细胞增殖实验结果显示,在培养1、3 d时,各组培养的HDFs细胞增殖率差异无统计学意义。在培养第5天时,与正常对照组相比,HG1组和HG2组HDFs增殖率略有下降,但差异无统计学意义。而在培养第7天时,HG1和HG2组细胞增殖能力明显抑制(P < 0.01,图 1A)。结果显示,用26、35 mmol/L葡萄糖培养基培养HDFs 7 d可明显抑制成纤维细胞增殖能力。
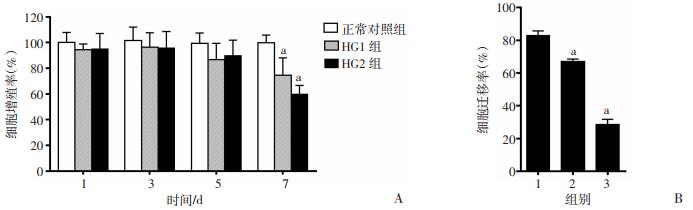
|
| A: CCK-8法检测高糖对HDFs增殖能力的影响;B:划痕实验检测高糖对HDFs迁移能力的影响 1:正常对照组;2:HG1组;3:HG2组;a: P < 0.01,与正常对照组比较 图 1 高糖对HDFs增殖的影响 |
根据细胞增殖实验结果,选择用高糖培养HDFs 7 d,以观察高糖对HDFs迁移能力的影响。划痕实验结果显示,与正常对照组相比,HG1组和HG2组HDFs迁移率显著降低(P < 0.01,图 1B、图 2A)。划痕实验结果显示,在高糖环境培养7 d时,26、35 mmol/L葡萄糖培养基均可以抑制成纤维细胞的迁移能力。
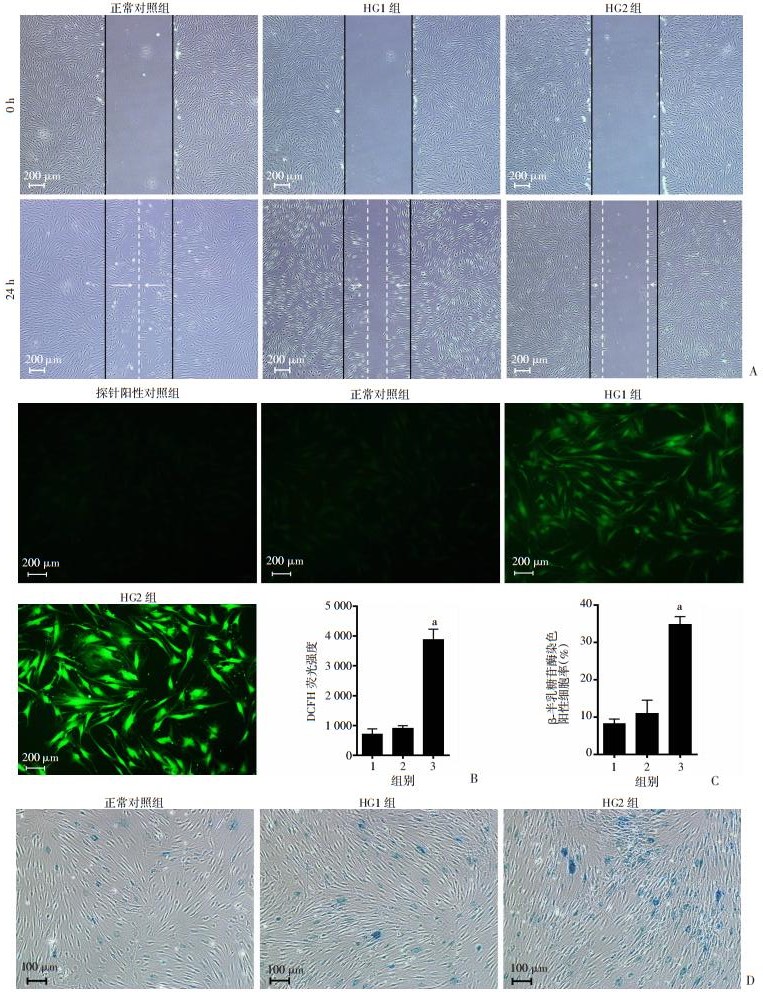
|
| A:划痕实验观察高糖对HDFs迁移能力的影响;B: DCFH探针检测高糖对HDFs内ROS产生水平的影响;C、D:衰老β半乳糖苷酶试剂评估高糖对HDFs衰老的影响1:正常对照组;2:HG1组;3:HG2组;a: P < 0.01,与正常对照组比较 图 2 高糖对HDFs迁移及衰老的影响 |
如图 2B所示,培养7 d后,与正常对照组相比,HG1组细胞内产生ROS水平差异无统计学意义,而HG2组HDFs内ROS水平显著升高(P < 0.01),提示35 mmol/L的高糖环境可刺激HDFs细胞内的ROS水平升高,从而诱发细胞衰老。
镜下观察细胞衰老β半乳糖苷酶染色结果(图 2D),HG1组HDFs无明显变化,染色率与正常对照组相比差异无统计学意义。但用HG2培养HDFs 7 d后,细胞逐渐出现老化表现,镜下可见明显蓝绿色细胞染色(P < 0.01)。衰老相关β半乳糖苷酶染色提示35 mmol/L的高糖环境可加速成纤维细胞老化(图 2C)。
2.2 PMSCs及其上清液来源Exos的鉴定流式细胞仪检测结果显示,该细胞高表达CD105、CD90和CD73,而低表达CD34和CD45(图 3A)。P3代PMSCs经成骨诱导培养后,茜素红染色可见钙结节呈红色(图 3B)。经成脂诱导培养后,油红O染色后可见脂滴呈红色(图 3C)。结果证明,从胎盘组织中提取的细胞属于间充质干细胞。
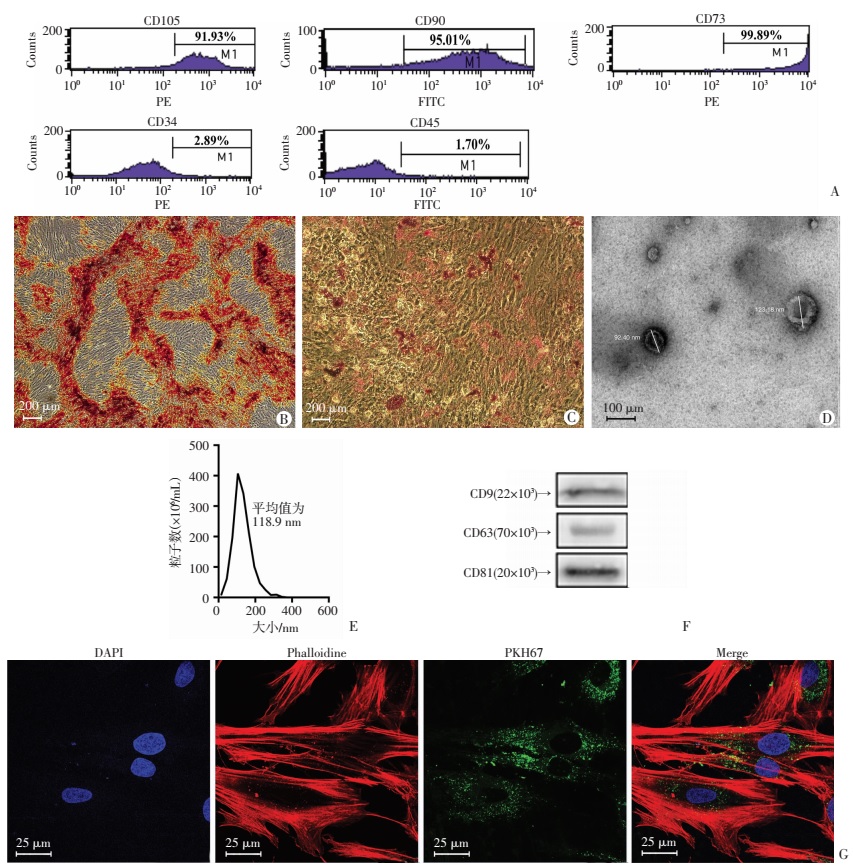
|
| A:流式细胞仪检测PMSCs表面抗原表达特征;B:茜素红S染色评估PMSCs成骨诱导钙化情况;C:油红O染色显示胎盘间充质干细胞成脂诱导情况;D:透射电镜观察外泌体超微结构;E:纳米颗粒跟踪分析仪测量Exos粒度分布;F:Western blot检测CD9、CD63和CD81的表达水平;G:免疫荧光观察Exos在HDFs内定位 图 3 PMSCs及其培养上清液来源Exos鉴定 |
透射电子显微镜下Exos为大小分布均匀的杯状双层膜性囊泡(图 3D)。纳米颗粒跟踪分析仪检测Exos粒径为(118.9±49.5)nm(图 3E)。Western blot检测Exos膜表面标志性蛋白CD9、CD63和CD81表达均呈阳性(图 3F)。Exos内化实验结果显示,经共聚焦显微镜检可见绿色荧光小点分布于细胞内并积聚于细胞核周围,说明HDFs可摄取Exos进入细胞内(图 3G)。
2.3 Exos促进高糖培养HDFs的增殖能力、迁移能力并改善HDFs的衰老状态为了探索不同浓度的Exos是否能使高糖诱导衰老的HDFs进入细胞增殖期,通过流式细胞术检测细胞DNA分布来估计3个细胞亚群(G0/G1、S和G2/M)(图 4A、B)。HG2+低浓度Exos组增殖指数值(PI,G2/M与S之和)与HG2组相比,差异无统计学意义。但HG2+高浓度Exos组的PI值则明显升高,与对照组相比差异有统计学意义(P < 0.01)。通过比较PI值,说明HG2+高浓度Exos组可使得更多HDFs进入S期和G2/M期,从而促进细胞增殖。
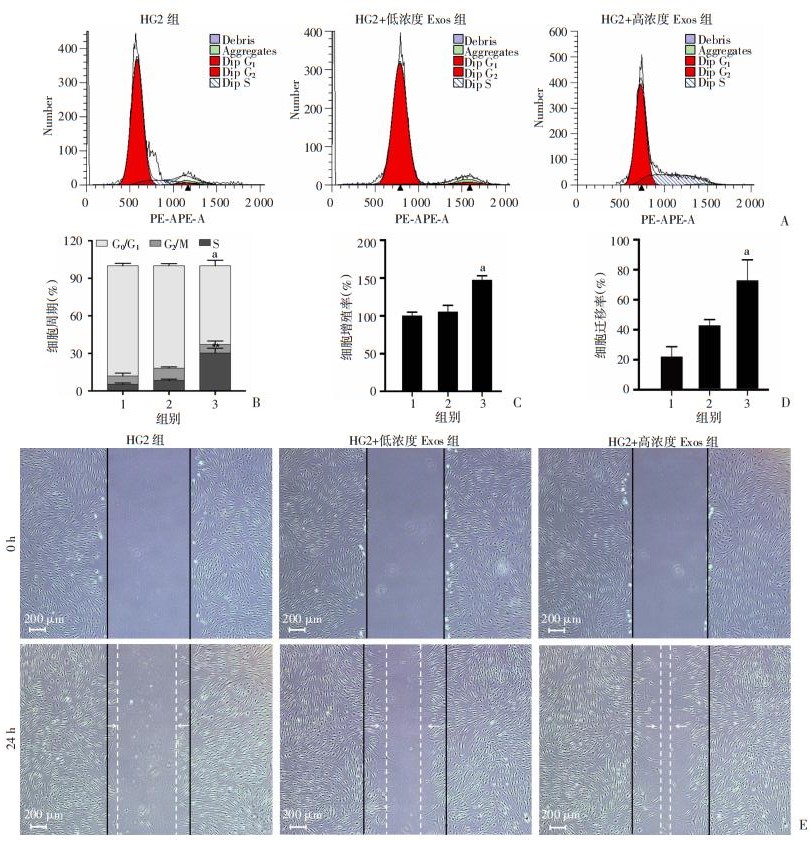
|
| A、B:流式细胞仪检测Exos对HDFs细胞周期的影响;C: CCK-8法检测Exos对高糖培养的HDFs增殖能力的影响;D、E:划痕实验检测Exos对HDFs迁移能力的影响 1: HG2组;2: HG2+低浓度Exos组;3: HG2+高浓度Exos组;a: P < 0.01,与HG2组比较 图 4 Exos对高糖培养的HDFs增殖能力、细胞周期及迁移能力的影响 |
细胞增殖实验结果显示(图 4C),与HG2组相比,5 μg/mL的Exos对HDFs增殖能力影响差异无统计学意义。当Exos浓度提高到50 μg/mL时,增殖率明显提高(P < 0.01)。
划痕实验结果显示(图 4D、E),HG2+低浓度Exos组与未处理组相比,迁移率差异无统计学意义。但HG2+高浓度Exos组的细胞迁移率显著增加(P < 0.01)。
细胞内ROS产生量检测结果显示,HG2+低浓度Exos组未能有效抑制细胞内ROS的产生。然而HG2+高浓度Exos组可显著抑制细胞内ROS产生,与HG2组相比,差异有统计学意义(P < 0.01, 图 5A)。
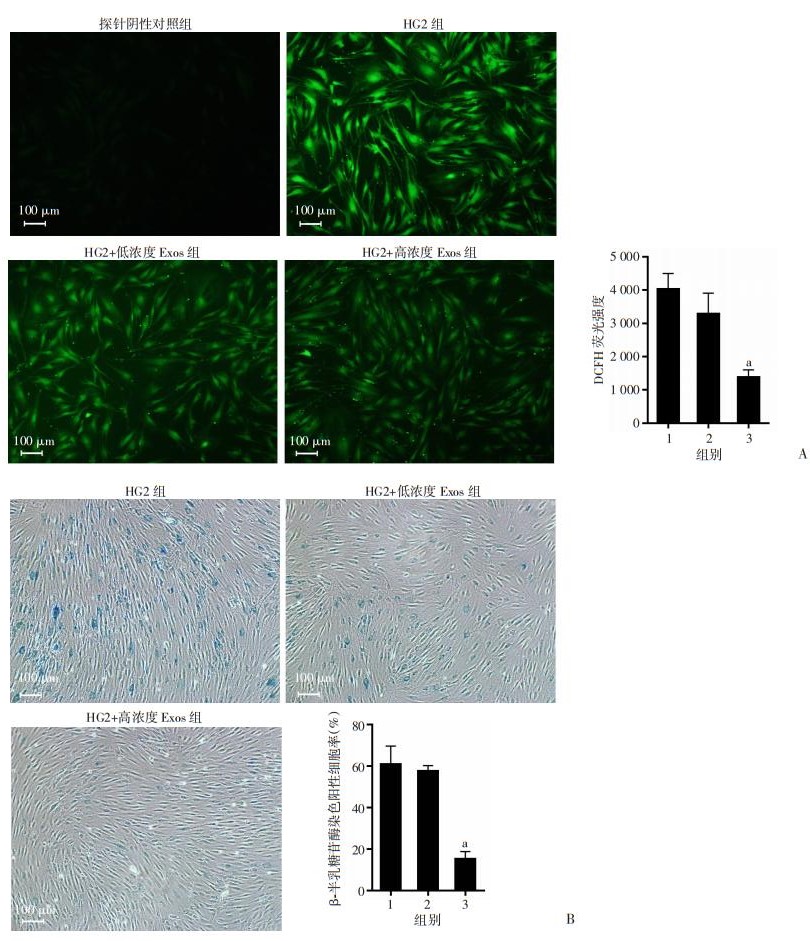
|
| A: DCFH探针检测高糖对HDFs内ROS产生水平的影响;B:衰老β半乳糖苷酶试剂评估Exos缓解HDFs的衰老状态 1:HG2组;2:HG2+低浓度Exos组;3:HG2+高浓度Exos组;a: P < 0.01,与HG2组比较 图 5 Exos对高糖培养的HDFs细胞内ROS产生水平及细胞衰老状态的影响 |
镜下观察衰老β半乳糖苷酶染色结果(图 5B),与HG2组相比,HG2+低浓度Exos组并未显著降低β半乳糖苷酶染色率。然而HG2+高浓度Exos组可显著降低β半乳糖苷酶染色率(P < 0.01)。结果提示,HG2+高浓度Exos组可逆转高糖培养HDFs的衰老状态。
2.4 Exos对高糖培养HDFs衰老相关蛋白p53和p21表达水平的影响Western blot结果显示,与HG2组相比,HG2+高浓度Exo组衰老相关蛋白p53和p21表达水平显著降低(P < 0.01,图 6)。表明50 μg/mL Exos可通过降低衰老相关蛋白p53和p21的表达水平,减轻HDFs的衰老状态。
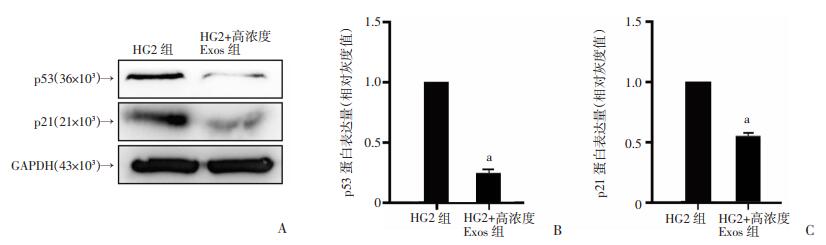
|
| A:Western blot检测结果;B:p53;C:p21;a: P < 0.01,与HG2组比较 图 6 Western blot测定p53和p21表达水平及半定量分析 |
3 讨论
糖尿病慢性难愈合创面是糖尿病的重要并发症,严重影响患者的生活质量。正常的创面愈合过程大致分为止血期、炎症期、增殖期(包括细胞外基质沉积)和重塑期[11]。此过程需要多种细胞参与,包括上皮层(角质形成细胞、表皮细胞、表皮干细胞等)、真皮层(成纤维细胞和肌成纤维母细胞)、血管和皮肤附属器等[12]。特别是成纤维细胞,其在创伤发生时受到其他细胞、细胞因子及细胞外基质等的调节,迅速增殖和迁移、组成肉芽组织填充创口、分泌胶原及最终参与瘢痕形成,其生物学行为决定了创面的愈合情况[13]。糖尿病所致的体内高糖环境可使上述参与创口愈合的多种细胞行为学功能紊乱,包括成纤维细胞的增殖和迁移受抑制,导致创面愈合延迟[14]。因此修复高糖条件下老化成纤维细胞的功能是加速慢性创面愈合的关键。
要研究如何改善高糖状态下成纤维细胞的功能状态,首先需要建立高糖老化模型。目前,大部分研究选择使用D-半乳糖诱导衰老,这与体内实际的高糖成分不相符。在本研究中,我们选择高浓度葡萄糖培养成纤维细胞,高浓度葡萄糖能更准确地模拟体内的高糖环境,实验采用26、35 mmol/L两种浓度诱导成纤维细胞[15]。结果表明, 用26、35 mmol/L培养成纤维细胞7 d时,均可抑制其增殖和迁移能力,但35 mmol/L葡萄糖还可促进成纤维细胞内产生更多ROS,并诱导细胞衰老。THOMAS等[16]研究发现,皮下组织的葡萄糖浓度与血浆中相似(5.5 mmol/L左右),因此我们将葡萄糖浓度为5.5 mmol/L的培养基作为正常对照组。在高糖环境下,细胞内ROS水平会急剧增加。ROS产生过多会直接导致细胞衰老[17]。高血糖血症在多种细胞中诱导过量ROS产生,包括人肾小管上皮细胞[18]、内皮细胞[19]和成纤维细胞,持续高水平的活性氧可诱导细胞衰老[20]。本研究中,短时间高糖诱导成纤维细胞ROS水平并无明显增长,而随着高糖培养时间的延长,成纤维细胞ROS水平可骤然升高。此外,在高糖条件下,衰老β半乳糖苷酶染色阳性的细胞数量明显增加。这些结果显示,高血糖环境可抑制成纤维细胞增殖能力、迁移能力并促进细胞衰老。
PMSCs是再生医学重要的干细胞来源[21],其培养上清液因含有外泌体,而对多种疾病损伤的修复都表现出良好的效果,例如PMSCs来源外泌体可促进体内血管形成[9],将其与壳聚糖水凝胶复合后,可以增强外泌体的保留和稳定性,并增强对后肢缺血的治疗作用[22]。还有研究证实,PMSCs来源外泌体可显著降低TGF-β的表达以及心肌的纤维化水平从而抑制炎症,在杜氏肌营养不良的细胞治疗中具有重要的作用[23]。在本实验中,PMSCs来源外泌体促进高糖培养的成纤维细胞的增殖、迁移能力,类似报道还有滑膜间充质干细胞来源外泌体促进成纤维细胞的增殖,体内实验证实外泌体可促进胶原蛋白成熟[24],诱导性多能干细胞源的MSCs来源的外泌体在体外以剂量依赖的方式刺激了成纤维细胞增殖和迁移并促进Ⅰ、Ⅲ型胶原和弹性蛋白的分泌[8, 25]。
近年来研究表明,外泌体能够修复衰老(包括自然衰老[26]、UVB诱导衰老[27-28]、阿霉素诱导衰老[28])的成纤维细胞,促进其增殖、迁移,减少细胞内ROS产生等(例如,脂肪干细胞来源的外泌体可促进高糖培养的内皮祖细胞血管形成并减少其细胞内ROS产生[29],诱导性多能干细胞来源外泌体可减轻MSCs细胞内ROS水平,从而减缓细胞衰老[30]等)。在本研究中,我们将PMSCs来源的外泌体分为高浓度(50 μg/mL)组和低浓度(5 μg/mL)组进行实验。结果显示,高浓度外泌体可促进高糖培养成纤维细胞的增殖、迁移,并减少细胞内ROS产生,减缓细胞衰老。进一步研究发现,PMSCs来源的外泌体抵抗成纤维细胞衰老并促进其增殖、迁移的机制可能与下调衰老相关蛋白p53和p21的表达有关。细胞衰老是多种信号通路调控下的生理过程,其中p53-p21-pRB是代表性信号通路[31]。p53不仅是肿瘤抑制因子,也可调控细胞衰老。在正常细胞中,p53的表达通常维持在较低的水平,当p53激活时,通过诱导细胞周期阻滞,有效抑制细胞增殖[32]。p21一种是周期蛋白依赖激酶(cyclin-dependent kinases,CDK)抑制剂,可以拮抗周期蛋白-CDK复合物的活性,抑制细胞周期G1期向S期的转化[33]。p53在衰老过程中通过诱导p21发挥作用,因此p53和p21过表达被认为是细胞衰老的标志[34]。
综上,本研究建立了高浓度葡萄糖体外诱导成纤维细胞衰老的具体培养条件,证实了PMSCs来源的Exos通过下调成纤维细胞内p53及p21表达,从而改善高糖对成纤维细胞增殖、迁移的抑制作用,缓解高糖培养成纤维细胞的衰老状态,为PMSCs来源的Exos应用于糖尿病慢性创面的临床治疗提供参考。
| [1] |
LEFRANCOIS T, MEHTA K, SULLIVAN V, et al. Evidence based review of literature on detriments to healing of diabetic foot ulcers[J]. Foot Ankle Surg, 2017, 23(4): 215-224. DOI:10.1016/j.fas.2016.04.002 |
| [2] |
JOHNSTONE R M, ADAM M, HAMMOND J R, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262(19): 9412-9420. |
| [3] |
RANI S, RYAN A E, GRIFFIN M D, et al. Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications[J]. Mol Ther, 2015, 23(5): 812-823. DOI:10.1038/mt.2015.44 |
| [4] |
COOPER D R, WANG C Y, PATEL R, et al. Human adipose-derived stem cell conditioned media and exosomes containing MALAT1 promote human dermal fibroblast migration and ischemic wound healing[J]. Adv Wound Care (New Rochelle), 2018, 7(9): 299-308. DOI:10.1089/wound.2017.0775 |
| [5] |
TAKEUCHI R, KATAGIRI W, ENDO S, et al. Exosomes from conditioned media of bone marrow-derived mesenchymal stem cells promote bone regeneration by enhancing angiogenesis[J]. PLoS ONE, 2019, 14(11): e0225472. DOI:10.1371/journal.pone.0225472 |
| [6] |
LI X C, CHEN C Y, WEI L M, et al. Exosomes derived from endothelial progenitor cells attenuate vascular repair and accelerate reendothelialization by enhancing endothelial function[J]. Cytotherapy, 2016, 18(2): 253-262. DOI:10.1016/j.jcyt.2015.11.009 |
| [7] |
SHABBIR A, COX A, RODRIGUEZ-MENOCAL L, et al. Mesenchymal stem cell exosomes induce proliferation and migration of normal and chronic wound fibroblasts, and enhance angiogenesis in vitro[J]. Stem Cells Dev, 2015, 24(14): 1635-1647. DOI:10.1089/scd.2014.0316 |
| [8] |
ZHANG J Y, GUAN J J, NIU X, et al. Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis[J]. J Transl Med, 2015, 13: 49. DOI:10.1186/s12967-015-0417-0 |
| [9] |
KOMAKI M, NUMATA Y, MORIOKA C, et al. Exosomes of human placenta-derived mesenchymal stem cells stimulate angiogenesis[J]. Stem Cell Res Ther, 2017, 8(1): 219. DOI:10.1186/s13287-017-0660-9 |
| [10] |
ZHAO B, ZHANG Y J, HAN S C, et al. Exosomes derived from human amniotic epithelial cells accelerate wound healing and inhibit scar formation[J]. J Mol Hist, 2017, 48(2): 121-132. DOI:10.1007/s10735-017-9711-x |
| [11] |
FALANGA V. Wound healing and its impairment in the diabetic foot[J]. Lancet, 2005, 366(9498): 1736-1743. DOI:10.1016/S0140-6736(05)67700-8 |
| [12] |
DESJARDINS-PARK H E, FOSTER D S, LONGAKER M T. Fibroblasts and wound healing: an update[J]. Regen Med, 2018, 13(5): 491-495. DOI:10.2217/rme-2018-0073 |
| [13] |
ROGNONI E, WATT F M. Skin cell heterogeneity in development, wound healing, and cancer[J]. Trends Cell Biol, 2018, 28(9): 709-722. DOI:10.1016/j.tcb.2018.05.002 |
| [14] |
SUNDARAM G M, COMMON J E, GOPAL F E, et al. 'See-saw' expression of microRNA-198 and FSTL1 from a single transcript in wound healing[J]. Nature, 2013, 495(7439): 103-106. DOI:10.1038/nature11890 |
| [15] |
MAEDA M, HAYASHI T, MIZUNO N, et al. Intermittent high glucose implements stress-induced senescence in human vascular endothelial cells: role of superoxide production by NADPH oxidase[J]. PLoS ONE, 2015, 10(4): e0123169. DOI:10.1371/journal.pone.0123169 |
| [16] |
THOMAS K, KIWIT M, KERNER W. Glucose concentration in human subcutaneous adipose tissue: comparison between forearm and abdomen[J]. Exp Clin Endocrinol Diabetes, 1998, 106(6): 465-469. DOI:10.1055/s-0029-1212017 |
| [17] |
LEE J, SHIN Y K, SONG J Y, et al. Protective mechanism of morin against ultraviolet B-induced cellular senescence in human keratinocyte stem cells[J]. Int J Radiat Biol, 2014, 90(1): 20-28. DOI:10.3109/09553002.2013.835502 |
| [18] |
HE T, GUAN X, WANG S, et al. Resveratrol prevents high glucose-induced epithelial-mesenchymal transition in renal tubular epithelial cells by inhibiting NADPH oxidase/ROS/ERK pathway[J]. Mol Cell Endocrinol, 2015, 402: 13-20. DOI:10.1016/j.mce.2014.12.010 |
| [19] |
KANIKARLA-MARIE P, JAIN S K. L-Cysteine supplementation reduces high-glucose and ketone-induced adhesion of monocytes to endothelial cells by inhibiting ROS[J]. Mol Cell Biochem, 2014, 391(1/2): 251-256. DOI:10.1007/s11010-014-2009-3 |
| [20] |
LAMERS M L, ALMEIDA M E, VICENTE-MANZANARES M, et al. High glucose-mediated oxidative stress impairs cell migration[J]. PLoS ONE, 2011, 6(8): e22865. DOI:10.1371/journal.pone.0022865 |
| [21] |
LOBO S E, LEONEL L C, MIRANDA C M, et al. The placenta as an organ and a source of stem cells and extracellular matrix: a review[J]. Cells Tissues Organs (Print), 2016, 201(4): 239-252. DOI:10.1159/000443636 |
| [22] |
ZHANG K Y, ZHAO X N, CHEN X N, et al. Enhanced therapeutic effects of mesenchymal stem cell-derived exosomes with an injectable hydrogel for hindlimb ischemia treatment[J]. ACS Appl Mater Interfaces, 2018, 10(36): 30081-30091. DOI:10.1021/acsami.8b08449 |
| [23] |
BIER A, BERENSTEIN P, KRONFELD N, et al. Placenta-derived mesenchymal stromal cells and their exosomes exert therapeutic effects in Duchenne muscular dystrophy[J]. Biomaterials, 2018, 174: 67-78. DOI:10.1016/j.biomaterials.2018.04.055 |
| [24] |
TAO S C, GUO S C, LI M, et al. Chitosan wound dressings incorporating exosomes derived from microRNA-126-overexpressing synovium mesenchymal stem cells provide sustained release of exosomes and heal full-thickness skin defects in a diabetic rat model[J]. Stem Cells Transl Med, 2017, 6(3): 736-747. DOI:10.5966/sctm.2016-0275 |
| [25] |
KIM S, LEE S K, KIM H, et al. Exosomes secreted from induced pluripotent stem cell-derived mesenchymal stem cells accelerate skin cell proliferation[J]. Int J Mol Sci, 2018, 19(10): E3119. DOI:10.3390/ijms19103119 |
| [26] |
LEE H, CHA H, PARK J H. Derivation of cell-engineered nanovesicles from human induced pluripotent stem cells and their protective effect on the senescence of dermal fibroblasts[J]. Int J Mol Sci, 2020, 21(1): E343. DOI:10.3390/ijms21010343 |
| [27] |
OH M, LEE J, KIM Y J, et al. Exosomes derived from human induced pluripotent stem cells ameliorate the aging of skin fibroblasts[J]. Int J Mol Sci, 2018, 19(6): E1715. DOI:10.3390/ijms19061715 |
| [28] |
BAE Y U, SON Y, KIM C H, et al. Embryonic stem cell-derived mmu-miR-291a-3p inhibits cellular senescence in human dermal fibroblasts through the TGF-β receptor 2 pathway[J]. J Gerontol A Biol Sci Med Sci, 2019, 74(9): 1359-1367. DOI:10.1093/gerona/gly208 |
| [29] |
LI X, XIE X Y, LIAN W S, et al. Exosomes from adipose-derived stem cells overexpressing Nrf2 accelerate cutaneous wound healing by promoting vascularization in a diabetic foot ulcer rat model[J]. Exp Mol Med, 2018, 50(4): 29. DOI:10.1038/s12276-018-0058-5 |
| [30] |
LIU S Q, MAHAIRAKI V, BAI H, et al. Highly purified human extracellular vesicles produced by stem cells alleviate aging cellular phenotypes of senescent human cells[J]. Stem Cells, 2019, 37(6): 779-790. DOI:10.1002/stem.2996 |
| [31] |
KONG J G, PARK J B, LEE D, et al. Effect of high glucose on stress-induced senescence of nucleus pulposus cells of adult rats[J]. Asian Spine J, 2015, 9(2): 155-161. DOI:10.4184/asj.2015.9.2.155 |
| [32] |
CHOI O R, RYU M S, LIM I K. Shifting p53-induced senescence to cell death by TIS21(/BTG2/Pc3) gene through posttranslational modification of p53 protein[J]. Cell Signal, 2016, 28(9): 1172-1185. DOI:10.1016/j.cellsig.2016.05.014 |
| [33] |
BEAUSÉJOUR C M, KRTOLICA A, GALIMI F, et al. Reversal of human cellular senescence: roles of the p53 and p16 pathways[J]. EMBO J, 2003, 22(16): 4212-4222. DOI:10.1093/emboj/cdg417 |
| [34] |
JIN H, LIAN N, ZHANG F, et al. Activation of PPARγ/P53 signaling is required for curcumin to induce hepatic stellate cell senescence[J]. Cell Death Dis, 2016, 7. DOI:10.1038/cddis.2016.92 |



