胃癌是全球常见的肿瘤,也是我国发病率较高的肿瘤之一,五年生存率较低[1]。东亚属于高发区,日本、韩国因为对胃癌的早期筛查十分重视,虽然仍处在较高的发病水平,但患者的五年生存率以及预后情况均明显高于世界平均水平[2]。作为胃癌发病的大国,我国目前对胃癌的防控治疗虽取得了较大的进步,但仍然不容乐观。虽然胃癌的诊断和治疗已有长足的进展,但胃癌每年的发病率与死亡率仍然居高不下,归根结底与胃癌的早期侵袭转移密切相关,导致很多胃癌患者在明确诊断时已经出现远处转移而失去治疗机会。因此,探索参与胃癌侵袭转移的关键分子及机制具有重要的临床意义。
乙酰肝素酶2(Heparanase-2,HPSE2)是乙酰肝素酶(Heparanase,HPSE)目前发现的唯一同源基因。HPSE是一种极其重要的内源性糖苷内切酶,能够特异性剪切细胞外基质中的重要成分硫酸乙酰肝素蛋白多糖的侧链硫酸乙酰肝素(Heparan sulfate,HS)[3]。而HS的酶促降解可破坏细胞外基质的结构,从而促进肿瘤细胞生长、血管生成和侵袭转移,与肿瘤的发生发展密切相关[4-5]。研究表明,在多种肿瘤中,过表达HPSE可以明显促进肿瘤的生长和侵袭,而抑制HPSE表达或使用肝素酶活性抑制剂可显著抑制肿瘤的生长及侵袭转移能力[6-7]。HPSE2由McKenzie团队于2000年首次克隆出[8]。完整的HPSE2基因全长2 353 bp,由592个编码氨基酸组成。在HPSE和HPSE2的编码区域中,它们的总一致性为40%,序列相似度为59%,其中对HPSE酶活性极其重要的残基Glu225和Glu343仍然存在于HPSE2中。由于HPSE2的特异性剪接,除了全长的肝素酶2(HPSE2c)以外,还有480个氨基酸的HPSE2a和534个氨基酸的HPSE2b[8]。与HPSE不同的是,由于HPSE2并不经历蛋白水解过程,HPSE2并没有HPSE的酶活性,不能特异性地剪切HS。但HPSE2却仍然保留了结合HS的能力,并且相比HPSE有着更高的亲和力,能竞争性结合HS,从而抑制HPSE的活性[9]。HPSE2在很多组织中均有表达,尤其是在大脑、乳腺、前列腺、小肠、睾丸、子宫和膀胱中的表达较高。与之相反,在正常人体中HPSE几乎不表达,仅少量存在于造血细胞和胎盘中[10-11]。二者表达的位置明显不同表明,至少在正常组织中,HPSE2和HPSE有着不同的功能。有研究报道,HPSE2过表达可导致赖氨酰氧化酶(Lysyl oxidase,Lox)表达显著增加[3]。另外,在头颈癌中HPSE2高表达使得分化抑制因子1(Inhibitor of differentiation 1,Id-1)表达减少,抑制新生血管的生成[12-13]。虽然已有部分研究发现HPSE2可能抑制其他多种肿瘤的侵袭转移,但HPSE2在胃癌中的表达及其作用仍不清楚。因此,本研究拟通过检测HPSE2在胃癌组织表达,分析其表达水平与胃癌临床特征及其预后的关系,进一步体外生物学验证HPSE2过表达对胃癌细胞侵袭和迁移能力的影响。
1 材料与方法 1.1 临床资料胃癌组织芯片购买自上海芯超生物,共188例,为2006年7月至2010年6月均经病理诊断为胃癌并接受手术治疗的患者,由上海芯超生物伦理委员会审批并出具相关证明。选取其中135例胃腺癌患者, 包含135点胃癌组织,127点癌旁组织。术后随访至患者因胃癌死亡,或截至2016年6月6日。时长0~108个月,随访过程中,失访2例,随访率98.52%。
1.2 细胞培养及慢病毒感染胃腺癌细胞SGC7901以及MKN28均为新桥医院消化内科实验室保存,采用DMEM高糖培养基(10%胎牛血清)于37 ℃、5% CO2培养箱中培养。过表达HPSE2的慢病毒及其对照由上海吉凯公司构建,LV-HPSE2慢病毒感染SGC7901以及MKN28并用嘌呤霉素筛选得到稳转株(LV-HPSE2组),转染其阴性对照的作为对照组(LV-NC组)。
1.3 试剂与仪器高糖DMEM培养液及胎牛血清购自美国Hyclone公司, 8 μm Transwell小室购自Corning公司, Matrigel基质胶标准品购自Biocoat公司,anti-HPSE2购自Abcam公司。
1.4 Western blot检测以蛋白裂解液提取细胞总蛋白,BCA法检测蛋白浓度,使用5%的浓缩胶和10%的分离胶SDS-PAGE电泳, 每孔的上样量为30 μg总蛋白。浓缩胶60 V电泳30 min,分离胶120 V电泳90 min,常规湿转法100 V转膜70 min,5%脱脂奶粉封闭2 h,免疫抗体反应(稀释比例,一抗HPSE2 1 :1 000,GAPDH 1 :1 000;二抗:山羊抗兔1 :10 000)。ECL化学发光,凝胶成像系统显影。
1.5 Transwell实验细胞迁移能力检测:在Transwell小室的下室加入含10%胎牛血清的培养基,上室加入无血清培养基(约含细胞1×105/孔),培养24 h后,用PBS清洗3遍,4%多聚甲醛固定20 min,再用PBS清洗3遍,0.1%结晶紫染色15 min,棉签轻轻刮掉小室上室内的细胞,在显微镜下随机选取3个高倍视野并计数细胞。每组重复3次。
细胞侵袭能力检测:将无血清培养基预冷,按1 :8稀释基质胶,加入小室,37 ℃放置30 min,呈凝胶状态备用,其余步骤同迁移实验。
1.6 免疫组化先将组织芯片在60 ℃烤箱烘烤60 min,随后加入3%过氧化氢阻断液室温放置15 min。将组织芯片置于柠檬酸钠抗原修复液中修复,足量山羊封闭血清,37 ℃封闭45 min。滴加一抗(1 :200配比稀释获得),4 ℃过夜。置于室温30 min,PBS溶液洗涤3次每次5 min。滴加足量兔用二抗,37 ℃孵育60 min。弃二抗,PBS洗3次每次15 min。DAB显色,苏木精复染,60 ℃烘箱烘干脱水,二甲苯透明,中性树胶进行封片。阴性对照采用PBS代替一抗,阳性对照采用HPSE2在结直肠腺体中的阳性染色。
采用半定量法判定结果:染色强度:按无染色、浅黄色、黄色、黄褐色分别赋予0、1、2、3分;阳性细胞百分比:按 <5%、5%~25%、>25%~50%、>50%~75%、>75%分别赋予0、1、2、3、4分。将二者得分相乘判定结果,0~6分为阴性(-),>6分为阳性(+)。每个病理切片均由病理科2位医师盲法完成观察,并提供相应的病理评分。
1.7 统计学分析采用SPSS20.0统计软件,两组间比较采用t检验或非参数秩和检验,生存分析用Kaplan Meier法和Log rank检验,采用Cox比例风险模型分析影响患者预后的风险因素。
2 结果 2.1 Western blot检测HPSE2蛋白变化LV-HPSE2慢病毒感染SGC7901以及MKN28并用嘌呤霉素筛选,通过Western blot检测发现,LV-HPSE2组蛋白表达水平(2.75±0.09, 1.61±0.02)明显高于LV-NC组(P < 0.05,图 1),表明慢病毒感染有效,靶向HPSE2的LV-HPSE2能显著提高HPSE2的表达。
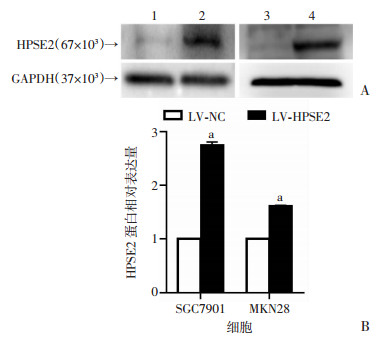
|
| A:Western blot检测结果 1:SGC7901-NC; 2: SGC7901-HPSE2; 3: MKN28-NC; 4: MKN28-HPSE2;B:半定量分析结果 a:P < 0.05,与LV-NC组比较 图 1 Western blot检测慢病毒感染后HPSE2在蛋白水平的变化 |
2.2 胃腺癌及癌旁组织中的HPSE2蛋白表达
HPSE2蛋白位于细胞质中,且阳性表达主要在癌旁组织,明显高于癌组织。在癌组织的平均病理评分为4.56,显著低于癌旁组织(t=13.77,P < 0.05,图 2)。
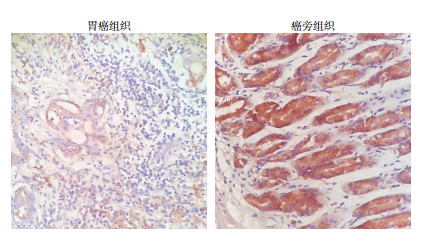
|
| 图 2 HPSE2在胃癌组织及癌旁组织中的表达 (×200) |
2.3 HPSE2在胃癌组织中表达与临床病理特征的关系
不同性别、不同T分期、不同M分期的HPSE2蛋白阳性表达率差异无统计学意义(P>0.05),不同临床分期、不同年龄、不同大小和不同N分期的HPSE2蛋白阳性表达率差异有统计学意义(P < 0.05,表 1)。
| 临床病理参数 | n | HPSE2蛋白 | χ2 | P | |
| 低表达 | 高表达 | ||||
| 性别 | 0.530 | 0.467 | |||
| 男性 | 101 | 57 | 44 | ||
| 女性 | 33 | 21 | 12 | ||
| 年龄/岁 | 10.585 | 0.001 | |||
| <65 | 62 | 27 | 35 | ||
| ≥65 | 73 | 52 | 21 | ||
| 肿瘤大小 | 6.946 | 0.008 | |||
| <5 cm | 54 | 24 | 30 | ||
| ≥5 cm | 77 | 52 | 25 | ||
| T分期 | 1.597 | 0.206 | |||
| T1-T2 | 26 | 12 | 14 | ||
| T3-T4 | 95 | 57 | 38 | ||
| N分期 | 5.713 | 0.017 | |||
| N1-N2 | 58 | 27 | 31 | ||
| N3-N4 | 76 | 51 | 25 | ||
| M分期 | 0.507 | 0.476 | |||
| M0 | 128 | 74 | 54 | ||
| M1 | 7 | 5 | 2 | ||
| 临床分期 | 3.956 | 0.047 | |||
| Ⅰ-Ⅱ | 54 | 26 | 28 | ||
| Ⅲ-Ⅳ | 73 | 48 | 25 | ||
2.4 HPSE2蛋白表达与胃癌患者预后的关系
135例患者术后随访0~108个月,中位随访时间36个月。Kaplan Meier生存分析结果显示,HPSE2蛋白低表达组患者中位生存时间23个月,累积生存率46.8%,HPSE2蛋白高表达组患者中位生存时间72个月,累积生存率50.0%,Log rank检验差异有统计学意义(χ2=15.11,P < 0.05,图 3)
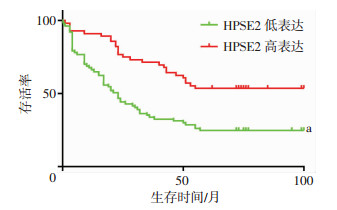
|
| a:P < 0.05,与HPSE2高表达组比较 图 3 HPSE2蛋白表达量与胃癌患者生存的关系 |
2.5 Cox比例风险模型分析影响胃癌患者预后的因素
结果显示,临床分期、肿瘤大小和HPSE2蛋白表达是影响胃癌患者预后的风险因素(HR=3.534, 1.919, 1.818,P < 0.05,表 2)。
| 临床病理参数 | n | 单因素回归分析 | 多因素回归分析 | ||||||
| HR | 95% CI | P | HR | 95% CI | P | ||||
| 性别 | |||||||||
| 男性 | 101 | ||||||||
| 女性 | 33 | 0.928 | 0.567~1.519 | 0.767 | |||||
| 年龄/岁 | |||||||||
| <65 | 62 | ||||||||
| ≥65 | 73 | 1.033 | 1.012~1.055 | 0.002 | 1.019 | 0.996~1.043 | 0.110 | ||
| 临床分期 | |||||||||
| Ⅰ-Ⅱ | 54 | ||||||||
| Ⅲ-Ⅳ | 73 | 2.748 | 1.698~4.449 | 0.000 | 3.534 | 1.187~10.518 | 0.023 | ||
| T分期 | |||||||||
| T1-T2 | 26 | ||||||||
| T3-T4 | 95 | 2.920 | 1.451~5.874 | 0.003 | 1.526 | 0.710~3.281 | 0.279 | ||
| N分期 | |||||||||
| N1-N2 | 58 | ||||||||
| N3-N4 | 76 | 1.908 | 1.222~2.980 | 0.005 | 0.410 | 0.151~1.110 | 0.079 | ||
| M分期 | |||||||||
| M0 | 128 | ||||||||
| M1 | 7 | 3.748 | 1.702~8.253 | 0.001 | |||||
| 肿瘤大小 | |||||||||
| <5 cm | 54 | ||||||||
| ≥5 cm | 77 | 2.988 | 1.854~4.813 | 0.000 | 1.919 | 1.075~3.427 | 0.027 | ||
| HPSE2 | |||||||||
| 低表达 | 79 | ||||||||
| 高表达 | 56 | 2.304 | 1.465~3.625 | 0.000 | 1.818 | 1.098~3.010 | 0.020 | ||
2.6 HPSE2对胃癌细胞迁移和侵袭力的影响
Transwell实验结果显示,高表达HPSE2的SGC7901、MKN28细胞, 其迁移细胞数(80.33±12.01,80.33±8.02)与对照组(126.67±5.03, 170.33±14.36)相比均显著减少(t=6.161,9.475, P < 0.05,图 4)。高表达HPSE2的SGC7901、MKN28细胞,其侵袭细胞数(55.67±10.07,37.67±3.51)与对照组(99.67±5.69,115.33±14.74)相比也显著减少(t=6.592, 8.877, P < 0.05,图 5)。
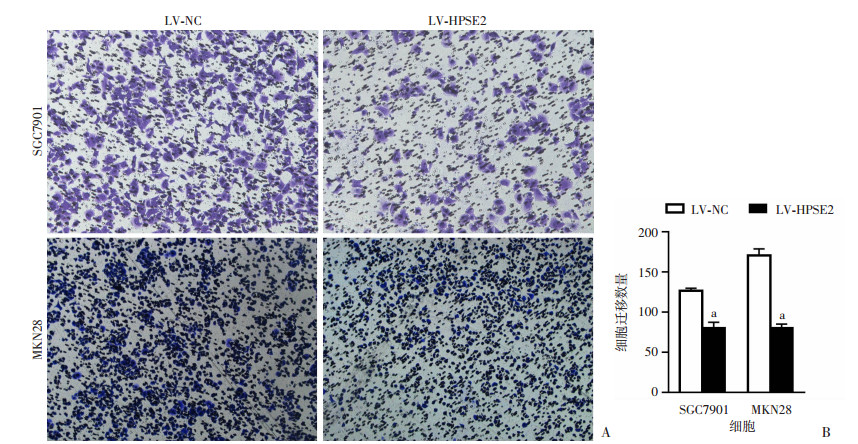
|
| A:各组胃癌细胞的迁移能力(结晶紫×200);B:胃癌细胞的迁移细胞数 a:P < 0.05,与LV-NC组比较 图 4 Transwell法检测胃癌细胞的迁移能力 |
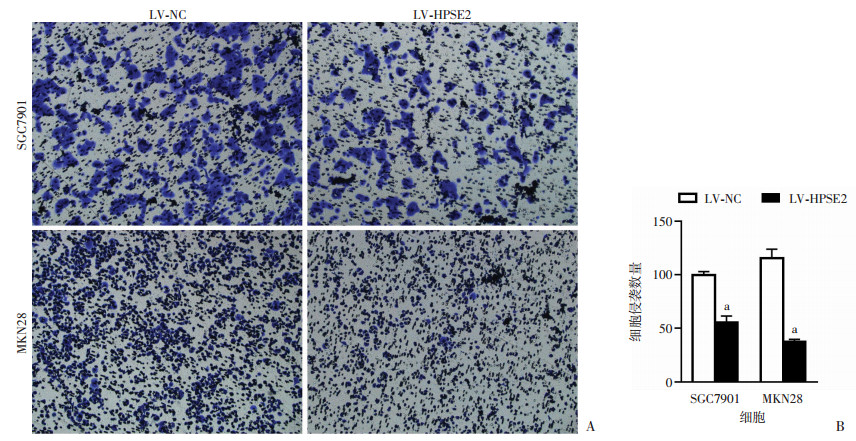
|
| A:各组胃癌细胞的侵袭能力(结晶紫×200);B:胃癌细胞的侵袭细胞数 a:P < 0.05,与LV-NC组比较 图 5 Transwell法检测胃癌细胞侵袭能力 |
3 讨论
我国的胃癌早期诊断率不高,且发病有年轻化趋势。目前主流的治疗方案以手术切除为主,辅以放化疗,复发率较高,并且患者生存质量较差。基因靶向治疗为胃癌的治疗提供新的方向。HPSE与胃癌的发展有密切的关系,且与肿瘤耐药相关。而HPSE2作为HPSE的同源基因,目前在胃癌中的作用及机制不清。在结直肠癌中,HPSE2与HPSE的蛋白表达呈负相关,HPSE2表达越高,HPSE的表达随之降低,肿瘤的恶性程度也越低,提示HPSE2可能通过抑制HPSE的酶活性从而抑制肿瘤的进展。另外在膀胱癌中,HPSE2过表达可导致Lox表达显著增加。这是一种与胶原沉积和组织纤维化密切相关的酶,可以抑制肿瘤血管生成[3]。而在头颈癌中HPSE2高表达者,其Id-1表达明显减少,这是一种促血管生成转录因子[12]。值得注意的是,在膀胱癌及头颈癌中,HPSE2过表达并没有抑制HPSE的酶活性,提示HPSE2在膀胱和头颈部具有与HPSE无关的机制,说明了HPSE2与HPSE之间可能存在多种调控机制。
本研究结果显示,HPSE2在胃癌组织中呈低表达,在癌旁组织中呈高表达,并且表达水平与胃癌的淋巴结转移及临床分期密切相关,高表达HPSE2的肿瘤转移及临床分期均明显优于低表达患者。进一步通过Kaplan Meier生存分析发现,HPSE2蛋白高表达患者的中位生存时间以及累积生存率均高于HPSE2低表达患者,表明HPSE2蛋白表达水平与胃癌患者生存率有一定的关系。同时,Cox比例风险模型分析结果显示,HPSE2蛋白水平是影响胃癌患者生存预后的重要风险因素之一。以上结果初步提示,HPSE2在胃癌及癌旁组织中的表达存在明显差异,HPSE2的表达水平与胃癌的侵袭转移及预后密切相关,提示HPSE2可能在胃癌侵袭转移调控中发挥重要作用。
本研究进一步在胃癌细胞过表达HPSE2建立稳定表达细胞,通过Transwell实验发现,HPSE2过表达可明显抑制胃癌细胞的体外侵袭和迁移能力,提示HPSE2确实参与了胃癌细胞侵袭和迁移的调控,但其机制仍不十分清楚。在肿瘤细胞迁移侵袭过程中,细胞外基质中的胶原蛋白、层粘连蛋白、纤维结合蛋白和HS的降解是其中重要的始动因素。因此,包括基质金属蛋白酶、丝氨酸蛋白酶以及糖苷内切酶在内的多种基质降解酶的作用就显得非常重要。而既往研究显示,HPSE2可能通过抑制HPSE的活性而抑制肿瘤的侵袭转移[14],那么,HPSE2是否可通过抑制包括HPSE在内的其他基质降解酶的作用而参与胃癌侵袭转移的调控,尚需进一步研究证明。同时,亦有研究发现,HPSE2可以调节特定的肿瘤抑制基因,这些基因与肿瘤侵袭转移、细胞凋亡、内质网应激等作用密切相关[14-16]。因此,在我们的后续研究中,将重点关注HPSE2通过直接作用抑制其他相关活性酶的作用以及HPSE2在调控其他相关基因表达中的作用及机制,以期阐明HPSE2抑制胃癌侵袭转移的作用机制。
综上所述,本研究显示,HPSE2蛋白在胃癌组织中低表达,与肿瘤大小、淋巴结转移及临床分期及生存预后密切相关。HPSE2过表达可明显抑制胃癌细胞的体外侵袭和迁移能力。深入阐明HPSE2在胃癌侵袭转移中的作用及机制,将为胃癌侵袭转移的早期诊治提供新的理论依据。
| [1] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
BENCIVENGA M, VERLATO G, HAN D S, et al. Validation of two prognostic models for recurrence and survival after radical gastrectomy for gastric cancer[J]. Bri J Surg, 2017, 104(9): 1235-1243. DOI:10.1002/bjs.10551 |
| [3] |
VLODAVSKY I, GROSS-COHEN M, WEISSMANN M, et al. Opposing functions of heparanase-1 and heparanase-2 in cancer progression[J]. Trends Biochem Sci, 2018, 43(1): 18-31. DOI:10.1016/j.tibs.2017.10.007 |
| [4] |
VLODAVSKY I, SINGH P, BOYANGO I, et al. Heparanase: From basic research to therapeutic applications in cancer and inflammation[J]. Drug Resistance Updates, 2016, 29: 54-75. DOI:10.1016/j.drup.2016.10.001 |
| [5] |
CHEN X, ZHAO H, CHEN C, et al. The HPA/SDC1 axis promotes invasion and metastasis of pancreatic cancer cells by activating EMT via FGF2 upregulation[J]. Oncol Lett, 2020, 19(1): 211-220. DOI:10.3892/ol.2019.11121 |
| [6] |
VORNICOVA O, BOYANGO I, FELD S, et al. The prognostic significance of heparanase expression in metastatic melanoma[J]. Oncotarget, 2016, 7(46): 74678-74685. DOI:10.18632/oncotarget.12492 |
| [7] |
SHAH S, FOURGEAUD C, DERIEUX S, et al. The close relationship between heparanase and epithelial mesenchymal transition in gastric signet-ring cell adenocarcinoma[J]. Oncotarget, 2018, 9(73): 33778. DOI:10.18632/oncotarget.26042 |
| [8] |
JIN H, CUI M. New advances of heparanase and heparanase-2 in human diseases[J]. Arch Med Res, 2018, 49(7): 423-429. DOI:10.1016/j.arcmed.2019.02.004 |
| [9] |
LEVY-ADAM F, FELD S, COHEN-KAPLAN V, et al. Heparanase 2 interacts with heparan sulfate with high affinity and inhibits heparanase activity[J]. J Biol Chem, 2010, 285(36): 28010-28019. DOI:10.1074/jbc.M110.116384 |
| [10] |
MARQUES R M, FOCCHI G R, THEODORO T R, et al. The immunoexpression of heparanase 2 in normal epithelium, intraepithelial, and invasive squamous neoplasia of the cervix[J]. J Low Genit Tract Dis, 2012, 16(3): 256-262. DOI:10.1097/LGT.0b013e3182422c69 |
| [11] |
WHITEHEAD M J, MCGONIGAL R, WILLISON H J, et al. Heparanase attenuates axon degeneration following sciatic nerve transection[J]. Sci Rep, 2018, 8(1). DOI:10.1038/s41598-018-23070-6 |
| [12] |
GROSS-COHEN M, FELD S, DOWECK I, et al. Heparanase 2 attenuates head and neck tumor vascularity and growth[J]. Cancer Res, 2016, 76(9): 2791-2801. DOI:10.1158/0008-5472.CAN-15-1975 |
| [13] |
LV B, ZHANG B, HU X Y, et al. Heparanase regulates in vitro VEGF-C expression and its clinical significance to pancreatic ductal cell adenocarcinoma[J]. Oncol Lett, 2016, 11(2): 1327-1334. DOI:10.3892/ol.2016.4085 |
| [14] |
FU J, KHAYBULLIN R, ZHANG Y, et al. Gene expression profiling leads to discovery of correlation of matrix metalloproteinase 11 and heparanase 2 in breast cancer progression[J]. BMC Cancer, 2015, 15(1). DOI:10.1186/s12885-015-1410-y |
| [15] |
GARCÍA B, MARTÍN C, GARCÍA-SUÁREZ O, et al. Upregulated Expression of Heparanase and Heparanase 2 in the Brains of Alzheimer's Disease[J]. J Alzheimer's Dis, 2017, 58(1): 185-192. DOI:10.3233/JAD-161298 |
| [16] |
ROBERTS N A, HILTON E N, LOPES F M, et al. Lrig2 and Hpse2, mutated in urofacial syndrome, pattern nerves in the urinary bladder[J]. Kidney Int, 2019, 95(5): 1138-1152. DOI:10.1016/j.kint.2018.11.040 |



