2. 610041 成都,四川大学:华西药学院微生物与生化药学教研室
2. Department of Microbiology and Biochemical Pharmacy, West China School of Pharmacy, Sichuan University, Chengdu, Sichuan Province, 610041, China
Heregulin(HRG),又称neuregulin,是一类激活酪氨酸激酶受体的EGF样生长因子。HRG有4种亚型,其中有关HRG1的研究最多。HRG1可以调节细胞增殖、分化、凋亡和迁移[1],在乳腺癌、胰腺癌、肺癌、结直肠癌和卵巢癌等多种人类癌症的发生、发展中起作用[2-3]。HRG1的高表达与乳腺癌患者预后不良有关,多达50%的人类乳腺肿瘤中发现HRG1表达增加[4]。HRG1是多种组织中ErbB3和ErbB4的内源性配体。由HRG1介导的ErbB2/ErbB3异源二聚体在促进HER2阳性乳腺癌细胞增殖和细胞迁移中起重要作用[5]。HRG1亚型分为α、β和γ三种,HRG-β1与受体的亲和力最高[6],常选择HRG-β1用于研究。
研究表明,脂代谢异常在恶性肿瘤的发生、发展中起重要作用[7]。硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase-1,SCD1)催化饱和脂肪酸(saturated fatty acids,SFAs)转变为单不饱和脂肪酸(monounsaturated fatty acids,MUFAs),主要是将硬脂酸和棕榈酸催化形成油酸(oleic acid,OA)和棕榈油酸[8-9]。SCD1在包括肺癌、肝癌、结直肠癌和乳腺癌等癌症中高表达,且SCD1及其催化产物在恶性肿瘤的发生、发展中起重要作用[10-14]。在乳腺癌中,SCD1高表达患者的总生存期和无复发生存期短于SCD1低表达患者。因此,SCD1可作为乳腺癌患者预后的指标[12]。但HRG-β1是否能影响乳腺癌细胞中SCD1的表达尚不清楚。本研究观察HRG-β1对脂代谢关键酶SCD1表达的影响,进而初步探讨SCD1酶活性在HRG-β1诱导的乳腺癌MCF7和SK-BR-3细胞增殖、迁移和侵袭中的作用。
1 材料与方法 1.1 实验材料 1.1.1 细胞株人乳腺癌细胞MCF7购自中国科学院上海生命科学研究院细胞资源中心,人乳腺癌细胞SK-BR-3购自中国医学科学院基础医学研究所基础医学细胞中心。
1.1.2 主要试剂DMEM/F12(1:1)培养基、RPMI 1640培养基、青霉素-链霉素(penicillin-streptomycin, PS)、胰蛋白酶购自美国HyClone公司;胎牛血清(fetal bovine serum,FBS)购自以色列Biological Industries公司;蛋白标准品和PVDF膜购自美国Bio-Rad公司;Heregulin-β1(HRG-β1)购自美国Peprotech公司;SCD1抑制剂A939572购自美国MedChemExpress公司;油酸购自美国Cayman公司;TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒(RR360A)和qPCR试剂盒(RR820A)均购自日本TaKaRa公司。SCD1和β-actin引物购自上海吉玛制药技术有限公司;SCD1抗体购自美国Abcam公司;α-Tubulin抗体、Bradford蛋白浓度测定试剂盒、ECL超敏化发光试剂盒以及辣根酶过氧化物酶标记的抗鼠和抗兔二抗购自上海碧云天生物技术有限公司。MTT试剂购自浙江RUIBIO公司,Matrigel基底胶和8 μm Transwell细胞培养小室均购自美国BD公司。
1.2 方法 1.2.1 细胞培养人乳腺癌细胞MCF7和SK-BR-3分别用含10%FBS、1%PS的DMEM/F12和RPMI 1640培养基,于37 ℃、5% CO2饱和湿度的细胞培养箱中培养。
1.2.2 HRG-β1处理MCF7和SK-BR-3细胞取生长期的MCF7和SK-BR-3细胞,用胰酶消化重悬后接种于6孔板(MCF7细胞数为8×105个/孔,SK-BR-3细胞数为3×105个/孔),贴壁后,饥饿处理8 h,分为两组进行实验。第1组,检测HRG-β1剂量对SCD1表达的影响:在铺入MCF7和SK-BR-3细胞的6孔板中加入PBS(对照组)或不同浓度的HRG-β1(2、10、20 ng/mL),对MCF7细胞处理36 h,对SK-BR-3细胞处理24 h。第2组,检测时间对SCD1表达的影响:在铺入MCF7和SK-BR-3细胞的6孔板中加入HRG-β1 (10 ng/mL),收集HRG-β1处理不同时间的MCF7细胞(0、12、24、36 h)和SK-BR-3细胞(0、6、12、24 h)。收集细胞,用于后续RT-qPCR实验和Western blot实验。
1.2.3 RNA的提取和qPCR检测细胞mRNA表达TRIzol法提取总RNA,测定RNA样品浓度,置于-80 ℃保存。使用逆转录试剂盒将提取的RNA逆转为cDNA,随后进行qPCR实验。qPCR使用的引物序列为:SCD1 上游5′-CTCCACTGCTGGACATGAGA-3′,下游5′-AATGAGTGAAGGGGCACAAC-3′;β-actin 上游5′-AGGGGCCGGACTCGTCATACT-3′,下游5′-GGCGGCACCACCATGTACCCT-3′。PCR反应条件:95 ℃,30 s;(预变性)95 ℃,5 s;60 ℃,30 s。PCR反应共40个循环。重复实验3次。
1.2.4 Western blot检测蛋白表达取对数生长期的MCF7和SK-BR-3细胞,用胰酶消化重悬后接种于12孔板(MCF7细胞数为4×105个/孔,SK-BR-3细胞数为1.5×105个/孔),处理方法同1.2.2。按每孔上样量35 μg制备蛋白样品。在80~100 V条件下进行SDS-PAGE电泳1.5 h后,湿转电泳仪转至0.2 μm PVDF膜。转膜完成后,用含5%的脱脂奶粉的TBS室温封闭1 h,1×TBST洗膜3次。孵育SCD1一抗(稀释比为1:1 000),4 ℃,过夜。回收一抗,洗膜3次,室温孵育辣根酶过氧化物酶标记的二抗(稀释比为1:1 000),1 h,以α-Tubulin为内参,用ECL化学发光试剂盒检测目的条带。使用Image Lab软件拍照并用Image J软件进行灰度扫描,以目的条带与内参条带的灰度比值作为SCD1蛋白的相对表达量,重复实验3次。
1.2.5 MTT法检测细胞增殖实验取对数生长期的MCF7和SK-BR-3细胞,分别以5 000个细胞/孔接种于96孔板,贴壁后分别加入PBS、HRG-β1(20 ng/mL)和A939572(2 μmol/L),每组3个复孔。MCF7细胞继续培养72 h,SK-BR-3细胞继续培养48 h后,每孔加入10 μL MTT继续培养4 h后,再加入150 μL DMSO,振荡,于570 nm波长下测量每孔光密度值[D(570)],以细胞的相对增殖率表示细胞增殖能力。细胞的相对增殖率=D(570)对照组/D(570)实验组×100%,重复实验3次。
1.2.6 细胞划痕实验取对数生长期的MCF7和SK-BR-3细胞,用胰酶消化重悬后,接种MCF7和SK-BR-3细胞于6孔板(MCF7细胞数为2×106个/孔,SK-BR-3细胞数为1.5×106个/孔),在细胞培养箱中贴壁培养18 h后进行划痕,然后加入含1% FBS的完全培养基,再分为4组:第1组加入PBS(对照组);第2组加入HRG-β1 (20 ng/mL);第3组同时加入HRG-β1 (20 ng/mL)和SCD1抑制剂A939572(2 μmol/L);第4组同时加入HRG-β1(20 ng/mL)、SCD1抑制剂A939572(2 μmol/L)和油酸(oleic acid, OA, 50 μmol/L)。MCF7细胞在划痕0 h和48 h,SK-BR-3细胞在0 h和24 h时,于显微镜(×100)下选取相同的4个视野进行拍照,并测量划痕宽度,细胞迁移能力用划痕迁移百分率表示,实验重复3次。划痕迁移百分率越高,细胞迁移能力越强。划痕迁移百分率=(初始划痕宽度-迁移后划痕宽度)/初始划痕宽度×100%。重复实验3次。
1.2.7 细胞侵袭实验取对数生长期的MCF7和SK-BR-3细胞,用胰酶消化重悬后接种于4个12孔板。贴壁后,饥饿处理8 h,分别用PBS、HRG-β1(20 ng/mL)、HRG-β1(20 ng/mL)和A939572(2 μmol/L)联用以及HRG-β1(20 ng/mL)、SCD1抑制剂A939572(2 μmol/L)和油酸(50 μmol/L)处理12 h。在Transwell小室中铺入100 μL Matrigel,包被2 h。用胰酶消化细胞,无血清培养基重悬,取200 μL细胞(MCF7细胞数为1×105个/室,SK-BR-3细胞数为2×105个/室)接种至小室上室,下室加入700 μL含20% FBS的基础培养基,于37 ℃细胞培养箱中继续培养,MCF7细胞培养48 h,SK-BR-3细胞培养24 h。取出小室,PBS清洗后,固定染色,烘干。将烘干后的小室放于显微镜(×100)下随机选取5个视野观察拍照并细胞计数。以侵袭的细胞数表示细胞的侵袭能力,实验重复3次。
1.3 统计学分析采用GraphPad Prism 6软件进行统计分析,数据以x±s表示,组间差异比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 HRG-β1对MCF7和SK-BR-3细胞SCD1 mRNA表达的影响为了检测HRG-β1对SCD1 mRNA表达的诱导作用及是否具有剂量依赖性,分别用PBS和不同浓度HRG-β1(2、10、20 ng/mL)处理MCF736 h(图 1A)和SK-BR-3细胞24 h(图 1B),HRG-β1处理组SCD1 mRNA的相对表达量均较PBS对照组明显增加(P < 0.05)。而且在两种细胞中,随着HRG-β1浓度的增加,SCD1 mRNA的表达量也随之增加(图 1)。为了检测SCD1 mRNA表达量是否随着HRG-β1处理时间变化而变化,用10 ng/mL HRG-β1处理MCF7细胞(图 2A),SCD1 mRNA表达量在12~36 h持续上升,在36 h达到最高值;与0 h组比较,12、24、36 h处理组差异均有统计学意义(P < 0.01)。用10 ng/mL HRG-β1处理SK-BR-3细胞(图 2B)后,SCD1 mRNA表达量在6~24 h持续上升,在24 h达到最高值;与0 h组比较,6、12、24 h处理组差异有统计学意义(P < 0.01)。而且在两种细胞中,随着HRG-β1处理时间的延长,SCD1 mRNA的相对表达量也逐渐增加(图 2)。结果表明HRG-β1能明显上调MCF7和SK-BR-3细胞中SCD1的mRNA水平,且HRG-β1对SCD1 mRNA表达的影响具有剂量和时间依赖性。
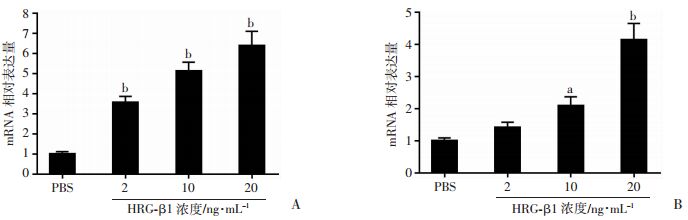
|
| a:P < 0.05,b:P < 0.01,与PBS组比较; A:HRG-β1处理MCF7细胞36 h;B:HRG-β1处理SK-BR-3细胞24 h 图 1 不同浓度HRG-β1处理MCF7和SK-BR-3细胞后SCD1 mRNA的表达变化 |
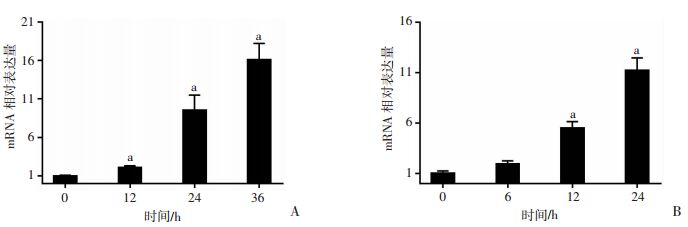
|
| a:P < 0.01,与0 h比较; A:MCF7细胞;B:SK-BR-3细胞 图 2 10 ng/mL HRG-β1处理MCF7和SK-BR-3细胞不同时间后SCD1 mRNA的表达变化 |
2.2 HRG-β1对MCF7和SK-BR-3细胞SCD1蛋白表达的影响
为了检测HRG-β1对SCD1蛋白表达的诱导作用及是否具有剂量依赖性,分别用PBS和不同浓度(2、10、20 ng/mL)HRG-β1处理MCF736 h(图 3A)和SK-BR-3细胞24 h(图 3B),HRG-β1处理后SCD1蛋白表达量均较PBS组明显增加(P < 0.01)。而且在两种细胞中,随着HRG-β1浓度的增加,SCD1蛋白的相对表达量也随之增加(图 3)。为了检测SCD1蛋白表达量是否随着HRG-β1处理时间变化而变化,用10 ng/mL HRG-β1处理MCF7细胞(图 4A),SCD1蛋白表达量在12~36 h持续上升,在36 h达到最高值;与0 h比较,HRG-β1处理12、24、36 h差异均有统计学意义(P < 0.01)。用10 ng/mL HRG-β1处理SK-BR-3细胞(图 4B)后,SCD1蛋白表达量在6~24 h持续上升,在24 h达到最高值;与0 h比较,HRG-β1处理6、12、24 h差异有统计学意义(P < 0.01)。而且在两种细胞中,随着HRG-β1处理时间的延长,SCD1蛋白的相对表达量也逐渐增加(图 4)。结果表明,在MCF7和SK-BR-3细胞中,HRG-β1能明显上调SCD1的蛋白水平,且HRG-β1对SCD1蛋白表达的影响具有剂量和时间依赖性。
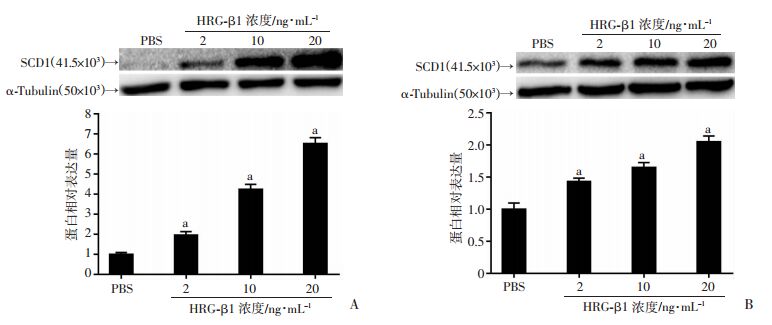
|
| a:P < 0.01,与PBS组比较; A:Western blot检测HRG-β1处理MCF7细胞36 h后SCD1蛋白表达及半定量分析;B:Western blot检测HRG-β1处理SK-BR-3细胞24 h后SCD1蛋白表达及半定量分析 图 3 不同浓度HRG-β1处理MCF7和SK-BR-3细胞后SCD1蛋白的表达变化 |
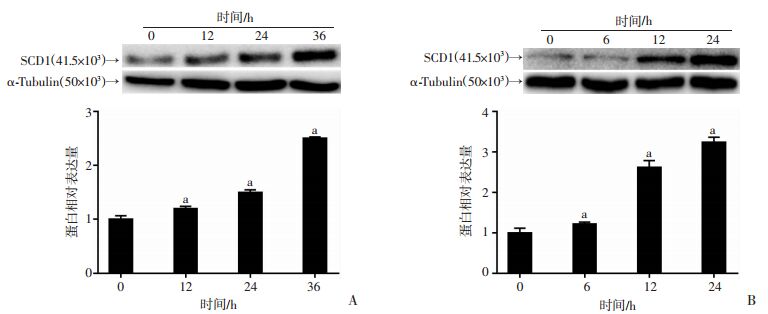
|
| a:P < 0.01,与0 h比较; A:Western blot检测HRG-β1处理MCF7细胞后SCD1蛋白表达及半定量分析;B:Western blot检测HRG-β1处理SK-BR-3细胞后SCD1蛋白表达及半定量分析 图 4 10 ng/mL HRG-β1处理MCF7和SK-BR-3细胞不同时间后SCD1蛋白的表达变化 |
2.3 HRG-β1和SCD1抑制剂A939572对细胞增殖能力的影响
在两种细胞中分别加入PBS、HRG-β1和HRG-β1+ A939572后检测细胞增殖,MCF7细胞(图 5A)处理72 h,SK-BR-3细胞(图 5B)处理48 h。与PBS组比较,两种细胞中HRG-β1组细胞增殖率均显著增加(P < 0.01)。与HRG-β1组比较,HRG-β1+A939572组细胞增殖率明显降低(P < 0.01)。结果表明,SCD1抑制剂能抑制由HRG-β1介导的乳腺癌MCF7和SK-BR-3细胞的增殖能力。

|
| a:P < 0.01,与PBS组比较;b:P < 0.01,与HRG-β1组比较; A:MCF7细胞处理72 h;B:SK-BR-3细胞处理48 h 图 5 HRG-β1和SCD1抑制剂A939572对细胞增殖能力的影响 |
2.4 SCD1抑制剂A939572和SCD1催化产物油酸对HRG-β1诱导细胞迁移能力的影响
MCF7细胞划痕48 h后,与PBS组相比,HRG-β1组细胞划痕迁移率明显增加(P < 0.01,图 6);SK-BR-3细胞划痕24 h后,与PBS组相比,HRG-β1组细胞划痕迁移率明显增加(P < 0.01,图 7),说明HRG-β1能促进乳腺癌细胞MCF7和SK-BR-3的迁移能力。与HRG-β1组相比,HRG-β1和A939572联用组两种细胞的划痕迁移率明显降低(P < 0.01),说明SCD1抑制剂A939572能逆转HRG-β1诱导的MCF7和SK-BR-3细胞迁移。
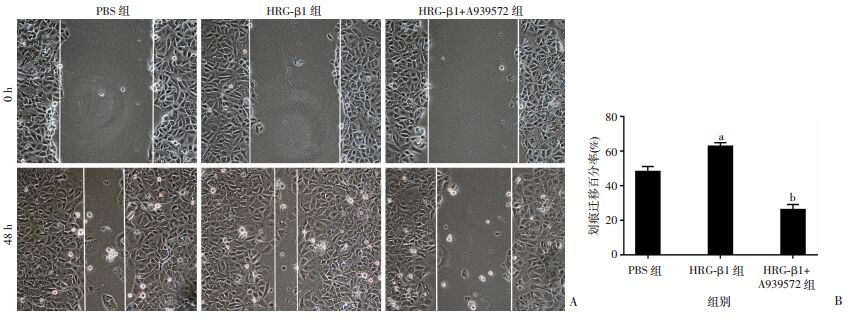
|
| A:各组处理后MCF7细胞迁移情况(×100);B:各组细胞划痕迁移百分率 a:P < 0.01,与PBS组比较;b:P < 0.01,与HRG-β1组比较 图 6 划痕实验观测SCD1抑制剂A939572逆转HRG-β1诱导的MCF7细胞迁移 |
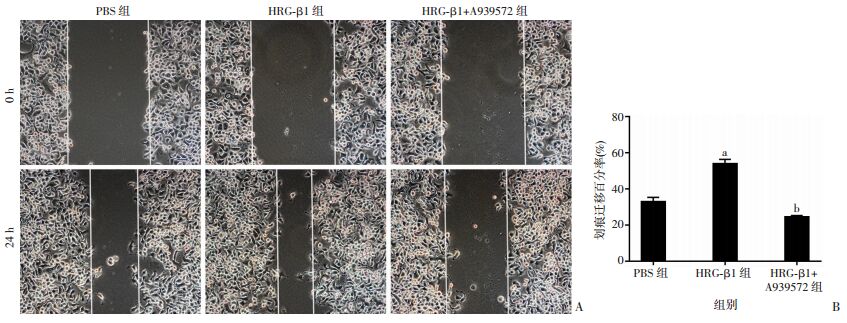
|
| A:各组处理后SK-BR-3细胞迁移情况(×100);B:各组细胞划痕迁移百分率 a:P < 0.01,与PBS组比较;b:P < 0.01,与HRG-β1组比较 图 7 划痕实验观测SCD1抑制剂A939572逆转HRG-β1诱导的SK-BR-3细胞迁移 |
进一步检测了回补SCD1的催化产物油酸(OA)对细胞迁移能力的影响。MCF7细胞划痕48 h后,与HRG-β1和A939572联用组相比,回补油酸组细胞划痕迁移率明显增加(P < 0.01,图 8);SK-BR-3细胞划痕24 h后,与HRG-β1和A939572联用组相比,回补油酸组细胞划痕迁移率明显增加(P < 0.01,图 9)。说明油酸能逆转A939572对乳腺癌细胞MCF7和SK-BR-3迁移能力的抑制作用,提示SCD1的催化活性对HRG-β1诱导的MCF7和SK-BR-3细胞迁移能力有关键作用。

|
| A:各组处理后MCF7细胞迁移情况(×100);B:各组细胞划痕迁移百分率 a:P < 0.01,与HRG-β1组比较;b:P < 0.01,与HRG-β1+A939572组比较 图 8 划痕实验观测油酸回补A939572对MCF7细胞迁移的抑制作用 |

|
| A:各组处理后SK-BR-3细胞迁移情况(×100);B:各组细胞划痕迁移百分率 a:P < 0.01,与HRG-β1组比较;b:P < 0.01,与HRG-β1+A939572组比较 图 9 划痕实验观测油酸回补A939572对SK-BR-3细胞迁移的抑制作用 |
2.5 SCD1抑制剂A939572和SCD1催化产物油酸对HRG-β1诱导细胞侵袭能力的影响
如图 10所示,MCF7细胞侵袭48 h后,与PBS组相比,HRG-β1组侵袭细胞数明显增加(P < 0.01);与HRG-β1和A939572联用组相比,回补油酸组侵袭细胞数明显增加(P < 0.01)。如图 11所示,SK-BR-3细胞侵袭24 h后,与PBS组相比,HRG-β1组侵袭细胞数明显增加(P < 0.05);与HRG-β1组相比,HRG-β1和A939572联用组侵袭细胞数明显降低(P < 0.01);与HRG-β1和A939572联用组相比,回补油酸组侵袭细胞数明显增加(P < 0.01)。结果表明SCD1的活性对HRG-β1诱导的MCF7和SK-BR-3细胞侵袭能力有重要作用。
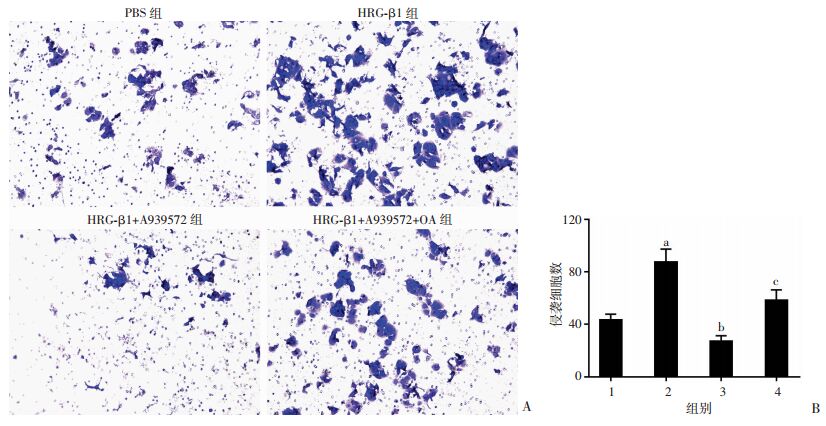
|
| A:各组处理后MCF7细胞侵袭情况(×100);B:各组侵袭细胞数 1:PBS组;2:HRG-β1组;3:HRG-β1+A939572组;4:HRG-β1+A939572+OA组; a:P < 0.01,与PBS组比较;b:P < 0.01,与HRG-β1组比较;c:P < 0.01,与HRG-β1+A939572组比较 图 10 Transwell检测A939572和油酸对MCF7细胞侵袭的影响 |

|
| A:各组处理后SK-BR-3细胞侵袭情况(×100);B:各组侵袭细胞数 1:PBS组;2:HRG-β1组;3:HRG-β1+A939572组;4:HRG-β1+A939572+OA组; a:P < 0.05,与PBS组比较;b:P < 0.01,与HRG-β1组比较;c:P < 0.01,与HRG-β1+A939572组比较 图 11 Transwell检测A939572和油酸对SK-BR-3细胞侵袭的影响 |
3 讨论
脂代谢异常是肿瘤代谢的特征之一。已有多项研究表明,肿瘤细胞可以合成大量的SFAs和MUFAs用以合成新的脂类。这些脂类一方面作为合成细胞膜的原材料,另一方面可以参与肿瘤细胞中生长和耐药相关的信号转导[15],所以很多脂类生成相关基因都在肿瘤细胞中具有较高的表达水平。近几年的研究发现,调控脂类合成的关键分子SCD1在包括卵巢癌、肺癌、乳腺癌等癌症中高表达,且能促进细胞的迁移侵袭能力[11, 16-17]。在乳腺癌细胞中,SCD1的表达水平下调能明显抑制β-catenin信号通路,从而抑制细胞的增殖和迁移侵袭能力[17]。因此,SCD1在乳腺癌的发生发展中起着重要作用,深入研究SCD1对治疗乳腺癌具有重要意义。
HRG1是一种致癌基因。HRG1主要通过激活ErbB酪氨酸激酶受体蛋白家族来发挥其生物学功能[18]。ErbB酪氨酸激酶受体蛋白家族有4个成员ErbB1(EGFR)、ErbB2、ErbB3和ErbB4。HRG1包含一个表皮生长因子(epidermal growth factor, EGF)样结构域。它与ErbB3和ErbB4受体结合,诱导ErbB3和ErbB2或ErbB4和ErbB2之间的异二聚化,从而激活ErbB2下游信号通路,最终影响细胞的增殖、迁移和侵袭[6]。例如,HRG1能诱导肌动蛋白细胞骨架重组和细胞迁移[19]。HRG-β1能激活YAP信号通路,促进乳腺癌细胞的迁移[20]。HRG-β1能通过诱导GPR30蛋白表达,从而促进乳腺癌细胞MCF7迁移和侵袭[21]。HRG-β1能通过诱导肿瘤坏死因子受体超家族成员Fn14表达,从而促进乳腺癌细胞迁移和侵袭[22]。YAMASHITA等[5]的研究也表明,HRG-β1能促进乳腺癌细胞中芳烃受体(aryl hydrocarbon receptor,AhR)的表达,进而影响细胞的迁移侵袭能力。以上研究结果均表明HRG1在乳腺癌中发挥着重要作用,因此有必要深入研究探讨HRG1在影响乳腺癌发生发展中的具体机制。
ZHANG等[23]的研究表明,EGFR介导的SCD1第55位酪氨酸磷酸化能维持SCD1蛋白的稳定性,增加细胞内MUFA水平,从而促进肺癌的生长。而EGFR属ErbB家族成员,HRG-β1能激活该家族,我们由此假设HRG-β1与SCD1有一定联系。本研究采用同时表达ErbB2、ErbB3和SCD1的乳腺癌细胞MCF7和SK-BR-3,结果表明,在两种乳腺癌细胞系中,HRG-β1均能明显上调SCD1的mRNA和蛋白水平。研究表明,在乳腺癌细胞中HRG-β1能通过PI3K/AKT-Snail信号通路促进EMT过程,从而促进乳腺癌的转移[24]。另有研究表明,在哺乳动物中PI3K/AKT信号通路能激活胆固醇调节元件结合蛋白1(sterol-regulatory element binding protein 1,SREBP1)[25],而SREBP1是SCD1的主要转录调控因子[26]。因此,HRG-β1可能通过PI3K/AKT-SREBP1信号通路来上调SCD1的表达,但该机制有待实验证明。
我们实验室前期的研究证明,HRG-β1能诱导糖酵解过程进而促进乳腺癌细胞MCF7的迁移能力[27]。因此,本研究进一步探讨HRG-β1对细胞增殖、迁移和侵袭能力的促进作用是否与SCD1有关。结果表明,加入SCD1抑制剂A939572后能抑制由HRG-β1促进的细胞增殖、迁移和侵袭能力,而回补SCD1催化产物油酸能逆转A939572对细胞迁移和侵袭能力的抑制作用。结果证明HRG-β1能通过促进SCD1的活性,影响乳腺癌细胞的增殖、迁移和侵袭能力。
综上所述,本研究显示,在乳腺癌细胞MCF7和SK-BR-3中,HRG-β1可以诱导SCD1 mRNA和蛋白表达,对乳腺癌细胞MCF7和SK-BR-3增殖、迁移和侵袭的促进作用是由SCD1介导的。该发现为进一步研究HRG-β1和SCD1在乳腺癌细胞增殖、迁移和侵袭中的作用奠定了基础。
| [1] |
BREULEUX M. Role of heregulin in human cancer[J]. Cell Mol Life Sci, 2007, 64(18): 2358-2377. DOI:10.1007/s00018-007-7120-0 |
| [2] |
FALLS D L. Neuregulins: functions, forms, and signaling strategies[J]. Exp Cell Res, 2003, 284(1): 14-30. DOI:10.1016/s0014-4827(02)00102-7 |
| [3] |
NAGASAKA M, OU S I. Neuregulin 1 Fusion-positive NSCLC[J]. J Thorac Oncol, 2019, 14(8): 1354-1359. DOI:10.1016/j.jtho.2019.05.015 |
| [4] |
DE ALAVA E, OCAÑA A, ABAD M, et al. Neuregulin expression modulates clinical response to trastuzumab in patients with metastatic breast cancer[J]. J Clin Oncol, 2007, 25(19): 2656-2663. DOI:10.1200/JCO.2006.08.6850 |
| [5] |
YAMASHITA N, SAITO N, ZHAO S, et al. Heregulin-induced cell migration is promoted by aryl hydrocarbon receptor in HER2-overexpressing breast cancer cells[J]. Exp Cell Res, 2018, 366(1): 34-40. DOI:10.1016/j.yexcr.2018.02.033 |
| [6] |
ZUO B L, YAN B, ZHENG G X, et al. Targeting and suppression of HER3-positive breast cancer by T lymphocytes expressing a heregulin chimeric antigen receptor[J]. Cancer Immunol Immunother, 2018, 67(3): 393-401. DOI:10.1007/s00262-017-2089-5 |
| [7] |
MENENDEZ J A, LUPU R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J]. Nat Rev Cancer, 2007, 7(10): 763-777. DOI:10.1038/nrc2222 |
| [8] |
ALJOHANI A M, SYED D N, NTAMBI J M. Insights into stearoyl-CoA desaturase-1 regulation of systemic metabolism[J]. Trends Endocrinol Metab, 2017, 28(12): 831-842. DOI:10.1016/j.tem.2017.10.003 |
| [9] |
TRACZ-GASZEWSKA Z, DOBRZYN P. Stearoyl-CoA desaturase 1 as a therapeutic target for the treatment of cancer[J]. Cancers (Basel), 2019, 11(7): E948. DOI:10.3390/cancers11070948 |
| [10] |
MERINO SALVADOR M, GÓMEZ DE CEDRÓN M, MORENO RUBIO J, et al. Lipid metabolism and lung cancer[J]. Crit Rev Oncol, 2017, 112: 31-40. DOI:10.1016/j.critrevonc.2017.02.001 |
| [11] |
LIU G H, FENG S, JIA L, et al. Lung fibroblasts promote metastatic colonization through upregulation of stearoyl-CoA desaturase 1 in tumor cells[J]. Oncogene, 2018, 37(11): 1519-1533. DOI:10.1038/s41388-017-0062-6 |
| [12] |
HOLDER A M, GONZALEZ-ANGULO A M, CHEN H Q, et al. High stearoyl-CoA desaturase 1 expression is associated with shorter survival in breast cancer patients[J]. Breast Cancer Res Treat, 2013, 137(1): 319-327. DOI:10.1007/s10549-012-2354-4 |
| [13] |
RAN H, ZHU Y M, DENG R Y, et al. Stearoyl-CoA desaturase-1 promotes colorectal cancer metastasis in response to glucose by suppressing PTEN[J]. J Exp Clin Cancer Res, 2018, 37(1): 54. DOI:10.1186/s13046-018-0711-9 |
| [14] |
李卫华, 杨佳欣. 硬脂酰辅酶A去饱和酶1与恶性肿瘤的研究进展[J]. 中国肿瘤临床, 2014, 41(17): 1131-1134. LI W H, YANG J X. Development in the study of the correlation between stearoyl-coenzyme A desaturase 1 and cancer progression[J]. Chin J Clin Oncol, 2014, 41(17): 1131-1134. DOI:10.3969/j.issn.1000-8179.20140483 |
| [15] |
SHE K L, FANG S H, DU W, et al. SCD1 is required for EGFR-targeting cancer therapy of lung cancer via re-activation of EGFR/PI3K/AKT signals[J]. Cancer Cell Int, 2019, 19: 103. DOI:10.1186/s12935-019-0809-y |
| [16] |
ZHAO G, CARDENAS H, MATEI D. Ovarian cancer-why lipids matter[J]. Cancers (Basel), 2019, 11(12): 1870. DOI:10.3390/cancers11121870 |
| [17] |
MAUVOISIN D, CHARFI C, LOUNIS A M, et al. Decreasing stearoyl-CoA desaturase-1 expression inhibits β-catenin signaling in breast cancer cells[J]. Cancer Sci, 2013, 104(1): 36-42. DOI:10.1111/cas.12032 |
| [18] |
KATARIA H, ALIZADEH A, KARIMI-ABDOLREZAEE S. Neuregulin-1/ErbB network: an emerging modulator of nervous system injury and repair[J]. Prog Neurobiol, 2019, 180: 101643. DOI:10.1016/j.pneurobio.2019.101643 |
| [19] |
HIJAZI M M, THOMPSON E W, TANG C, et al. Heregulin regulates the actin cytoskeleton and promotes invasive properties in breast cancer cell lines[J]. Int J Oncol, 2000, 17(4): 629-641. DOI:10.3892/ijo.17.4.629 |
| [20] |
HASKINS J W, NGUYEN D X, STERN D F. Neuregulin 1-activated ERBB4 interacts with YAP to induce Hippo pathway target genes and promote cell migration[J]. Sci Signal, 2014, 7(355): ra116. DOI:10.1126/scisignal.2005770 |
| [21] |
RUAN S Q, WANG S W, WANG Z H, et al. Regulation of HRG-β1-induced proliferation, migration and invasion of MCF-7 cells by upregulation of GPR30 expression[J]. Mol Med Rep, 2012, 6(1): 131-138. DOI:10.3892/mmr.2012.874 |
| [22] |
ASRANI K, KERI R A, GALISTEO R, et al. The HER2- and heregulin β1 (HRG)-inducible TNFR superfamily member Fn14 promotes HRG-driven breast cancer cell migration, invasion, and MMP9 expression[J]. Mol Cancer Res, 2013, 11(4): 393-404. DOI:10.1158/1541-7786.MCR-12-0542 |
| [23] |
ZHANG J Q, SONG F, ZHAO X J, et al. EGFR modulates monounsaturated fatty acid synthesis through phosphorylation of SCD1 in lung cancer[J]. Mol Cancer, 2017, 16(1): 127. DOI:10.1186/s12943-017-0704-x |
| [24] |
CHENG L S, ZHA Z, LANG B, et al. Heregulin-beta1 promotes metastasis of breast cancer cell line SKBR3 through upregulation of Snail and induction of epithelial-mesenchymal transition[J]. Cancer Lett, 2009, 280(1): 50-60. DOI:10.1016/j.canlet.2009.02.007 |
| [25] |
PORSTMANN T, SANTOS C R, GRIFFITHS B, et al. SREBP activity is regulated by mTORC1 and contributes to Akt-dependent cell growth[J]. Cell Metab, 2008, 8(3): 224-236. DOI:10.1016/j.cmet.2008.07.007 |
| [26] |
GRIFFITHS B, LEWIS C A, BENSAAD K, et al. Sterol regulatory element binding protein-dependent regulation of lipid synthesis supports cell survival and tumor growth[J]. Cancer Metab, 2013, 1(1): 3. DOI:10.1186/2049-3002-1-3 |
| [27] |
蒋素芳, 屠凯岭, 周兰, 等. Heregulin-β1诱导的糖酵解对乳腺癌细胞MCF7迁移的影响[J]. 四川大学学报(医学版), 2016, 47(4): 463-467. JIANG S F, TU K L, ZHOU L, et al. Heregulin-β1-induced glycolysis promotes migration of breast cancer cell line MCF7[J]. J Sichuan Univ Med Sci Ed, 2016, 47(4): 463-467. DOI:10.13464/j.scuxbyxb.2016.04.003 |



