心血管疾病已经超越肿瘤成为人类健康的第一杀手[1]。作为心肌梗死、脑卒中等多种疾病共同的病理基础,动脉粥样硬化(atherosclerosis,AS)成为人类急需攻克的医学难题。目前以他汀类为代表的降脂药广泛应用于AS的防治[2],但是并未能有效抑制其致死率和致残率,给人类生活带来了巨大的经济负担。研究表明,炎症参与AS发生、发展的全过程,如内皮功能的紊乱、泡沫细胞的形成、平滑肌细胞的增殖、易损斑块的形成等[2-4],使得抗炎治疗成为最具前景的治疗方式。大量的抗炎药物被应用于抗AS研究,尽管取得了一定的疗效,但是由于传统的药物递送方式效率低,无靶向特点,长期使用抗炎药物带来了很多不必要的副作用,从而影响其进一步的临床应用。近年来,纳米技术的出现为药物递送提供了更好的选择。如基于炎症局部的病理特征构建的微环境响应性纳米粒,能够实现药物的靶向响应性释放[5-8],相较于传统制剂具有更好的药代动力学参数和组织特异性,同时对于疏水性药物递送具有更高的载药量和包封率[9]。此外,随着仿生策略的兴起,基于响应性材料构建的仿生纳米粒具有更为显著的体内生物相容性和躲避网状内皮系统吞噬的能力,能够进一步增强递送效率,提高治疗效果[10-12]。高密度脂蛋白(high-density lipoprotein, HDL)具有天然的抗AS作用[13],其保护作用主要体现在介导细胞内胆固醇逆转运至肝脏代谢的能力,从而降低胞内过多的脂质滞留聚集[14-16]。因此,本研究旨在利用具有炎症局部活性氧响应性的材料,采用仿生策略构建仿HDL纳米粒(HDL-mimetic nanoparticles, mHDL NP),以期获得一种既能够实现局部活性氧(reactive oxygen species,ROS)响应性清除,又能够介导胆固醇逆转运的多功能纳米系统,为AS的防治提供新的选择。
1 材料与方法 1.1 材料与试剂β-环糊精(β-CD)、大豆卵磷脂均购自日本Tokyo Chemical Industry公司;对羟甲基苯硼频那醇酯(PBAP)、N, N′-羰基二咪唑(CDI)、4-二甲氨基吡啶(DMAP)、脂多糖(LPS)、油红O均购自Sigma-Aldrich公司;二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇2000(DSPE-PEG2000)购自瑞士Corden Pharma公司;DMEM培养基、胎牛血清、青霉素-链霉素双抗、胰酶均购自HyClone公司;干扰素γ(IFN-γ)购自Sigmia公司;肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)ELISA试剂盒购自博士德生物公司;活性氧探针DCFH-DA购自Beyotime公司;氧化低密度脂蛋白(OX-LDL)购自广州奕元生物技术有限公司;NBD-胆固醇购自美国Avanti Polar Lipid公司。
1.2 方法 1.2.1 氧化敏感性材料的合成与表征将PBAP溶于适量二氯甲烷(DCM),经CDI活化后与β-CD反应,乙醚沉淀,离心得到目标产物(OXbCD)。称取适量产物分别进行核磁和红外光谱检测。
1.2.2 不同纳米粒的制备与表征取4 mg卵磷脂和6 mg DSPE-PEG2000于9.6 mL双蒸水中,65 ℃下搅拌30 min,作为水相;室温条件下将50 mg OXbCD的甲醇溶液缓慢滴加在水相中,室温搅拌反应2 h,得到氧化响应性纳米粒(OXbCD NP)。将1 mg Cy5荧光染料溶解在OXbCD甲醇溶液中,与上述相同处理可得到Cy5荧光纳米粒(Cy5-OXbCD NP)。取定量卵磷脂、DSPE-PEG2000的乙醇溶液于茄形瓶中,45 ℃旋蒸成干膜,含有定量载脂蛋白(Apo-A1)的PBS水化,得到磷脂混悬液。将磷脂混悬液挤压过不同孔径的聚碳脂膜(Whatman),再将该悬液与OXbCD NP均匀混合,挤压过400 nm聚碳脂膜,得到仿高密度脂蛋白纳米粒(mHDL NP);若混悬液与Cy5-OXbCD NP混合挤压过膜,得到仿高密度脂蛋白荧光纳米粒(Cy5-mHDL NP)。通过激光粒度仪(DLS)测定纳米粒粒径大小、分布、表面电位。采用透射电子显微镜(TEM)、场发射扫描电子显微镜(FE-SEM)观察纳米粒子形貌。
1.2.3 纳米粒体外水解研究配置系列H2O2浓度的PBS溶液,取0.4 mL现制备OXbCD NP溶液于1.6 mL对应的介质中,利用紫外分光光度计测对应点透光率;并选定1 mmol/L H2O2浓度的PBS溶液为水解介质,分别在设定时间点拍照,定性观察纳米粒对双氧水的响应性。
1.2.4 纳米粒体外生物学评价 1.2.4.1 纳米粒细胞吞噬行为研究流式细胞术检测RAW264.7细胞(中国科学院细胞库)对OXbCD NP的吞噬:1 mL(2×105个/mL)RAW264.7细胞悬液接种在12孔板中,孵育过夜;弃去培养基,加入含有不同浓度Cy5-OXbCD NP的DMEM培养基,孵育2 h,考察细胞对纳米粒吞噬的浓度依赖性;或另加入含有50 μg/mL Cy5-OXbCD NP的培养基,分别孵育不同时间考察细胞对纳米粒吞噬的时间依赖性;胰酶消化细胞收集细胞悬液,1 000 r/min离心5 min后弃上清,重悬细胞,使其浓度为(1~5)×106个/mL,取100 μL细胞悬液上机检测。激光共聚焦观察RAW264.7细胞对OXbCD NP的吞噬:1 mL(2×105个/mL)细胞悬液接种在20 mm细胞爬片上,孵育过夜;分别加入含不同浓度Cy5-OXbCD NP的DMEM培养基,孵育2 h,观察细胞对纳米粒吞噬的浓度依赖性;或另加入含有50 μg/mL Cy5-OXbCD NP的培养基,分别孵育不同时间观察细胞对纳米粒吞噬的时间依赖性;培养基洗涤,多聚甲醛固定,用75 nmol/L Lyso-tracker green DND-26对溶酶体染色1 h,DAPI复染,封片后激光共聚焦观察拍照,Zen软件处理图像。
流式细胞术考察细胞对不同纳米粒的吞噬:1 mL(2×105个/mL)细胞悬液接种在12孔板中,孵育过夜;分别加入含有等量Cy5-OXbCD NP和Cy5-mHDL NP的DMEM培养基,孵育2 h,收集细胞上机检测。
1.2.4.2 细胞外炎症因子水平测定在24孔板中加入0.5 mL RAW264.7细胞(2×105个/mL)接种,DMEM培养基过夜,弃去培养基,加入0.5 mL含有50 μg/mL OXbCD NP或mHDL NP的DMEM培养基,孵育2 h,弃去培养基并加入0.5 mL 100 ng/mL脂多糖(LPS)和100 IU干扰素γ(IFN-γ)培养基孵育细胞24 h;收集上清液,用ELISA方法检测上清液中TNF-α、MCP-1的含量。
1.2.4.3 细胞内活性氧水平测定1 mL(2×105个/mL)RAW264.7细胞悬液接种在12孔板中,培养过夜;加入含有50 μg/mL OXbCD NP或mHDL NP或空白(Model)的DMEM培养基,共孵育2 h;再加入含有100 ng/mL PMA的培养基共孵育4 h;接着加入含有10 μmol/L DCFH-DA活性氧探针的空白培养基,37 ℃孵育20 min,收集细胞,流式细胞仪检测(EX/EM: 488 nm/525 nm)。
1.2.4.4 胆固醇外排水平测定酶标仪考察纳米粒对细胞胆固醇外排的影响:1 mL(2×105个/mL)RAW264.7细胞悬液接种在12孔板中,饥饿细胞2 h,与含有1 μg/mL NBD-胆固醇的无血清培养基共孵育4 h;吸弃上清,加入含有80 μg/mL OXbCD NP或mHDL NP的培养基共孵育不同时间考察纳米粒对细胞胆固醇外排的时间依赖性,或加入含有不同浓度OXbCD NP或mHDL NP的培养基,共孵育4 h,考察纳米粒对细胞胆固醇外排的剂量依赖性;在设计时间点收集细胞培养上清和细胞,并加入0.1% Triton-X100裂解细胞,14 000×g离心15 min,取上清;酶标仪检测细胞培养上清和细胞裂解液中的荧光强度(EX/EM: 465 nm/535 nm)。胆固醇外排率=Fm×100%/(Fm+Fc),其中Fm指培养基中的荧光值,Fc指细胞裂解液中的荧光值。
激光共聚焦观察纳米粒对细胞胆固醇外排的影响:1×105个/mL细胞接种在15 mm细胞爬片上,孵育过夜使细胞贴壁饥饿细胞2 h,与含有1 μg/mL NBD-胆固醇的无血清培养基共孵育4 h;吸弃上清,加入含有80 μg/mL OXbCD NP或mHDL NP的培养基共孵育4 h;多聚甲醇固定细胞15 min,DAPI染液复染细胞核,封片后激光共聚焦观察,Zen软件处理图片。
1.2.4.5 纳米粒对泡沫细胞形成的影响1 mL(1×105个/mL)RAW264.7细胞悬液接种在12孔板中,与含有100 ng/mL LPS和100 IU IFN-γ的培养基孵育细胞24 h,后加入含有50 μg/mL OXbCDNP或mHDL NP培养基,孵育2 h;再与含有50 μg/mL OX-LDL的培养基共孵育36 h,油红工作液染色,光镜拍照。
1.2.4.6 纳米粒体外安全性评价细胞毒性检测:细胞按1×104个/mL接种在96孔板,培养过夜;加入不同浓度OXbCD NP的培养基,孵育12 h或24 h,在设计时间点加入CCK-8溶液,继续培养2 h,在450 nm处测光密度值[D(450)]。
体外溶血实验检测:雄性SD大鼠麻醉取血于EDTA抗凝管中,经处理得到红细胞悬液;取一定体积的红细胞悬液、生理盐水、不同浓度的纳米粒混合,考察纳米粒体外溶血情况;接着37 ℃孵育2 h,300×g离心5 min,于酶标仪570 nm处测定光密度值[D(570)],溶血分数=[D(570)实验组-D(570)阴性组]/[D(570)阳性组-D(570)阴性组]×100%。
1.3 统计学分析数据以x±s表示,运用SPSS20.0统计软件,各组数据近似正态分布(正态检验),对于多组间差异比较采用单因素方差分析,两组间比较采用非配对t检验。检验水准α=0.05。
2 结果 2.1 氧化敏感性材料的红外和核磁表征核磁图谱(图 1A)表明PBAP成功键合在β-CD上,1个β-CD分子约键合5个PBAP分子。红外图谱(图 1B)中OXbCD在3 300 cm-1信号减弱,在1 745 cm-1和1 500 cm-1分别出现羰基信号、苯环信号,同样证明PBAP成功连接在β-CD上,活性氧响应性材料成功合成。
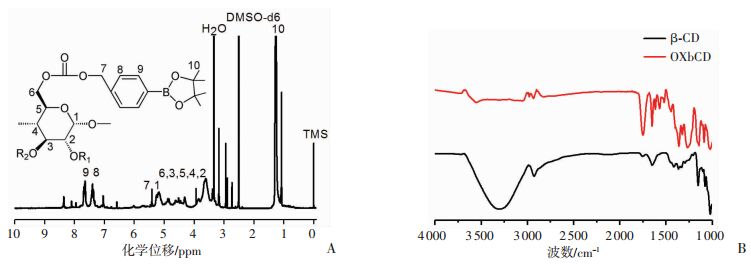
|
| 图 1 OXbCD的氢核磁图谱(A)和红外图谱(B) |
2.2 仿高密度脂蛋白纳米粒的表征和对体外水解行为研究
如图 2A~F所示,OXbCD NP与mHDL NP分布均匀,形态为规则类球形。OXbCD NP粒径为(190±2)nm,PDI为0.183;mHDL NP粒径为(210±10)nm,PDI为0.143。TEM结果可以看出mHDL NP为明显的核壳结构,其内核为类球形的实心结构,外层包裹着一层脂质膜。OXbCD NP具有H2O2响应性水解性能,当H2O2浓度为1 mmol/L时,在10 min左右就能看到明显的水解,30 min时几乎完全水解(图 2G);OXbCD NP与系列浓度梯度双氧水中共孵育时,OXbCD NP的水解速度与双氧水的浓度呈正相关性(40 min时皮尔森相关系数为0.86),在高浓度双氧水的水解速度显著大于低浓度的双氧水,40 min时,OXbCD NP在1 mmol/L和0.25 mmol/L H2O2的水解百分数为79.7%和23.7%(图 2H),直接证明所制备纳米粒具有活性氧响应性水解的能力。
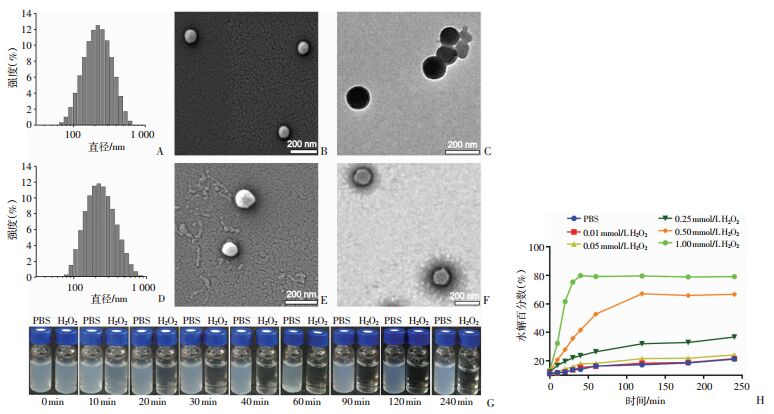
|
| A~C:OXbCD NP的粒径分布、扫描电镜和透射电镜;D~F:mHDL NP的粒径分布、扫描电镜和透射电镜;G:OXbCD NP分别在PBS和1 mmol/L H2O2中不同时间水解程度;H:OXbCD NP在不同浓度H2O2中的水解曲线 图 2 纳米粒的表征和水解行为研究(n=3) |
2.3 RAW264.7细胞对纳米粒的吞噬作用
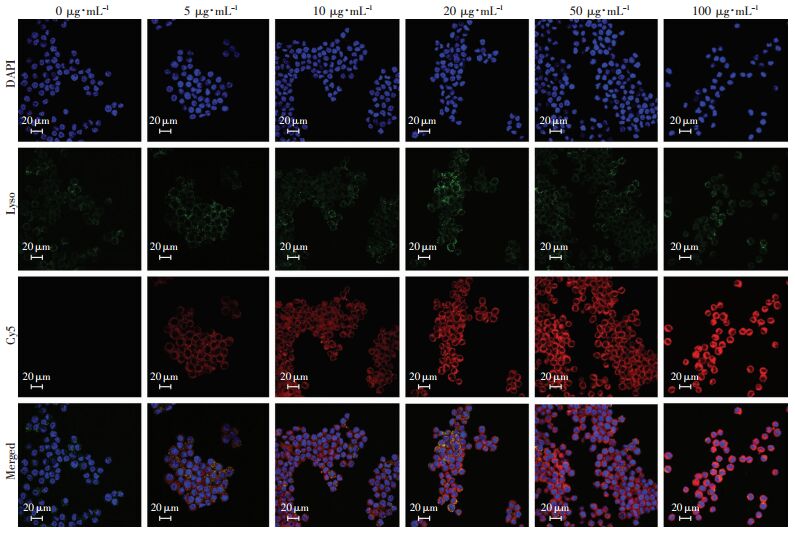
运用流式细胞术考察RAW264.7细胞对OXbCD NP的吞噬能力,如图 3A、B所示,随着OXbCD NP与细胞共孵育时间的延长,纳米粒在细胞内的聚集增多,呈正相关性(皮尔森相关系数为0.98),但5 h后细胞吞噬会逐渐达到饱和,与0 h组比较,差异有统计学意义(P < 0.01);而高浓度纳米粒与细胞共孵育会增加细胞对纳米粒的吞噬,与0 μg/mL组比较,20、50、100 μg/mL组平均荧光强度显著增加(P < 0.05,P < 0.01,图 3C、D);表明细胞对纳米粒的吞噬具有时间和浓度依赖性。共聚焦结果显示,随着浓度或者时间的增加,Cy5(红色)在胞内聚集增加,且与溶酶体(绿色)有很好的共定位(图 4、5),表明细胞吞噬纳米粒是通过溶酶体途径。通过比较细胞对OXbCD NP和mHDL NP吞噬能力的不同,发现细胞对mHDL NP的吞噬能力显著下降(P=0.01,图 3E、F),表明从细胞水平验证mHDL NP的成功构建。
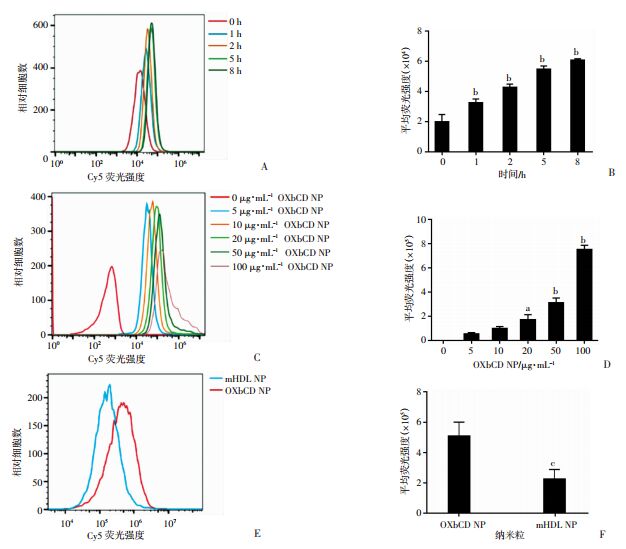
|
| A:细胞对OXbCD NP吞噬的时间依赖性;C:细胞对OXbCD NP吞噬的浓度依赖性;B、D:对应荧光强度的统计结果;E:细胞对两种纳米粒吞噬的流式分析结果;F:对应荧光强度的统计分析;a:P < 0.05,与0 μg/mL组比较;b:P < 0.01,与0 h或0 μg/mL比较;c:P < 0.05,与OXbCD NP比较 图 3 流式细胞术检测RAW264.7细胞对OXbCD NP的吞噬作用(n=3) |
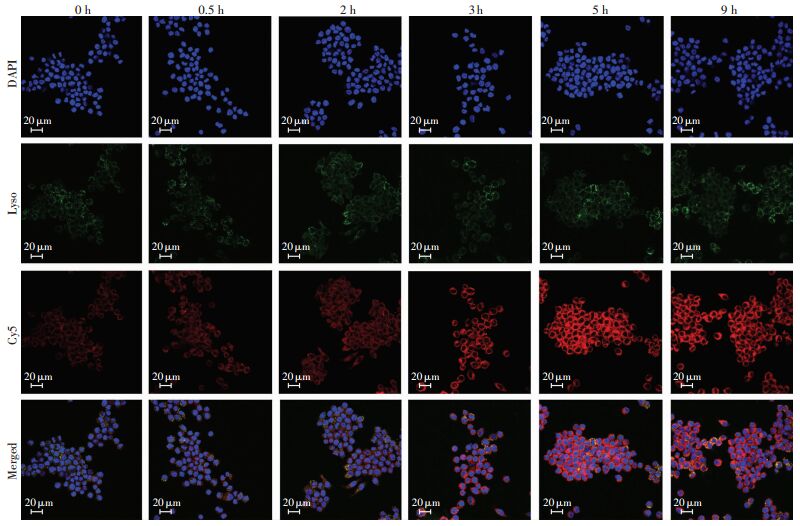
|
| 图 4 激光共聚焦观察细胞对OXbCD NP吞噬的时间依赖性 |
|
| 图 5 激光共聚焦观察细胞对OXbCD NP吞噬的浓度依赖性 |
2.4 纳米粒体外抗AS作用评价
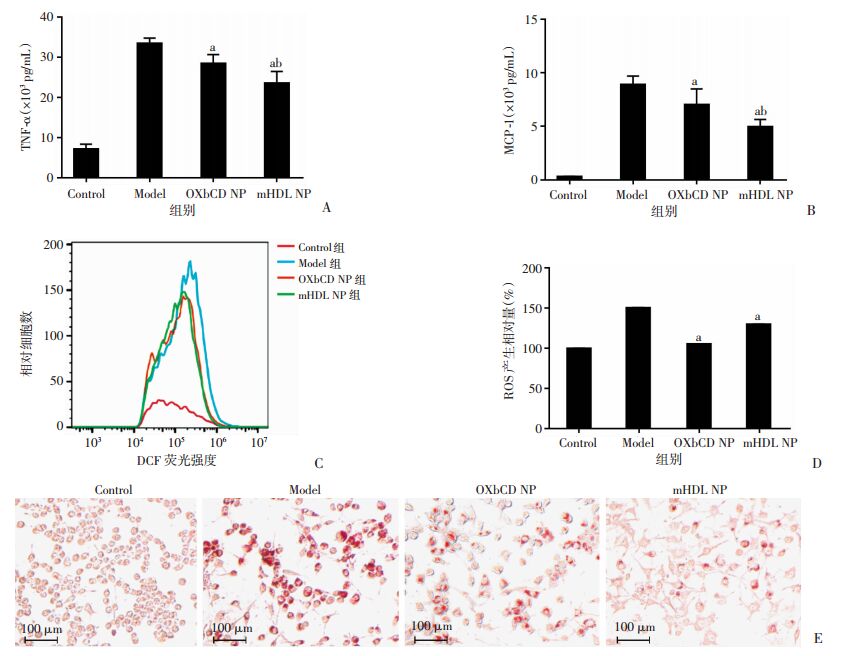
结果(图 6A、B)显示,与Model组比较,两种纳米粒都能显著降低细胞炎症因子TNF-α(OXbCD NP:P=0.008;mHDL NP:P < 0.001)和MCP-1(OXbCD NP:P=0.025;mHDL NP:P < 0.001)的表达,且mHDL NP降低效果比OXbCD NP更为显著(P < 0.05),比OXbCD NP组降低15.6%,推测纳米粒具有抑制巨噬细胞炎症因子分泌的作用。而天然的高密度脂蛋白具有抗炎的效果,进一步在细胞水平证明mHDL NP的成功构建。
|
| A、B:细胞培养上清TNF-α和MCP-1含量统计;C、D:细胞内ROS含量流式分析和统计结果;E:油红染色观察不同纳米粒抑制泡沫细胞形成;a:P < 0.05,与Model组比较;b:P < 0.05,与OXbCD NP组比较 图 6 纳米粒抑制细胞炎症和氧化应激水平(n=3) |
运用活性氧探针检测细胞内ROS水平(图 6C、D),纳米粒能明显降低细胞ROS的产生量,与Model组比较,mHDL NP组ROS产生相对量降低15.6%(P=0.027),具有抗氧化的能力;证明表面修饰的仿HDL磷脂膜不会影响材料对氧化应激的响应性。
相对于Model组细胞内大量脂滴滞留,OXbCD NP组和mHDL NP组细胞内脂滴聚集明显减少,说明两种纳米粒都具有抑制细胞泡沫化的作用,且mHDL NP的效果更为明显(图 6E)。
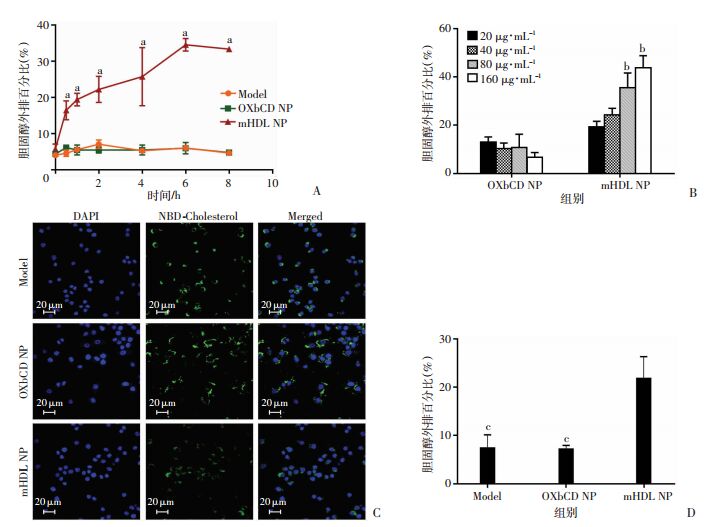
2.5 mHDL NP促进细胞胆固醇外排细胞实验发现(图 7A、B)mHDL NP具有能够促进细胞胆固醇外排的能力,而且具有浓度[与20 μg/mL组比较,差异有统计学意义(P < 0.05)]和时间[与0 h组比较,差异有统计学意义(P < 0.05)]依赖性,但是随着孵育时间的延长,细胞外排胆固醇速率降低,细胞内外胆固醇含量趋于平衡;接着也运用激光共聚焦方法进一步证明,发现OXbCD NP处理的细胞胞内有大量的胆固醇(绿色)滞留,而mHDL NP处理的细胞胞内胆固醇聚集较少(图 7C)。选定纳米粒浓度和孵育时间进一步证明mHDL NP具有促进细胞胆固醇外排的作用,且比OXbCD NP外排率增加15%左右(P < 0.01,图 7D)。证明mHDL NP具有天然HDL逆转胆固醇相似的作用。
|
| A:酶标仪检测细胞胆固醇外排率的时间曲线;B:不同浓度纳米粒对细胞胆固醇外排率的影响;C、D:激光共聚焦观察、酶标仪检测不同纳米粒对细胞胆固醇外排的影响;a:P < 0.05,与0 h比较;b:P < 0.05,与20 μg/mL比较;c:P < 0.05,与mHDL NP组比较 图 7 mHDL NP促进细胞胆固醇外排(n=3) |
2.6 纳米粒的体外安全性评价
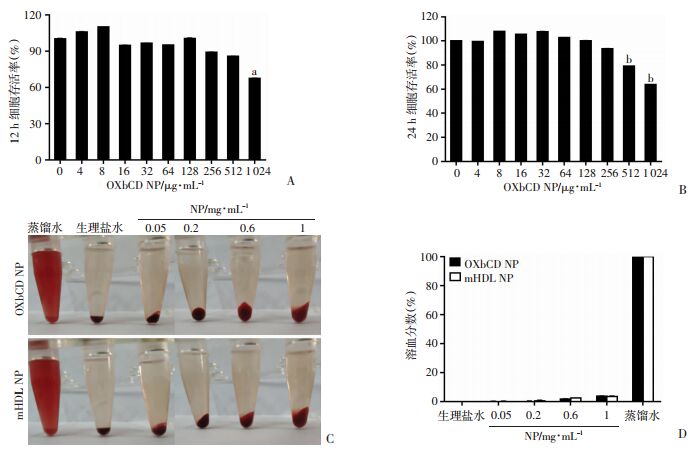
运用CCK-8评价了纳米粒对细胞的毒性,发现纳米粒与细胞共孵育12 h,浓度达到512 μg/mL时细胞活力大于80%,当浓度扩大到1 024 μg/mL时产生细胞毒性(P=0.003),此条件下纳米粒浓度应不高于1 024 μg/mL;将孵育时间延长至24 h,浓度为256 μg/mL时细胞活力大于90%,浓度扩大到512 μg/mL时产生明显的细胞毒性(P < 0.01,图 8),此条件下纳米粒浓度应不高于512 μg/mL。体外溶血实验证明当纳米粒浓度到达1 mg/mL时,均未观察到溶血现象。初步证明通过该方法所制备的纳米粒在安全剂量范围内具有良好的生物安全性,可用于后续体内实验研究。
|
| A、B:CCK-8检测纳米粒在细胞12、24 h对细胞的毒性(n=5);C、D:体外考察纳米粒的溶血现象和对应溶血分数分析;a:P < 0.05,b:P < 0.01,与0 μg/mL比较 图 8 纳米粒体外安全性评价 |
3 讨论
炎症局部特征微环境是构建炎症响应性纳米探针和纳米药物的依据。本研究中,基于ROS响应性材料OXbCD,我们通过自组装纳米沉淀法制备了ROS响应性纳米粒OXbCD NP,并在体外水解研究中证实其具有较好的ROS响应性水解性能。通过仿生策略在OXbCD NP表面修饰了仿HDL结构,不仅能够增强其体内生物相容性,而且能够赋予纳米粒胆固醇逆转运作用,使得构建的纳米粒mHDL NP兼具抗炎、降脂的作用;同时可以作为响应性纳米递送系统实现抗炎药物的靶向释放。这些结果都充分显示了仿HDL纳米粒在抗动脉粥样硬化中的作用优势,为后续在体内治疗动脉粥样硬化提供了良好的实验基础。
此外,我们还可以通过表面修饰的方式引入更多的其他不同靶向分子的方式,实现AS的多重靶向治疗。另一方面,除了ROS响应性材料外,其他类型的炎症响应性材料,如pH响应性材料、酶响应性材料以及多重响应性材料也越来越多地被用于炎症相关疾病的治疗之中[17-18]。同时,内源性细胞,如白细胞、血小板等在炎症中的特殊作用也指引研究者构建了众多的仿生粒子,实现了更为高效的递送。我们有理由相信,随着纳米医学的飞速发展和对炎性疾病发病机制的研究,更为智能的纳米递送系统和纳米药物将会被应用于动脉粥样硬化的治疗中。
| [1] |
AL-MAMARI A. Atherosclerosis and physical activity[J]. Oman Med J, 2009, 24(3): 173-178. DOI:10.5001/omj.2009.34 |
| [2] |
CERVADORO A, PALOMBA R, VERGARO G, et al. Targeting inflammation with nanosized drug delivery platforms in cardiovascular diseases:immune cell modulation in atherosclerosis[J]. Front Bioeng Biotechnol, 2018, 6: 177. DOI:10.3389/fbioe.2018.00177 |
| [3] |
BELDMAN T J, MALINOVA T S, DESCLOS E, et al. Nano-particle-aided characterization of arterial endothelial architec-ture during atherosclerosis progression and metabolic therapy[J]. ACS Nano, 2019, 13(12): 13759-13774. DOI:10.1021/acsnano.8b08875 |
| [4] |
DUIVENVOORDEN R, SENDERS M L, VAN LEENT M M T, et al. Nanoimmunotherapy to treat ischaemic heart disease[J]. Nat Rev Cardiol, 2019, 16(1): 21-32. DOI:10.1038/s41569-018-0073-1 |
| [5] |
DUIVENVOORDEN R, TANG J, CORMODE D P, et al. A statin-loaded reconstituted high-density lipoprotein nanoparticle inhibits atherosclerotic plaque inflammation[J]. Nat Commun, 2014, 5: 3065. DOI:10.1038/ncomms4065 |
| [6] |
GHARAGOZLOO M, MAJEWSKI S, FOLDVARI M. Thera-peutic applications of nanomedicine in autoimmune diseases:from immunosuppression to tolerance induction[J]. Nanomed-Nanotechnol Biol Med, 2015, 11(4): 1003-1018. DOI:10.1016/j.nano.2014.12.003 |
| [7] |
LOBATTO M E, FAYAD Z A, SILVERA S, et al. Multimodal clinical imaging to longitudinally assess a nanomedical anti-inflammatory treatment in experimental atherosclerosis[J]. Mol Pharm, 2010, 7(6): 2020-2029. DOI:10.1021/mp100309y |
| [8] |
MULDER W J, JAFFER F A, FAYAD Z A, et al. Imaging and nanomedicine in inflammatory atherosclerosis[J]. Sci Transl Med, 2014, 6(239): 239s. DOI:10.1126/sci-translmed.3005101 |
| [9] |
BARAZZA A, BLACHFORD C, EVEN-OR O, et al. The complex fate in plasma of gadolinium incorporated into high-density lipoproteins used for magnetic imaging of atherosclerotic plaques[J]. Bioconjug Chem, 2013, 24(6): 1039-1048. DOI:10.1021/bc400105j |
| [10] |
CORMODE D P, SKAJAA T, VAN SCHOONEVELD M M, et al. Nanocrystal core high-density lipoproteins:a multimodality contrast agent platform[J]. Nano Lett, 2008, 8(11): 3715-3723. DOI:10.1021/nl801958b |
| [11] |
EL ANDALOUSSI S, MÄGER I, BREAKEFIELD X O, et al. Extracellular vesicles:biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12(5): 347-357. DOI:10.1038/nrd3978 |
| [12] |
MULDER W J M, VAN LEENT M M T, LAMEIJER M, et al. High-density lipoprotein nanobiologics for precision medicine[J]. Acc Chem Res, 2018, 51(1): 127-137. DOI:10.1021/acs.accounts.7b00339 |
| [13] |
BODEN W E. High-density lipoprotein cholesterol as an independent risk factor in cardiovascular disease:assessing the data from Framingham to the Veterans Affairs High:Density Lipoprotein Intervention Trial[J]. Am J Cardiol, 2000, 86(12A): 19L-22L. DOI:10.1016/s0002-9149(00)01464-8 |
| [14] |
FAZIO S, PAMIR N. HDL particle size and functional heterogeneity[J]. Circ Res, 2016, 119(6): 704-707. DOI:10.1161/CIRCRESAHA.116.309506 |
| [15] |
FEIG J E, RONG J X, SHAMIR R, et al. HDL promotes rapid atherosclerosis regression in mice and alters inflammatory properties of plaque monocyte-derived cells[J]. Proc Natl Acad Sci USA, 2011, 108(17): 7166-7171. DOI:10.1073/pnas.1016086108 |
| [16] |
ROTHBLAT G H, PHILLIPS M C. High-density lipoprotein heterogeneity and function in reverse cholesterol transport[J]. Curr Opin Lipidol, 2010, 21(3): 229-238. DOI:10.1097/mol.0b013e328338472d |
| [17] |
ZHANG R J, LIU R F, LIU C, et al. A pH/ROS dual-responsive and targeting nanotherapy for vascular inflammatory diseases[J]. Biomaterials, 2020, 230: 119605. DOI:10.1016/j.biomaterials.2019.119605 |
| [18] |
CARLINI A S, GAETANI R, BRADEN R L, et al. Enzyme-responsive progelator cyclic peptides for minimally invasive delivery to the heart post-myocardial infarction[J]. Nat Commun, 2019, 10(1): 1735. DOI:10.1038/s41467-019-09587-y |



