现代医学治疗时,常根据疾病的病理生理学特点、患者的年龄和疾病状态以及患者用药依从性等因素来确定合适的给药途径。常见的给药途径有口服、静脉注射、肌肉注射、皮下注射、直肠给药、经皮给药等;其中口服给药凭借其安全简便、经济有效、患者依从性好等优点,成为临床上最常用的给药途径[1-3]。然而,目前临床使用的大量小分子药物的溶解度极低,导致其口服生物利用度较低,最终影响疗效,故难以实现口服应用。提高难溶性药物的溶出是改善其口服生物利用度的重要手段。药剂学领域,常把难溶性药物制成固体分散体、微球、纳米粒等不同递送系统,以解决该问题;而设计并开发高效的口服微粒是当前先进药物递送系统研发的热点和前沿[4-5]。大量研究表明,微球递送系统可以显著增加难溶性药物的溶出速率,进而大大提高其口服生物利用度[6]。然而,胃肠道的生理和物理屏障是阻碍微粒递送系统吸收的一大难题,因为这些屏障会明显影响微粒中所负载药物的口服吸收,导致血药浓度无法满足治疗需要[7-8]。广泛的研究表明,通过调整微球的理化性质,如粒径[9]、载体材料性质(pH响应性、生物可降解性以及黏膜粘附性等)[10-11]、表面物理化学特性(如表面疏水性和电荷)[12],微球表面修饰靶向基团[13-15]和仿生化修饰微球[15-18],都可以改善微球释药系统的口服吸收。在生物药剂学分类系统中,大部分疏水药物属于BCSⅡ类。因此,递送疏水药物的微粒系统只需增加药物在吸收部位的溶出即可提高其口服生物利用度。基于这一考虑,我们课题组尝试构建可在小肠部位选择性释放疏水药物的pH响应性微球递送系统。
寡聚天冬氨酸是一种氨基酸均聚物,其在生物体内可以被酶解成天冬氨酸和小肽,进而被清除或作为营养物质重新利用;因此,天冬氨酸多肽具有良好的生物可降解性和相容性,常用作构建不同递送系统的载体材料[19]。未开环的聚天冬氨酸即聚琥珀酰亚胺是一种活性较强的聚酰亚胺,很容易被氨解开环生成胺基取代的聚天冬酰胺[20]。利用聚酰亚胺这一特殊的开环活性,结合课题组前期研究[6],本研究拟通过异丙胺氨解聚琥珀酰亚胺合成载体材料,并考察其与羧基药物的自组装特性和载药性能。
本研究以疏水性药物吲哚美辛为模型药物,选用亲水性天冬氨酸多肽衍生物(PIPAA)作为载体材料,通过其与羧基小分子药物间的多重非共价键作用进行自组装,以构建pH响应性微球,并探讨其对疏水药物口服生物利用度和疗效的影响。
1 材料与方法 1.1 主要实验材料D, L-天冬氨酸(D1514002)、熊去氧胆酸(UDCA,E1715044)购自Aladdin公司;吲哚美辛(IND,BCBK0293V)、异丙胺、甲灭酸(Mef)和角叉菜胶购自Sigma公司;鲁米诺(L810O01)购自J&K Scientific公司;EudragitS100(S100)来源于Evonik Industries公司;聚乙烯醇(PVA,L780R17)购自Acros Organics公司。
1.2 方法 1.2.1 聚(异丙基)天冬酰胺(PIPAA)的合成及表征20 g D, L-天冬氨酸置于50 mL圆底烧瓶中,其中加85%磷酸7.5 mL溶解,180 ℃油浴加热回流、常压搅拌4 h。用适量的二甲基甲酰胺(DMF)溶解反应产物,过滤除去不溶物;将得到的滤液逐渐加入到大量的去离子水中沉淀产物,抽滤后用去离子水洗涤至中性,最终得到的固体于60 ℃真空烘干,得到聚琥珀酰亚胺(PSI)。然后,将5 mL异丙胺(CaH2除水)和260 mg干燥的PSI分别溶解于5 mL DMF中,将PSI的DMF溶液缓慢加入到溶有异丙胺的DMF溶液中,常温常压下搅拌12 h;之后将反应液转移至透析袋中,于去离子水中透析72 h,透析液离心后取上清冻干得终产物PIPAA。
中间产物PSI和终产物PIPAA分别溶解于氘代二甲基亚砜(DMSO-d6)和D2O后,于Avance-500 Spectrometer型核磁共振仪上进行1H NMR光谱分析。同时,取D, L-天冬氨酸、PSI和PIPAA粉末于Perkin Elmer Spectrum 100型傅里叶变换红外光谱仪上进行红外光谱分析。
1.2.2 IND/PIPAA微球的制备及表征按照不同的质量比(IND :PIPAA=10 :10、15 :10、20 :10、30 :10)分别称量一定量的IND和PIPAA,各自溶解于1 mL DMSO后混匀,置于透析袋中透析24 h得到不同质量比的IND/PIPAA微球。取1 mL含微球的水溶液,采用马尔文Nano ZS90粒度分析仪测定不同质量比的IND/PIPAA微球的粒径及其分布。将不同质量比的IND/PIPAA微球分散液分别滴于云母片和铜网上,室温干燥后,利用扫描电镜(SEM)和透射电镜(TEM)观察微球形态。
按照20 :10的质量比分别称取一定量的UDCA和PIPAA,各自溶解于1 mL DMSO后混匀,置于透析袋中透析24 h得到UDCA/PIPAA微球;同样采用SEM观察微球形态。
1.2.3 IND/PIPAA微球载药量和包封率的测定准确配制一系列浓度梯度的IND乙醇溶液,以乙醇为空白对照,于紫外-可见光谱仪在310 nm处测定IND的紫外吸收,绘制IND的标准曲线。
精密称量一定量的不同质量比的IND/PIPAA微球溶解于3 mL乙醇中,以乙醇为空白对照,测定310 nm处IND的光密度值。根据IND标准曲线,计算相应的IND的浓度、载药量和包封率。计算公式如下:
载药量(%)=微粒中药物质量/微粒的质量×100%
包封率(%)=微粒中药物含量/理论药物含量×100%
1.2.4 IND/PIPAA微球中分子间相互作用力的表征分别取少量IND、PIPAA和IND/PIPAA微球(20 :10)样品,利用傅里叶变换红外光谱仪测定波数800~4 000 cm-1之间样品的红外光谱图。另取一定量的IND、PIPAA以及二者的物理混合物分别溶解于DMSO-d6中,使用Avance-500 Spectrometer型核磁共振谱仪测定不同样品的1H NMR谱图。
称取一定量的IND、PIPAA以及质量比分别为5 :10、10 :10、15 :10、20 :10和30 :10的IND/PIPAA微球进行差示扫描量热(DSC)分析。另外,取一定量的IND、IND与PIPAA物理混合物和IND/PIPAA微球,进行X射线衍射(XRD)分析。通过DSC和XRD测定考察IND在IND/PIPAA微球中的存在形式。
1.2.5 IND/PIPAA微球的体外释药行为研究采用透析法,分别在pH=7.4的PBS和模拟胃肠pH值的释放介质中考察IND、IND/S100微球和IND/PIPAA微球的释药行为。其中IND/S100微球为阳性微球对照组,S100是美国FDA批准的肠溶包衣材料,它是一种pH敏感性丙烯酸聚合物。IND/S100微球制备方法如下:40 mg S100和10 mg IND分别溶于1 mL无水乙醇和3 mL二氯甲烷后缓慢混匀作为油相;配制2% PVA溶液(PVA为乳化剂)作为水相。冰浴条件下迅速将油相加入20 mL水相,并立即探头超声,每超声3 s停1 s,重复5次,功率为70%。得到的水包油乳液在室温下搅拌4 h,溶剂挥发后16 000 r/min离心10 min收集IND/S100微球,去离子水清洗3次。
准确配制一系列浓度梯度的溶有IND的PBS (pH=7.4)溶液,以PBS溶液为空白对照,测定310 nm处IND的紫外吸收,并绘制IND在PBS溶液中的标准曲线。按照前述方法测定IND/S100和IND/PIPAA微球的载药量,根据载药量计算释放实验所需微球的量,使3组的IND含量保持一致。
将IND、IND/S100微球和IND/PIPAA微球分散于300 μL去离子水中后加入透析袋中,在pH=7.4的PBS中释放18 h或在人工胃液中释放2 h后转移到pH=7.4的PBS缓冲溶液中继续释放至48 h。整个释放过程中,在特定的时间点取出4 mL释放介质,测定其在310 nm处的光密度值,同时补充4 mL新鲜释放介质。根据标准曲线计算不同时间点,释放介质中IND的含量,并计算累积释放量和累积释放百分比,绘制累计释放曲线。
1.2.6 IND/PIPAA微球体内药动学研究体质量(250±10)g的SD雄性大鼠9只,按随机数字表法分为3组,每组3只,分别灌胃给予IND、IND/S100微球和IND/PIPAA微球,给药剂量为5 mg/kg(按IND含量计)。灌胃后不同时间点取血,置于肝素钠抗凝管中。根据文献[21]处理血样,以甲灭酸作为内标,HPLC测定IND的血药浓度,色谱条件如下:流动相为乙腈-6 μmol/L H3PO4水溶液(55 :45,体积比);流速1 mL/min;柱温40 ℃;检测波长245 nm;进样量20 μL。进而以时间为横轴,IND血药浓度为纵轴绘制IND药时曲线,并利用DAS 3.2.8软件计算药-时曲线下面积AUC。其中,IND/S100微球为阳性微球对照组,其制备方法如前所述。
1.2.7 IND/PIPAA微球在角叉菜胶诱导的大鼠足跖肿胀模型中的抗炎效果评价体质量(250±10)g的SD雄性大鼠20只,按随机数字表法分为4组,分别为模型组、Raw IND组、IND/S100微球组和IND/PIPAA微球组,每组5只。大鼠麻醉后右后肢足跖部位注射0.1 mL角叉菜胶生理盐水溶液(2%),诱导足跖肿胀模型。造模0.5 h后,分别给大鼠灌胃IND、IND/S100微球和IND/PIPAA微球,给药剂量为5 mg/kg(按IND含量计),对照组给予相同体积的生理盐水。6 h后在肿胀部位注射50 μL鲁米诺溶液,以IVIS Spectrum小动物活体成像系统进行成像,统计足跖部位自发光强度。
1.3 统计学分析计量资料以x±s表示,运用SPSS 20.0软件进行统计分析,不同组间差异用单因素方差分析,药-时曲线不同组间差异用重复度量的方法进行统计,检验水准α=0.05。
2 结果 2.1 PIPAA的制备与表征PIPAA的合成路线如图 1所示,以浓磷酸为催化剂催化D, L-天冬氨酸在高温条件下聚合成聚琥珀酰亚胺(PSI),并用异丙胺氨解PSI得到PIPAA。
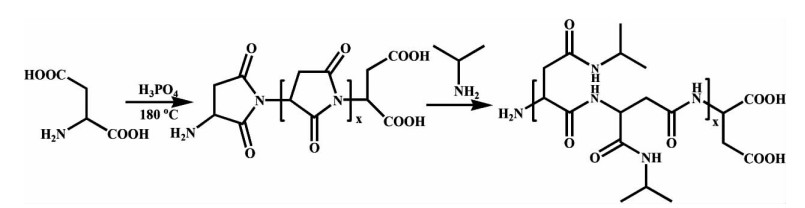
|
| 图 1 PIPAA的合成路线图 |
中间产物PSI与原料D, L-天冬氨酸的FT-IR图谱(图 2A)对比可以看出,在合成的PSI红外图谱中,2 970 cm-1处的次甲基峰和2 926 cm-1、2 853 cm-1处的亚甲基峰大大减弱,而1 799 cm-1、1 712 cm-1处环上羰基的伸缩振动峰明显出现,证明PSI成功合成。同样,PSI的1H NMR图谱(图 2B)也佐证了这一结论,5.3 ppm是PSI的次甲基质子峰,2.7和3.2 ppm处是PSI亚甲基的质子峰。此外,8~10 ppm之间几乎无质子峰出现,表明中间产物几乎没有支化结构或者未成环的结构,从而说明合成的PSI线性结构较好。
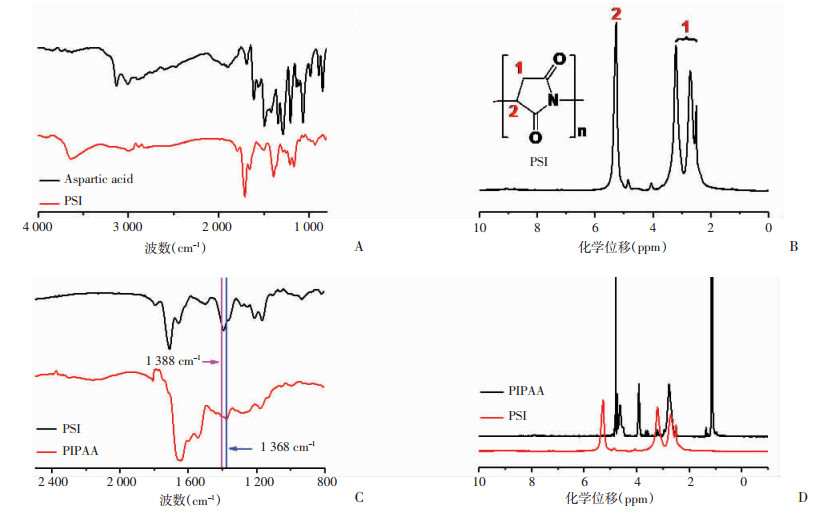
|
| A:中间产物PSI与原料D, L-天冬氨酸的FT-IR图谱;B:PSI的1H NMR图谱;C:异丙基胺氨解PSI后得到的PIPAA的FT-IR图谱;D:PIPAA的1H NMR谱图 图 2 PSI、PIPAA的FT-IR图谱和1H NMR图谱 |
图 2C所示为异丙基胺氨解PSI后得到的PIPAA的FT-IR图谱,与PSI的谱图相比,在1 368和1 388 cm-1处出现了明显的异丙基特征峰,说明PSI经异丙基胺氨解后成功合成了PIPAA。同样地,PIPAA的1H NMR谱图(图 2D)也出现了异丙基的质子峰(1.0对应与异丙基中1、3位碳相连的氢),而在PSI核磁谱图的相应位置未见该质子峰,这一结果佐证了红外结论。
2.2 IND/PIPAA微球的制备与表征为考察所合成的亲水性聚合物PIPAA能否包载含羧基小分子疏水药物形成微球,我们以IND为模型药物,通过透析法制备了不同质量比(MIND :MPIPAA=10 :10、15 :10、20 :10和30 :10)的IND/PIPAA微球。
本研究使用的IND原料的晶型主要为γ型,扫描电镜下表现为片状晶体(图 3A)。IND溶解于DMSO并在去离子水中透析后,SEM观察为针状晶体(图 3B)。SEM表征显示IND和PIPAA质量比分别为10 :10、15 :10、20 :10的IND/PIPAA微球呈现规整的球形,粒径较为均一,且未见IND针状晶体(图 3C~H,M),表明小分子疏水药物IND几乎完全和PIPAA自组装形成微球。而当IND和PIPAA的质量比提高至30 :10时,SEM观察发现IND针状晶体的存在(图 3I,J),提示PIPAA并不能无限制地与IND自组装;当IND增加到一定量后,它更倾向于自身分子堆砌成晶体而非与PIPAA共组装形成微球。另外,高IND投料比(20 :10)的IND/PIPAA微球的TEM结果(图 3K)显示该微球结构较紧实。当UDCA作为小分子疏水药物时,它与PIPAA也可以通过自组装得到形态良好的微球(图 3L),说明PIPAA可以作为通用型亲水载体材料,与多种羧基小分子疏水药物自组装形成微球释药系统。
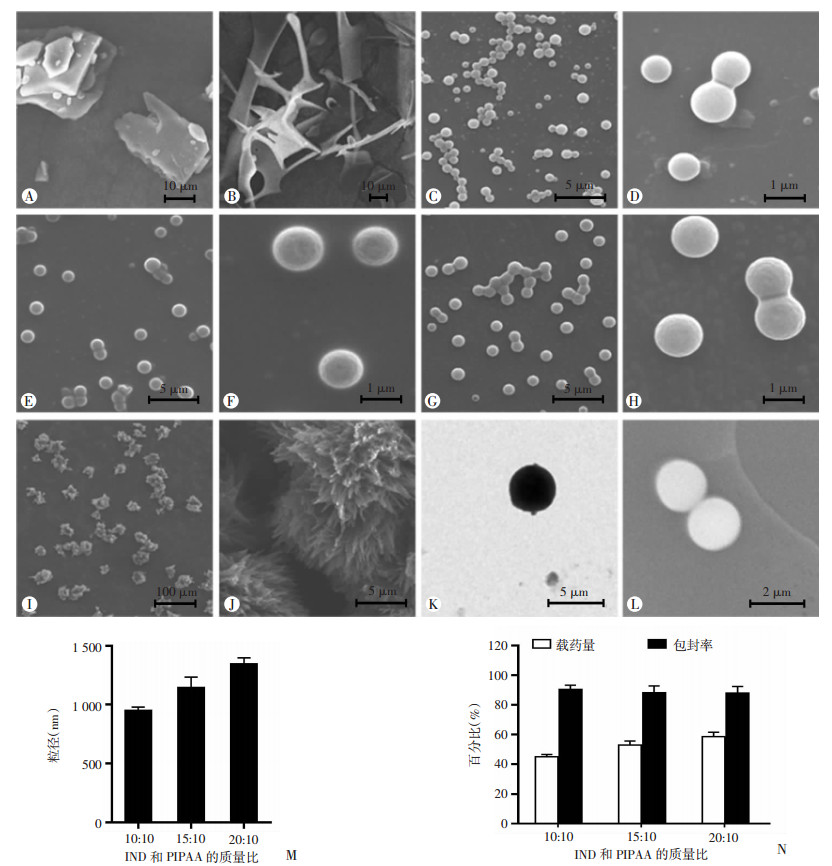
|
| A、B:透析前和透析后IND的SEM观察;C~J:不同投料比的IND/PIPAA微球的SEM观察;C、D:MIND :MPIPAA=10 :10,E、F:15 :10,G、H:20 :10,I、J:30 :10;K:投料比为20 :10的IND/PIPAA微球的TEM观察;L:UDCA/PIPAA(20 :10)微球的SEM观察;M、N:不同投料比的IND/PIPAA微球的平均粒径和载药量与包封率 图 3 不同投料比的微球的表征 |
为了定量分析自组装微球对IND的负载能力,通过紫外法检测了不同IND投料比的微球的载药量和包封率。结果显示其载药量随着IND投料比的增加而增加,最高可达58.71%,而包封率均在80%以上,最高可达90.33%(图 3N),说明PIPAA对IND具有极其优异的负载性能。
2.3 IND/PIPAA微球中分子间相互作用力的表征为了进一步考察IND和PIPAA是通过何种分子间相互作用力介导自组装形成微球,我们利用FT-IR、1H NMR、DSC和XRD进行了表征。由IND和IND/PIPAA微球的FT-IR谱图(图 4A)可以看出:由于羧基阴离子的对称伸缩振动和不对称伸缩振动,IND在1 604 cm-1和1 399 cm-1处有较强的吸收峰;而在微球中该吸收峰明显减弱,说明IND和PIPAA之间存在静电力,该静电力大大减弱了羧基阴离子的对称伸缩振动和不对称伸缩振动。同时,微球中缺少了IND的羰基基团的反对称伸缩振动峰和对称伸缩振动峰(1 712 cm-1和1 690 cm-1),仅在1 674 cm-1处存在一个吸收峰,这可能由于IND中的羰基与PIPAA的酰胺之间形成了氢键,从而降低了羰基的吸收。另外,IND、PIPAA和二者的物理混合物的1H NMR谱图(图 4B)显示,混合物中IND的信号明显减弱,羧基的质子峰几乎完全消失,而PIPAA部分的信号有所增强,这说明在DMSO-d6中IND与PIPAA间仍存在较强的非共价键相互作用。
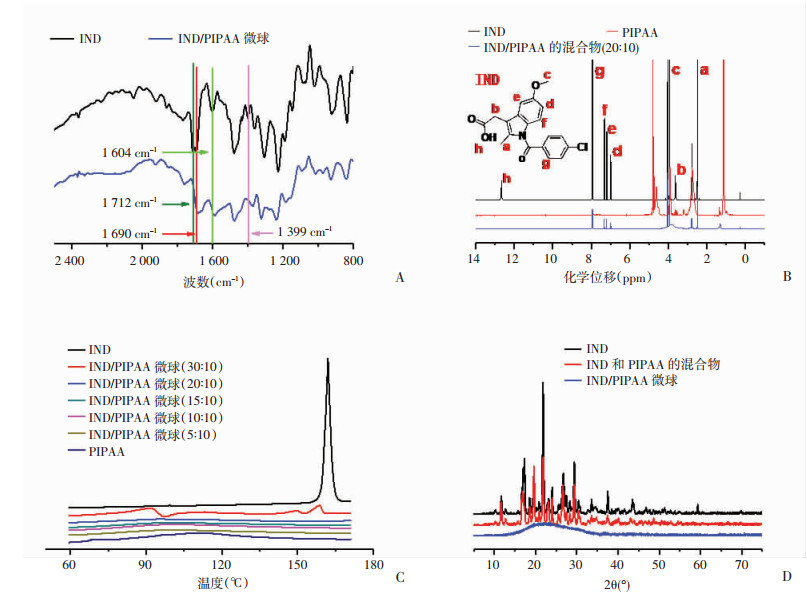
|
| A:FT-IR图谱;B:1H NMR图谱;C:DSC曲线;D:XRD谱 图 4 IND/PIPAA微球中分子间相互作用的表征 |
进一步通过DSC和XRD检测了IND在微球中的存在形式。DSC结果(图 4C)显示IND在162 ℃左右有一明显的吸热峰;然而,在PIPAA和投料比为10 :10、15 :10、20 :10的IND/PIPAA微球的DSC曲线中未见吸热峰,这表明IND主要以无定型的分子形式而非微晶形态存在于微球中;而疏水药物的无定型态有利于其快速溶出,从而提高口服生物利用度。另外,DSC检测发现投料比为30 :10的IND/PIPAA微球在160 ℃左右存在一可见的吸热峰,表明该投料比时,部分IND无法与PIPAA自组装于微球中,而以结晶形式存在。并且,IND和IND/PIPAA微球(投料比为30 :10)二者的IND晶体吸热峰的位置不同,可能源于IND的不同晶型,这与扫描电镜结果相吻合。而在XRD检测中观察到了相同的结果(图 4D)。综合上述结果,我们选择投料比为20 :10的IND/PIPAA微球用于后续研究。
2.4 IND/PIPAA微球的体外药物释放行为为了考察IND/PIPAA微球能否提高IND溶出,我们分别在pH=7.4的PBS和模拟胃肠pH值的释放介质中考察了IND原料、IND/PIPAA和IND/S100微球的释药行为。
IND在PBS中的标准曲线(图 5A)的拟合方程为y=11.970 34x+0.015 11(R2=0.999 9,mg/mL)。在pH=7.4的PBS中,IND/PIPAA和IND/S100微球可以迅速释放IND,几乎在2 h内完全释放(图 5B)。IND原料则呈现出典型的药物溶解曲线,并且仅有约66%的IND溶出,而含有等量IND的IND/PIPAA微球可以实现100%的IND溶出;表明IND/PIPAA微球可以有效提高小分子疏水药物的溶出速率。在模拟胃肠pH值的释放介质中,最初2 h(pH=1.2,模拟胃液)IND/PIPAA和IND/S100微球几乎均无IND释放,这主要由于IND在该pH条件下质子化,溶解度极低。当pH值从1.2变为7.4后,IND迅速从IND/PIPAA和IND/S100微球中释放,在8 h内几乎完全释放(图 5C);而IND原料在48 h时仅有约48%溶出。这些结果表明IND/ PIPAA微球除了可以提高小分子疏水药物的溶出之外,还具有良好的pH响应性释药特性,其与FDA批准的肠溶包衣材料S100具有相近的效果。此外,可以看出IND/PIPAA微球的pH响应性与IND的解离特性有关。IND的pKa约为4.5,在pH=1.2时,IND羧基质子化从而导致极低的溶解度;而在pH=7.4时,IND的解离可以显著增加其溶解度。因此,在pH=7.4时,IND的解离会导致IND/PIPAA微球的侵蚀和瓦解,实现pH响应性药物释放。

|
| A:IND在pH=7.4 PBS中的标准曲线;B、C:IND、IND/PIPAA和IND/S100微球在pH=7.4 PBS缓冲溶液和模拟胃肠pH环境的释放介质中的累积释放曲线 图 5 IND/PIPAA微球的体外释药行为 |
2.5 IND/PIPAA微球的体内药动学研究
体外释药实验证明IND/PIPAA微球可以提高小分子疏水药物的溶出和释放,我们进而通过大鼠体内药动学实验进一步考察IND/PIPAA微球能否提高IND的口服生物利用度。
以甲灭酸为内标,采用内标法,利用HPLC定量分析了灌胃给予IND原料药、IND/S100和IND/PIPAA微球后,不同时间点大鼠血样中IND的含量,并绘制药-时曲线,计算药-时曲线下面积(AUC)。图 6A为IND在血样中的标准曲线,其拟合方程为AIND/AMef= 1.233 68C+0.674 15 (R2 =0.998 45,μg/mL)。图 6B为IND在血样中的典型HPLC谱图(IND浓度8 μg/mL),可以看出IND和甲灭酸出峰时间分别为10 min和16 min,二者能够完全分离且无其他干扰。

|
| A:IND在血浆中的标准曲线;B:IND和甲灭酸在血浆中的代表性HPLC谱图;C:药-时曲线;D:不同样品的AUC值;a: P < 0.05,与IND组比较 图 6 IND/PIPAA微球的体内药动学研究 |
大鼠体内药动学实验结果表明:灌胃给予IND原料药、IND/PIPAA和IND/S100微球后,与IND原料药相比,IND/PIPAA和IND/S100微球可以显著提高IND的口服生物利用度(P=0.001, P=0.000)(图 6C)。与此一致,二者与IND原料药的AUC值的差异具有统计学意义(P=0.01, P=0.000);IND/PIPAA微球组的AUC值为IND原料药组的2.4倍(图 6D)。不过,IND/PIPAA微球的口服生物利用度低于IND/S100微球。
2.6 IND/PIPAA微球的体内药效学评价鲁米诺可以被炎症局部的活性氧氧化转变成激发态氨基邻苯二甲酸,发出较强的自发光。利用鲁米诺的发光特性,我们在造模6 h后大鼠右后足跖部位注射鲁米诺进行IVIS成像,以考察足趾部位的炎症情况。IVIS成像结果如图 7A~D所示,可以观察到4组大鼠右后足跖部位均有不同程度的发光,表明足跖部位出现了炎性反应,急性足跖肿胀模型成功建立。将各组的发光强度进行量化统计(图 7E),与生理盐水对照组相比,灌胃给予IND/PIPAA微球治疗的大鼠足跖部位的发光强度显著减弱(P=0.046)。此外,IND/PIPAA微球组足跖部位的发光强度也明显弱于IND原料药和IND/S100微球治疗组(P=0.002, P=0.007),表明在大鼠急性足趾肿胀模型中,IND/PIPAA微球可显著减轻炎症局部的炎性反应,其效果明显优于IND原料药和IND/S100微球治疗组。
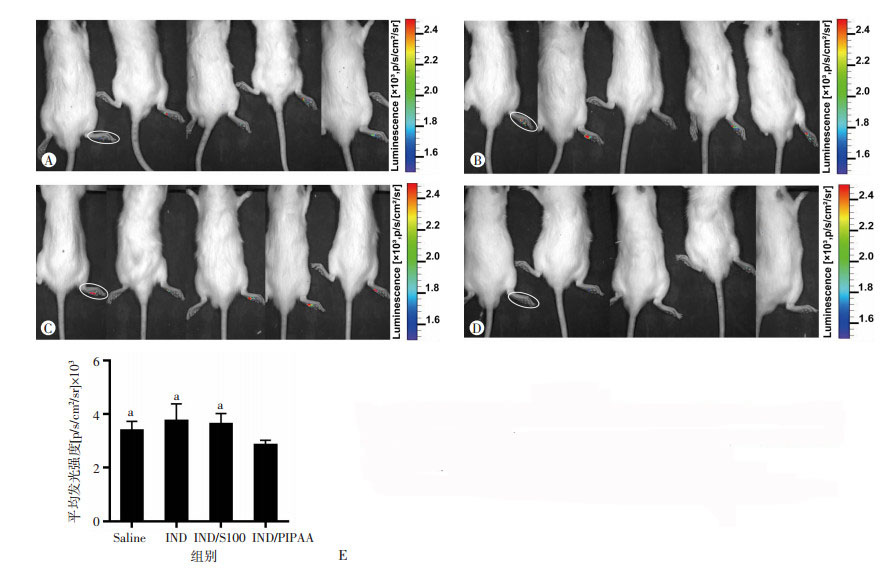
|
| A~D:各实验组足部位注射鲁米诺溶液后IVIS成像观察;A:Saline组,B:IND组,C:IND/S100组,D:IND/PIPAA组;E:各组足环部位自发光强度定量统计结果(n=5),a:P < 0.05,与IND/PIPAA组比较 图 7 IND/PIPAA微球对角又菜胶诱导的足跖肿胀的治疗效果评价 |
3 讨论
目前,作为药物递送系统研究的聚合物组装体大多是由非共价键作用力介导两亲性共聚物的自组装制备,疏水药物主要通过疏水作用负载其中。但是共聚物较为复杂的分子结构往往会导致其合成复杂、批次重复性不好、结构表征困难、难以规模化制备等一系列问题。针对这些问题,基于我们在小分子药物介导的亲水性聚合物自组装构建高效药物递送系统方面的前期发现,本研究中我们设计并合成了一种新型的亲水性载体材料PIPAA。PIPAA中酰胺、异丙基等基团与羧基小分子药物之间存在氢键、静电和疏水作用等多重非共价键作用力,从而介导自组装微球的形成。与常用的两亲性共聚物相比,PIPAA由单一的天冬氨酸聚合而成,其结构简单、生物相容性较好,且合成容易、过程易于重复。此外,PIPAA与羧基小分子药物通过多重非共价键作用力介导的自组装形成的微球较传统聚合物自组装体大幅度提高了疏水药物的载药量和包封率,从而可以减少因载体材料过多而导致的潜在毒副作用。
IND/PIPAA微球的体外释药行为表现出明显的pH响应特性,与IND/S100微球相近,但是二者pH响应性的机制不同。IND/S100乳化微球的pH响应性归因于S100的pH敏感性,而IND/PIPAA微球的pH响应性与IND的解离特性有关。IND的酸度系数约为4.5,在pH=1.2的介质中,IND/PIPAA微球中的IND羧基呈现质子化状态,导致其溶解度极低。而在pH=7.4的介质中,IND羧基迅速离子化,其溶解度大大增加;另一方面,IND中羧基的解离极大地削弱了药物与PIPAA的分子间作用力,从而导致IND/PIPAA微球的侵蚀和瓦解,加速药物释放。另外,IND/PIPAA微球中IND主要以无定型态存在。因此,口服IND/PIPAA微球后,在肠道pH条件下微球崩解,其中负载的IND以分子形式直接游离出来,无须经过药物晶体的溶解过程,从而可以显著增加IND的溶出速率,提高IND的口服生物利用度。这对于降低IND微球释药系统的给药剂量,减少IND引起的胃肠出血事件有重要的作用。
综上所述,本研究合成了一种新型的亲水性多肽衍生物载体材料PIPAA,其结构简单,易于合成,且可以通过多重非共价键作用力与IND自组装形成微球。IND/PIPAA微球可以显著增加所负载小分子疏水药物的溶出,提高口服生物利用度,进而增强其疗效,并有望减少IND引起的胃肠出血事件的发生。此外,PIPAA可作为一种通用型载体材料,通过自组装负载不同结构的含羧基小分子疏水药物,实现多种疾病的有效口服治疗。
| [1] |
AL-HILAL T A, ALAM F, BYUN Y. Oral drug delivery systems using chemical conjugates or physical complexes[J]. Adv Drug Deliv Rev, 2013, 65(6): 845-864. DOI:10.1016/j.addr.2012.11.002 |
| [2] |
BAKHRU S H, FURTADO S, MORELLO A P, et al. Oral delivery of proteins by biodegradable nanoparticles[J]. Adv Drug Deliv Rev, 2013, 65(6): 811-821. DOI:10.1016/j.addr.2013.04.006 |
| [3] |
PORTER C J, TREVASKIS N L, CHARMAN W N. Lipids and lipid-based formulations: optimizing the oral delivery of lipophilic drugs[J]. Nat Rev Drug Discov, 2007, 6(3): 231-248. DOI:10.1038/nrd2197 |
| [4] |
LU Y, CHEN S C. Micro and nano-fabrication of biodegradable polymers for drug delivery[J]. Adv Drug Deliv Rev, 2004, 56(11): 1621-1633. DOI:10.1016/j.addr.2004.05.002 |
| [5] |
ZHANG J X, LI X D, LI X H. Stimuli-triggered structural engineering of synthetic and biological polymeric assemblies[J]. Prog Polym Sci, 2012, 37(8): 1130-1176. DOI:10.1016/j.progpolymsci.2011.11.005 |
| [6] |
ZHOU X, ZHAO Y, CHEN S Y, et al. Self-assembly of pH-responsive microspheres for intestinal delivery of diverse lipophilic therapeutics[J]. Biomacromolecules, 2016, 17(8): 2540-2554. DOI:10.1021/acs.biomac.6b00512 |
| [7] |
GOLDBERG M, GOMEZ-ORELLANA I. Challenges for the oral delivery of macromolecules[J]. Nat Rev Drug Discov, 2003, 2(4): 289-295. DOI:10.1038/nrd1067 |
| [8] |
NORRIS D A, PURI N, SINKO P J. The effect of physical barriers and properties on the oral absorption of particulates[J]. Adv Drug Deliv Rev, 1998, 34(2/3): 135-154. DOI:10.1016/s0169-409x(98)00037-4 |
| [9] |
SANT S, TAO S L, FISHER O Z, et al. Microfabrication technologies for oral drug delivery[J]. Adv Drug Deliv Rev, 2012, 64(6): 496-507. DOI:10.1016/j.addr.2011.11.013 |
| [10] |
SINHA V R, TREHAN A. Biodegradable microspheres for protein delivery[J]. J Control Release, 2003, 90(3): 261-280. DOI:10.1016/s0168-3659(03)00194-9 |
| [11] |
TAKEUCHI H, THONGBORISUTE J, MATSUI Y, et al. Novel mucoadhesion tests for polymers and polymer-coated particles to design optimal mucoadhesive drug delivery systems[J]. Adv Drug Deliv Rev, 2005, 57(11): 1583-1594. DOI:10.1016/j.addr.2005.07.008 |
| [12] |
CHEN H, LANGER R. Oral particulate delivery: status and future trends[J]. Adv Drug Deliv Rev, 1998, 34(2/3): 339-350. DOI:10.1016/s0169-409x(98)00047-7 |
| [13] |
FOSTER N, HIRST B H. Exploiting receptor biology for oral vaccination with biodegradable particulates[J]. Adv Drug Deliv Rev, 2005, 57(3): 431-450. DOI:10.1016/j.addr.2004.09.009 |
| [14] |
KHAFAGY E L S, MORISHITA M. Oral biodrug delivery using cell-penetrating peptide[J]. Adv Drug Deliv Rev, 2012, 64(6): 531-539. DOI:10.1016/j.addr.2011.12.014 |
| [15] |
KUNISAWA J, KURASHIMA Y, KIYONO H. Gut-associated lymphoid tissues for the development of oral vaccines[J]. Adv Drug Deliv Rev, 2012, 64(6): 523-530. DOI:10.1016/j.addr.2011.07.003 |
| [16] |
AOUADI M, TESZ G J, NICOLORO S M, et al. Orally delivered siRNA targeting macrophage Map4k4 suppresses systemic inflammation[J]. Nature, 2009, 458(7242): 1180-1184. DOI:10.1038/nature07774 |
| [17] |
KWON K C, VERMA D, SINGH N D, et al. Oral delivery of human biopharmaceuticals, autoantigens and vaccine antigens bioencapsulated in plant cells[J]. Adv Drug Deliv Rev, 2013, 65(6): 782-799. DOI:10.1016/j.addr.2012.10.005 |
| [18] |
YOO J W, IRVINE D J, DISCHER D E, et al. Bio-inspired, bioengineered and biomimetic drug delivery carriers[J]. Nat Rev Drug Discov, 2011, 10(7): 521-535. DOI:10.1038/nrd3499 |
| [19] |
YAMAKAWA I, KAWAHARA M, WATANABE S, et al. Sustained release of insulin by double-layered implant using poly(D, L-lactic acid)[J]. J Pharm Sci, 1990, 79(6): 505-509. DOI:10.1002/jps.2600790610 |
| [20] |
XU W, LI L, YANG W L, et al. Amphiphilic hexylamine modified polysuccinimide: synthesis, characterization, and formation of nanoparticles in aqueous medium[J]. J Macromol Sci Part A, 2003, 40(5): 511-523. DOI:10.1081/ma-120019889 |
| [21] |
ZHANG S Y, BELLINGER A M, GLETTIG D L, et al. A pH-responsive supramolecular polymer gel as an enteric elastomer for use in gastric devices[J]. Nat Mater, 2015, 14(10): 1065-1071. DOI:10.1038/nmat4355 |



