2. 400016 重庆, 重庆医科大学基础医学院病理生理学教研室
2. Department of Pathophysiology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
脑出血(intracerebral hemorrhage,ICH)是一类高致死率高致残率的卒中亚型,目前对其发病机制和治疗手段的研究均十分有限[1]。近年来,针对ICH后继发性脑损伤治疗成为ICH研究的重点。研究表明免疫炎症反应在继发性脑损伤中扮演重要角色[2]。在ICH发生后,炎性细胞浸润以及小胶质细胞的活化导致大量促炎因子的释放,从而引起级联的炎症反应,导致神经细胞死亡和组织损伤[3-4]。因此,针对ICH后炎症反应的研究可能为ICH提供新的治疗靶点。
柚皮素(naringenin,NGN)属于黄酮类化合物黄烷酮类。研究证明柚皮素可以发挥多种生理学作用,包括抗氧化、抗炎和抗肿瘤的作用[5-7]。多项研究表明柚皮素具有抑制肿瘤坏死因子(TNF)-α、NF-κB介导的信号通路,抑制白细胞介素(interleukin,IL)-1β、IL-6等促炎因子的表达,从而抑制炎症反应,参与了多项炎症疾病的病理过程[8-10]。此外柚皮素可改善大鼠缺血性脑卒中后神经功能缺损、脑水肿[11-12]。然而,柚皮素在ICH后的作用尚未见报道。
蛋白激酶C(protein kinase C,PKC)-δ是一种炎症调节因子。它可以调节转录因子NF-κB以及促炎基因(如IL-1β、IL-6)表达的激活、细胞因子和趋化因子的分泌,以及活性氧(ROS)的产生[13]。有研究发现在大鼠ICH后,脑组织内PKC-δ明显升高且介导了脑出血后的炎性损伤[14]。由此可见,PKC-δ可能是ICH后炎症反应的关键调节因子。本研究将探讨柚皮素对大鼠ICH后炎症损伤的作用以及其机制是否与PKC-δ的磷酸化有关。
1 材料与方法 1.1 动物及ICH模型SPF级成年雄性SD大鼠(体质量250~300 g)购自重庆医科大学实验动物中心,动物实验由重庆医科大学伦理委员会批准(2017-11-15)。将SD大鼠采用随机数表法分为假手术组(手术18只,成功18只)、ICH模型组(手术19只,成功18只)、ICH+DMSO+PEG400组(手术20只,成功18只)、ICH+NGN低剂量组(10 mg/kg)(手术14只,成功12只)、ICH+NGN中剂量组(20 mg/kg)(手术18只,成功18只)、ICH+NGN高剂量组(40 mg/kg)(手术12只,成功12只)、ICH+DMSO组(手术6只,成功6只)、ICH+PKC-δ激活剂Phorbol 12-myristate 13-acetate(PMA)组(手术8只,成功6只)、ICH+PMA+NGN组(手术7只,成功6只)。
按照文献报道的ICH模型建立方法[15],将SD大鼠腹腔注射水合氯醛(350 mg/kg)麻醉后,固定于大鼠脑立体定位仪(深圳瑞沃德),随后将从大鼠股动脉抽取的50 μL自体血缓慢注入大鼠右侧基底节(前囟后0.2 mm,旁开3.0 mm,深5.8 mm),留针10 min防止血液流出,随后取出针头,缝合头皮,将手术后大鼠置于37 ℃恒温毯上直至苏醒,给予水和食物。假手术组按照相同方法插入针头但不注入血液。总共建立了104例大鼠ICH模型,成功96例,成功率为92.3%。
1.2 给药NGN(Sigma-Aldrich,W530098)依次溶于DMSO及PEG400(1 :4),终浓度为3 mg/mL。于ICH术后1 h按照低剂量组(10 mg/kg)、中剂量组(20 mg/kg)、高剂量组(40 mg/kg)腹腔注射给药。NGN溶剂对照组给予相同剂量的DMSO+PEG400。PMA(MedChem-Express,HY-18739)溶于DMSO(50 mg/mL),于ICH术前12 h侧脑室注射PMA(200 μg/kg)[16]。PMA溶剂对照组给予相同剂量的DMSO。
1.3 神经功能评分于ICH术后24 h分别对各组大鼠采用Modified Garcia评分[17],评分越低,神经损伤越重。
1.4 脑含水量测定按照文献[4]方法,在ICH术后24 h,将大鼠在麻醉状态下断头取脑,随即称取脑组织质量得到湿质量。将得到的脑组织置于冷凝干燥箱中干燥24 h后,称取脑组织质量得到干质量。脑含水量由以下公式计算得到:脑含水量=(湿质量-干质量)/湿质量。
1.5 HE染色ICH术后24 h,将大鼠在麻醉状态下顺序心脏灌注生理盐水和4%多聚甲醛溶液,然后迅速断头取脑并在4%多聚甲醛溶液中固定。将固定后的脑组织石蜡包埋、切片并进行染色。将HE染色切片置于光学显微镜下观察并采集图像。
1.6 Westernblot ICH术后24 h,将大鼠在麻醉状态下断头取脑,血肿周围脑组织提取总蛋白。将提取的总蛋白于SDS-PAGE胶上电泳并电转到PVDF膜(Millipore)上。随后,用脱脂牛奶封闭,一抗4 ℃孵育过夜。使用的一抗如下:抗PKC-δ(1 :1 000,# 2058S,Cell Signaling Technology),抗Phospho-PKC-δ (Tyr311) (1 :1 000,# 2055S,Cell Signaling Technology),抗NF-κB(1 :500,AF5006, Affinity Biosciences),抗IL-1β(1 :500, AF4006, Affinity Biosciences),抗IL-6(1 :500, A0286, ABClonal),抗β-actin(1 :3 000,66009-1-Ig,Proteintech Group, lnc.)。一抗孵育结束后,洗膜并用相应的二抗室温孵育2 h,使用的二抗如下:羊抗兔IgG (1 :3 000, S0001, Affinity Biosciences),羊抗鼠IgG (1 :3 000, S0002, Affinity Biosciences)。蛋白特异显影在Bio-Rad Gel Doc Imager(Bio-Rad)上进行。
1.7 统计学分析所有数据以x±s表示。用GraphPad Prism 7和Microsoft excel 2016软件进行统计分析。样本之间的比较采用单因素方差分析或非配对t检验。检验水准α=0.05。
2 结果 2.1 NGN提高了大鼠ICH后神经功能评分ICH后24 h,对各组大鼠进行Modified Garcia评分。与假手术组相比,ICH组神经功能评分明显降低,而ICH组和ICH+DMSO+PEG400组神经功能评分无统计学差异,提示溶剂对照不影响药物处理的结果。与ICH组和ICH+DMSO+PEG400组相比,ICH+NGN低剂量组神经功能评分有所提高(P < 0.05),而ICH+NGN中剂量组、ICH+NGN高剂量组神经功能评分显著提高(P < 0.01, 图 1A)。结果提示中剂量和高剂量NGN能显著提高大鼠ICH后神经功能评分。

|
| 1:假手术组;2:ICH组;3:ICH+DMSO+PEG400组;4:ICH+NGN低剂量组;5:ICH+NGN中剂量组;6:ICH+NGN高剂量组A:大鼠ICH后Modified Garcia评分;B大鼠ICH后脑含水量测定a:P < 0.05,b:P < 0.01,与ICH组比较;C:大鼠ICH后脑组织HE染色观察结果 图 1 NGN改善了大鼠ICH后的神经功能评分、脑含水量和神经元变性死亡(n=6, x±s) |
2.2 NGN降低了大鼠ICH后脑含水量
ICH后24 h,对各组大鼠脑组织进行含水量测定。与假手术组相比,ICH组脑含水量明显增加,而ICH组和ICH+DMSO+PEG400组脑水含量差异无统计学意义,提示溶剂对照不影响药物处理的结果。与ICH组和ICH+DMSO+PEG400组相比,ICH+NGN低剂量组脑含水量有所降低(P < 0.05),而ICH+NGN中剂量组、ICH+NGN高剂量组脑含水量显著降低(P < 0.01, 图 1B)。结果提示中剂量和高剂量NGN能显著降低大鼠ICH后脑水含量。
2.3 NGN减少了大鼠ICH后神经元变性死亡ICH后24 h,对各组大鼠脑组织进行HE染色。HE染色结果显示,与假手术组相比,ICH组神经元变性死亡数量明显增多,而ICH组和ICH+DMSO+PEG400组HE染色无明显差异,提示溶剂对照不影响药物处理的结果。与ICH组和ICH+DMSO+PEG400组相比,ICH+NGN低剂量组神经元变性坏死数量有所减少,而ICH+NGN中剂量组、ICH+NGN高剂量组神经元变性坏死数量显著减少(图 1C)。结果提示中剂量和高剂量NGN能显著减少大鼠ICH后神经元变性坏死。
2.4 NGN降低了大鼠ICH后PKC-δ的相对磷酸化水平以及NF-κB、IL-1β、IL-6的表达ICH后24 h,取大鼠血肿周围脑组织进行检测PKC-δ的磷酸化水平以及NF-κB、IL-1β、IL-6。Western blot结果显示,与假手术组相比,ICH组的PKC-δ相对磷酸化水平以及NF-κB、IL-1β、IL-6的相对表达水平均明显升高(P < 0.01),而ICH组和ICH+DMSO+PEG400组无统计学差异。根据2.1~2.3的结果,选用中剂量NGN作为给药组,结果显示,与ICH组和ICH+DMSO+PEG400组相比,ICH+NGN中剂量组的PKC-δ相对磷酸化水平以及NF-κB、IL-1β、IL-6的相对表达水平均显著降低(P < 0.01, 图 2)。该结果表示NGN可降低大鼠ICH后脑组织内炎症因子表达。
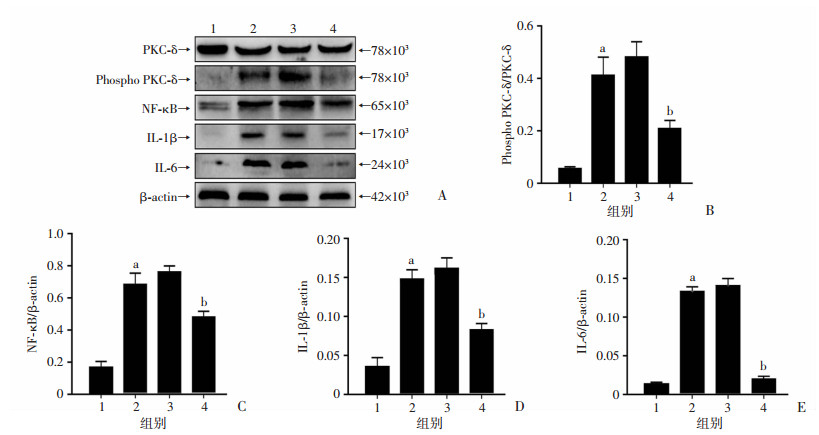
|
| 1:假手术组;2:ICH组;3:ICH+DMSO+PEG400组;4:ICH+NGN中剂量组A:Western blot检测大鼠ICH后PKC-δ、Phospho PKC-δ、NF-κB、IL-1β、IL-6的表达;B:PKC-δ的相对磷酸化水平;C~E:分别为NF-κB、IL-1β、IL-6的相对表达水平a:P < 0.01,与假手术组比较;b:P < 0.01,与ICH组比较 图 2 NGN降低了大鼠ICH后PKC-δ的相对磷酸化水平以及NF-κB、IL-1β、IL-6的相对表达(n=6,x±s) |
2.5 增加大鼠ICH后PKC-δ的磷酸化可升高NF-κB、IL-1β、IL-6的相对表达
为进一步验证PMA对PKC-δ的磷酸化激活的效果,以及PKC-δ磷酸化增加之后对大鼠ICH后下游炎症因子的影响,在ICH后24 h,取大鼠血肿周围脑组织进行检测PKC-δ的磷酸化水平以及NF-κB、IL-1β、IL-6。Western blot结果显示,与ICH组相比,ICH+PMA组的PKC-δ相对磷酸化水平以及NF-κB、IL-1β、IL-6的相对表达均显著升高(P < 0.01, 图 3A~E),而ICH组和ICH+DMSO组无统计学差异。该结果表示增加大鼠ICH后PKC-δ的磷酸化水平可提高大鼠ICH后脑组织内炎症因子表达。
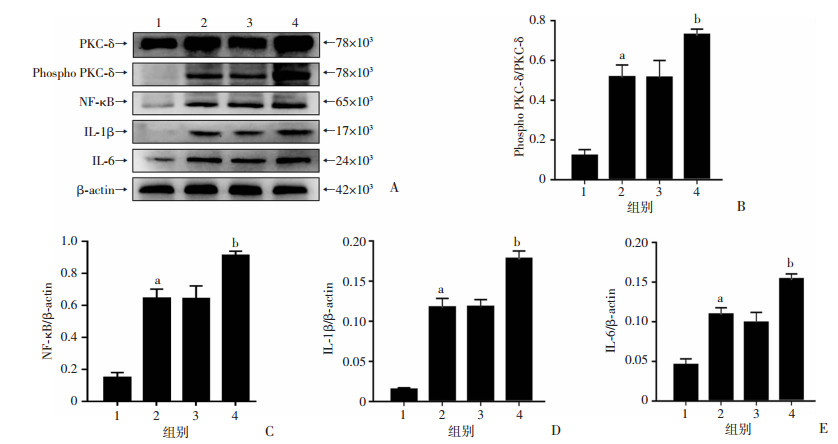
|
| 1:假手术组;2:ICH组;3:ICH+DMSO组;4:ICH+PMA组A:Western blot检测大鼠ICH后PKC-δ、Phospho PKC-δ、NF-κB、IL-1β、IL-6的表达;B:PKC-δ的相对磷酸化水平;C~E:分别为NF-κB、IL-1β、IL-6的相对表达水平;a:P < 0.01,与假手术组比较;b:P < 0.01,与ICH组比较 图 3 PMA增加了大鼠ICH后PKC-δ的相对磷酸化水平以及NF-κB、IL-1β、IL-6的相对表达(n=6,x±s) |
2.6 NGN降低大鼠脑出血后炎症可能与抑制PKC-δ的磷酸化水平有关
Western blot结果显示,与ICH组相比,ICH+NGN中剂量组的NF-κB、IL-1β、IL-6的相对表达水平降低(P < 0.01),与ICH+NGN中剂量组相比,ICH+PMA+NGN组的NF-κB、IL-1β、IL-6的相对表达水平显著升高(P < 0.01, 图 4A~D)。该结果表示增加PKC-δ的磷酸化水平可逆转NGN的降低大鼠ICH后NF-κB、IL-1β、IL-6的相对表达水平的效应,提示NGN降低大鼠ICH后炎症反应可能与抑制PKC-δ的磷酸化水平有关。
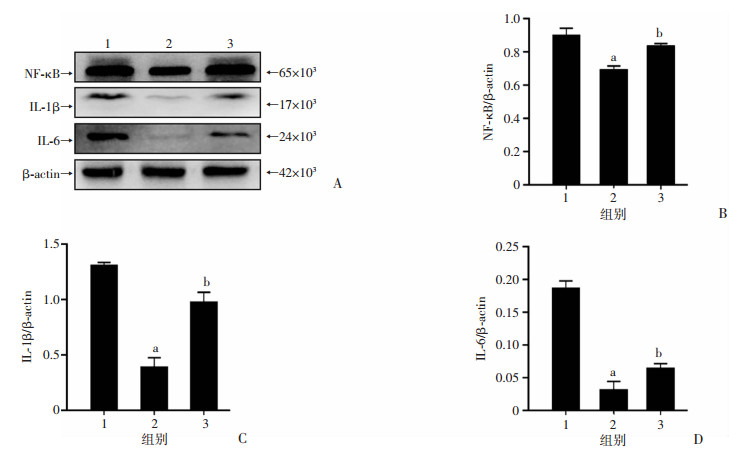
|
| 1:ICH组;2:ICH+NGN中剂量组;3:ICH+PMA+NGN组A: Western blot检测大鼠ICH后NF-κB、IL-1β、IL-6的表达;B~D:分别为NF-κB、IL-1β、IL-6的相对表达水平;a:P < 0.01,与ICH组比较;b:P < 0.01,与ICH+NGN中剂量组比较 图 4 NGN通过抑制PKC-δ的磷酸化来降低大鼠脑出血后NF-κB、IL-1β、IL-6的相对表达(n=6,x±s) |
3 讨论
中药成分在缺血性脑卒中的应用逐渐趋于成熟,然而,在ICH中的应用研究较少[18]。鉴于ICH的高致死率、高致残率,以及目前治疗手段的限制,深入探究中药成分对ICH的治疗作用及其机制十分必要。ICH后的继发性脑损伤包括炎症反应、氧化应激、血脑屏障破坏等[2, 19-20],而NGN在与炎症相关的多种疾病中具有不同程度缓解疾病的作用,包括败血症、急性肝炎、恶性肿瘤[7-8]。研究发现,NGN可能通过抑制前列腺素E2和NO从而对内毒素引起的大鼠眼色素层炎症具有改善的作用[21]。2项在大鼠缺血性脑卒中模型中的独立研究发现NGN在缺血性脑卒中的大鼠模型中具有改善神经功能、降低脑水肿的作用[11-12],分别从氧化应激、神经凋亡的角度解释NGN改善脑卒中后损伤的机制。本研究首次在ICH模型中探讨NGN的治疗作用,发现NGN在大鼠ICH后具有改善神经功能评分和神经元变性坏死、降低脑水肿的功能,并通过NGN对炎症反应的影响来解释了其在大鼠ICH模型中的保护机制。
PKC-δ已被证实是在炎症中具有关键作用的调节因子[13]。在中性粒细胞和内皮细胞中,PKC-δ可调节NF-κB的信号活化,促进IL-1β、IL-6等炎症因子的转录激活[22-23]。研究发现PKC-δ参与调节脓毒症、结核、败血症诱发肺损伤等疾病过程中的炎症反应[24-25]。PKC-δ在大鼠ICH中也介导了炎症反应[14]。本研究采用PKC-δ磷酸化激活剂PMA,进一步证实了PKC-δ在大鼠ICH后炎症损伤中的调节作用。此外,有文献报道,NGN在高胆固醇血症的肝细胞中通过抑制NF-κB降低TNF-α、IL-6和IL-1β[26]。我们的研究也发现NGN可降低ICH后NF-κB、IL-1β、IL-6的表达。为研究这一效应是否可通过抑制PKC-δ的磷酸化来实现,我们在大鼠ICH模型中给予NGN的基础上用PMA增加PKC-δ的磷酸化,实验结果发现PMA逆转了NGN对大鼠ICH后减少NF-κB、IL-1β、IL-6等炎症因子表达的作用,进一步证明NGN降低大鼠ICH后炎症反应可能与抑制PKC-δ的磷酸化水平有关。
总之,本研究揭示了NGN在大鼠ICH后的抗炎及神经保护功能,该作用可能是通过抑制磷酸化PKC-δ来实现的,这为寻找ICH后的治疗靶点提供了新的思路。
| [1] |
QURESHI A I, MENDELOW A D, HANLEY D F. Intrac-erebral haemorrhage[J]. Lancet, 2009, 373(9675): 1632-1644. DOI:10.1016/S0140-6736(09)60371-8 |
| [2] |
MRACSKO E, VELTKAMP R. Neuroinflammation after intracerebral hemorrhage[J]. Front Cell Neurosci, 2014, 8: 388. DOI:10.3389/fncel.2014.00388 |
| [3] |
ZHOU Y, WANG Y C, WANG J, et al. Inflammation in intracerebral hemorrhage: from mechanisms to clinical translation[J]. Prog Neurobiol, 2014, 115: 25-44. DOI:10.1016/j.pneurobio.2013.11.003 |
| [4] |
REN H L, KONG Y, LIU Z J, et al. Selective NLRP3 (pyrin domain-containing protein 3) inflammasome inhibitor reduces brain injury after intracerebral hemorrhage[J]. Stroke, 2018, 49(1): 184-192. DOI:10.1161/STROKEAHA.117.018904 |
| [5] |
WANG J C, YANG Z J, LIN L, et al. Protective effect of naringenin against lead-induced oxidative stress in rats[J]. Biol Trace Elem Res, 2012, 146(3): 354-359. DOI:10.1007/s12011-011-9268-6 |
| [6] |
CHOI Y H. Naringenin attenuates the release of pro-inflammatory mediators from lipopolysaccharide-stimulated BV2 microglia by inactivating nuclear factor-κB and inhibiting mitogen-activated protein kinases[J]. Int J Mol Med, 2012, 30. DOI:10.3892/ijmm.2012.979 |
| [7] |
LEONARDI T, VANAMALA J, TADDEO S S, et al. Apigenin and naringenin suppress colon carcinogenesis through the aberrant crypt stage in azoxymethane-treated rats[J]. Exp Biol Med (Maywood), 2010, 235(6): 710-717. DOI:10.1258/ebm.2010.009359 |
| [8] |
JIN L T, ZENG W F, ZHANG F Y, et al. Naringenin ameliorates acute inflammation by regulating intracellular cytokine degradation[J]. J Immunol, 2017, 199(10): 3466-3477. DOI:10.4049/jimmunol.1602016 |
| [9] |
CHAEN, YAMAMOTO Y, SUZUKI T. Naringenin promotes recovery from colonic damage through suppression of epithelial tumor necrosis factor-α production and induction of M2-type macrophages in colitic mice[J]. Nutr Res, 2019, 64: 82-92. DOI:10.1016/j.nutres.2019.01.004 |
| [10] |
KUMAR R P, ABRAHAM A. Inhibition of LPS induced pro-inflammatory responses in RAW 264.7 macrophage cells by PVP-coated naringenin nanoparticle via down regulation of NF-κB/P38MAPK mediated stress signaling[J]. Pharmacol Rep, 2017, 69(5): 908-915. DOI:10.1016/j.pharep.2017.04.002 |
| [11] |
WANG K H, CHEN Z Z, HUANG J M, et al. Naringenin prevents ischaemic stroke damage via anti-apoptotic and anti-oxidant effects[J]. Clin Exp Pharmacol Physiol, 2017, 44(8): 862-871. DOI:10.1111/1440-1681.12775 |
| [12] |
唐黎黎, 杨运周, 傅佳, 等. 柚皮素对大鼠局灶性脑缺血再灌注损伤的保护作用[J]. 安徽医科大学学报, 2006, 41(4): 430-432. TANG L L, YANG Y Z, FU J, et al. Protective effect of naringenin on focal cerebral ischemia reperfusion injury in rats[J]. J Anhui Med Univ, 2006, 41(4): 430-432. DOI:10.3969/j.issn.1000-1492.2006.04.022 |
| [13] |
YANG Q L, LANGSTON J C, TANG Y, et al. The role of tyrosine phosphorylation of protein kinase C delta in infection and inflammation[J]. Int J Mol Sci, 2019, 20(6): E1498. DOI:10.3390/ijms20061498 |
| [14] |
CUI G Y, GAO X M, QI S H, et al. The action of thrombin in intracerebral hemorrhage induced brain damage is mediated via PKCα/PKCδ signaling[J]. Brain Res, 2011, 1398: 86-93. DOI:10.1016/j.brainres.2010.11.095 |
| [15] |
DEINSBERGER W, VOGEL J, KUSCHINSKY W, et al. Experimental intracerebral hemorrhage: description of a double injection model in rats[J]. Neurol Res, 1996, 18(5): 475-477. DOI:10.1080/01616412.1996.11740456 |
| [16] |
HOU S, SHEN P P, ZHAO M M, et al. Mechanism of mitochondrial Connexin43's protection of the neurovascular unit under acute cerebral ischemia-reperfusion injury[J]. Int J Mol Sci, 2016, 17(5): E679. DOI:10.3390/ijms17050679 |
| [17] |
GARCIA J H, WAGNER S, LIU K F, et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation[J]. Stroke, 1995, 26(4): 627-634, discussion 635. DOI:10.1161/01.str.26.4.627 |
| [18] |
樊永平, 胡璘媛. 应用中药活性成分治疗脑出血的机制研究[J]. 中国中西医结合杂志, 2006, 26(4): 376-380. FAN Y P, HU L Y. Review of study on the mechanism of active ingredients of single chinese drug in treating intracerebral hemorrhage[J]. Chin J Integr Tradit Western Med, 2006, 26(4): 376-380. DOI:10.3321/j.issn:1003-5370.2006.04.034 |
| [19] |
张莉, 王露, 肖涵, 等. 抑制Fyn可激活Nrf2信号通路减轻大鼠脑出血后氧化应激损伤[J]. 第三军医大学学报, 2019, 41(21): 2035-2042. ZHANG L, WANG L, XIAO H, et al. Inhibition of Fyn activates Nrf2 signaling pathway to attenuate oxidative stress injury after intracerebral hemorrhage in rats[J]. J Third Mil Med Univ, 2019, 41(21): 2035-2042. DOI:10.16016/j.1000-5404.201906063 |
| [20] |
王露, 张莉, 肖涵, 等. PTPN22在大鼠脑出血后炎症损伤中的作用研究[J]. 第三军医大学学报, 2019, 41(24): 2409-2416. WANG L, ZHANG L, XIAO H, et al. Interference of protein tyrosine phosphatase non-receptor type 22 inhibits NLRP3 inflammasome activation to alleviate inflammation after cerebral hemorrhage in rats[J]. J Third Mil Med Univ, 2019, 41(24): 2409-2416. |
| [21] |
SHIRATORI K, OHGAMI K, ILIEVA I, et al. The effects of naringin and naringenin on endotoxin-induced uveitis in rats[J]. J Ocul Pharmacol Ther, 2005, 21(4): 298-304. DOI:10.1089/jop.2005.21.298 |
| [22] |
KILPATRICK L E, SUN S, LI H Y, et al. Regulation of TNF-induced oxygen radical production in human neutrophils: role of δ-PKC[J]. J Leukoc Biol, 2010, 87(1): 153-164. DOI:10.1189/jlb.0408230 |
| [23] |
SOROUSH F, ZHANG T, KING D J, et al. A novel microfluidic assay reveals a key role for protein kinase C δ in regulating human neutrophil-endothelium interaction[J]. J Leukoc Biol, 2016, 100(5): 1027-1035. DOI:10.1189/jlb.3MA0216-087R |
| [24] |
DUAN Y T, BI K Y, MA Y S. PKC δ gene can induce macrophages to release inflammatory factors against Mycobacterium tuberculosis infection[J]. Eur Rev Med Pharmacol Sci, 2018, 22(13): 4228-4237. DOI:10.26355/eurrev_201807_15417 |
| [25] |
KILPATRICK L E, STANDAGE S W, LI H Y, et al. Protection against Sepsis-induced lung injury by selective inhibition of protein kinase C-δ (δ-PKC)[J]. J Leukoc Biol, 2011, 89(1): 3-10. DOI:10.1189/jlb.0510281 |
| [26] |
CHTOUROU Y, FETOUI H, JEMAI R, et al. Naringenin reduces cholesterol-induced hepatic inflammation in rats by modulating matrix metalloproteinases-2, 9 via inhibition of nuclear factor κB pathway[J]. Eur J Pharmacol, 2015, 746: 96-105. DOI:10.1016/j.ejphar.2014.10.027 |



