2. 400038 重庆,陆军军医大学药学与检验医学系临床微生物与免疫学教研室
2. Department of Clinical Microbiology and Immunology, Faculty of Pharmacy and Medical Laboratory, Army Medical University (Third Military medical University), Chongqing, 400038, China
类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,BP,简称类鼻疽菌)是一种革兰氏阴性菌,常见于许多热带和亚热带地区的土壤和污水中[1]。该菌是类鼻疽的病原体[2],通过吸入气溶胶和接触被污染的水、土壤而感染。类鼻疽临床症状表现多样,包括肺炎、多器官脓肿、全身性疾病、败血症甚至感染性休克,由于其诊断困难,治疗不及时,导致死亡率高达40%[3-4]。作为一种兼具有公共卫生威胁和生物恐怖的病原体,美国疾病预防控制中心(centers for disease control and prevention,CDC)将类鼻疽菌列为Ⅰ类生物战剂。类鼻疽菌研究的社会效益和军事价值越来越受到重视,已成为相关国家包括美国、澳大利亚、新加坡等政府和军队公共卫生健康和生物国防安全的重要内容。
类鼻疽菌的基因组较大,为7.24 Mb,由两条染色体组成[5],其重要的毒力因子之一是Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)[6]。类鼻疽菌的T3SS有3个基因簇,分别是T3SS1、T3SS2和T3SS3[7]。T3SS3与沙门氏菌、志贺氏菌的Inv/Mxi-Spa T3SSs有同源性,是小鼠感染中重要的毒力因子[8-9]。以往的研究报道,T3SS1和T3SS2在类鼻疽菌囊泡逃逸过程中不是必需的,且在仓鼠感染模型中也无重要作用[10],但在植物感染模型中有着较为重要的作用。T3SS1和T3SS2与植物致病菌青枯菌和黄单胞菌的T3SS有相似的致病性,在植物感染中,和野生株相比,类鼻疽菌的T3SS1和T3SS2突变株的毒力减弱,且疾病的进程明显减缓,这说明类鼻疽菌的T3SS1和T3SS2对植物的毒力和致病有重要作用[11-12]。其中T3SS1是类鼻疽菌特有的,在同属的洋葱伯克霍尔德菌和泰国伯克霍尔德菌中均不存在[13-14]。但是近年有研究称T3SS1突变的类鼻疽菌在RAW 264.7细胞的胞内存活率降低,在同一研究中,也发现T3SS1在类鼻疽菌呼吸道感染小鼠模型中所必需的毒力因子,提示T3SS1在类鼻疽菌的胞内生存和小鼠模型中有重要作用[15]。T3SS1基因簇编码19个蛋白,大部分为膜蛋白,而目前这些蛋白的致病机制还不是很清楚[16]。生物信息学分析发现T3SS1的BPSS1395与青枯雷尔氏菌的HrpF (hypersentive response and pathogenicity F,属于T3SS效应蛋白)具有高度同源性[17-18],而HrpF对青枯雷尔氏菌在植株感染中的致病作用至关重要[19-20]。因此,为了探究BPSS1395在类鼻疽菌感染植株中的作用,我们采用类鼻疽菌感染番茄幼苗模型,通过透射电镜和PCR等技术研究BPSS1395在类鼻疽菌感染番茄植株过程中的定植、胞内增殖和引起病理改变的功能作用。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株类鼻疽伯克霍尔德菌BPC006[21],大肠埃希菌BL21 (DE3)(TaKaRa公司);pET-22b质粒(Sigma公司),自杀性质粒pK18mobSacB (本实验室保存),回补质粒pUCP28T(新加坡国立大学医学院生物化学系Yunn-Hwen Gan教授惠赠),质粒均用于BPSS1395基因敲除株和回补株的构建;大肠杆菌S17-1λpir (陆军军医大学基础医学院微生物学教研室惠赠)。
1.1.2 主要试剂细菌基因组DNA提取试剂盒、质粒小量提取试剂盒、凝胶回收试剂盒均购自北京天根公司,高保真DNA聚合酶、EcoRⅠ、BamHⅠ和XhoⅠ限制性内切酶、DNA连接酶、DNA Marker购自大连TaKaRa公司。
1.1.3 实验植物四到六叶期的番茄植株,由寿光蔬菜种苗基地提供。
1.2 方法 1.2.1 BPSS1395基因敲除株和回补株的构建利用同源重组的方法构建敲除株ΔBPSS 1395 。根据NCBI数据库中类鼻疽菌BPC006全基因组序列中BPSS1395基因序列及两侧序列,设计3对引物PBPSS1395-F,PBPSS1395-R;PBPSS1395L-1, PBPSS1395L-2和PBPSS1395R-1, PBPSS1395R-2(表 1)分别扩增BPSS1395基因(870 bp)及两端的同源臂(上下游各800 bp),敲除菌株构建的具体操作方法见参考文献[22]。将BPSS1395片段和pET-22b质粒分别用BamHⅠ和XhoⅠ双酶切后连接,连接产物转化到大肠埃希菌BL21(DE3)感受态细胞,在含氨苄的LB平板上筛选出阳性菌落后提取质粒,具体操作方法见参考文献[23]。将BPSS1395基因序列与回补载体pUCP28T用HindⅢ和EcoRⅠ双酶切后连接,然后将重组质粒导入敲除株ΔBPSS 1395 的感受态细胞中进行平板涂布,PCR进一步鉴定出含重组质粒的菌株,即得回补株c-ΔBPSS 1395 。
| 引物 | 序列 | 扩增片段 | 产物长度(bp) |
| PBPSS1395L-1 | 5′-CCCAAGCTTCGCGCATTTGCGCCGCCGTCAG-3′ (HindⅢ) | ||
| PBPSS1395L-2 | 5′-GCTCTAGAGCGTACTCCGGCAATAATCGAG-3′ (XbaⅠ) | BPSS1395右侧翼序列 | 800 |
| PBPSS1395R-1 | 5′-GCTCTAGAGCGCGGACGAGCCCTTGCGC-3′ (XbaⅠ) | ||
| PBPSS1395R-2 | 5′-CGCGGATCCCGTCAACGAGTCCATCATC-3′ (BamHⅠ) | BPSS1395左侧翼序列 | 819 |
| PBPSS1395-F | 5′-CGGAATTCATGGCTATTTGGTTGAGACGTCCC-3′ (EcoRⅠ) | ||
| PBPSS1395-R | 5′- GCGAAGCTTTCATGCCCGCCCCCCCGCATCCT-3′ (HindⅢ) | BPSS1395 | 870 |
| PE.coli - F | 5′-GAGCGCAACCCTTATCCTTTG-3′ | ||
| PE.coli - R | 5′-TACTAGCGATTCCGACTTCATGG-3′ | 16S rDNA | 246 |
1.2.2 类鼻疽菌感染番茄幼苗和PCR鉴定
将番茄幼苗(L402)种植于营养土中,环境温度为25 ℃,每天光照处理16 h,黑暗处理8 h,培养15 d。将野生株BPC006、敲除株ΔBPSS 1395 、回补株c-ΔBPSS 1395 和大肠杆菌培养至对数生长期,调整感染复数为1×108,每个实验组加入1~2 mL相关菌液到番茄根部,第2、8、15天后分别观察番茄叶子是否萎蔫、变黄,茎干等部位是否发黑、腐烂等症状。然后在第7、14、21天提取植株叶片基因组,进行PCR鉴定。
1.2.3 透射电镜观察番茄幼苗叶片的病理变化用浓度为1×108 CFU/mL的BPC006菌液感染番茄幼苗根部,感染一周后,将感染的叶片边缘剪下1 mm丢弃,以避免被叶片细胞外的杂菌污染。再剪下离边缘2 mm的叶片,剪成碎片,用2.5%戊二醛固定2 h,1%锇酸固定1.5 h,然后乙醇梯度(30%、50%、70%、90%、100%)脱水;100% spur树脂包埋后,70 ℃过夜处理,超薄切片机(Reichert, 美国)切片;0.3%柠檬酸铅染色;用透射电镜(Philips EM420,英国)观察,采集图片。
1.2.4 番茄幼苗叶片细胞中类鼻疽菌的增殖类鼻疽菌通过根部感染5株番茄幼苗,在感染第3、7、10、14、17和21天,从每株植物剪去3片叶子,用10%消毒液清洗1 min,再用无菌水冲洗。无菌滤纸吸干叶片后,将叶片印在LB平板上,37 ℃培养24 h,以检测叶片表面是否有细菌存在。然后将叶片称重后置于微型小杵, 加入1 mL PBS研磨,梯度稀释后,涂至LB平板,37 ℃培养48 h后计数,只有在印记板上无细菌生长的叶片才能计数,以避免叶片表面的杂菌影响结果。
1.2.5 类鼻疽菌的生长曲线测定将过夜培养的野生株BPC006、敲除株ΔBPSS 1395 和回补株c-ΔBPSS 1395 菌液分别接种于5 mL LB液体培养基中,于600 nm波长测其光密度,使初始OD值为0.1,37 ℃培养,0、2、4、6、8、10、12、24、26、28、30、32 h测定其光密度。
1.3 统计分析结果以至少3个独立实验的x±s表示,实验重复3次。采用SPSS 20.0软件对数据进行Student’s检验或ANOVA分析。
2 结果 2.1 类鼻疽菌能在番茄幼苗植株中定殖为了检测类鼻疽菌能否感染番茄幼苗,我们将1×108 CFU/mL的BP和大肠杆菌加入到番茄幼苗根部,分别在第7、14、21天后提取植物叶片的基因组进行PCR检测。利用类鼻疽菌和大肠杆菌特异性引物,PBPSS1395-F/ PBPSS1395-R和PE.coli -F/ PE.coli -R进行PCR扩增,我们发现在第7、14、21天类鼻疽菌感染后提取的植物基因组DNA均能扩增出870 bp条带(图 1 A),但是,在相同时间点大肠杆菌感染组未扩增出任何条带(图 1 B)。以上结果表明,类鼻疽菌能够在番茄幼苗植株中定植。
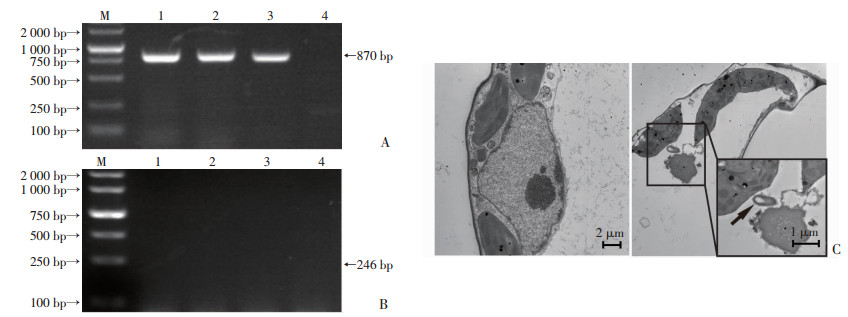
|
| A:类鼻疽菌基因检测;B:E.coli的16S rDNA检测(M:标准DL 2000,1:感染第7天,2:感染第14天,3:感染第21天,4:未感染组);C:类鼻疽菌在感染番茄幼苗叶片中的检测,未感染组(左)和感染组(右),→:示类鼻疽菌 图 1 类鼻疽菌在番茄植株中的定植 |
进一步我们利用透射电镜观察感染组和未感染组的番茄幼苗的叶片细胞,发现在感染组中叶片细胞内有类鼻疽菌,且细胞破碎,细胞结构不完整,而未感染组的细胞结构完整,无类鼻疽菌(图 1 C)。为了探究类鼻疽菌是否能在叶片细胞内增殖,我们分别在类鼻疽菌感染第3、7、10、14、17、21天后随机选取两株感染组的番茄幼苗,排除叶片表面无杂菌污染后,将叶片研磨后涂至LB平板培养,对类鼻疽菌计数分析,发现类鼻疽菌的数量随着感染时间的延长而增加(图 2)。以上结果说明类鼻疽菌定植在番茄幼苗后能在叶片细胞内增殖。
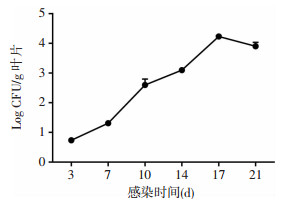
|
| 图 2 类鼻疽菌感染番茄植株不同时间点在叶片细胞中的增殖情况 |
2.2 类鼻疽菌敲除株ΔBPSS 1395 、回补株c-ΔBPSS 1395 的鉴定
为了确定BPSS1395在类鼻疽菌感染植株中的作用,我们构建了敲除株ΔBPSS 1395 。用上游臂上游引物和下游臂下游引物PBPSS395L-1/ PBPSS1395R-2对敲除株验证,如图 3A,野生株得到扩增产物约2 470 bp,为L-BPSS1395-R全长,而敲除株则为1 600 bp,为L-R全长,显示敲除株比野生株的确缺失了BPSS1395基因片段。在此基础上,我们将BPSS1395基因回补到敲除株中,用引物PBPSS1395-F/ PBPSS1395-R扩增回补株的BPSS1395基因片段获得870 bp条带(图 3B),结果显示回补株BPSS1395基因片段确实存在。
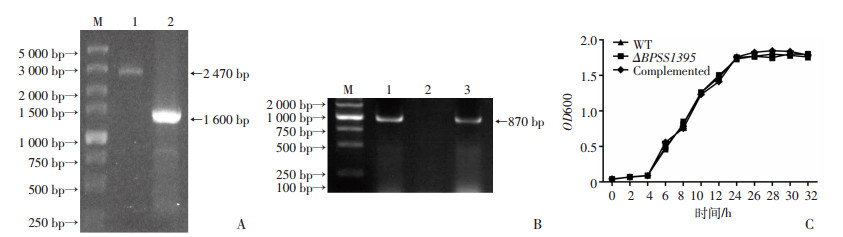
|
| A:BPSS1395基因敲除的鉴定M:标准(DL 5000);1:野生株;2:敲除株;B:BPSS1395回补株的鉴定M:标准(DL 2000);1:野生株;2:敲除株;3:回补株;C:野生株、敲除株ΔBPSS 1395 和回补株c-ΔBPSS 1395 在LB液体培养基的生长曲线 图 3 敲除株ΔBPSS 1395 、回补株c-ΔBPSS 1395 的鉴定 |
此外,我们还检测了野生株、敲除株和回补株的类鼻疽菌在LB液体培养基的生长情况,结果发现三者的生长曲线并没有区别(图 3C),这说明BPSS1395基因的缺失对类鼻疽菌在体外的增殖没有影响,同时也排除了BPSS1395的缺失导致类鼻疽菌对环境适应性减弱的可能性。
2.3 BPSS1395基因有利于类鼻疽菌在番茄幼苗中的定殖用类鼻疽菌野生株、敲除株ΔBPSS 1395 和回补株c-ΔBPSS 1395 分别感染番茄幼苗根部,第21天观察叶片形态变化。结果发现野生株和回补株感染的叶片有些许萎蔫症状,无其他症状,而敲除株的叶片无任何疾病症状(图 4 A)。通过PCR检测植株中是否有类鼻疽菌存在,在第14和21天提取各组植株的基因组进行检测,用引物PBPSS395L-1/ PBPSS1395R-2扩增,野生株和回补株感染组扩增出2 470 bp条带,说明的确有类鼻疽菌存在,而在敲除株感染组未扩增出条带,说明没有类鼻疽菌存在(图 4 B),即敲除株不能在番茄幼苗中定植。
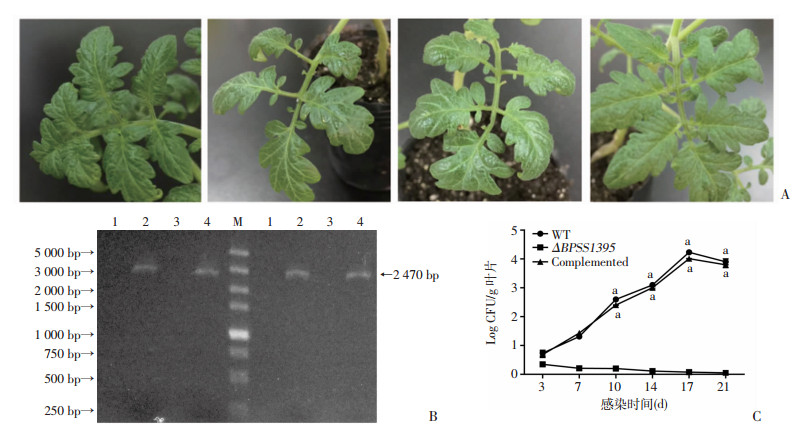
|
| A:类鼻疽菌感染第21天的番茄幼苗叶片的形态变化;a:未感染植株;b:野生型株感染的植株;c:敲除株ΔBPSS 1395 感染的植株;d:回补株c-ΔBPSS 1395 感染的植株;B:感染第14天(左)和第21天(右),番茄幼苗叶片中的类鼻疽菌的PCR检测;M:标准(DL 5000);1:未感染植株;2:感染野生型菌株;3:感染敲除株ΔBPSS 1395 ;4:感染回补株c-ΔBPSS 1395 ;C:感染第3、7、10、14、17、21天野生株、敲除株ΔBPSS 1395 和回补株c-ΔBPSS 1395 的类鼻疽菌在番茄幼苗叶片细胞内的增殖a: P < 0.01, 与敲除株ΔBPSS 1395比较 图 4 BPSS1395在类鼻疽菌感染植物中的作用 |
在本研究中,我们进一步检测了类鼻疽菌在叶片细胞内的增殖,在感染第3、7、10、14和21天后,分别随机选取两株野生株、敲除株ΔBPSS 1395 和回补株c-ΔBPSS 1395 感染组的叶片,排除叶片表面无杂菌污染后,将叶片研磨后涂至LB平板培养,对类鼻疽菌计数分析,发现敲除株ΔBPSS 1395 在感染第3天有少数的类鼻疽菌存在,而在一周后,几乎检测不到类鼻疽菌,与野生株、回补株c-ΔBPSS 1395 比较,差异有统计学意义(P < 0.01, 图 4C)。而回补株c-ΔBPSS 1395 和野生株的类鼻疽菌数量随着感染时间的延长而增加,即胞内增殖能力相似(图 4C)。以上结果表明,BPSS1395基因有利于类鼻疽菌在番茄幼苗中的定植和增殖。
3 讨论类鼻疽菌的基因组为7.24 Mb,能编码多种毒力因子,包括荚膜多糖、菌毛、脂多糖、T3SS和T6SS[24],其中T3SS在类鼻疽菌感染宿主并在宿主体内存活起重要作用。我们把T3SS1簇的基因BPSS1395敲除后,发现类鼻疽菌在感染番茄幼苗后,叶片细胞中的定植和增殖明显减少,说明BPSS1395在类鼻疽菌感染番茄幼苗过程中发挥重要作用。
类鼻疽菌常见于疫区的土壤、污水和稻田中[25],不仅能感染人和动物,还能使植物致病[26]。有研究表明,将番茄幼苗浸入含类鼻疽菌的培养液中培养,大多数幼苗在感染第7天后死亡[27]。我们的研究结果表明,类鼻疽菌能感染番茄幼苗并在叶片细胞中定植和增殖。类鼻疽菌野生株和回补株c-ΔBPSS 1395 感染的番茄幼苗,能在叶片细胞中检测到类鼻疽菌的存在,但是在感染过程中没有引起植株明显的病理表型变化,敲除株ΔBPSS 1395 感染的植物没有检测到类鼻疽菌的存在和表型变化,这可能是因为番茄幼苗有自己的免疫系统。植物细胞有两种抵抗病原微生物感染的方式,病原相关分子模式(pathogen-associated molecular pattern,PAMP)-触发免疫(PAMP-triggered immunity,PTI)和效应分子触发的免疫(effector-triggered immunity,ETI)[28]。有研究表明,细菌鞭毛是一种PAMP,能诱导植物产生防御机制[29]。与动物致病菌一样,植物致病菌也会分泌效应蛋白到植物细胞中,干扰宿主的免疫过程,有利于病原体的生存,其中最重要的效应分子就是T3SS分泌的毒力蛋白。在T3SS的毒力蛋白干扰宿主免疫系统的同时,也会被宿主细胞的特异性抗性蛋白识别,从而激活ETI[30]。本研究所用的番茄幼苗为15天幼龄,在与自然生长环境相似的土壤中培育,将类鼻疽菌液灌到土壤中,幼苗从土壤中吸收营养,同时识别土壤中类鼻疽菌的PAMP,激活番茄幼苗的PTI[31],当类鼻疽菌的T3SS将毒力蛋白分泌到番茄幼苗细胞中时,激活宿主细胞的ETI。因此,我们推测类鼻疽菌可能寄生在番茄植株体内与之共存。
T3SS是许多革兰氏阴性菌重要的毒力因子[32],在类鼻疽菌感染过程中,T3SS3在动物致病中有发挥重要作用,T3SS1和T3SS2与植物致病有关[33]。T3SS2在类鼻疽菌和鼻疽杆菌中的研究较多,而关于T3SS1的作用研究较少[34]。我们在前期研究工作中,通过生物信息学分析(数据未显示),发现除了BPSS1395基因,其他T3SS1的基因对感染植株没有明显影响。且BPSS1395与青枯雷尔氏菌的致病因子HrpF有高度同源性。HrpF由hrp(hypersensitive reaction and pathogenicity)基因簇编码,而hrp蛋白是革兰氏阴性植物致病菌T3SS的主要组成部分,也是一种能引起病原菌在植物寄主中致病的效应蛋白。其中HrpF蛋白具有与脂结合的活性,并在人工脂质双层膜中有形成离子传导孔的能力,这提示HrpF蛋白能插入植物细胞膜,使T3SS的效应蛋白进入宿主细胞[35]。HrpF突变会导致植物致病菌的毒力减弱,说明HrpF与植物致病菌的致病性有关[19],为BPSS1395能引起植物致病提供了证据。本研究中进一步证实了BPSS1395的缺失使类鼻疽菌不能在番茄幼苗叶片细胞中定植和增殖。致病菌常利用T3SS的效应蛋白干扰宿主细胞的肌动蛋白细胞骨架,导致细胞骨架重排,有利于致病菌进入宿主细胞,干扰吞噬作用,在胞内存活[36],这为BPSS1395有利于类鼻疽菌在番茄幼苗叶片细胞中的定殖提供依据。
综上所述,研究结果表明了类鼻疽菌作为一种人畜共患病原菌,其感染植物的能力与T3SS1簇的BPSS1395基因有关。本研究为类鼻疽菌可能通过感染植物途径传播到人和动物提供了实验证据,同时也为类鼻疽病防控策略的制订提供了新思路。
| [1] |
KAESTLI M, SCHMID M, MAYO M, et al. Out of the ground: aerial and exotic habitats of the melioidosis bacterium Burkholderia pseudomallei in grasses in Australia[J]. Environ Microbiol, 2012, 14(8): 2058-2070. DOI:10.1111/j.1462-2920.2011.02671.x |
| [2] |
WIERSINGA W J, VIRK H S, TORRES A G, et al. Melioidosis[J]. Nat Rev Dis Primers, 2018, 4: 17107. DOI:10.1038/nrdp.2017.107 |
| [3] |
WIERSINGA W J, CURRIE B J, PEACOCK S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. DOI:10.1056/nejmra1204699 |
| [4] |
WIERSINGA W J, CURRIE B J, PEACOCK S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. DOI:10.1056/nejmra1204699 |
| [5] |
HOLDEN M T G, TITBALL R W, PEACOCK S J, et al. Genomic plasticity of the causative agent of melioidosis, Burkholderia pseudomallei[J]. Proc Nat Acad Sci, 2004, 101(39): 14240-14245. DOI:10.1073/pnas.0403302101 |
| [6] |
SUN G W, GAN Y H. Unraveling type Ⅲ secretion systems in the highly versatile Burkholderia pseudomallei[J]. Trends Microbiol, 2010, 18(12): 561-568. DOI:10.1016/j.tim.2010.09.002 |
| [7] |
KANG W T, VELLASAMY K M, CHUA E G, et al. Functional characterizations of effector protein BipC, a type Ⅲ secretion system protein, in Burkholderia pseudomallei pathogenesis[J]. J Infect Dis, 2015, 211(5): 827-834. DOI:10.1093/infdis/jiu492 |
| [8] |
STEVENS M P, WOOD M W, TAYLOR L A, et al. An Inv/Mxi-Spa-like type Ⅲ protein secretion system in Burkholderia pseudomallei modulates intracellular behaviour of the pathogen[J]. Mol Microbiol, 2002, 46(3): 649-659. DOI:10.1046/j.1365-2958.2002.03190.x |
| [9] |
WARAWA J, WOODS D E. Type Ⅲ secretion system cluster 3 is required for maximal virulence of Burkholderia pseudomalleiin a hamster infection model[J]. FEMS Microbiol Lett, 2005, 242(1): 101-108. DOI:10.1016/j.femsle.2004.10.045 |
| [10] |
BURTNICK M N, BRETT P J, NAIR V, et al. Burkholderia pseudomallei type Ⅲ secretion system mutants exhibit delayed vacuolar escape phenotypes in RAW 264.7 murine macrophages[J]. Infect Immun, 2008, 76(7): 2991-3000. DOI:10.1128/IAI.00263-08 |
| [11] |
ANGUS A A, AGAPAKIS C M, FONG S, et al. Plant-associated symbiotic Burkholderia species lack hallmark strategies required in mammalian pathogenesis[J]. PloS ONE, 2014, 9(1). |
| [12] |
LEE Y, CHEN Y H, OUYANG X Z, et al. Identification of tomato plant as a novel host model for Burkholderia pseudomallei[J]. BMC Microbiol, 2010, 10(1): 28. DOI:10.1186/1471-2180-10-28 |
| [13] |
WIERSINGA W J, VAN DER POLL T, WHITE N J, et al. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei[J]. Nat Rev Microbiol, 2006, 4(4): 272-282. DOI:10.1038/nrmicro1385 |
| [14] |
WINSTANLEY C, HALES B A, HART C A. Evidence for the presence in Burkholderia pseudomallei of a type Ⅲ secretion system-associated gene cluster[J]. J Med Microbiol, 1999, 48(7): 649-656. DOI:10.1099/00222615-48-7-649 |
| [15] |
D'CRUZE T, GONG L, TREERAT P, et al. Role for the Burkholderia pseudomallei type three secretion system cluster 1 bpscN gene in virulence[J]. Infect Immun, 2011, 79(9): 3659-3664. DOI:10.1128/IAI.01351-10 |
| [16] |
RAINBOW L, HART C A, WINSTANLEY C. Distribution of type Ⅲ secretion gene clusters in Burkholderia pseudomallei, B. mallei[J]. J Med Microbiol, 2002, 51(5): 374-384. DOI:10.1099/0022-1317-51-5-374 |
| [17] |
LIPSCOMB L, SCHELL M A. Elucidation of the regulon and cis-acting regulatory element of HrpB, the AraC-type regulator of a plant pathogen-like type Ⅲ secretion system in Burkholderia pseudomallei[J]. J Bacteriol, 2011, 193(8): 1991-2001. DOI:10.1128/JB.01379-10 |
| [18] |
VANDER BROEK C W, STEVENS J M. Type Ⅲ secretion in the melioidosis pathogen Burkholderia pseudomallei[J]. Front Cell Infect Microbiol, 2017, 7: 255. DOI:10.3389/fcimb.2017.00255 |
| [19] |
LI Y R, CHE Y Z, ZOU H S, et al. Hpa2 required by HrpF to translocate Xanthomonas oryzae transcriptional activator-like effectors into rice for pathogenicity[J]. Appl Environ Microbiol, 2011, 77(11): 3809-3818. DOI:10.1128/AEM.02849-10 |
| [20] |
HUANG Y C, LIN Y C, WEI C F, et al. The pathogenicity factor HrpF interacts with HrpA and HrpG to modulate type Ⅲ secretion system (T3SS) function and t3ss expression in Pseudomonas syringae pv. averrhoi[J]. Molecular plant pathology, 2016, 17(7): 1080-1094. DOI:10.1111/mpp.12349 |
| [21] |
FANG Y, HUANG Y, LI Q, et al. First genome sequence of a Burkholderia pseudomallei Isolate in China, strain BPC006, obtained from a melioidosis patient in Hainan[J]. J Bacteriol, 2012, 194(23): 6604-6605. DOI:10.1128/JB.01577-12 |
| [22] |
胡治强, 方瑶, 朱攀, 等. 类鼻疽伯克霍尔德菌BPSL1549基因敲除株的构建及鉴定[J]. 第三军医大学学报, 2016, 38(11): 1210-1214. HU Z Q, FANG Y, ZHU P, et al. Construction and identification of Burkholderia pseudomallei BPSL1549 gene knockout mutant strain[J]. J Third Mil Med Univ, 2016, 38(11): 1210-1214. DOI:10.16016/j.1000-5404.201602029 |
| [23] |
胡艺, 胡志强, 马腾飞, 等. 类鼻疽杆菌Ⅲ型分泌系统BPSS1395蛋白表达及其抗体制备与鉴定[J]. 第三军医大学学报, 2017, 39(10): 941-945. HU Y, HU Z Q, MA T F, et al. Expression and identification of recombinant Burkholderia pseudomallei type Ⅲ secretion system BPSS1395 protein and preparation of its polyclonal antibodies[J]. J Third Mil Med Univ, 2017, 39(10): 941-945. DOI:10.16016/j.1000-5404.201611152 |
| [24] |
ADLER N R L, STEVENS J M, STEVENS M P, et al. Autotransporters and their role in the virulence of Burkholderia pseudomallei and Burkholderia mallei[J]. Front Microbio, 2011, 2: 151. DOI:10.3389/fmicb.2011.00151 |
| [25] |
JONES A L, BEVERIDGE T J, WOODS D E. Intracellular survival of Burkholderia pseudomallei[J]. Infect Immun, 1996, 64(3): 782-790. DOI:10.1128/iai.64.3.782-790.1996 |
| [26] |
BERNIER S P, SILO-SUH L, WOODS D E, et al. Comparative analysis of plant and animal models for characterization of Burkholderia cepacia virulence[J]. Infect Immun, 2003, 71(9): 5306-5313. DOI:10.1128/iai.71.9.5306-5313.2003 |
| [27] |
LEE Y H, CHEN Y H, OUYANG X Z, et al. Identification of tomato plant as a novel host model for Burkholderia pseudomallei[J]. BMC Microbiol, 2010, 10: 28. DOI:10.1186/1471-2180-10-28 |
| [28] |
ZIPFEL C. Early molecular events in PAMP-triggered immunity[J]. Curr Opin Plant Biol, 2009, 12(4): 414-420. DOI:10.1016/j.pbi.2009.06.003 |
| [29] |
FELIX G, DURAN J D, VOLKO S, et al. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin[J]. Plant J, 1999, 18(3): 265-276. DOI:10.1046/j.1365-313x.1999.00265.x |
| [30] |
CUI H T, XIANG T T, ZHOU J M. Plant immunity: a lesson from pathogenic bacterial effector proteins[J]. Cell Microbiol, 2009, 11(10): 1453-1461. DOI:10.1111/j.1462-5822.2009.01359.x |
| [31] |
JWA N S, HWANG B K. Convergent evolution of pathogen effectors toward reactive oxygen species signaling networks in plants[J]. Front Plant Sci, 2017, 8: 1687. DOI:10.3389/fpls.2017.01687 |
| [32] |
FRANCIS M S, WOLF-WATZ H, FORSBERG Å. Regulation of type Ⅲ secretion systems[J]. Current Opin Microbiol, 2002, 5(2): 166-172. DOI:10.1016/S1369-5274(02)00301-6 |
| [33] |
VANDER BROEK C W, STEVENS J M. Type Ⅲ secretion in the melioidosis pathogen Burkholderia pseudomallei[J]. Front Cell Infect Microbiol, 2017, 7: 255. DOI:10.3389/fcimb.2017.00255 |
| [34] |
RAINBOW L, HART C A, WINSTANLEY C. Distribution of type Ⅲ secretion gene clusters in Burkholderia pseudomallei, B. thailandensis and B. mallei[J]. J Med Microbiol, 2002, 51(5): 374-384. DOI:10.1099/0022-1317-51-5-374 |
| [35] |
SUGIO A, YANG B, WHITE F F. Characterization of the hrpF pathogenicity peninsula of Xanthomonas oryzae pv. oryzae[J]. Mol Plant Microbe Interact, 2005, 18(6): 546-554. DOI:10.1094/MPMI-18-0546 |
| [36] |
GALÁN J E, COLLMER A. Type Ⅲ secretion machines: bacterial devices for protein delivery into host cells[J]. Science, 1999, 284(5418): 1322-1328. DOI:10.1126/science.284.5418.1322 |



