2. 400047 重庆,重庆师范大学:重庆市特殊儿童心理诊断与教育技术重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学)基础医学院生物化学与分子生物学教研室
2. Chongqing Key Laboratory of Psychological Diagnosis and Educational Technology for Children with Special Needs, College of Education Science, Chongqing Normal University, Chongqing, 400047;
3. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
孤独症(autism),又称自闭症,主要表现为社会交往障碍、语言交流障碍、刻板行为及兴趣狭窄等。研究表明,孤独症患者的大脑皮质结构紊乱,皮质下神经细胞结构异常,小脑与脑干区的蒲肯野细胞萎缩或丢失,边缘系统神经细胞发育异常且数量减少[1]。这提示脑神经细胞发育成熟延迟及异常可能是导致孤独症发病的重要原因。在脑发育的关键期,一些环境因素很可能通过影响神经细胞中的关键信号通路而导致神经元的成熟延迟或发育异常。在影响脑神经发育的诸多环境因素中,丙戊酸钠(sodium valproate,VPA)暴露是一种重要的独立危险因素。VPA是一种常用抗癫痫药,对各种癫痫均有疗效[2],但它的不良反应也比较重,除常见的胃肠道反应外,还会损害儿童的认知功能[3]。VPA会损害儿童的学习、记忆及智力等,表现为智商降低和学习成绩下降[4]。另外,研究表明VPA还会影响胎儿脑发育,容易导致先天脑畸形[5]。那么,VPA究竟是通过何种机制影响脑神经细胞的功能并最终导致孤独症发病目前还不太清楚。
Mcl-1是Bcl-2抗凋亡蛋白家族中一个重要成员,通过结合促凋亡蛋白Bak、Bax而发挥抗凋亡作用[6]。研究表明,VPA可在多种肿瘤细胞中促进Mcl-1表达下调并诱导细胞凋亡,但在神经细胞中是否具有类似作用尚不清楚。本研究旨在探讨VPA暴露对神经细胞中Mcl-1表达的影响及可能机制,以期为阐明VPA致儿童脑发育异常的相关机制提供依据。
1 材料与方法 1.1 细胞株及培养SH-SY5Y细胞株为人神经母细胞瘤细胞,购买自中国科学院生物化学与细胞生物学研究所。细胞用含10%胎牛血清的DMEM培养基,于5% CO2、37 ℃条件下培养。
1.2 试剂及药品DMEM培养基与胰蛋白酶购自Invitrogen公司,胎牛血清购自HyClone公司,VPA购自Sigma公司,miRNA提取试剂盒购自天根公司,蛋白定量试剂盒购自碧云天公司,双荧光素酶报告基因检测试剂盒购自Promega公司,定量PCR试剂盒购自TaKaRa公司,蛋白分子量标准购自北京中杉公司,miR-148a-3p抑制剂购自Thermo公司,PVDF膜购自Bio-Rad公司,Mcl-1、GAPDH抗体购自Cell Signaling公司。
1.3 细胞处理将细胞分为3组:①对照组用PBS处理;②低剂量组用0.3 mmol/L的VPA处理;③高剂量组用0.6 mmol/L的VPA处理。处理24 h后收集细胞进行分析。
1.4 细胞凋亡检测VPA处理完后,用PBS洗涤细胞2次,再用Annexin V/PI标记细胞,于室温避光孵育10 min,然后经流式细胞仪检测分析。实验重复3次。
1.5 Western blot检测细胞处理结束后,在冰上用RIPA溶液裂解15 min。于4 ℃、12 000 r/min离心10 min。然后取上清,将蛋白定量后行电泳分析,上样量为每孔总蛋白40 μg。电泳结束后,用半干转法将蛋白从凝胶中转移至PVDF膜上,在室温用5%脱脂奶粉封闭2 h, 再分别用Mcl-1 (1 :1 000稀释)与GAPDH抗体(1 :5 000稀释)4 ℃孵育过夜,PBST洗膜3次,每次5 min,然后分别用山羊抗兔二抗(1 :10 000稀释)在室温孵育1 h,最后经PBST洗膜后再用化学发光法显影曝光。
1.6 microRNA的提取与测定根据试剂盒说明书提取microRNA并利用qRT-PCR进行测定,以U6基因为内参照。按照2-ΔΔCt方法对microRNA的相对表达量进行计算。
1.7 定量PCR分析细胞处理结束后,用TRIzol法提取总RNA,经M-MLV反转录酶逆转录为cDNA,再利用SYBR法进行定量PCR检测,检测结果用2-ΔΔCt法分析作图。
1.8 报告基因检测待细胞生长至80%左右融合度时,将pGL3-Mcl-1质粒与pRL-TK质粒共转染,以pRL-TK/pGL3-Basic共转染作对照。转染后36 h,在冰上用1×PLB裂解液裂解细胞20 min,于4 ℃、12 000 r/min离心15 min。然后取20 μL上清,加入50 μL萤火虫荧光素酶底物并混匀,立即在报告基因检测系统检测荧光素酶活性,检测完后加入50 μL反应终止液,继续检测海肾荧光素酶活性。以荧光素酶活性值对海肾荧光素酶活性值的比值进行量化分析。
1.9 统计学分析采用SPSS 20.0统计软件进行分析,数据以x±s表示,采用单因素方差分析,组间两两比较采用t检验。检验水准α=0.05。
2 结果 2.1 VPA促进SH-SY5Y细胞凋亡为验证VPA能否促进神经细胞凋亡,分别使用不同浓度处理SH-SY5Y细胞24 h,然后流式分析细胞凋亡水平。结果显示,VPA可显著促进SH-SY5Y细胞凋亡(P < 0.05),且剂量越高效果越显著(图 1)。
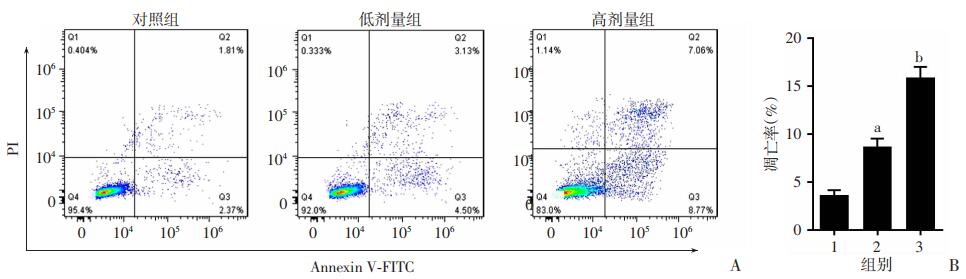
|
|
1:对照组;2:低剂量组;3:高剂量组 A:流式细胞检测结果;B:各组凋亡率统计分析 a: P < 0.05,b: P < 0.01,与对照组比较 图 1 流式细胞检测VPA促进SH-SY5Y细胞凋亡 |
2.2 VPA下调SH-SY5Y细胞中Mcl-1表达
为进一步分析Mcl-1在VPA促SH-SY5Y细胞凋亡中的作用,用不同剂量VPA处理SH-SY5Y细胞,然后分别使用定量PCR与Western blot检测Mcl-1的mRNA与蛋白水平变化。结果显示,不论是在mRNA水平还是在蛋白水平,VPA处理可以显著下调SH-SY5Y细胞中Mcl-1的表达(P < 0.05),且剂量越高下调效果越明显(图 2)。

|
|
A:定量PCR分析VPA对Mcl-1 mRNA表达的影响;B:Western blot检测VPA对Mcl-1蛋白表达的影响;C:半定量分析 1:对照组;2:低剂量组;3:高剂量组; a: P < 0.05,b: P < 0.01,与对照组比较 图 2 VPA下调SH-SY5Y细胞中Mcl-1表达 |
2.3 VPA处理不改变SH-SY5Y细胞中Mcl-1启动子活性
为探讨VPA下调SH-SY5Y细胞中Mcl-1表达的可能机制,首先克隆了Mcl-1的启动子片段,构建报告基因载体pGL3-Mcl-1质粒,将pGL3-Mcl-1质粒转染SH-SY5Y细胞12 h后再用VPA处理细胞24 h,然后以空载体pGL3为对照,通过荧光素酶报告基因检测系统测定报告基因活性,结果显示,VPA处理并不能改变SH-SY5Y细胞中Mcl-1启动子活性(图 3)。
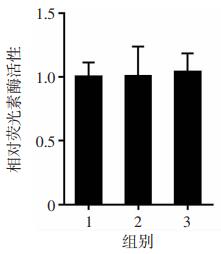
|
| 1:对照组;2:低剂量组;3:高剂量组 图 3 报告基因检测系统分析VPA对SH-SY5Y细胞中Mcl-1启动子活性的影响 |
2.4 VPA处理上调SH-SY5Y细胞中miR-148a-3p水平
在导致mRNA与蛋白水平均下调的诸多因素中,microRNA的作用比较明确。序列对比分析发现,miR- 148a-3p与Mcl-1 mRNA的3′-UTR区存在互补(图 4)。因此,用VPA处理SH-SY5Y细胞,采用定量PCR法检测miR-148a-3p的水平变化,结果发现VPA处理可以显著上调SH-SY5Y细胞中miR-148a-3p水平(P < 0.05,图 5)。

|
| 图 4 序列对比分析发现Mcl-1 mRNA的3′-UTR区与miR-148a-3p存在互补 |
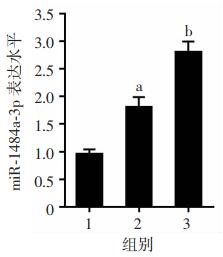
|
|
1:对照组;2:低剂量组;3:高剂量组 a: P < 0.05,b: P < 0.01,均与对照组比较 图 5 VPA处理上调SH-SY5Y细胞中miR-148a-3p水平 |
2.5 抑制miR-148a-3p可逆转VPA对Mcl-1的下调作用
为探讨VPA诱导的miR-148a-3p上调在其下调Mcl-1中发挥的作用,将miR-148a-3p的特异抑制剂miR-148a-3p antagonist转染SH-SY5Y细胞,12 h后用VPA处理细胞,然后分别用定量PCR与Western blot检测Mcl-1的mRNA与蛋白水平变化。结果显示,miR-148a-3p抑制剂可以在mRNA与蛋白水平均逆转VPA对Mcl-1的下调作用(P < 0.05,图 6)。
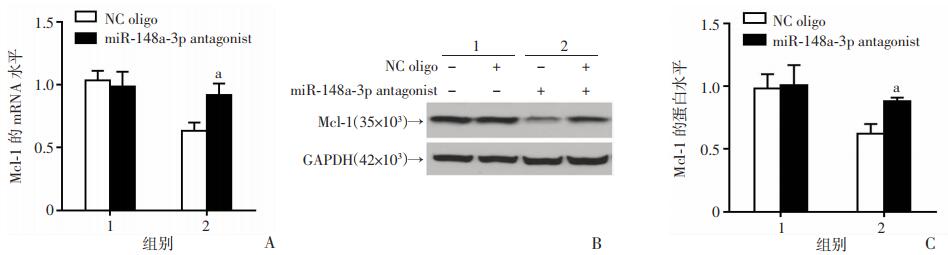
|
| A:定量PCR分析Mcl-1 mRNA水平;B:Western blot检测Mcl-1蛋白水平;C:半定量分析 1:对照组;2:低剂量组;a: P < 0.05,与对照组比较 图 6 miR-148a-3p抑制剂逆转VPA对SH-SY5Y细胞中Mcl-1表达的下调 |
2.6 抑制miR-148a-3p减轻VPA对SH-SY5Y细胞凋亡的诱导效果
为明确抑制miR-148a-3p后对VPA诱导细胞凋亡作用的效果,将miR-148a-3p的特异抑制剂miR-148a-3p antagonist转染SH-SY5Y细胞,12 h后再用VPA处理细胞,然后流式分析细胞凋亡水平。结果显示,抑制miR-148a-3p后SH-SY5Y细胞凋亡水平得到显著减少(P < 0.05,图 7)。
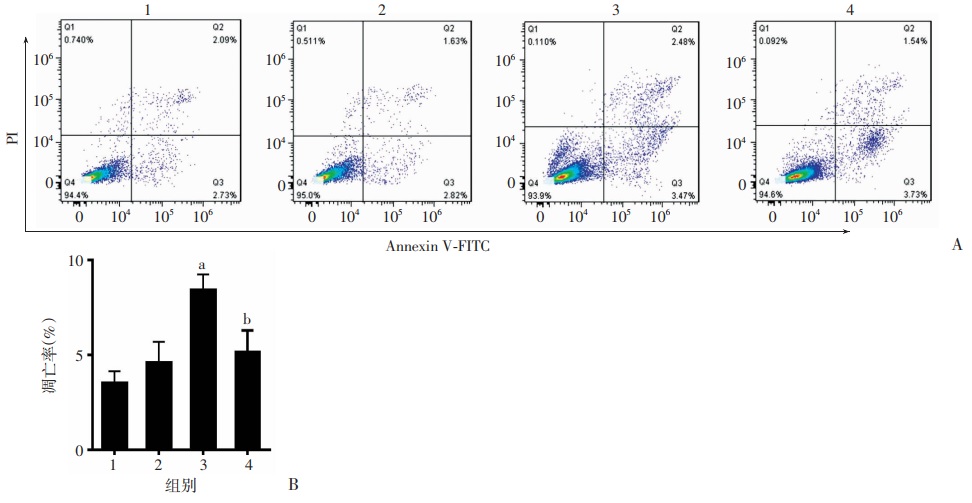
|
| A:流式细胞仪检测细胞凋亡水平; B:半定量分析 1:对照组; 2 :miR-148a-3p抑制剂组; 3:VPA单独处理组(0.3 mmol/L); 4:miR-148a-3p抑制剂联合VPA处理组; a: P < 0.05, 与对照组比较; b:P < 0.01, 与VPA单独处理组比较 图 7 抑制miR-148a-3p减轻VPA对SH-SY5Y细胞凋亡的诱导效果 |
3 讨论
人群调查发现,VPA的产前暴露会显著提高胎儿患孤独症的风险[7]。并且,产前注射VPA也是目前制备孤独症动物模型的常用方法。VPA注射产生的孤独症模型动物不仅具有孤独症的特征行为,而且脑组织中神经细胞的形态变化也与孤独症患者尸检报告相似[8]。但VPA暴露到底如何导致孤独症发病的机制还有待深入研究。研究表明,VPA可能通过抑制分解γ-氨基丁酸的酶活性,升高脑组织中的γ-氨基丁酸水平,来影响抑制性神经细胞的正常信号传递功能而干扰学习记忆过程[9];VPA还可能通过影响组蛋白乙酰化水平而调节AKT激酶信号通路[10]、mTOR信号通路[11]等影响脑组织的发育。本课题组研究也发现,VPA产前暴露可引起仔鼠脑组织中神经细胞凋亡率增加、自噬水平下降,且该现象与孤独症的发病关系密切[12-13]。并且,VPA诱导神经细胞凋亡的机制可能与Bcl-2的表达下调有关。本研究进一步证实,VPA还能通过下调Mcl-1而诱导神经细胞凋亡,而其中Mcl-1是影响细胞凋亡的关键分子。因此,miR-148a-3p/Mcl-1信号轴可能是VPA诱导神经细胞凋亡的一条重要通路。本研究使用的VPA剂量0.3 mmol/L和0.6 mmol/L均在临床正常用药范围之内[14],所以相关实验结果能够在一定程度上反映VPA的临床效应。
Mcl-1作为Bcl-2抗凋亡家族的重要成员,尽管在结构和功能上都与Bcl-2类似,但两种蛋白的组织分布与表达调控都不同,提示它们在调控细胞凋亡的过程中发挥的功能也有不同。如Mcl-1敲除鼠会导致的胚胎发育致死,而Bcl-2敲除鼠则不会[15]。研究表明,Mcl-1与Bcl-2在脑组织中均有表达,且与脑组织的发育密切相关[16]。Mcl-1对于神经系统的发育是必不可少的,在神经系统中条件性敲除Mcl-1则引起神经细胞的过度凋亡而导致神经系统不能正常发育[17]。Mcl-1的表达下调还是阿尔茨海默症、帕金森病等多种神经退行性疾病发病的重要原因[18-19]。研究也表明,VPA可在胰腺癌、白血病等肿瘤细胞中下调Mcl-1而发挥抗肿瘤作用[20-21]。但VPA能否在神经细胞中下调Mcl-1,以及Mcl-1的下调是否与VPA的促神经细胞凋亡作用相关尚少见报道。本研究证实,VPA能在SH-SY5Y细胞中下调Mcl-1,且这种下调是导致SH-SY5Y细胞凋亡的重要原因。
进一步的分析显示,VPA并不能在SH-SY5Y细胞中改变Mcl-1的启动子活性,但可以通过增加miR-148a-3p的表达来降低Mcl-1的mRNA和蛋白水平。MicroRNA是细胞内的一种小分子RNA,通常与靶基因mRNA的3′-UTR结合而促进其降解。miR-148a-3p是特异调控Mcl-1的一种microRNA,对Mcl-1 mRNA的调控作用在食管鳞状细胞癌细胞中已有报道[22]。本研究进一步确认,VPA能够在SH-SY5Y细胞中通过上调miR-148a-3p的表达而下调Mcl-1的mRNA和蛋白水平。
综上,本研究发现VPA可在SH-SY5Y细胞中通过激活miR-148a-3p/Mcl-1信号轴而促进神经细胞凋亡,相关研究结果可能为揭示VPA在神经系统的作用机制及可能的副作用提供理论依据。
| [1] |
CAREAGA M, MURAI T, BAUMAN M D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human Primates[J]. Biol Psychiatry, 2017, 81(5): 391-401. DOI:10.1016/j.biopsych.2016.10.020 |
| [2] |
中国抗癫痫协会精准医学与药物不良反应监测专业委员会. 抗癫痫药物所致不良反应的研究进展[J]. 癫痫杂志, 2019, 5(4): 280-283. Medicine and ADR Monitoring Committee of China Anti Epilepsy Association. Research progress of adverse reactions caused by anti-epileptic drugs[J]. J Epilepsy, 2019, 5(4): 280-283. DOI:10.7507/2096-0247.20190047 |
| [3] |
胡美玲, 孙红斌.丙戊酸钠所致震颤的临床特征及诊治进展[J].癫痫杂志, 2019, 5(3): 205-208. DOI: 107507/2096-0247-20190037. HU M L, SUN H B. The clinical characteristics, diagnosis and treatment of tremor caused by sodium valproate[J]. J Epilepsy, 2019, 5(3): 205-208. DOI: 107507/2096-0247-20190037. |
| [4] |
AUVIN S. Advancing pharmacologic treatment options for pharmacologic treatment options for children with epilepsy[J]. Expert Opin Pharmacother, 2016, 17(11): 1475-1482. DOI:10.1080/14656566.2016.1195809 |
| [5] |
KUO H Y, LIU F C. Molecular pathology and pharmacological treatment of autism spectrum disorder-like phenotypes using rodent models[J]. Front Cell Neurosci, 2018, 12: 422. DOI:10.3389/fncel.2018.00422 |
| [6] |
SENICHKIN VV, STRELETSKAIA A Y, ZHIVOTOVSKY B, et al. Molecular comprehension of mcl-1: from gene structure to cancer therapy[J]. Trends Cell Biol, 2019, 29(7): 549-562. DOI:10.1016/j.tcb.2019.03.004 |
| [7] |
ROULLET F I, LAI J K, FOSTER J A. In utero exposure to valproic acid and autism: a current review of clinical and animal studies[J]. Neurotoxicol Teratol, 2013, 36: 47-56. DOI:10.1016/j.ntt.2013.01.004 |
| [8] |
CHO H, KIM C H, KNIGHT E Q, et al. Changes in brain metabolic connectivity underlie autistic-like social deficits in a rat model of autism spectrum disorder[J]. Sci Rep, 2017, 7(1): 13213. DOI:10.1038/s41598-017-13642-3 |
| [9] |
LI X, RISBROUGH V B, CATES-GATTO C, et al. Compari- son of the effects of the GABAB receptor positive modulator BHF177 and the GABAB receptor agonist baclofen on anxiety-like behavior, learning, and memory in mice[J]. Neuropharmacology, 2013, 70: 156-167. DOI:10.1016/j.neuropharm.2013.01.018 |
| [10] |
YANG E J, AHN S, LEE K, et al. Early behavioral abnormalities and perinatal alterations of PTEN/AKT pathway in valproic acid autism model mice[J]. PLoS ONE, 2016, 11(4): e0153298.. DOI:10.1371/journal.pone.0153298 |
| [11] |
HU G W, MCQUISTON T, BERNARD A, et al. A conserved mechanism of Tor-dependent RCK-mediated mRNA degradation regulates autophagy[J]. Nat Cell Biol, 2015, 17(7): 930-942. DOI:10.1038/ncb3189 |
| [12] |
QIN L Y, DAI X F, YIN Y H. Valproic acid exposure sequentially activates Wnt and mTOR pathways in rats[J]. Mol Cell Neurosci, 2016, 75: 27-35. DOI:10.1016/j.mcn.2016.06.004 |
| [13] |
DAI X F, YIN Y H, QIN L Y. Valproic acid exposure decreases the mRNA stability of Bcl-2 via up-regulating miR-34a in the cerebellum of rat[J]. Neurosci Lett, 2017, 657: 159-165. DOI:10.1016/j.neulet.2017.08.018 |
| [14] |
刘沙, 金梅, 傅川, 等. 丙戊酸钠血药浓度与抗癫痫疗效及影响因素分析[J]. 重庆医学, 2016, 45(27): 3805-3807. LIU S, JIN M, FU C, et al. Association of blood concentration of sodium valproate and anti-epileptic effect and influencing factors[J]. Chongqing Med, 2016, 45(27): 3805-3807. DOI:10.3969/j.issn.1671-8348.2016.27.020 |
| [15] |
ROBINSON E J, AGUIAR S P, KOUWENHOVEN W M, et al. Survival of midbrain dopamine neurons depends on the Bcl2 factor Mcl1[J]. Cell Death Discov, 2018, 4: 107. DOI:10.1038/s41420-018-0125-7 |
| [16] |
DAWE G B, YU H, GU S Y, et al. A7 nicotinic acetylcholine receptor upregulation by anti-apoptotic Bcl-2 proteins[J]. Nat Commun, 2019, 10(1): 2746. DOI:10.1038/s41467-019-10723-x |
| [17] |
FOGARTY L C, FLEMMER R T, GEIZER B A, et al. Mcl-1 and Bcl-xL are essential for survival of the developing nervous system[J]. Cell Death Differ, 2019, 26(8): 1501-1515. DOI:10.1038/s41418-018-0225-1 |
| [18] |
NIKHIL K, SHAH K. The Cdk5-Mcl-1 Axis promotes mitochondrial dysfunction and neurodegeneration in a model of Alzheimer's disease[J]. J Cell Sci, 2017, 130(18): 3023-3039. DOI:10.1242/jcs.205666 |
| [19] |
CARROLL R G, HOLLVILLE E, MARTIN S J. Parkin sensitizes toward apoptosis induced by mitochondrial depolarization through promoting degradation of Mcl-1[J]. Cell Rep, 2014, 9(4): 1538-1553. DOI:10.1016/j.celrep.2014.10.046 |
| [20] |
GILARDINI MONTANI M S, GRANATO M, SANTONI C, et al. Histone deacetylase inhibitors VPA and TSA induce apoptosis and autophagy in pancreatic cancer cells[J]. Cell Oncol (Dordr), 2017, 40(2): 167-180. DOI:10.1007/s13402-017-0314-z |
| [21] |
YOON J Y, SZWAJCER D, ISHDORJ G, et al. Synergistic apoptotic response between valproic acid and fludarabine in chronic lymphocytic leukaemia (CLL) cells involves the lysosomal protease cathepsin B[J]. Blood Cancer J, 2013, 3: e153. DOI:10.1038/bcj.2013.50 |
| [22] |
TANG Y, YANG P, ZHU Y F, et al. LncRNA TUG1 contributes to ESCC progression via regulating miR-148a-3p/MCL-1/Wnt/β-catenin Axis in vitro[J]. Thorac Cancer, 2020, 11(1): 82-94. DOI:10.1111/1759-7714.13236 |



