2. 400038 重庆,陆军军医大学(第三军医大学):基础医学部生物化学与分子生物学教研室
2. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
胃癌是世界上常见的恶性肿瘤之一,也是导致癌症死亡的第三大病因[1]。随着现代医疗技术的发展,以及胃癌治疗策略的不断完善,胃癌的治疗取得了极大的进展[2]。但是胃癌的早期诊断及术后复发转移仍是影响胃癌患者生存率的重要因素。有效的早期诊断及预后标记物对于提高胃癌的预后具有重要的意义,可为胃癌的预防和治疗开辟新的途径。高迁移率族蛋白A2(high-mobility group protein A2,HMGA2)是一种非组蛋白染色体蛋白,不具有内在的转录活性,通过改变染色质结构来调节靶基因的转录, 因此它们被称为架构转录因子[3]。HMGA2的过度表达与许多癌症的发生发展相关[4],研究表明,HMGA2在肿瘤的发生、侵袭和转移过程中发挥着重要作用[5],但是其在胃癌中的具体生物学作用及分子机制尚不明确。本研究拟将生物信息学与免疫组化检测相结合,分析HMGA2在胃癌中的差异表达及其临床相关性,并通过体外实验探讨HMGA2调控胃癌增殖、侵袭的机制。
1 材料与方法 1.1 标本与临床信息收集2018年6~12月于陆军军医大学第一附属医院治疗的胃癌组织标本72例,癌旁组织(距离肿瘤组织2 cm以上)标本72例作为对照。所有患者术前均未行放疗、化疗,且不合并其他肿瘤。对患者的年龄,性别,病理分型,分期,组织分化程度,肿瘤浸润深度,是否有淋巴结转移等进行统计。本研究经本院伦理委员会批准(批件号KY201837)。
1.2 材料胃癌细胞系MGC-803、MKN-28、SGC-7901和正常胃黏膜细胞系GES-1由陆军军医大学第一附属医院普通外科实验室冻存;EDTA抗原修复液(上海吉雅生物科技有限公司); DMEM培养基、胎牛血清(ThermoFisher Scientific);Lipofectamine 2000转染试剂(Invitrogen);Matrigel胶(Corning); 结晶紫(碧云天); 总蛋白提取试剂盒(Solarbio),SDS-PAGE凝胶试剂盒(Bio Rad);PVDF膜(Millipore),ECL化学发光试剂(碧云天);DAB显色液(Solarbio),抗体HMGA2, Snail1, GAPDH, E-Cadhrein, N-Cadhrein, Vimentin(affinity),山羊抗兔HRP标记二抗抗体(中杉金桥);免疫组织化学SP试剂盒(中杉金桥);Transwell小室(Corning);HMGA2过表达和shRNA沉默慢病毒载体(上海吉凯基因化学技术有限公司)、Snail1的siRNA(上海吉荧公司)。
1.3 免疫组化参照免疫组化S-P试剂盒说明书行免疫组化染色:胃癌组织切片置于60 ℃烘箱中2 h后迅速置入新鲜二甲苯中脱蜡,然后于梯度乙醇中水化。蒸馏水冲洗1 min后,加入EDTA抗原修复液煮沸10 min,冷却至室温。磷酸盐缓冲液(PBS)冲洗3 min×3次, 加入适量内源性过氧化物酶阻断剂, 室温孵育10 min,PBS冲洗3 min×3次,滴加适量封闭用正常山羊血清工作液,室温孵育15 min,倾去山羊血清,根据切片组织大小滴加适量兔抗人胃癌单克隆抗体HMGA2,37 ℃孵箱中孵育60 min,PBS冲洗3 min×3次,滴加适量生物素标记的山羊抗兔IgG聚合物工作液,室温孵育15 min,PBS缓冲液冲洗3 min×3次,滴加适量辣根酶标记链霉卵白素工作液,室温孵育15 min;PBS缓冲液冲洗3 min×3次,DAB显色,室温孵育8 min,自来水冲洗后滴加改良苏木精染色液孵育20 s;自来水冲洗,脱水、透明、封片、阅片。免疫组化评分为染色强度评分和阳性面积评分的乘积。染色强度评分标准:0(无阳性染色),1(弱阳性),2(中等强度阳性),3(强阳性)。阳性面积评分标准:1(阳性面积 < 25%),2(25%~50%),3(50%~75%),4(阳性面积>75%)[6]。将病例按照免疫组化评分进行分组,0~7分归入低表达组,8~12分归入高表达组。
1.4 生物信息学分析利用GEPIA网站(http://gepia.cancer-pku.cn/)分析HMGA2mRNA在胃癌和正常胃组织的表达情况,胃癌组织和正常胃组织HMGA2 mRNA测序数据分别来源于TCGA(The Cancer Genome Atlas)数据库和GTE×(Genotype-Tissue Expression)数据库;利用Kaplan Meier-plotter网站(http://kmplot.com/analysis/)分析HMGA2mRNA表达水平与胃癌患者OS(Overall Survival)、RFS(recurrence-free survival)的相关性。
1.5 细胞培养MGC-803、MKN-28、SGC-7901、GES-1细胞利用含10%胎牛血清的DMEM完全培养基培养,孵箱温度37 ℃,CO2浓度5%。
1.6 转染MGC-803细胞、SGC-7901细胞以每孔2×104个细胞接种于48孔板,待细胞融合度40%~50%时,分别转染HMGA2高表达以及shRNA慢病毒,滴度为1×104TU, 转染8~12 h后换液,更换新的培养基。待细胞长满后正常传代至12孔板,分别于24、48 h,利用荧光显微镜观察细胞荧光表达情况。过表达HMGA2的SGC-7901细胞,按照Lipofectamine 2000说明书转染靶向特异性敲降Snail1的siRNA,转染时间为48 h。
1.7 平板克隆实验收集对数期生长的细胞接种于6孔板中,每孔约300个细胞。添加含10%FBS的DMEM完全培养液至2 mL,37 ℃孵箱培养。定期观察细胞集落数量,直至出现肉眼可见的细胞克隆(10 d左右)。弃培养液,PBS洗涤后无水甲醛固定,结晶紫染色5 min,PBS洗净拍照计数。计算细胞数10以上的细胞集落数。
1.8 侵袭实验Transwell小室(Corning)铺于24孔板上,Matrigel胶(Corning)稀释至200 μg/mL,每小室加150 μL(37 ℃)。待胶凝固后,收集对数期生长的MGC-803细胞,以无血清DMEM培养液稀释至5×105个/mL,上室加入150 μL细胞悬液,下室加入700 μL含10% FBS的DMEM完全培养液。37 ℃孵箱培养24 h后取出小室,PBS漂洗2次,棉签拭去上室内残留的Matrigel胶,无水甲醇固定20 min后结晶紫染色5 min。将小室倒置于显微镜下,选取中间及上下左右5个视野观察拍照,计数并统计。重复3次实验。
1.9 Western blot细胞转染48 h后,按照总蛋白提取试剂盒说明提取蛋白,利用SDS-PAGE凝胶配置试剂盒制胶,加样,电泳电压为浓缩胶80 V,30 min,分离胶120 V,1 h,电泳完成后,半干转18 V,20 min。取出PVDF膜用5%牛奶封闭2 h,添加一抗(1 :1 000)4 ℃过夜。取出PVDF膜,PBST洗涤3次,每次10 min。添加二抗(1 :5 000),室温孵育1 h。后用PBST洗涤3次,每次10 min,滴加ECL化学发光试剂,使用凝胶成像仪采集图像。
1.10 统计学方法采用SPSS 21.0软件对相关数据资料进行分析,配对计量资料比较采用t检验,计数资料比较采用χ2检验,检验水准α=0.05。
2 结果 2.1 HMGA2 mRNA在胃癌组织中表达水平上调利用GEPIA网站比较211例正常胃组织和408例胃腺癌组织样本中HMGA2 mRNA表达差异,结果发现HMGA2 mRNA在正常胃组织表达较低,在胃癌组织中表达明显增加(P < 0.05,图 1),提示HMGA2 mRNA在胃癌组织中高表达,可能有促进癌症进展的作用。
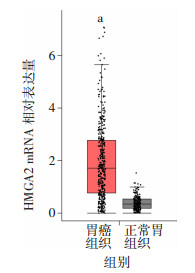
|
| a:P < 0.05, 与正常胃组织比较 图 1 HMGA2 mRNA在TCGA胃癌组织数据库和GTEx正常胃组织数据库中的表达情况差异比较 |
2.2 HMGA2蛋白在胃癌组织中表达水平上调
胃癌组织中HMGA2阳性表达率为69.4%(50/72), 明显高于癌旁组织12.5%(9/72),(P < 0.05,图 2)。
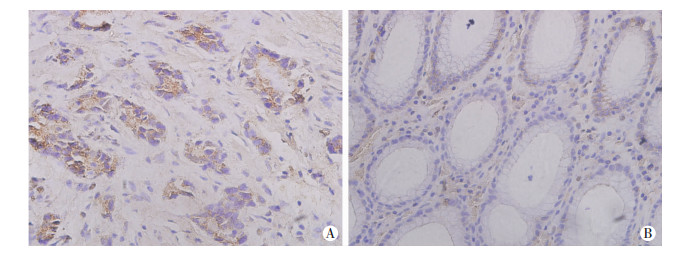
|
| 图 2 免疫组化实验检测胃癌组织(A)和癌旁组织(B)中HMGA2表达情况 (S-P×400) |
2.3 HMGA2表达与胃癌临床病理特征的相关性
HMGA2的表达水平与胃癌组织的分化程度、TNM分期、有无淋巴结转移相关(P < 0.05)。与性别、年龄无相关性,见表 1。
| 临床特征 | 例数 | HMGA2表达水平 | P | |
| 低 | 高 | |||
| 性别 | ||||
| 男 | 43 | 15 | 28 | 0.972 |
| 女 | 29 | 10 | 19 | |
| 年龄 | ||||
| ≤60 | 25 | 11 | 14 | 0.516 |
| > 60 | 47 | 17 | 30 | |
| 分化程度 | ||||
| 中、高分化 | 42 | 18 | 24 | 0.019 |
| 低分化 | 30 | 5 | 25 | |
| TNM分期 | ||||
| Ⅰ-Ⅱ期 | 21 | 11 | 10 | 0.007 |
| Ⅲ-Ⅳ期 | 51 | 13 | 48 | |
| 淋巴结转移 | ||||
| 有 | 39 | 4 | 35 | 0.002 |
| 无 | 33 | 15 | 18 | |
2.4 HMGA2表达与胃癌患者生存相关
结合TCGA数据库胃癌患者生存预后信息和HMGA2 mRNA表达水平,利用Kaplan Meier-plotter网站分析HMGA2 mRNA表达水平与胃癌患者OS的关系(图 3)。结果显示,HMGA2高表达的胃癌患者,OS明显缩短(P < 0.05)。进一步分析HMGA2 mRNA表达水平对患者RFS的影响,结果显示HMGA2 mRNA高表达的胃癌患者, RFS明显缩短(P < 0.05)。
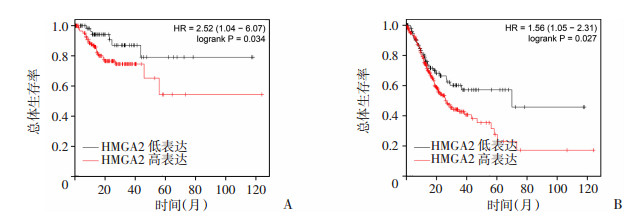
|
| A:HMGA2 mRNA表达水平对胃癌患者RFS的影响;B:HMGA2 mRNA表达水平对胃癌患者OS的影响 图 3 HMGA2 mRNA表达水平在胃癌患者中的生存分析 |
2.5 在MGC-803和SGC-7901细胞中下调和上调HMGA2的表达水平
为了研究HMGA2在胃癌中发挥的作用需要筛选合适的细胞系调控HMGA2的表达。Western blot结果显示HMGA2在MGC-803细胞中相对高表达,在SGC-7901细胞中相对低表达(图 4),在此基础上,MGC-803细胞转染HMGA2 shRNA, 使其表达下调,SGC-7901细胞转染HMGA2高表达慢病毒,使其表达上调,Western blot验证转染后HMGA2表达水平(图 5)。
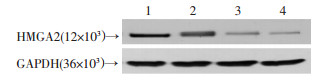
|
| 1:MGC-803;2:MKN-28;3:SGC-7901;4:GES-1 图 4 胃癌细胞系MGC-803、MKN-28、SGC-7901和正常胃黏膜细胞系GES-1中HMGA2蛋白表达情况 |
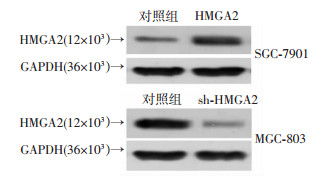
|
| 图 5 分别转染HMGA2和sh-HMGA2后SGC-7901和MGC-803细胞中HMGA2蛋白的表达水平 |
2.6 HMGA2对胃癌细胞增殖能力的影响
应用平板克隆实验检测敲低和高表达HMGA2对胃癌细胞增殖能力的影响(图 6)。在MGC-803细胞中敲低HMGA2,结果显示对照组与sh-HMGA2组细胞集落数有差异(P < 0.05),对照组细胞集落数为225.70±12.91,sh-HMGA2组细胞集落数为101.03± 6.69;在SGC-7901细胞中高表达HMGA2,结果显示对照组与HMGA2组细胞集落数有差异(P < 0.05),对照组细胞集落数为79.70±7.31, HMGA2组细胞集落数为283.00±28.04。
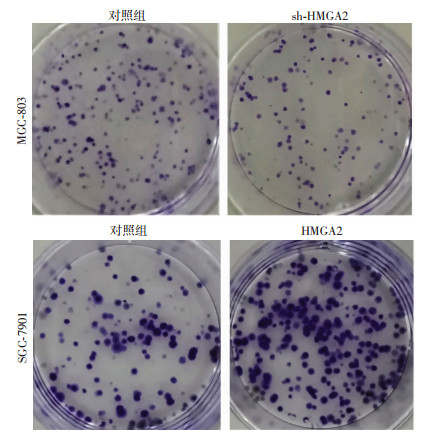
|
| 图 6 平板克隆实验检测HMGA2对胃癌细胞增殖能力的影响 |
2.7 HMGA2对胃癌细胞侵袭能力的影响
利用Transwell实验检测敲低和高表达HMGA2对胃癌细胞侵袭能力的影响(图 7)。在MGC-803细胞中敲低HMGA2,结果显示对照组与sh-HMGA2组穿膜细胞数有差异(P < 0.05),对照组穿膜细胞数为325.70± 14.05,sh-HMGA2组穿膜细胞数为124.30±10.91;在SGC-7901细胞中高表达HMGA2,结果显示对照组与HMGA2组穿膜细胞数有差异(P < 0.05),对照组穿膜细胞数为123.30±6.94,HMGA2组穿膜细胞数为424.30±8.99。
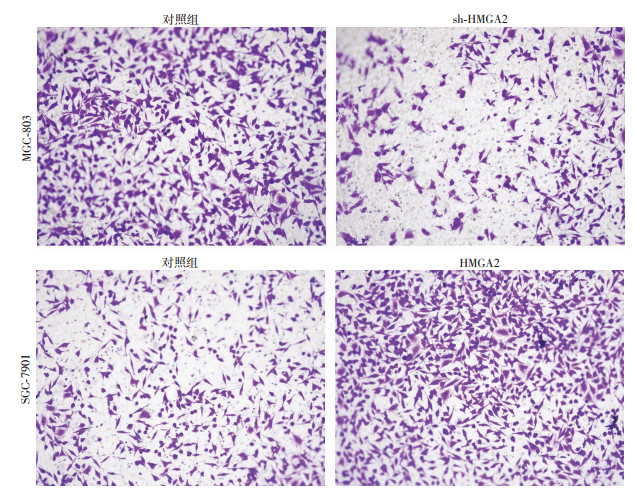
|
| 图 7 Transwell实验检测HMGA2对胃癌细胞侵袭能力的影响 (×200) |
2.8 HMGA2通过Snail1调节促进胃癌细胞侵袭转移
Transwell实验(图 8)、Western blot(图 9)检测转染HMGA2以及抑制Snail1表达后,SGC-7901细胞侵袭能力的变化。Transwell实验结果显示HMGA2+对照组和HMGA2+si-HMGA2组穿膜细胞数有差异(P < 0.05),HMGA2+对照组穿膜细胞数为286.00±13.65,HMGA2+si-HMGA2组穿膜细胞数为121.30±7.22;Western blot结果显示高表达HMGA2后,E-cadherin的表达降低,N-cadherin和Vimentin的表达升高(P < 0.05);若同时抑制Snail1的表达,HMGA2的调控作用受到抑制,表现为E-cadherin的表达升高,N-cadherin和Vimentin的表达降低(P < 0.05)。

|
| 图 8 Transwell实验检测敲低Snail1对胃癌细胞侵袭功能的影响 (×200) |
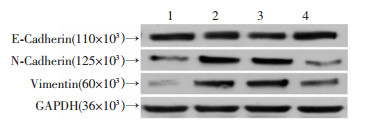
|
| 1:对照组;2:HMGA2高表达组;3:HMGA2高表达+si-NC组;4:HMGA2高表达+si-Snail1组 图 9 Western blot检测敲低Snail1对胃癌细胞EMT标志蛋白表达的影响 |
3 讨论
HMGA2蛋白作为细胞内重要的转录调节因子,参与着多种细胞功能的调节,包括细胞周期[7],细胞分化[8],衰老和肿瘤转化[4]。HMGA2过度表达与许多癌症的发生发展相关,包括乳腺癌[9]、非小细胞肺癌[10]、胃癌[11]、结直肠癌[12]等。本研究利用生物信息学和免疫组化技术检测HMGA2在胃癌组织及癌旁组织的表达,发现HMGA2在胃癌组织表达水平高于癌旁组织;免疫组化结果及临床数据分析表明HMGA2表达水平与胃癌的分化程度、淋巴结转移、TNM分期相关,而与性别、年龄无关。HMGA2低表达患者OS和RFS显著升高,提示HMGA2可能与胃癌的发展有关,但具体机制仍不清楚。
上皮-间质转化(EMT)是肿瘤侵袭转移中的关键过程[13-14]。ZHA等[15]研究发现HMGA2通过Wnt/β-catenin途径诱导胃癌发生EMT从而促进胃癌的侵袭转移。同时,HMGA2与pRb相互作用驱动FOXL2的反活化可能对胃癌的转移和EMT产生重要影响[16]。可以推断,HMGA2在胃癌细胞EMT中起重要作用。EMT相关转录因子Snail1属于锌指蛋白Snail超家族,通过同Smad相互作用蛋白(SIP1)竞争性结合E-cadherin启动子区的E-box连接基序,抑制E-cadherin的表达并使Vimentin表达水平上升,从而诱导EMT的发生[17]。研究表明,Snail1过表达可以促进胃癌细胞的侵袭和转移。CLDN6能通过YAP1-snail1通路促进胃癌的进展[18]。长链非编码RNA H19被证实通过miR-22-3p/Snail1通路调控胃癌细胞的生长和转移[19]。同时,FBXO31能够通过靶向Snail1抑制蛋白酶体降解来抑制胃癌EMT过程,从而抑制胃癌的转移[20]。研究发现,在TGF-β信号通路中,Smad可以通过HMGA2上调其下游目标基因Snail1的表达[21]。然而,HMGA2是否通过Snail1调节胃癌细胞EMT从而促进胃癌的侵袭转移尚未得到证实。本研究通过在SGC-7901细胞中过表达HMGA2,同时抑制Snail1的表达,观察Snail1和HMGA2在胃癌细胞侵袭转移和EMT启动中的作用。结果显示,SGC-7901细胞过表达HMGA2后侵袭、增殖能力升高,同时E-cadherin的表达降低,N-cadherin和Vimentin的表达升高。敲低Snail1抑制了HMGA2介导的胃癌细胞侵袭转移,并使EMT过程增加。这些结果显示HMGA2可能通过影响Snail1的表达,诱导胃癌细胞EMT从而促进胃癌的侵袭转移。
本研究验证了HMGA2与胃癌临床病理特征及预后的相关性,还通过体外实验探索了HMGA2可能通过调控Snail1促进胃癌细胞侵袭转移,可能为胃癌治疗提供新的靶点。本研究的不足之处在于未能在体内实验验证HMGA2通过Snail1影响胃癌侵袭转移的机制,具体实验将在后续深入研究中进行。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
KIM G H, LIANG P S, BANG S J, et al. Screening and surveillance for gastric cancer in the United States: Is it needed?[J]. Gastrointest Endosc, 2016, 84(1): 18-28. DOI:10.1016/j.gie.2016.02.028 |
| [3] |
SGARRA R, RUSTIGHI A, TESSARI M A, et al. Nuclear phosphoproteins HMGA and their relationship with chromatin structure and cancer[J]. FEBS Lett, 2004, 574(1/2/3): 1-8. DOI:10.1016/j.febslet.2004.08.013 |
| [4] |
WOOD L J, MAHER J F, BUNTON T E, et al. The oncogenic properties of the HMG-I gene family[J]. Cancer Res, 2000, 60(15): 4256-4261. |
| [5] |
LEE J, HA S, JUNG C K, et al. High-mobility-group A2 overexpression provokes a poor prognosis of gastric cancer through the epithelial-mesenchymal transition[J]. Int J Oncol, 2015, 46(6): 2431-2438. DOI:10.3892/ijo.2015.2947 |
| [6] |
HINDRIKSEN S, BIJLSMA M F. Cancer stem cells, EMT, and developmental pathway activation in pancreatic tumors[J]. Cancers, 2012, 4(4): 989-1035. DOI:10.3390/cancers4040989 |
| [7] |
FEDELE M, FUSCO A. Role of the high mobility group A proteins in the regulation of pituitary cell cycle[J]. J Mol Endocrinol, 2010, 44(6): 309-318. DOI:10.1677/JME-09-0178 |
| [8] |
PARISI S, PISCITELLI S, PASSARO F, et al. HMGA proteins in stemness and differentiation of embryonic and adult stem cells[J]. Int J Mol Sci, 2020, 21(1): E362. DOI:10.3390/ijms21010362 |
| [9] |
LANGELOTZ C, SCHMID P, JAKOB C, et al. Expression of high-mobility-group-protein HMGI-C mRNA in the peripheral blood is an independent poor prognostic Indicator for survival in metastatic breast cancer[J]. Br J Cancer, 2003, 88(9): 1406-1410. DOI:10.1038/sj.bjc.6600935 |
| [10] |
MEYER B, LOESCHKE S, SCHULTZE A, et al. HMGA2 overexpression in non-small cell lung cancer[J]. Mol Carcinog, 2007, 46(7): 503-511. DOI:10.1002/mc.20235 |
| [11] |
MOTOYAMA K, INOUE H, NAKAMURA Y, et al. Clinical significance of high mobility group A2 in human gastric cancer and its relationship to let-7 microRNA family[J]. Clin Cancer Res, 2008, 14(8): 2334-2340. DOI:10.1158/1078-0432.CCR-07-4667 |
| [12] |
HUANG M L, CHEN C C, CHANG L C. Gene expressions of HMGI-C and HMGI(Y) are associated with stage and metastasis in colorectal cancer[J]. Int J Colorectal Dis, 2009, 24(11): 1281-1286. DOI:10.1007/s00384-009-0770-7 |
| [13] |
WATANABE S, UEDA Y, AKABOSHI S, et al. HMGA2 maintains oncogenic RAS-induced epithelial-mesenchymal transition in human pancreatic cancer cells[J]. Am J Pathol, 2009, 174(3): 854-868. DOI:10.2353/ajpath.2009.080523 |
| [14] |
WU J J, LIU Z J, SHAO C S, et al. HMGA2 overexpression-induced ovarian surface epithelial transformation is mediated through regulation of EMT genes[J]. Cancer Res, 2011, 71(2): 349-359. DOI:10.1158/0008-5472.CAN-10-2550 |
| [15] |
ZHA L, ZHANG J, TANG W X, et al. HMGA2 elicits EMT by activating the Wnt/β-catenin pathway in gastric cancer[J]. Dig Dis Sci, 2013, 58(3): 724-733. DOI:10.1007/s10620-012-2399-6 |
| [16] |
DONG J Q, WANG R, REN G, et al. HMGA2-FOXL2 Axis regulates metastases and epithelial-to-mesenchymal transition of chemoresistant gastric cancer[J]. Clin Cancer Res, 2017, 23(13): 3461-3473. DOI:10.1158/1078-0432.CCR-16-2180 |
| [17] |
WANG Y F, SHI J, CHAI K Q, et al. The role of snail in EMT and tumorigenesis[J]. Curr Cancer Drug Targets, 2013, 13(9): 963-972. DOI:10.2174/15680096113136660102 |
| [18] |
YU S T, ZHANG Y Q, LI Q, et al. CLDN6 promotes tumor progression through the YAP1-snail1 Axis in gastric cancer[J]. Cell Death Dis, 2019, 10(12): 949. DOI:10.1038/s41419-019-2168-y |
| [19] |
GAN L, LV L, LIAO S. Long non-coding RNA H19 regulates cell growth and metastasis via the miR-22-3p/Snail1 axis in gastric cancer[J]. Int J Oncol, 2019, 54(6): 2157-2168. DOI:10.3892/ijo.2019.4773 |
| [20] |
ZOU S Y, MA C Y, YANG F H, et al. FBXO31 suppresses gastric cancer EMT by targeting Snail1 for proteasomal degradation[J]. Mol Cancer Res, 2018, 16(2): 286-295. DOI:10.1158/1541-7786.MCR-17-0432 |
| [21] |
THUAULT S, VALCOURT U, PETERSEN M, et al. Transforming growth factor-beta employs HMGA2 to elicit epithelial-mesenchymal transition[J]. J Cell Biol, 2006, 174(2): 175-183. DOI:10.1083/jcb.200512110 |



