2. 400042 重庆,陆军军医大学(第三军医大学)大坪医院:超声科;
3. 400042 重庆,陆军军医大学(第三军医大学)大坪医院:妇产科
2. Department of Ultrasonography, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China;
3. Department of Obstetrics and Gynecology, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
新生儿肺部感染性疾病主要包括不同程度的新生儿肺炎和感染所致的新生儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),其作为新生儿感染的最常见形式,亦是此类患儿最主要的死亡原因。其中,宫内感染为引起新生儿肺部感染性疾病的最常见病因,病死率为5%~20%[1];新生儿ARDS作为最严重的新生儿肺部疾病,病死率高达30%~40%[2]。因此,如何对有宫内感染高危因素的新生儿进行肺部感染早期预警及探索具体作用机制对提高此类患儿救治成功率,降低其病死率至关重要。研究报道,大量炎性因子除了可介导炎性反应导致肺泡上皮细胞受损、坏死而减少肺表面活性物质的分泌及降低其活性外,还可能通过增加肺泡内炎性渗出和影响肺液清除而导致肺水肿的发生[3-4]。本研究评估脐血炎性标志物在新生儿肺部感染性疾病早期预警中的应用价值,旨在早期识别及积极救治新生儿肺部感染性疾病,减少病死率,改善预后。
1 资料与方法 1.1 研究对象2018年6月至2019年9月在本院妇产科出生且胎龄为34~42周的新生儿。分为病例组和对照组。病例组纳入标准:①孕期有胎膜早破/B组链球菌感染/绒毛膜羊膜炎/发热/炎性指标升高等感染征象。②新生儿在生后24 h内出现呼吸窘迫并需要呼吸机支持。对照组纳入标准:①孕期无任何感染征象。②新生儿出生后无呼吸道症状。
排除标准:①新生儿呼吸窘迫综合征、暂时性呼吸增快、先天性膈疝及肺泡毛细血管发育不良等先天性畸形引起的呼吸困难。②先天性心脏病、原发性肺动脉高压、遗传代谢性疾病。③不能具体定量分析的标本(低于或高于仪器监测下限或上限)。本研究经陆军军医大学大坪医院伦理委员会批准(2018第18号)。
1.2 研究方法 1.2.1 炎性标志物的检验方法中性粒细胞CD64的检测采用流式细胞仪及配套专用试剂盒直接免疫荧光法测定,试剂盒购自重庆联庆仪器仪表有限公司。白细胞介素2受体(interleukin-2 receptor,IL-2R)、IL-8、IL-10、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、IL-6的测定:先将全血以3 500 r/min离心5 min后,分离上清液,采用西门子Immulite 1000化学发光免疫分析仪进行测定,所有操作严格按照试剂盒说明书进行,所有试剂购自重庆莱帮医疗器械有限公司。
1.2.2 临床资料收集收集纳入对象母亲临床资料,包括胎膜早破、B组链球菌感染、绒毛膜羊膜炎、发热、炎性指标升高等宫内感染征象及分娩方式。新生儿临床资料包括胎龄、性别、出生体质量、Apgar评分、脐血pH值及临床表现;并收集病例组肺部超声及胸片影像学、血气分析、病情严重程度等资料。在新生儿娩出后胎盘娩出前收集2管脐血,分别送检中性粒细胞CD64及炎性因子(IL-2R、IL-8、IL-10、TNF-α、IL-6)。在亚组分析中,根据肺部超声结果,将病例组分为肺水肿组和非肺水肿组;根据2017年新生儿ARDS蒙特勒诊断标准[5],将病例组分为ARDS组和非ARDS组。
1.3 统计学分析采用SPSS 17.0统计学软件进行分析,计量资料用x±s表示,总体方差具有齐性,采用t检验;总体方差不具有齐性,采用t’检验。并绘制炎性标志物检验水平的受试者工作曲线(receiver operator characteristic curve, ROC)及计算曲线下面积(area under the curve, AUC)。
2 结果 2.1 基线资料收集病例组脐血标本39例,对照组脐血标本40例。病例组剖宫产率59.0%(23/39),男性16例,女性23例,胎龄(38.3±2.3)周,出生体质量(3 144±614)g;对照组剖宫产率42.5%(17/40),男性17例,女性23例,胎龄(39.3±1.9)周,出生体质量(3 325±455)g。两组间剖宫产率,新生儿性别、胎龄、出生体质量差异均无统计学意义(P > 0.05)。
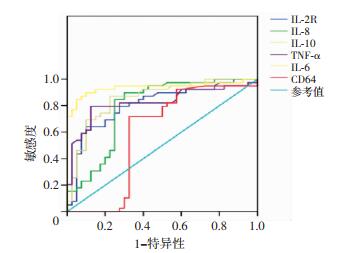
2.2 脐血炎性标志物在新生儿肺部感染性疾病早期预警中的应用价值评估病例组IL-2R、IL-8、IL-10、TNF-α、IL-6较对照组明显升高(P < 0.05),CD64在两组间差异无统计学意义(P > 0.05),见表 1。IL-6有较高的准确性(AUC=0.938),其次是IL-10(AUC=0.856)、TNF-α(AUC=0.825)、IL-2R(AUC=0.809)、IL-8 (AUC= 0.789),而CD64的准确性较低(AUC=0.591),见图 1、表 2。
| 组别 | n | IL-2R/U·mL-1 | IL-8/pg·mL-1 | IL-10/pg·mL-1 | TNF-α/pg·mL-1 | IL-6/pg·mL-1 | CD64 |
| 病例组 | 39 | 1 057.2±649.3 | 444.9±833.9 | 56.0±115.6 | 27.7±24.9 | 385.5±772.3 | 1.4±0.6 |
| 对照组 | 40 | 699.1±302.5 | 96.1±170.2 | 9.8±31.6 | 12.5±4.3 | 6.0±3.6 | 2.0±1.7 |
| t/t’值 | 3.129 | 2.560 | 2.411 | 3.748 | 3.068 | -1.747 | |
| P值 | 0.003 | 0.014 | 0.020 | 0.001 | 0.004 | 0.087 |
|
| 图 1 各个炎性标志物预测新生儿肺部感染性疾病的ROC曲线 |
| 检验结果变量 | 面积 | 标准误 | 95%CI | |
| 下限 | 上限 | |||
| IL-2R | 0.809 | 0.050 | 0.710 | 0.908 |
| IL-8 | 0.789 | 0.054 | 0.684 | 0.894 |
| IL-10 | 0.856 | 0.043 | 0.772 | 0.941 |
| TNF-α | 0.825 | 0.050 | 0.727 | 0.923 |
| IL-6 | 0.938 | 0.031 | 0.877 | 0.999 |
| CD64 | 0.591 | 0.071 | 0.452 | 0.729 |
IL-2R=849.00 U/mL、IL-8=37.55 pg/mL、IL-10= 3.73 pg/mL、TNF-α=13.95 pg/mL、IL-6=9.62 pg/mL、CD64=1.21的灵敏度及特异度分别为64.1%及90.0%、89.7%及70.0%、87.2%及77.5%、79.5%及87.5%、87.2%及92.5%、71.8%及67.5%。
2.3 脐血炎性标志物在肺水肿及ARDS患儿中的水平分析在病例组中,肺水肿组TNF-α及IL-6水平显著高于非肺水肿组,差异有统计学意义(P < 0.05),见表 3;ARDS组IL-2R及TNF-α水平较非ARDS组明显升高,差异有统计学意义(P < 0.05),见表 4。
| 组别 | n | IL-2R/U·mL-1 | IL-8/pg·mL-1 | IL-10/pg·mL-1 | TNF-α/pg·mL-1 | IL-6/pg·mL-1 |
| 肺水肿组 | 30 | 1 165.4±701.0 | 422.2±799.8 | 65.2±129.5 | 31.3±27.2 | 491.5±855.0 |
| 非肺水肿组 | 9 | 696.2±175.2 | 520.3±987.9 | 25.4±37.2 | 15.6±5.6 | 32.1±30.3 |
| t/t’值 | 1.973 | -0.306 | 0.903 | 2.950 | 2.937 | |
| P值 | 0.056 | 0.762 | 0.373 | 0.006 | 0.006 |
| 组别 | n | IL-2R/U·mL-1 | IL-8/pg·mL-1 | IL-10/pg·mL-1 | TNF-α/pg·mL-1 | IL-6/pg·mL-1 |
| ARDS组 | 24 | 1 231.3±758.7 | 480.5±884.9 | 61.7±140.7 | 33.7±29.9 | 517.2±932.2 |
| 非ARDS组 | 15 | 778.5±251.5 | 387.9±771.6 | 47.0±60.2 | 18.0±6.6 | 174.8±337.9 |
| t/t’值 | 2.226 | 0.333 | 0.382 | 2.479 | 1.636 | |
| t/t’ | 0.032 | 0.741 | 0.705 | 0.020 | 0.112 |
3 讨论
新生儿肺部感染性疾病是新生儿死亡的重要原因之一。尤其是近年提出的新生儿ARDS,肺部感染是其重要病因之一,属于新生儿危急重症,进展快、死亡率高,目前临床上尚缺乏有效的标准化治疗方案。据报道[6],宫内感染是新生儿肺部感染性疾病的重要病因,尽管针对妊娠晚期出现感染征象的孕产妇和新生儿给予预防及治疗性抗感染,仍有部分患儿因肺部感染而出现呼吸急促、缺氧等症状,甚至死亡。此外,部分亚临床型感染孕产妇因无发热、分泌物异常等表现而错过早期积极抗感染时机,从而导致新生儿生后肺部感染进行性加重,治疗起来十分棘手。因此,通过脐血炎性标志物寻找特异性和敏感性高的新生儿肺部感染早期预警标志物,对降低新生儿肺部感染性疾病病死率有重要临床价值,并有望为下一步深入探索新生儿ARDS病因及发病机制提供线索和理论依据。
3.1 脐血炎性标志物对新生儿肺部感染性疾病的早期预警CD64是免疫球蛋白IgG的Fc片段Ⅰ型受体(Fcγ-RⅠ),为免疫球蛋白超家族成员之一,在正常情况下,中性粒细胞CD64表达很低,甚至不表达。当机体遭遇细菌感染时,中性粒细胞CD64会明显升高[7]。有研究表明[8],中性粒细胞CD64对新生儿早发型败血症有一定的诊断价值,但一项关于17个研究3 478例新生儿败血症的meta分析显示[9]:虽然中性粒细胞CD64的AUC相对较高,但敏感性和特异性不高,阳性似然比和阴性似然比也不令人满意,认为中性粒细胞CD64对新生儿败血症的诊断效能不佳,在新生儿败血症诊断中的应用仍需谨慎。目前国内外关于脐血中性粒细胞CD64的报道甚少,对于脐血CD64与新生儿肺部感染的相关性几乎无报道。本研究发现脐血中性粒细胞CD64并不能预测或评估新生儿肺部感染性疾病(P > 0.05),且诊断的准确性较低(AUC=0.591),与既往研究结果一致,但仍需大样本多中心临床试验验证。
CD4+T细胞是机体抗感染的重要免疫细胞,当机体遭遇病原体感染时,CD4+T细胞迅速活化、增殖,而IL-2R是CD4+T细胞活化的重要标志。朱建幸等[10]发现,新生儿发生感染时,IL-2R较健康新生儿明显升高,认为IL-2R对诊断新生儿感染有临床应用价值。此外,国外有研究报道[11],IL-2R不仅对全身感染(如败血症)有一定诊断价值,对评估肺部感染性疾病也有临床意义。但以上报道均是对新生儿外周血IL-2R水平的测定,对于进展较快的肺部感染性疾病尤其是新生儿ARDS可能存在诊断上的滞后,目前国内外关于脐血IL-2R与新生儿肺部感染性疾病相关性暂无报告。本研究发现脐血IL-2R在病例组较健康对照组显著升高,且AUC为0.809,提示脐血IL-2R可能对新生儿生后出现肺部感染有重要的早期预警价值。
正常情况下体内存在促炎因子及抗炎因子,促炎因子包括IL-1β、IL-6、TNF-α、IL-8等,抗炎因子包括IL-4及IL-10等。当孕妇发生宫内感染,胎儿通过呼吸将胎肺暴露于炎性环境中,病原微生物可直接与胎儿呼吸道黏膜接触,引发大量促炎因子释放,造成促炎因子与抗炎因子失衡,抗炎机制无法控制潜在的炎症,导致持续的肺损伤[11],其后果可能导致生后急性肺炎,甚至发展为新生儿ARDS。在动物实验中发现,IL-1β、IL-6、TNF-α在宫内感染肺损伤组较健康对照组明显升高[12]。大量临床研究也表明:IL-6、IL-8、IL-10、TNF-α等炎性因子在肺部感染性疾病中显著升高,并且与疾病严重程度、住院时间、呼吸机使用时间及死亡率相关[11, 13-15]。本研究发现,有宫内感染征象、生后出现呼吸窘迫并需要呼吸支持的新生儿脐血IL-8、IL-10、TNF-α、IL-6水平较对照组显著升高(P < 0.05),提示脐血IL-8、IL-10、TNF-α、IL-6在早期预测新生儿肺部感染性疾病中可能具有一定的价值。根据ROC曲线及AUC值,其准确性由高到低依次为IL-6、IL-10、TNF-α及IL-8。
3.2 脐血炎性标志物在新生儿肺水肿及ARDS中的应用大量研究表明,多种炎性因子(如TNF-α、IL-1β、IL-6、IL-2R等)在包括ARDS在内的肺部感染性疾病的发病机制中扮演着重要角色[3-4, 12, 16]。一项关于儿童ARDS研究[17]表明,IL-10在ARDS患儿中过度表达,它可通过抑制骨髓干细胞向Ⅱ肺泡上皮细胞分化来促进ARDS的发生。研究发现ARDS患者血浆IL-6、IL-8和IL-10的水平较非ARDS患者明显升高,认为这些炎性因子能预测ARDS的发生[13-14]。TAKALA团队[16]研究发现,IL-2R作为CD4+T细胞活化的重要标志,在急性肺损伤患者中明显升高(P < 0.05),但在ARDS患者与非ARDS间无明显差异(P>0.05)。为了进一步探索炎性因子在新生儿肺水肿及ARDS中的作用,分别对肺水肿和ARDS患儿进行潜在致病炎性因子水平比较,结果提示脐血IL-6和TNF-α水平在肺水肿组中较非肺水肿组显著升高(P < 0.05),而IL-2R、IL-8及IL-10在两组间差异无统计学意义(P > 0.05);IL-2R和TNF-α水平在ARDS组较非ARDS组明显升高(P < 0.05),而IL-8、IL-10及IL-6在两组间无明显差异(P>0.05),与既往研究报道不完全一致,推测可能是由于新生儿具有特殊性,与成人及儿童ARDS的触发因素或病因不同(如宫内感染),易受围产期因素影响,并且新生儿肺生物学和成熟度(囊状或早期肺泡期)易感性存在差异,但仍需大样本多中心临床研究进一步证实。
众所周知,肺水肿是ARDS的主要肺组织病理学改变,但两者之间的因果关系及具体关联机制尚待进一步研究。既往研究表明,炎性因子可通过介导炎性反应导致肺泡毛细血管内皮细胞受损,毛细血管通透性增加,肺泡内炎性渗出过多,引起肺水肿;另一方面,因削弱了肺泡α-上皮钠离子通道(epithelial sodium,ENaC)表达量和活性,而影响肺液清除,导致肺水肿的发生[15]。值得一提的是,本研究显示TNF-α是唯一在肺水肿组及ARDS组中均显著升高的炎性因子,是否存在“TNF-α—肺水肿—ARDS”的可能性值得进一步探索。回顾既往研究发现,在新鲜分离的Ⅱ型肺泡上皮细胞中,TNF-α不仅破坏肺泡上皮紧密连接屏障,增加肺泡通透性,引起肺泡大量炎性渗出,还能降低α-ENaC的mRNA及蛋白水平,从而减少肺液清除[18-19];与此同时,当TNF-α与TNF受体1结合后,介导NF-κB活化增加细胞因子(IL-1、IL-8、IL-6)和趋化因子的产生,引起黏附分子高表达,加重炎性反应[20],可能在ARDS的发病机制中发挥重要作用。以上结论均为下一步深入探索“TNF-α—肺水肿—ARDS”具体作用机制提供思路及奠定理论基础。
综上所述,对于有宫内感染高危因素的近足月及足月儿,脐血炎性标志物IL-2R、IL-8、IL-10、TNF-α、IL-6有望成为新生儿肺部感染性疾病早期预警标志物。其中IL-6和IL-2R分别对肺水肿和ARDS的早期预估具有重要临床价值。脐血TNF-α水平对肺水肿及ARDS的早期预警均具有重要意义,并且可能在宫内感染致肺水肿进而导致新生儿ARDS的发病机制中发挥重要作用,具体作用机制有待进一步探索。
| [1] |
王卫平, 孙锟, 常立文, 等. 儿科学[M]. 9版. 北京: 人民卫生出版社, 2018: 124. WANG W P, SUN K, CHANG L W, et al. Paediatrics[M]. 9th ed. Beijing: People's Health Press, 2018: 124. |
| [2] |
周晓光, 洪慧. 新生儿急性呼吸窘迫综合征的治疗进展[J]. 中华实用儿科临床杂志, 2017, 32(2): 81-84. ZHOU X G, HONG H. Advances in the treatment of neonatal acute respiratory distress syndrome[J]. Chin J Appl Clin Pediatr, 2017, 32(2): 81-84. DOI:10.3760/cma.j.issn.2095-428X.2017.02.001 |
| [3] |
QIN M, QIU Z. Changes in TNF-α, IL-6, IL-10 and VEGF in rats with ARDS and the effects of dexamethasone[J]. Exp Ther Med, 2019, 17(1): 383-387. DOI:10.3892/etm.2018.6926 |
| [4] |
CZIKORA I, ALLI A, BAO H F, et al. A novel tumor necrosis factor-mediated mechanism of direct epithelial sodium channel activation[J]. Am J Respir Crit Care Med, 2014, 190(5): 522-532. DOI:10.1164/rccm.201405-0833oc |
| [5] |
DE LUCA D, VAN KAAM A H, TINGAY D G, et al. The Montreux definition of neonatal ARDS: biological and clinical background behind the description of a new entity[J]. Lancet Respir Med, 2017, 5(8): 657-666. DOI:10.1016/S2213-2600(17)30214-X |
| [6] |
CHATZAKIS C, PAPATHEODOROU S, SARAFIDIS K, et al. Effect on perinatal outcome of prophylactic antibiotics in preterm prelabor rupture of membranes: network meta-analysis of randomized controlled trials[J]. Ultrasound Obstet Gynecol, 2020, 55(1): 20-31. DOI:10.1002/uog.21884 |
| [7] |
LI S, HUANG X M, CHEN Z, et al. Neutrophil CD64 expression as a biomarker in the early diagnosis of bacterial infection: a meta-analysis[J]. Int J Infect Dis, 2013, 17(1): e12-e23. DOI:10.1016/j.ijid.2012.07.017 |
| [8] |
钟元枝, 王金虎, 陈玉霞, 等. 脐血和0~24 h外周血炎性标志物在新生儿早发败血症中的诊断价值[J]. 国际儿科学杂志, 2017, 44(7): 495-498. ZHONG Y Z, WANG J H, CHEN Y X, et al. Diagnostic value of cord blood and 0~24 hour peripheral blood inflammatory markers in early-onset neonatal sepsis[J]. Int J Pediatr, 2017, 44(7): 495-498. DOI:10.3760/cma.j.issn.1673-4408.2017.07.014 |
| [9] |
SHI J, TANG J, CHEN D. Meta-analysis of diagnostic accuracy of neutrophil CD64 for neonatal sepsis[J]. Ital J Pediatr, 2016, 42(1): 57. DOI:10.1186/s13052-016-0268-1 |
| [10] |
朱建幸, 李玉峰, 朱晓东, 等. 细菌感染时新生儿CD4+T细胞表面标记物的表达[J]. 上海第二医科大学学报, 2003, 23(Suppl): 9-11, 120. ZHU J X, LI Y F, ZHU X D, et al. Functional expression of CD4 +T lymphocytes in neonates with bacterial infection[J]. Acta Univ Med Second Shanghai, 2003, 23(Suppl): 9-11, 120. DOI:10.3969/j.issn.1674-8115.2003.z1.003 |
| [11] |
CHALMERS S, KHAWAJA A, WIERUSZEWSKI P M, et al. Diagnosis and treatment of acute pulmonary inflammation in critically ill patients: The role of inflammatory biomarkers[J]. World J Crit Care Med, 2019, 8(5): 59-71. DOI:10.5492/wjccm.v8.i5.59 |
| [12] |
PAN J, ZHAN C, YUAN T, et al. Effects and molecular mechanisms of intrauterine infection/inflammation on lung development[J]. Respir Res, 2018, 19(1): 93. DOI:10.1186/s12931-018-0787-y |
| [13] |
AISIKU I P, YAMAL J M, DOSHI P, et al. Plasma cytokines IL-6, IL-8, and IL-10 are associated with the development of acute respiratory distress syndrome in patients with severe traumatic brain injury[J]. Crit Care, 2016, 20: 288. DOI:10.1186/s13054-016-1470-7 |
| [14] |
HALTER S, AIMADE L, BARBIÉ M, et al. T regulatory cells activation and distribution are modified in critically ill patients with acute respiratory distress syndrome: a prospective single-centre observational study[J]. Anaesth Crit Care Pain Med, 2020, 39(1): 35-44. DOI:10.1016/j.accpm.2019.07.014 |
| [15] |
FUJISHIMA S. Pathophysiology and biomarkers of acute respiratory distress syndrome[J]. J Intensive Care, 2014, 2(1): 32. DOI:10.1186/2052-0492-2-32 |
| [16] |
TAKALA A, JOUSELA I, TAKKUNEN O, et al. A prospective study of inflammation markers in patients at risk of indirect acute lung injury[J]. Shock, 2002, 17(4): 252-257. DOI:10.1097/00024382-200204000-00002 |
| [17] |
CHEN Z, HU Y, XIONG T, et al. IL-10 promotes development of acute respiratory distress syndrome via inhibiting differentiation of bone marrow stem cells to alveolar type 2 epithelial cells[J]. Eur Rev Med Pharmacol Sci, 2018, 22(18): 6085-6092. DOI:10.26355/eurrev_201809_15947 |
| [18] |
WITTEKINDT O H. Tight junctions in pulmonary epithelia during lung inflammation[J]. Pflugers Arch, 2017, 469(1): 135-147. DOI:10.1007/s00424-016-1917-3 |
| [19] |
ROKKAM D, LAFEMINA M J, LEE J W, et al. Claudin-4 levels are associated with intact alveolar fluid clearance in human lungs[J]. Am J Pathol, 2011, 179(3): 1081-1087. DOI:10.1016/j.ajpath.2011.05.017 |
| [20] |
WYNNE B M, ZOU L, LINCK V, et al. Regulation of lung epithelial sodium channels by cytokines and chemokines[J]. Front Immunol, 2017, 8: 766. DOI:10.3389/fimmu.2017.00766 |



