2. 400016 重庆, 重庆医科大学附属第一医院:实验研究中心
2. Laboratory Research Center, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
心肌纤维化(myocardial fibrosis,MF)是众多心血管疾病发生和发展的共同病理基础, 与高血压性心脏病、冠心病、糖尿病心肌病等疾病密切相关,可导致心力衰竭、心律失常和心源性猝死等严重并发症,其本质是心脏细胞外基质重塑[1]。心肌梗死(myocardial infraction, MI)是导致心肌纤维化常见原因之一[2]。心内膜心肌活检组织病理学分析是目前用于评估心脏纤维化的金标准,因有创而较少开展[3]。血清Ⅰ型前胶原羧基端肽(procollagen typeⅠC-peptide, PⅠCP)和Ⅲ型前胶原氨基端肽(procollagen Ⅲ N-terminal peptide,PⅢNP)浓度与心内膜活检测定胶原体积分数关系密切,常作为心肌胶原代谢的循环分子标志物[4],目前多用于基础研究。寻找与心肌纤维化有关的其他生物标志物,对于评估心肌梗死后心肌纤维化程度及预后具有积极意义。
组织非特异性碱性磷酸酶(tissue non-specific alkaline phosphatase,TNAP)是磷酸酶家族成员,广泛分布于机体各组织并发挥多种生物学作用[5]。TNAP通过水解焦磷酸盐至游离磷酸根,发挥骨质矿化作用[6]。近年来有研究证实,TNAP不仅促进成骨矿化[6]和血管病理性钙化[7],还可促进脂肪细胞[8]、神经元细胞[9]、血管平滑肌细胞[10]分化和代谢,但TNAP在心脏的作用目前并不清楚。有研究报道:血清TNAP升高与急性心肌梗死患者远期死亡率相关,且增加新发心力衰竭风险,有学者认为这可能与TNAP加重血管钙化有关[11-12],而TNAP在心肌纤维化中的作用尚不清楚。本研究旨在探讨TNAP与心肌梗死后心肌纤维化的关系,明确TNAP是否与心肌梗死后心肌纤维化程度有关,探讨TNAP是否参与心肌梗死后心肌病理重塑过程。
1 材料与方法 1.1 材料 1.1.1 研究对象收集2019年3-11月本院心血管内科收治的经冠状动脉造影证实的急性心肌梗死患者46例,其中男性39例,女性7例。对照组选择同期冠状动脉造影完全阴性患者41例,其中男性23例,女性18例。入选病例均获得患者及家属的知情同意;收集陈旧性心肌梗死死亡患者心肌样本5例。本研究通过重庆医科大学附属第一医院伦理委员会的审查批准(2018-035)。排除标准:严重肝/肾功能不全、慢性阻塞性肺病、恶性肿瘤、重度感染、房颤、瓣膜疾病、先天性心脏病等其他心脏疾病。记录患者的临床资料,包括一般情况和人口统计学指标如姓名、性别、年龄、体质量指数(body mass index,BMI)、血压,疾病史(高血压史、糖尿病史),烟酒史,肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)和超敏肌钙蛋白(high-sensitivity cardiac troponin T, Hs-cTnt),左室射血分数(left ventricular ejection fraction,EF),冠状动脉造影结果,生化指标包括总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酐(creatinine,Cre)等。
1.1.2 实验动物及分组10只8周龄健康SPF级C57BL/6J雄性小鼠,质量(24±1)g,购自重庆医科大学实验动物中心[动物合格证号:SCXK(渝)2018-0003],按随机数字表法分为假手术组和心肌梗死组,每组5只,假手术组只穿针不结扎冠状动脉,心肌梗死组结扎冠状动脉前降支。
1.1.3 器材与试剂酶标仪购自芬兰Thermo公司,高速离心机购自美国Sigma公司,碱性磷酸酶测定试剂盒(A059-2)购自南京建成生物工程研究所有限公司。人Ⅰ型前胶原羧基端肽(PⅠCP)和人Ⅲ型前胶原肽N端肽(PⅢNP)酶联免疫分析试剂盒(MB-4130A,MB-4123A)购自江苏酶标生物科技有限公司。TNAP抗体(ab108337)购自Abcam公司。天狼星红染色液(G1470)购自索莱宝公司,Masson染色试剂购自武汉塞维尔生物公司。
1.2 方法 1.2.1 标本采集患者在心肌梗死后第7天留取外周静脉血,促凝管分离血清(1 500×g,离心10 min),样本冻存于-80 ℃超低温冰箱。
1.2.2 血清TNAP活性测定操作步骤按碱性磷酸酶试剂盒说明进行。
1.2.3 PⅠCP和PⅢNP测定采用酶联免疫法(ELISA)定量血清PⅠCP和PⅢNP浓度,操作步骤按试剂盒说明进行。
1.2.4 小鼠心肌梗死模型构建参考已建立的方法[13]稍作改进。小鼠以1%戊巴比妥钠50 mg/kg经腹腔注射麻醉,固定后局部备皮消毒,经口无创气管插管,连接小动物呼吸机,呼吸稳定后打开胸腔暴露心脏,以左心耳下缘水平线为标志,在线下2 mm处用8-0 Prolene缝线从右向左缓慢结扎小鼠冠状动脉前降支,结扎后可见左心室前壁颜色由鲜红变为暗紫至苍白色,活动减弱且心电图ST段明显抬高提示建模成功,然后逐层缝合胸部皮下组织和皮肤,待小鼠恢复自主呼吸后撤除呼吸机,拔除气管插管。心肌梗死术后2周处死小鼠,留取心肌组织标本。
1.2.5 免疫组织化学心肌梗死患者和小鼠心脏标本石蜡包埋后切片,切片常规脱蜡至水,余操作步骤按中杉金桥(PV-9000)试剂盒说明进行。
1.2.6 天狼星红染色人心脏组织切片脱蜡至水,天狼星红染色液滴染1 h,稍冲洗后苏木精染核1 min,流水冲洗10 min,常规脱水、透明、封片,择期拍照。
1.2.7 Masson染色小鼠心脏组织切片脱蜡至水,重铬酸钾染色,铁苏木素染色,丽春红酸性品红染色,磷钼酸染色,苯胺蓝染色,1%冰醋酸分化,常规脱水、透明、封片,择期拍照。
1.3 统计学分析采用SPSS 22.0统计软件。计量资料正态分布时数据以x±s表示;偏态分布时以中位数(Q1,Q3)表示;两组比较采用t检验(正态分布)或Mann-Whitney U检验(非正态分布);计数资料以例(%)表示,两组间比较采用χ2检验。相关性使用Spearman相关分析。双侧检验,P<0.05表示差异有统计学意义。
2 结果两组年龄、BMI、高血压史、EF、HDL-C、TC及Crea差异无统计学意义(P>0.05), MI组男性及吸烟比例更高。与对照组比较,MI组TG和LDL-C差异均有统计学意义(P<0.05),MI组Hs-cTnt、CK-MB、ALT及AST差异均有统计学意义(P<0.01),具体见表 1。
| 组别 | n | 男性/女性 | 年龄/岁 | BMI/kg·m-2 | 吸烟史/例(%) | 高血压史/例(%) | 2型糖尿病/例(%) | EF(%) | HDL-C/mmol·L-1 | LDL-C/mmol·L-1 | TC/mmol·L-1 | TG/mmol·L-1 | CK-MB/ng·mL-1 | Hs-cTnt/ng·mL-1 | ALT/U·L-1 | AST/U·L-1 | Crea/mmol·L-1 |
| 对照组 | 41 | 23/18 | 66±12 | 23.50±2.87 | 20(48.8) | 23(56.1) | 8(19.5) | 57.00±10.63 | 1.24(1.00, 1.40) | 2.29±0.90 | 3.82±0.99 | 1.00(0.80, 1.24) | 3.66±0.97 | 0.04(0.02, 0.07) | 19(14, 24) | 20(16, 23) | 78.51±25.43 |
| 心肌梗死组 | 46 | 39/7a | 63±12 | 23.47±3.07 | 34(73.9)a | 24(52.2) | 18(39.1)a | 54.52±7.56 | 1.03(0.92, 1.24) | 2.74±0.84a | 4.22±1.01 | 1.63(0.99, 2.10)a | 7.15±2.09b | 0.16(0.13, 0.22)b | 28(19, 41)b | 25(18, 46)b | 79.06±20.70 |
| a:P<0.05,b:P<0.01,与对照组比较 | |||||||||||||||||
2.2 心肌梗死患者血清TNAP、PⅠCP和PⅢNP表达水平
MI组患者血清TNAP活性为(8.49±3.30)金氏单位/100 mL,显著高于对照组的(6.20±2.95)金氏单位/100 mL(P<0.01,图 1A)。MI组血清PⅠCP浓度为63.86(42.07~87.68)mg/L,对照组为31.75(26.41~ 46.49)mg/L;MI组血清PⅢNP浓度为1.75(1.35~2.27)mg/L,对照组为1.37(1.13~1.72)mg/L,MI组血清PⅠCP和PⅢNP浓度均较对照组显著增加(P<0.01,图 1B、C)。

|
| a:P<0.01, 与对照组比较;A: TNAP表达水平;B: PⅠCP表达水平;C: PⅢNP表达水平 图 1 心肌梗死患者血清TNAP、PⅠCP以及PⅢNP浓度差异 |
2.3 血清TNAP水平与P ⅠCP及PⅢNP的相关性分析
根据相关性分析显示,血清中TNAP活性水平与PⅠCP浓度呈正相关(r=0.38,P<0.01,图 2A),血清中TNAP活性水平与PⅢNP浓度呈正相关(r=0.40,P<0.01, 图 2B)。
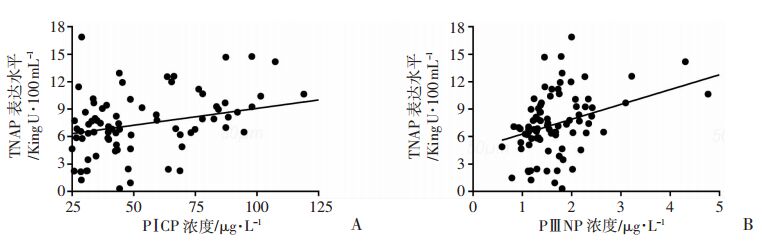
|
| A:血清TNAP与PⅠCP的相关性;B:血清TNAP与PⅢNP的相关性 图 2 血清TNAP活性水平与PⅠCP及PⅢNP的相关性分析 |
2.4 心肌梗死患者心肌组织中胶原沉积和TNAP表达水平
陈旧性心肌梗死患者心肌梗死边界区较梗死远端胶原沉积更多[(5.2±1.5)% vs (27.3±2.5)%,P<0.01,图 3], 心肌组织边界区TNAP表达增加[(1.0±0.1) vs (2.8±0.3),P<0.01,图 3],TNAP的表达与纤维分布区域一致。
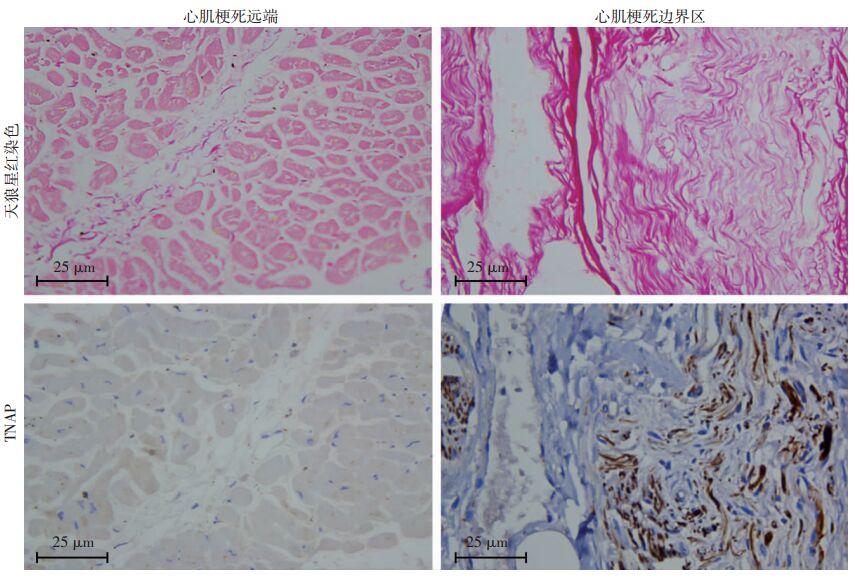
|
| 图 3 天狼星红及免疫组化染色观察陈旧性心肌梗死患者心肌组织病理学表现 |
2.5 小鼠心肌组织中胶原沉积和TNAP表达水平
小鼠心肌梗死组较假手术组胶原显著增多[(3.5±1.3)% vs (19.2±1.6)%,P<0.01,图 4), 心肌梗死组TNAP表达增加[(1.0±0.2) vs (3.8±0.3),P<0.01, 图 4), TNAP的表达与纤维分布区域一致。

|
| 图 4 Masson及免疫组化染色的心肌梗死小鼠类心肌组织病理表现 |
3 讨论
TNAP是一组具有底物特异性的水解同工酶,在碱性环境中能水解众多磷酸单酯化合物,其酶学性质已经得到广泛研究[5, 14]。近期有研究发现TNAP在动脉粥样硬化、心肌肥大及血管钙化等病理生理过程中发挥作用[15-16],但TNAP是否参与心肌梗死后心肌纤维化未见报道。本研究旨在探讨TNAP与心肌梗死后心肌纤维化的关系。
为了明确心肌梗死患者心肌梗死后TNAP的变化情况,本研究对比心肌梗死患者及冠脉阴性患者血清中TNAP活性水平,结果显示MI组患者血清中TNAP水平高于对照组。
胶原蛋白在心肌组织的表达主要由Ⅰ型、Ⅲ型胶原组成,并分别来源于各自的前胶原,在前胶原向胶原转化的过程中各自释放出特异的PⅠCP和PⅢNP[17]。心肌梗死后,局部缺血缺氧导致大量心肌细胞死亡,伴随心脏成纤维细胞活化增殖,表型转变形成肌成纤维细胞,后者首先在细胞内合成前胶原, 再分泌到细胞外转换为胶原纤维,最初为Ⅲ型胶原,梗死后愈合过程中逐渐被Ⅰ型胶原代替[18]。研究表明,PⅠCP和PⅢNP常分别作为Ⅰ型胶原和Ⅲ型胶原代谢生物标志物[3-4, 19]。我们发现心肌梗死1周后循环PⅠCP及PⅢNP显著升高,这与前人报道结果一致[20]。目前尚无关于MI患者血清TNAP水平与心肌胶原代谢之间相关性的研究。我们对心肌梗死组患者血清TNAP活性水平与PⅠCP及PⅢNP浓度进行相关性分析,结果显示心肌梗死后血清TNAP活性与胶原代谢标志物PⅠCP和PⅢNP呈显著正相关,提示在心肌纤维化形成早期,TNAP可能参与心肌梗死后胶原合成。
为进一步验证TNAP是否参与MI后心肌纤维化胶原合成过程,我们收集了5例陈旧性心肌梗死患者心肌样本,分别检测其心肌梗死边界区和梗死远端胶原沉积情况以及TNAP表达情况。免疫组化结果显示:陈旧性心肌梗死患者心肌梗死边界区较梗死远端胶原沉积更多(P<0.01),心肌组织TNAP表达增加(P<0.01),TNAP的表达与陈旧性心肌梗死的纤维瘢痕分布区域一致。我们发现心肌梗死患者心肌组织中TNAP表达增加,其组织分布与心肌梗死后心肌纤维组织重叠,提示TNAP可能参与急性心肌梗死后心肌纤维化过程。
为进一步深入探讨TNAP与心肌梗死后心肌纤维化的关系,我们建立小鼠MI模型,结果显示心肌梗死组小鼠较假手术组小鼠心脏胶原显著增加(P<0.01),心肌组织TNAP表达增加(P<0.01),且TNAP的表达与心肌梗死的纤维瘢痕分布区域一致,这与临床心肌梗死患者心肌标本结果一致。因此,我们推断TNAP可能参与急性心肌梗死后心肌纤维化过程,但TNAP参与心肌梗死后心肌纤维化具体机制有待进一步研究。
综上所述,本研究发现心肌梗死患者血清TNAP水平高于对照组,且心肌梗死患者血清TNAP水平与PⅠCP和PⅢNP浓度呈正相关,提示TNAP可能与心肌梗死后I型和Ⅲ型胶原代谢有关,通过免疫组化及胶原沉积检测我们发现在人体和小鼠心肌梗死后心脏组织中TNAP表达均增加,且其组织分布与心肌梗死后心肌纤维组织重叠, 因此,我们考虑TNAP可能与急性心肌梗死后心肌纤维化的形成有关,但具体机制有待进一步研究。
| [1] |
Writing Group Members, MOZAFFARIAN D, BENJAMIN EJ, et al. Heart disease and stroke statistics-2016 update:areport from the American Heart Association[J]. Circulation, 2016, 133(4): e38-e360. DOI:10.1161/CIR.0000000000000350 |
| [2] |
LI X, ZHU L, WANG B, et al. Drugs and targets in fibrosis[J]. Front Pharmacol, 2017, 8(11): 855. DOI:10.3389/fphar.2017.00855 |
| [3] |
RICHARDSAM. Circulating biomarkers of cardiac fibrosis: do we have any and what use are they?[J]. Circ Heart Fail, 2017, 10(3): e003936. DOI:10.1161/CIRCHEARTFAILURE.117.003936 |
| [4] |
LÓPEZ B, GONZÁLEZ A, RAVASSA S, et al. Circulating biomarkers of myocardial fibrosis[J]. JAm Coll Cardiol, 2015, 65(22): 2449-2456. DOI:10.1016/j.jacc.2015.04.026 |
| [5] |
SHARMA U, PAL D, PRASAD R. Alkaline phosphatase: an overview[J]. IndianJClin Biochem, 2014, 29(3): 269-278. DOI:10.1007/s12291-013-0408-y |
| [6] |
MILLÁN JL. The role of phosphatases in the initiation of skeletal mineralization[J]. Calcif Tissue Int, 2013, 93(4): 299-306. DOI:10.1007/s00223-012-9672-8 |
| [7] |
SHEENCR, KUSS P, NARISAWA S, et al. Pathophysiological role of vascular smooth muscle alkaline phosphatase in medial artery calcification[J]. JBone Miner Res, 2015, 30(5): 824-836. DOI:10.1002/jbmr.2420 |
| [8] |
HERNÁNDEZ-MOSQUEIRA C, VELEZ-DELVALLE C, KURI-HARCUCH W. Tissue alkaline phosphatase is involved in lipid metabolism and gene expression and secretion of adipokines in adipocytes[J]. Biochim Biophys Acta, 2015, 1850(12): 2485-2496. DOI:10.1016/j.bbagen.2015.09.014 |
| [9] |
ARUN P, OGUNTAYO S, ALBERTSV, et al. Acute decrease in alkaline phosphatase after brain injury:a potential mechanism for tauopathy[J]. Neurosci Lett, 2015, 609: 152-158. DOI:10.1016/j.neulet.2015.10.036 |
| [10] |
FAKHRY M, ROSZKOWSKA M, BRIOLAY A, et al. TNAP stimulates vascular smooth muscle cell trans-differentiation into chondrocytes through calcium deposition and BMP-2 activation: Possible implication in atherosclerotic plaque stability[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(3): 643-653. DOI:10.1016/j.bbadis.2016.12.003 |
| [11] |
OH PC, LEE K, KIMTH, et al. Prognostic impact of alkaline phosphatase measured at time of presentation in patients undergoing primary percutaneous coronary intervention for ST-segment elevation myocardial infarction[J]. PLoS ONE, 2017, 12(2): e0171914. DOI:10.1371/journal.pone.0171914 |
| [12] |
HAARHAUS M, BRANDENBURG V, KALANTAR-ZADEH K, et al. Alkaline phosphatase:a novel treatment target for cardiovascular disease in CKD[J]. Nat Rev Nephrol, 2017, 13(7): 429-442. DOI:10.1038/nrneph.2017.60 |
| [13] |
UNSÖLD B, KAUL A, SBROGGIÒ M, et al. Melusin protects from cardiac rupture and improves functional remodelling after myocardial infarction[J]. Cardiovasc Res, 2014, 101(1): 97-107. DOI:10.1093/cvr/cvt235 |
| [14] |
曹宇, 王莉莉. 血管内皮细胞生长因子与碱性成纤维细胞生长因子联合应用对鼠牙周膜成纤维细胞增殖与碱性磷酸酶活性的影响[J]. 中国组织工程研究, 2017, 21(4): 580-585. CAO Y, WANG L L. Effects of vascular endothelial growth factor combined with basic fibroblast growth factor on periodontal ligament fibroblast proliferation and alkaline phosphatase activity in rats[J]. Chin J Tissue Eng Res, 2017, 21(4): 580-585. DOI:10.3969/j.issn.2095-4344.2017.04.015 |
| [15] |
RODIONOVRN, BEGMATOV H, JARZEBSKA N, et al. Homoarginine supplementation prevents left ventricular dilatation and preserves systolic function in a model of coronary artery disease[J]. JAm Heart Assoc, 2019, 8(14): e012486. DOI:10.1161/JAHA.119.012486 |
| [16] |
YU TT, JIAOYD, SONG J, et al. Prognostic impact of alkaline phosphatase for in-hospital mortality in patients with acute coronary syndrome:a prospective cohort study in China[J]. BMJ Open, 2019, 9(8): e025648. DOI:10.1136/bmjopen-2018-025648 |
| [17] |
GYÖNGYÖSI M, WINKLER J, RAMOS I, et al. Myocardial fibrosis: biomedical research from bench to bedside[J]. EurJHeart Fail, 2017, 19(2): 177-191. DOI:10.1002/ejhf.696 |
| [18] |
BHATTAS, AMBROSYAP, VELAZQUEZEJ. Adverse remodeling and reverse remodeling after myocardial infarction[J]. Curr Cardiol Rep, 2017, 19(8): 71. DOI:10.1007/s11886-017-0876-4 |
| [19] |
WANGFF, CHENBX, YU HY, et al. Correlation between growth differentiation factor-15 and collagen metabolism indicators in patients with myocardial infarction and heart failure[J]. JGeriatr Cardiol, 2016, 13(1): 88-93. DOI:10.11909/j.issn.1671-5411.2016.01.002 |
| [20] |
RADOVAN J, VACLAV P, PETR W, et al. Changes of collagen metabolism predict the left ventricular remodeling after myocardial infarction[J]. Mol Cell Biochem, 2006, 293(1/2): 71-78. DOI:10.1007/s11010-006-2955-5 |



