肾母细胞瘤(nephroblastoma)又叫Wilms瘤,是一种来源于胚胎性肾组织的混合性胚胎瘤,也是婴幼儿泌尿系统最常见的恶性肿瘤[1]。越来越多的证据表明,长度超过200个核苷酸的长链非编码RNA(long noncoding RNAs, lncRNAs)在癌症的发生发展过程中起着至关重要的作用[2]。然而,大多数lncRNA与肾母细胞瘤之间的关系尚不清楚。LINC01006是一个基因间区长链非编码RNA(large intergenic non-coding RNA, lincRNA),位于7号染色体长臂3区6带(7q36)上[3]。有研究表明LINC01006是一种新的胃癌标志物[4]。然而,LINC01006在肾母细胞瘤中的相关研究较少。本研究通过检测肾母细胞瘤组织和细胞系中LINC01006的表达水平,分析LINC01006对肾母细胞瘤细胞增殖、侵袭及凋亡能力的影响及其相关机制,并通过体内实验进一步验证其功能。
1 资料与方法 1.1 资料 1.1.1 临床样本收集收集来自西安市儿童医院2017年9月至2018年7月血液肿瘤科肾母细胞瘤患者组织和瘤旁组织(肿瘤未侵及)20例,男女各10例,年龄(3.25±1.45)岁,新鲜组织从体内取出后立即置于-80 ℃保存。肾母细胞瘤患者必须符合以下标准:①肾母细胞瘤的诊断必须经影像学检查确认;②既往有癌症病史的患者不纳入本研究;③患者未接受化疗或放疗。本研究2017年7月经本院医学伦理委员会批准(004号),所有受试者获得书面知情同意书。
1.1.2 细胞系与试剂人胚胎肾正常细胞系CCC-HEK-1,肾母细胞瘤细胞系SK-NEP-1、G-401和WT-CLS1,人源胚胎肾细胞HEK-293T均来自本实验室细胞库。4~6周龄雌性BALB/c裸鼠购自成都达硕实验动物有限公司。胎牛血清(FBS)、McCoy’s 5A培养基、高糖DMEM培养基购自美国Gibco公司;LipofectamineTM 2000转染试剂购自Invitrogen公司;TRIzol、逆转录试剂盒、RT-qPCR试剂均购自大连TaKaRa公司;RIPA裂解液、GAPDH单克隆抗体和鼠源IgG抗体购自康为世纪生物科技有限公司;中胚层同源盒基因(mesoderm homoobox2, MEOX2)、磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase, PI3K)、p-PI3K、丝氨酸/苏氨酸激酶,即蛋白激酶B(protein kinase B, PKB/Akt)、p-Akt抗体均购自美国Abcam公司;Transwell小室购自美国Corning公司;膜联蛋白(Annexin)V-碘化丙啶(PI)双染凋亡试剂盒购自美国DB公司;细胞计数试剂盒(cell counting kit-8, CCK-8)购自中国BioTeke公司;BrdU细胞增殖检测试剂盒购自美国Cell Signaling Technology公司。
1.1.3 主要仪器设备细胞培养箱、酶标仪购自Thermo公司;实时荧光定量PCR仪、凝胶成像系统购自美国Bio-Rad公司;冷冻离心机购自德国Eppendorf公司。
1.2 方法 1.2.1 质粒构建及转染通过PCR扩增得到LINC01006片段,将其克隆到pShuttle-CMV载体,随后将其酶切后转化BJ5183大肠杆菌进行重组,得到腺病毒载体pAD-Shuttle-CMV-LINC01006。此外,以5′-GGAAGCTTTCATAAGTGCGTGCTCCAG-3′和5′-AAGG-TACCCATGGAACACCCCCTCTTTGGC-3′为引物,扩增得到MEOX2片段,将其克隆到pcDNA3.1载体构建过表达质粒,同时,设置空载体作对照。miR-148a-3p、LINC01006和MEOX2的siRNA及其阴性对照由公司设计并合成。将细胞接种于培养板,待其密度大约为70%时,根据Lipofectamine 2000转染试剂说明书进行质粒转染。
1.2.2 RNA提取及RT-qPCR按照说明书,用TRIzol试剂提取组织或细胞中的总RNA,测定RNA浓度,通过反转录产生cDNA,将其作为模板进行RT-qPCR,反应条件如下:95 ℃ 1 min;94 ℃ 15 s、54 ℃ 30 s、72 ℃ 20 s,共35个循环。分别以U6和GAPDH作为内源性对照,结果利用2-△△Ct法进行计算。引物序列见表 1。
| 基因 | 上游引物(5′→3′) | 下游引物(5′→3′) | 片段长度/bp |
| LINC01006 | TTTGTGGTGGTGAAGACGTG | TCCTCAAGAATAAGGAACATAGG | 120 |
| miR-148a-3p | TCAGTGCACTACAGAACTTTGT | GCTGTCAACGATACGCTACGT | 74 |
| MEOX2 | TCTGGGACCACCTTCTTTTG | CCACCACCCTCTGTCACTTT | 219 |
| U6 | CTCGCTTCGGCAGCACA | AACGCTTCACGAATTTGCGT | 94 |
| GAPDH | ACCCACTCCTCCACCTTTGAC | TGTTGCTGTAGCCAAATTCGTT | 100 |
1.2.3 CCK-8法检测细胞活性
转染48 h后,调整细胞数至2×105/mL接种于96孔板,于培养后24、48、72 h分别加入15 μL CCK-8溶液,孵育4 h之后弃培养液,每孔加150 μL DMSO震荡15 min,酶标仪测定450 nm波长处的光密度值[D(450)]。
1.2.4 BrdU法检测细胞增殖将细胞以1.5×104个细胞/孔接种于96孔板,于转染质粒培养24、48、72 h之后,每孔添加10 μL 10×BrdU溶液。37 ℃孵育12 h之后弃培养液,添加Fixing/Denaturing Solution室温孵育30 min。去除溶液后添加1×检测抗体溶液,室温孵育1 h。弃上清,洗涤之后添加1×辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗溶液,室温孵育30 min。去除溶液,洗涤之后,添加100 μL TMB Substrate室温孵育30 min,随后添加100 μL STOP Solution,30 min内读取450 nm处的D(450)值。
1.2.5 细胞侵袭实验在Transwell平板上涂Matrigel胶,孵育2~3 h。然后将无血清培养液制备的200 μL 2×105 /mL的细胞悬液加至上室,800 μL含10% FBS的培养基加至下室,在37 ℃培养箱继续培养24 h。去除上室底部膜表面的细胞,将细胞用甲醛溶液固定后,结晶紫染色,在显微镜下进行观察和计数。
1.2.6 细胞凋亡检测进行细胞计数之后将2×105~5×105 /mL细胞离心,弃上清,重悬于195 μL结合缓冲溶液中,与5 μL Annexin V-FITC孵育10 min,然后与10 μL PI(20 μg/mL)在避光条件下孵育5 min。设立空白对照、Annexin V-FITC和PI单染色组。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行实验。
1.2.7 靶基因预测及双荧光素酶报告基因实验通过生物信息学分析预测得到LINC01006可靶向结合的miRNA,及miRNA所靶向的基因。分别构建含有miR-148a-3p结合位点的LINC01006和MEOX2 3′-非翻译区(untranslated region, UTR)的野生型(wild type, WT)和突变型(mutant, MUT)荧光素酶报告载体,即pGL3-LINC01006-WT/MUT和pGL3-MEOX2 3′-UTR-WT/MUT。将荧光素酶报告载体分别与miR-148a-3p模拟物或阴性对照(negative control, NC)寡核苷酸共转染HEK-293T细胞。48 h之后裂解细胞,加入底物,通过双荧光素酶报告分析系统测定荧光素酶活性。
1.2.8 RNA Pull-down实验用生物素标记的miR-148a-3p转染HEK-293T细胞,48 h后将细胞裂解液与链亲和素包被磁珠4 ℃孵育3 h。充分洗涤珠子后,洗脱RNA-RNA复合物,对RNA提取物进行特异性RT-qPCR检测。
1.2.9 Western blot分析转染48 h之后,使用RIPA裂解液提取组织或细胞的总蛋白,通过BCA试剂盒测定每个样品的蛋白浓度。等量蛋白经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,将其转移到PVDF膜上,然后用5%牛血清白蛋白(BSA)室温封闭1 h,分别用相应的抗MEOX2、PI3K、p-PI3K、Akt、p-Akt抗体4 ℃孵育过夜,用TBST漂洗之后,与HRP标记的IgG抗体室温孵育1 h。TBST漂洗之后,ECL显影液曝光显影。基于每种蛋白质与GAPDH的灰度比,使用Image J软件进行蛋白质定量分析。
1.2.10 动物实验将18只4~6周龄雌性BALB/c裸鼠按体质量从小到大编号,然后从随机数字表连续抄取18个数字,分别除以3求余数,余数0、1、2分别代表进入第1、2、3组。得到第3组小鼠数量为8只,查随机数字表下一个数字为14,用该数字除以组内分得的小鼠数量,即14/8,所得余数为6,则将第3组内第6只小鼠调整到第2组,以此类推,将小鼠随机分为3组(每组6只):空白对照组、空载体对照组、过表达LINC01006组。分别将转染腺病毒空载体和LINC01006过表达腺病毒载体的SK-NEP-1细胞悬液接种于裸鼠右前腋皮下,建立肾母细胞瘤皮下移植瘤模型。接下来,每隔一周测量肿瘤体积,在第4周对裸鼠实施安乐死,测量其肿瘤的质量。提取肿瘤组织的RNA和蛋白,检测LINC01006、miR-148a-3p、MEOX2、p-PI3K和p-Akt的表达。
1.3 统计学分析采用SPSS 21.0统计软件进行分析,数据以x±s表示。两组间的数据比较采用独立性t检验,多组间比较采用单因素方差分析。
2 结果 2.1 LINC01006在肾母细胞瘤组织及细胞中表达下调通过RT-qPCR检测了肾母细胞瘤组织及细胞中LINC01006的表达,观察到肿瘤组织中LINC01006的相对表达量显著低于正常组织(P < 0.01,图 1A)。然后,我们检测了人胚胎肾正常细胞和3个不同的肾母细胞瘤细胞系中LINC01006的表达水平,结果如图 1B所示,与正常细胞系相比,肾母细胞瘤细胞系中LINC01006的表达水平显著降低。
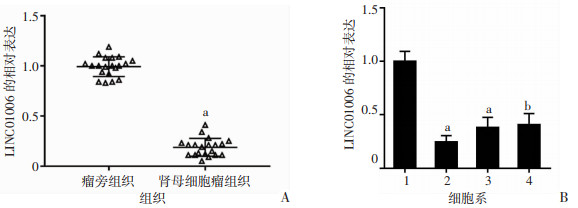
|
| A:肾母细胞瘤组织a:P < 0.01,与瘤旁组织比较;B:不同细胞系1:CCC-HEK-1;2:SK-NEP-1;3:G-401;4:WT-CLS1 a:P < 0.01,与CCC-HEK-1比较,b:P < 0.05,细胞系之间比较 图 1 肾母细胞瘤组织及细胞系中LINC01006的相对表达量 |
2.2 过表达LINC01006可以抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡
分别通过CCK-8、BrdU、Transwell侵袭实验和Annexin V-FITC/PI染色实验检测过表达和干扰LINC01006之后肾母细胞瘤细胞的活力、增殖、侵袭和凋亡能力。腺病毒载体过表达LINC01006以及si-RNA干扰的效果见图 2A。CCK-8结果显示过表达LINC01006可以降低肾母细胞瘤细胞的存活率(P < 0.05, 图 2B)。BrdU结果显示过表达LINC01006可以抑制肾母细胞瘤细胞的增殖(P < 0.01, 图 2C)。Transwell实验结果显示,过表达LINC01006后,肾母细胞瘤细胞的侵袭能力减弱(P < 0.05, 图 2D)。图 2E显示过表达LINC01006可以促进肾母细胞瘤细胞的凋亡。以上结果说明,LINC01006可以抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡。

|
| A: LINC01006过表达与干扰效果的鉴定;B: LINC01006对肾母细胞瘤细胞活性的影响;C: LINC01006对肾母细胞瘤细胞增殖的影响;D: LINC01006对肾母细胞瘤细胞侵袭的影响;E、F: LINC01006对肾母细胞瘤细胞凋亡的影响与统计结果1:Ad-NC组;2:Ad-LINC01006组;3:NC siRNA组;4:si-LINC01006组a:P < 0.01,b:P < 0.05,与Ad-NC组比较;c:P < 0.01,d:P < 0.05,与NC siRNA组比较 图 2 LINC01006对肾母细胞瘤细胞增殖、侵袭能力及凋亡的影响 |
2.3 LINC01006与miR-148a-3p直接结合
通过生物信息学分析预测得到LINC01006与miR-148a-3p直接结合(图 3A)。如图 3B所示构建野生型(WT)和突变型(MUT)载体进行双荧光素酶报告基因实验,结果显示miR-148a-3p抑制LINC01006-WT的荧光素酶活性(P < 0.01),不影响LINC01006-MUT的活性(图 3C)。与对照相比,生物素化的miR-148a-3p使LINC01006的表达增加(图 3D)。图 3E显示过表达LINC01006之后,miR-148a-3p的相对表达量下降,而干扰LINC01006之后,miR-148a-3p的相对表达量升高(P < 0.01)。以上结果说明,LINC01006在肾母细胞瘤细胞中可直接与miR-148a-3p结合发挥作用。
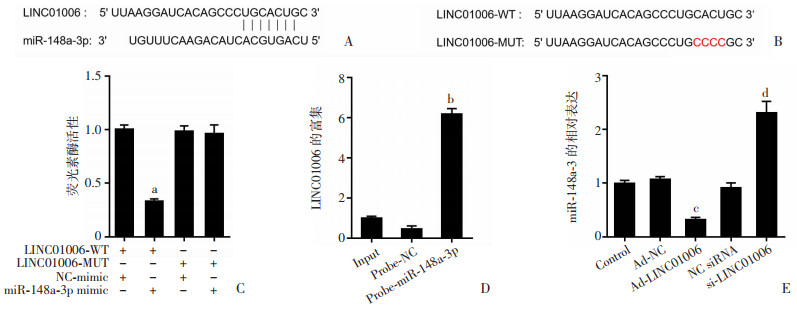
|
| A:LINC01006与miR-148a-3p结合的区域;B:LINC01006序列中与miR-148a-3p结合的野生型(WT)序列及突变型(MUT)序列;C:双荧光素酶报告基因实验检测荧光素酶活性的变化;D:RNA Pull-down实验进一步验证LINC01006与miR-148a-3p直接结合;E:LINC01006对miR-148a-3p表达的影响a:P < 0.01,与NC-mimic组比较;b:P < 0.001,与Probe-NC组比较;c:P < 0.01,与Ad-NC组比较;d:P < 0.01,与NC siRNA组比较 图 3 LINC01006直接与miR-148a-3p结合 |
2.4 MEOX2是miR-148a-3p的靶基因
通过生物信息学分析预测得到MEOX2是miR-148a-3p的靶基因,miR-148a-3p与MEOX2 3′-UTR互补序列如下。

miR-148a-3p mimic降低了野生型(WT)MEOX2 3′-UTR报告载体的荧光素酶活性,而对突变型(MUT)没有影响(P < 0.05, 图 4A、B)。过表达、干扰miR-148a-3p之后发现其对MEOX2的表达起负向调节作用(P < 0.01, 图 4C、D)。
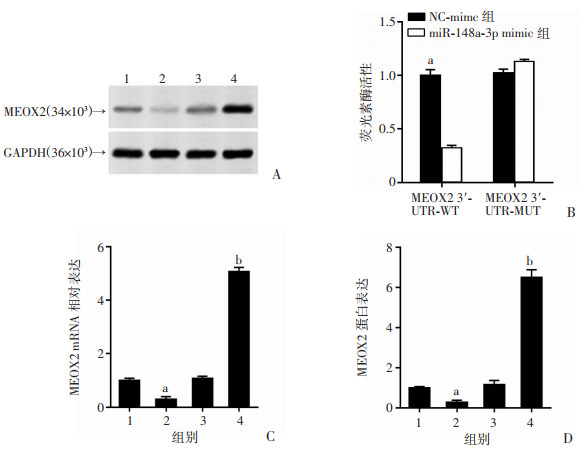
|
| A:双荧光素酶报告基因实验检测结果;B:荧光素酶活性检测结果;C: MEOX2 mRNA相对表达量分析;D: MEOX2蛋白定量分析1:NC-mimic组;2:miR-148a-3p mimic组;3:NC-antagomir组;4:miR-148a-3p antagomir组a:P < 0.05,与NC-mimic组比较;b:P < 0.01,与NC-antagomir组比较 图 4 miR-148a-3p靶向MEOX2的3′-UTR |
2.5 MEOX2在肾母细胞瘤中抑制PI3K/Akt信号通路的活性
SK-NEP-1细胞系转染MEOX2过表达载体或si-RNA 48 h之后通过Western blot检测其作用效果(图 5A)。分别检测过表达和干扰MEOX2之后细胞的活力、增殖、侵袭和凋亡能力,结果显示过表达MEOX2可以抑制肾母细胞瘤细胞的活力、增殖和侵袭(P < 0.01, 图 5B~D),促进细胞凋亡(P < 0.01, 图 5E)。Western blot检测结果显示,过表达MEOX2可以抑制PI3K/Akt通路的活性,导致p-PI3K和p-Akt蛋白表达显著降低(P < 0.01, 图 5F)。
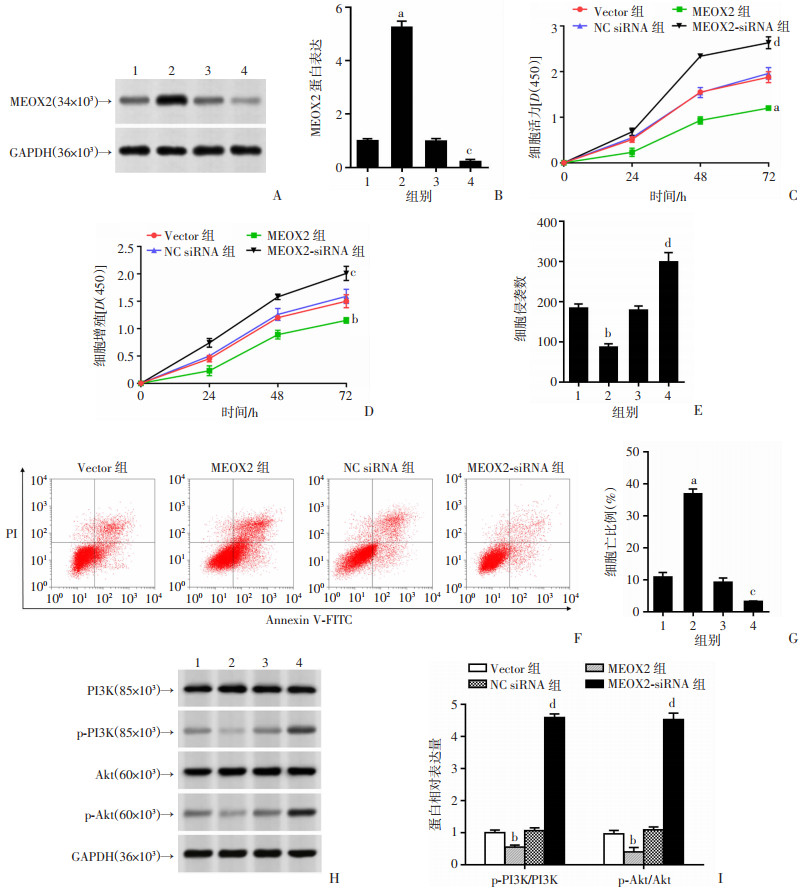
|
| A:MEOX2过表达与干扰效果的鉴定与统计结果;B~G:MEOX2对肾母细胞瘤细胞活力、增殖、侵袭和凋亡的影响;H~I:Western blot检测p-PI3K和p-Akt蛋白的表达与半定量分析1:Vector;2:MEOX2;3:NC siRNA;4:MEOX2-siRNA;a:P < 0.01,b:P < 0.05,与Vector组比较;c:P < 0.05,d:P < 0.01,与NC siRNA组比较 图 5 MEOX2对肾母细胞瘤细胞中PI3K/Akt信号通路的影响 |
2.6 LINC01006通过与miR-148a-3p相互作用来促进MEOX2的表达进而抑制PI3K/Akt信号通路的活性,抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡
过表达LINC01006可以促进MEOX2的表达,共同转染miR-148a-3p mimic之后可以减弱其促进作用(图 6A)。同样地,miR-148a-3p mimic可以减弱LINC01006对PI3K/Akt信号通路活性,对细胞活力、增殖和侵袭能力的抑制作用以及其促细胞凋亡作用(P < 0.01, 图 6B~F)。以上结果说明,LINC01006通过竞争性结合miR-148a-3p,减弱miR-148a-3p对靶基因MEOX2的抑制作用,从而促进其表达,增强对PI3K/Akt信号通路活性的抑制作用,进而抑制肾母细胞瘤细胞的增殖和侵袭能力,促进细胞凋亡。

|
| A:Western blot检测MEOX2的表达;B:Western blot检测p-PI3K和p-Akt蛋白的表达;C~F:分别为CCK-8法、BrdU法、Transwell侵袭实验、Annexinv/PI染色法分别检测细胞活力、增殖、侵袭和凋亡能力的变化1:Vector组;2:pcDNA-LINC01006组;3:pcDNA-LINC01006+NC-mimic组;4:pcDNA-LINC01006+miR-148a-3p mimic组; a:P < 0.01,与Vector组比较;b:P < 0.01,与pcDNA-LINC01006+NC-mimic组比较 图 6 LINC01006与miR-148a-3p相互作用通过MEOX2/PI3K/Akt途径影响肾母细胞瘤细胞的增殖、侵袭和凋亡 |
2.7 LINC01006能抑制裸鼠体内移植瘤的生长
裸鼠接种转染腺病毒空载体和LINC01006腺病毒过表达载体的SK-NEP-1细胞后,建立肾母细胞瘤皮下移植瘤模型。监测肿瘤体积可以发现Control组与Vector组移植瘤体积显著增大,两者差异无统计学意义;Ad-LINC01006组瘤体体积变化最小(P < 0.01, 图 7A)。处死小鼠之后,测量其瘤质量发现,Ad-LINC01006组瘤质量最轻(P < 0.01, 图 7B)。RT-qPCR及Western blot检测结果显示Ad-LINC01006组肾母细胞瘤组织中LINC01006、MEOX2表达上调,miR-148a-3p、p-PI3K、p-Akt的表达下调(P < 0.01, 图 7C~F)。
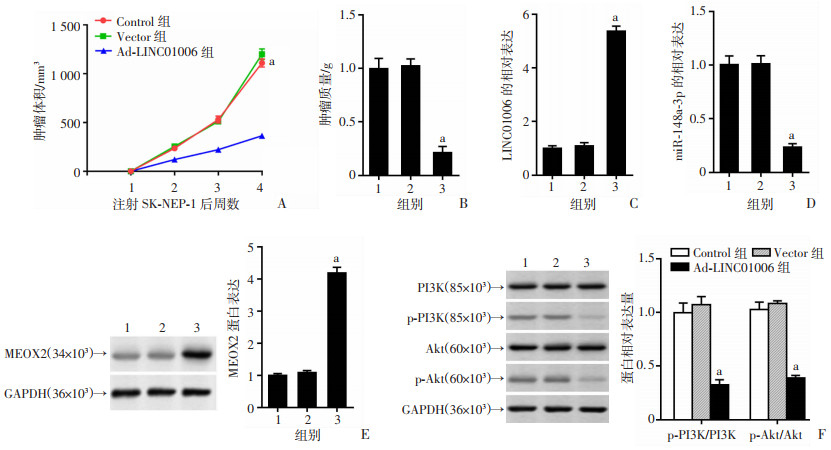
|
| A:各组不同时间移植瘤体积变化;B:接种第28天裸鼠瘤质量;C~F: RT-qPCR及Western blot检测移植瘤组织中LINC01006、miR- 148a-3p、MEOX2、p-PI3K和p-Akt的表达1:Control组;2:Vector组;3:Ad-LINC01006组; a:P < 0.01,与Vector组比较 图 7 LINC01006抑制裸鼠体内移植瘤的生长 |
3 讨论
肾母细胞瘤是婴幼儿泌尿系统最常见的恶性肿瘤,随着近年来治疗方案的不断改进,生存率有所提高[5]。但对该病进行早期诊断和治疗的研究及应用比较滞后,因此找到其有效标记物,提高诊疗水平成为当前社会关注的主要问题[6]。LncRNAs在各种生命活动过程中扮演着重要角色,例如在细胞周期、增殖、凋亡和侵袭过程中发挥重要作用[7]。其中lincRNA在基因表达中发挥关键的调控作用,尤其是在邻近基因之间[8]。研究表明LINC01006与肥胖相关[9],其可以通过调节体质量,对体质指数(BMI)进行调整,减弱LINC01006与骨关节炎(OA)之间的联系[3]。有研究表明LINC01006在胰腺癌组织和细胞中表达上调,其可以通过miR-2682-5p/HOXB8轴促进胰腺癌细胞的增殖和转移[10]。还有研究表明LINC01006在胃癌组织和细胞系中表达降低,其表达水平与年龄、肿瘤位置和肿瘤大小有关[4]。然而,LINC01006在肾母细胞瘤中的功能研究较少。本研究检测了肾母细胞瘤组织、细胞系中LINC01006的表达。之后过表达和敲低LINC01006,检测细胞增殖、侵袭及凋亡能力的变化,结果显示LINC01006在肾母细胞瘤中表达下调,过表达LINC01006可以抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡。
研究证明lncRNAs可作为miRNAs的“分子海绵”发挥作用,调控癌症的发生、发展[11]。miRNAs是一种内源性非编码RNA,长度为18~25个核苷酸,其在病理和生理过程中起调节作用[12]。miRNAs可以在转录水平抑制靶基因的表达,起到癌基因或抑癌基因的作用[13]。我们通过生物信息学分析发现,LINC01006序列中包含miR-148a-3p的结合位点,miR-148a-3p可以直接靶向MEOX2,随后通过双荧光素酶报告基因实验和RNA Pull-down实验对预测结果进行了验证。通过以往研究发现在不同的肿瘤类型中,miR-148可以作为癌基因,也可以作为肿瘤抑制因子发挥作用。在食管鳞状细胞癌(ESCC)患者中,miR-148的下调与生存期的显著缩短相关。在食管腺癌(EAC)中却发现miR-148上调之后,患者的生存期明显缩短,表明miR-148在EAC和ESCC中的功能相反[14]。有研究表明miR-148a在卵巢癌细胞株中表达下调,过表达miR-148a可以明显抑制细胞增殖[15]。miR-148在胃癌中也发挥抑癌作用[16-18]。还有研究表明miR-148a在肝细胞癌(HCC)、脊索瘤、喉鳞状细胞癌(LSCC)组织中表达上调[19-21]。miR-148a在骨肉瘤组织中的表达显著增加,可以促进PI3K信号通路的激活而发挥促肿瘤作用[22]。另外,miR-148a的高表达可以促进胶质母细胞瘤细胞的生长、存活、迁移和侵袭[23-24]。我们在肾母细胞瘤细胞中发现过表达LINC01006和敲低miR-148a-3p均能显著提高MEOX2的表达,从而初步表明LINC01006通过作为miR-148a-3p的“分子海绵”来调控MEOX2的表达。
有研究表明MEOX2在多种疾病中发挥重要作用,其在肺癌[25]、喉癌[26]和肾母细胞癌[27]等多种癌症中发挥抑癌作用。MEOX2可以通过抑制血管生成和Wnt信号通路的激活抑制肾母细胞癌的发展[27]。MEOX2可以阻滞细胞周期,诱导细胞凋亡,抑制血管周围脂肪细胞(PVAC)的增殖,还可以抑制ERK1/2和Akt1/2信号通路的激活[28]。MEOX2在喉癌组织中的表达水平低于正常组织,其可以通过抑制PI3K/Akt途径抑制细胞活性,促进细胞凋亡[26]。PI3K是脂肪细胞生物活性特定的信号传导途径,会影响细胞的增殖和分化[29]。Akt影响脂肪生成,通过影响细胞周期来促进增殖[30],Akt的活化可以抑制细胞凋亡,增强细胞代谢[31]。PI3K/Akt信号通路参与抗凋亡机制的激活、葡萄糖代谢和蛋白质合成,促进生物体内细胞的生长和增殖[32],其异常激活与大多数癌症的进展密切相关[33-35]。本研究发现MEOX2可以抑制PI3K/Akt通路的活性,进而抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡。另外,体内实验表明过表达LINC01006能抑制移植瘤的生长。
本研究发现LINC01006在肾母细胞瘤组织及细胞中呈低表达。过表达LINC01006可以抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡。作用机制可能是LINC01006通过与miR-148a-3p相互作用,促进MEOX2的表达,进而阻断PI3K/Akt通路的活性,抑制肾母细胞瘤细胞的增殖和侵袭,促进细胞凋亡,抑制肿瘤的生长。
| [1] |
VERSCHUUR A C, VUJANIC G M, VAN TINTEREN H, et al. Stromal and epithelial predominant Wilms tumours have an excellent outcome: The SIOP 93 01 experience[J]. Pediatr Blood Cancer, 2010, 55(2): 233-238. DOI:10.1002/pbc.22496 |
| [2] |
GUTSCHNER T, DIEDERICHS S. The hallmarks of cancer: a long non-coding RNA point of view[J]. RNA Biol, 2012, 9(6): 703-719. DOI:10.4161/rna.20481 |
| [3] |
LIU Y F, YAU M S, YERGES-ARMSTRONG L M, et al. Genetic determinants of radiographic knee osteoarthritis in African Americans[J]. J Rheumatol, 2017, 44(11): 1652-1658. DOI:10.3899/jrheum.161488 |
| [4] |
ZHU X Q, CHEN F, SHAO Y F, et al. Long intergenic non-protein coding RNA 1006 used as a potential novel biomarker of gastric cancer[J]. Cancer Biomark, 2017, 21(1): 73-80. DOI:10.3233/CBM-170273 |
| [5] |
ISRAELS T, PIDINI D, BORGSTEIN E, et al. Survival of children with a wilms tumor in Blantyre, Malawi[J]. Pediatr Hematol Oncol, 2018, 35(3): 196-202. DOI:10.1080/08880018.2018.1498564 |
| [6] |
VUJANIC′ G M, D'HOOGHE E, POPOV S D, et al. The effect of preoperative chemotherapy on histological subtyping and staging of Wilms tumors: The United Kingdom Children's Cancer Study Group (UKCCSG) Wilms tumor trial 3 (UKW3) experience[J]. Pediatr Blood Cancer, 2019, 66(3): e27549. DOI:10.1002/pbc.27549 |
| [7] |
PONTING C P, OLIVER P L, REIK W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4): 629-641. DOI:10.1016/j.cell.2009.02.006 |
| [8] |
QUINN J J, CHANG H Y. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47-62. DOI:10.1038/nrg.2015.10 |
| [9] |
WU Y L, WANG W J, JIANG W J, et al. An investigation of obesity susceptibility genes in Northern Han Chinese by targeted resequencing[J]. Medicine (Baltimore), 2017, 96(7): e6117. DOI:10.1097/MD.0000000000006117 |
| [10] |
ZHANG L Y, WANG Y J, ZHANG L, et al. LINC01006 promotes cell proliferation and metastasis in pancreatic cancer via miR-2682-5p/HOXB8 Axis[J]. Cancer Cell Int, 2019, 19: 320. DOI:10.1186/s12935-019-1036-2 |
| [11] |
TAY Y, RINN J, PANDOLFI P P. The multilayered complexity of Cerna crosstalk and competition[J]. Nature, 2014, 505(7483): 344-352. DOI:10.1038/nature12986 |
| [12] |
HA M J, KIM V N. Regulation of microRNA biogenesis[J]. Nat Rev Mol Cell Biol, 2014, 15(8): 509-524. DOI:10.1038/nrm3838 |
| [13] |
BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233. DOI:10.1016/j.cell.2009.01.002 |
| [14] |
HEZOVA R, KOVARIKOVA A, SROVNAL J, et al. Diagnostic and prognostic potential of miR-21, miR-29c, miR-148 and miR-203 in adenocarcinoma and squamous cell carcinoma of esophagus[J]. Diagn Pathol, 2015, 10: 42. DOI:10.1186/s13000-015-0280-6 |
| [15] |
ZHOU X, ZHAO F, WANG Z N, et al. Altered expression of miR-152 and miR-148a in ovarian cancer is related to cell proliferation[J]. Oncol Rep, 2012, 27(2): 447-454. DOI:10.3892/or.2011.1482 |
| [16] |
SAKAMOTO N, NAITO Y, OUE N, et al. MicroRNA-148a is downregulated in gastric cancer, targets MMP7, and indicates tumor invasiveness and poor prognosis[J]. Cancer Sci, 2014, 105(2): 236-243. DOI:10.1111/cas.12330 |
| [17] |
WANG S H, LI X, ZHOU L S, et al. MicroRNA-148a suppresses human gastric cancer cell metastasis by reversing epithelial-to-mesenchymal transition[J]. Tumour Biol, 2013, 34(6): 3705-3712. DOI:10.1007/s13277-013-0954-1 |
| [18] |
YU B Q, LV X, SU L P, et al. MiR-148a functions as a tumor suppressor by targeting CCK-BR via inactivating STAT3 and akt in human gastric cancer[J]. PLoS ONE, 2016, 11(8): e0158961. DOI:10.1371/journal.pone.0158961 |
| [19] |
HUANG Y S, DAI Y, YU X F, et al. Microarray analysis of microRNA expression in hepatocellular carcinoma and non-tumorous tissues without viral hepatitis[J]. J Gastroenterol Hepatol, 2008, 23(1): 87-94. DOI:10.1111/j.1440-1746.2007.05223.x |
| [20] |
BAYRAK O F, GULLUOGLU S, AYDEMIR E, et al. MicroRNA expression profiling reveals the potential function of microRNA-31 in chordomas[J]. J Neurooncol, 2013, 115(2): 143-151. DOI:10.1007/s11060-013-1211-6 |
| [21] |
WU Y, YU J, MA Y N, et al. MiR-148a and miR-375 may serve as predictive biomarkers for early diagnosis of laryngeal carcinoma[J]. Oncol Lett, 2016, 12(2): 871-878. DOI:10.3892/ol.2016.4707 |
| [22] |
ZHANG H, WANG Y, XU T M, et al. Increased expression of microRNA-148a in osteosarcoma promotes cancer cell growth by targeting PTEN[J]. Oncol Lett, 2016, 12(5): 3208-3214. DOI:10.3892/ol.2016.5050 |
| [23] |
KIM J, ZHANG Y, SKALSKI M, et al. MicroRNA-148a is a prognostic oncomiR that targets MIG6 and BIM to regulate EGFR and apoptosis in glioblastoma[J]. Cancer Res, 2014, 74(5): 1541-1553. DOI:10.1158/0008-5472.CAN-13-1449 |
| [24] |
CUI D M, SAJAN P, SHI J L, et al. MiR-148a increases glioma cell migration and invasion by downregulating GADD45A in human gliomas with IDH1 R132H mutations[J]. Oncotarget, 2017, 8(15): 25345-25361. DOI:10.18632/oncotarget.15867 |
| [25] |
CAO G, HUANG B, LIU Z, et al. Intronic miR-301 feedback regulates its host gene, ska2, in A549 cells by targeting MEOX2 to affect ERK/CREB pathways[J]. Biochem Biophys Res Comm, 2010, 396(4): 978-982. DOI:10.1016/j.bbrc.2010.05.037 |
| [26] |
TIAN L, TAO Z Z, YE H P, et al. Over-expression of MEOX2 promotes apoptosis through inhibiting the PI3K/Akt pathway in laryngeal cancer cells[J]. Neoplasma, 2018, 65(5): 745-752. DOI:10.4149/neo_2018_171218N824 |
| [27] |
OHSHIMA J, HARUTA M, ARAI Y, et al. Two candidate tumor suppressor genes, MEOX2 and SOSTDC1, identified in a 7p21 homozygous deletion region in a Wilms tumor[J]. Gene Chromosome Cancer, 2009, 48(12): 1037-1050. DOI:10.1002/gcc.20705 |
| [28] |
LIU P, KONG F, WANG J, et al. Involvement of IGF-1 and MEOX2 in PI3K/Akt1/2 and ERK1/2 pathways mediated proliferation and differentiation of perivascular adipocytes[J]. Exp Cell Res, 2015, 331(1): 82-96. DOI:10.1016/j.yexcr.2014.09.011 |
| [29] |
KWAK D H, LEE J H, KIM D G, et al. Inhibitory effects of hwangryunhaedok-Tang in 3T3-L1 adipogenesis by regulation of raf/MEK1/ERK1/2 pathway and PDK1/akt phosphorylation[J]. Evid Based Complement Alternat Med, 2013, 2013: 413906. DOI:10.1155/2013/413906 |
| [30] |
CLEVELAND-DONOVAN K, MAILE L A, TSIARAS W G, et al. IGF-I activation of the AKT pathway is impaired in visceral but not subcutaneous preadipocytes from obese subjects[J]. Endocrinology, 2010, 151(8): 3752-3763. DOI:10.1210/en.2010-0043 |
| [31] |
TSUCHIYA A, KANNO T, NISHIZAKI T. PI3 kinase directly phosphorylates Akt1/2 at Ser473/474 in the insulin signal transduction pathway[J]. J Endocrinol, 2014, 220(1): 49-59. DOI:10.1530/JOE-13-0172 |
| [32] |
CHIAPPINI P B O, DE MEDEIROS I U D, LIMA L G C, et al. Prognostic implications of phosphatidylinositol 3-kinase/AKT signaling pathway activation in gastric carcinomas[J]. Arch Med Sci, 2017, 13(6): 1262-1268. DOI:10.5114/aoms.2016.60394 |
| [33] |
LIU Z, WANG F, ZHOU Z W, et al. Alisertib induces G2/M arrest, apoptosis, and autophagy via PI3K/Akt/mTOR- and p38 MAPK-mediated pathways in human glioblastoma cells[J]. Am J Transl Res, 2017, 9(3): 845-873. |
| [34] |
WANG H, DENG X B, ZHANG J S, et al. Elevated expression of zinc finger protein 703 promotes cell proliferation and metastasis through PI3K/AKT/GSK-3β signalling in oral squamous cell carcinoma[J]. Cell Physiol Biochem, 2017, 44(3): 920-934. DOI:10.1159/000485360 |
| [35] |
GARCÍA-CARRACEDO D, VILLARONGA M Á, ÁLVAREZ-TEIJEIRO S, et al. Impact of PI3K/AKT/mTOR pathway activation on the prognosis of patients with head and neck squamous cell carcinomas[J]. Oncotarget, 2016, 7(20): 29780-29793. DOI:10.18632/oncotarget.8957 |



