2. 400038 重庆,陆军军医大学(第三军医大学):药学与检验医学系药物化学教研室
2. Department of Pharmaceutical Chemistry, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
勃起功能障碍(erectile dysfunction,ED)是泌尿男性科常见的疾病之一。随着人口老龄化的加快,ED患者正逐年增加,对老年男性的生活质量影响很大。衰老已被公认为是ED的高危影响因素[1]。磷酸二酯酶Ⅴ型抑制剂(phosphodiesterase type 5 inhibitors,PDE5Is)作为一线用药效果良好,但仍对30%~35%的患者作用欠佳[2]。阴茎海绵体平滑肌细胞(cavernous smooth muscle cells,CSMCs)舒张是阴茎勃起的关键。研究发现,老年ED发生过程中,阴茎海绵体出现了纤维化过程中CSMCs减少、胶原纤维增多[3]。目前尚无十分理想的方式逆转上述改变。ED患者阴茎组织中CSMCs减少,多数观点认为是CSMCs向成纤维细胞转化所致。
自噬是一种高度保守的细胞过程,能通过降解老化或受损的细胞器和蛋白质从而延缓衰老和预防疾病[4]。研究发现,老年患者发生ED与自噬减弱密切相关,但目前尚无抗衰老或增强自噬的理想口服药物。我们前期研究发现,老年大鼠CSMCs中mTOR(mammalian target of rapamycin)通路被激活,同时自噬水平降低[5]。二甲双胍作为治疗2型糖尿病的一线药物,被证实还有延缓衰老的能力,同时也能够通过激活AMPK诱导自噬[6]。二甲双胍是否对老年患者ED有良好防治作用,还需要进一步研究。本研究采用二甲双胍治疗老年ED大鼠,通过检测阴茎海绵体自噬及相关通路的表达,探讨二甲双胍能否通过增强阴茎海绵体组织自噬,最终改善勃起功能。以期为老年ED的治疗提供一个新的思路。
1 材料与方法 1.1 材料40只健康2月龄雄性SD大鼠(体质量250~300 g)购自陆军军医大学实验动物中心。入组前观察其与发情期雌鼠交配证实具有正常的勃起功能。一抗:p-AMPK、AMPK、p-mTOR、mTOR、p62、LC3B抗体购自Cell Signaling Technology公司;GAPDH抗体购自Santa Cruz公司。二抗:兔抗IgG Alexa Fluor 488购自Cell Signaling Technology公司;山羊抗兔(鼠)IgG HRP购自Bio-Rad公司。二甲双胍购自Aladdin Biochemical Technology公司。AMPK抑制剂compound C(dorsomorphin dihydrochloride)购自Med Chem Express公司。
1.2 方法 1.2.1 动物分组及处理大鼠等分为4组:A、B、C、D组。各组在处理之前(A组在2月龄时,其余3组在18月龄时)给予阿朴吗啡(apomorphine, APO,100 mg/kg[7])腹腔注射,暗室观察30 min,观察勃起次数用以筛选ED大鼠。无勃起的视为ED大鼠。A组大鼠均出现勃起;其余3组,每组有2只大鼠出现勃起,剩余大鼠未出现勃起。A组全部大鼠和B、C、D组的ED大鼠进行后续实验。A组(正常对照组):每日生理盐水灌胃2个月;其余3组饲养16个月后,每日处理如下:B组(ED对照组):生理盐水灌胃2个月;C组(二甲双胍组):二甲双胍生理盐水溶液(300 mg/kg[8])灌胃2个月;D组(二甲双胍+compound C组):二甲双胍生理盐水溶液(300 mg/kg)灌胃,同时给予compound C腹腔注射(0.2 mg/kg[9]),给药2个月。各组处理完毕,自由喂养1周,给予电刺激评价勃起功能。将各组大鼠麻醉后处死,截取阴茎组织,去除结缔组织,海绵体组织用PBS洗净,放入液氮保存(图 1)。

|
| A:(正常对照组);B:ED对照组;C:二甲双胍组;D:二甲双胍+compound C组 图 1 大鼠分组及实验流程示意图 |
1.2.2 电刺激测量勃起功能
大鼠腹腔注射戊巴比妥钠(45 mg/kg)麻醉,仰卧固定。下腹正中切口,暴露前列腺两侧,确认并游离部分海绵体神经以备电刺激之用。剪开覆盖在阴茎根部的皮肤暴露一侧阴茎脚,将注有250 U/mL肝素溶液的6号静脉针插入左侧阴茎海绵体,远端连接生物机能实验系统(BL-420F,成都泰盟公司)。用不锈钢电极刺激器钩住游离的海绵体神经,生理盐水湿纱布覆盖。刺激参数为电压5 V,波宽2 ms,频率25 Hz,刺激持续时间1 min;测定各组大鼠的海绵体内压(intracavernous pressure,ICP),同时穿刺颈动脉,监测平均周围动脉压(mean arterial pressure,MAP)。统计最大ICP/MAP值用于评价勃起功能。实验结束处死大鼠,小心切除受损部分,截取部分完整组织用做Masson染色、免疫荧光染色和透射电镜,余下组织液氮冻存。
1.2.3 Masson染色大鼠阴茎组织固定后冰冻切片。按Masson三色染色试剂盒说明书操作,实验重复3次。
1.2.4 免疫荧光染色大鼠阴茎组织先用4%多聚甲醛固定,再用含有蔗糖的4%多聚甲醛溶液梯度脱水。将组织进行冰冻切片,0.2%Triton室温孵育30 min,5%BSA室温封闭2 h,用稀释好的一抗(p-mTOR 1 :200)4 ℃孵育过夜,稀释的荧光二抗(兔抗IgG 1 :400),室温孵育2 h;滤纸吸干液体,滴加少量抗荧光淬灭封片液(含DAPI),盖玻片封片。实验重复3次,使用莱卡荧光显微镜观察拍照。
1.2.5 透射电镜大鼠阴茎组织用2.5%戊二醛4 ℃过夜固定。1%锇酸后固定2 h,梯度丙酮脱水,环氧树脂包埋,常规超薄切片70 nm,醋酸双氧铀和枸橼酸铅双染色,JEM1400 plus透射电镜观察拍照。每个样品随机选3个视野。
1.2.6 Western blot检测用冷PBS清洗大鼠阴茎海绵体组织,切至1 mm3左右,液氮下研磨,常规提取蛋白样品。BCA试剂盒检测蛋白浓度,30 μg蛋白上样,SDS-PAGE凝胶100 V电泳2 h,400 mA PVDF膜转膜2 h,5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜(p-AMPK 1 :1 000、AMPK 1 :1 000、p-mTOR 1 :1 000、mTOR 1 :1 000、p62 1 :1 000、LC3B 1:1 000、GAPDH 1 :2 000),TBST清洗10 min×3次,二抗室温孵育2 h [山羊抗兔(鼠)IgG HRP 1 :3 000],TBST清洗20 min×3次,ECL发光液曝光成像,Image J软件分析条带灰度值。实验重复3次。
1.3 统计学分析采用GraphPad Prism 7.0统计软件,数据以x±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey-Kramer检验,P < 0.05为差异有统计学意义。
2 结果 2.1 二甲双胍增强老年ED大鼠勃起功能给予大鼠电刺激后,收集各组大鼠平均动脉压和阴茎海绵体内压的比值作为测量勃起功能的量化指标。结果发现:与A组比较,B组大鼠ICP/MAP值明显降低(P < 0.05)。与B组比较,C组恢复了部分勃起功能(P < 0.05),但仍无法达到A组青年大鼠正常的水平(P < 0.05)。而D组与B组相比差异无统计学意义(P > 0.05,图 2)。
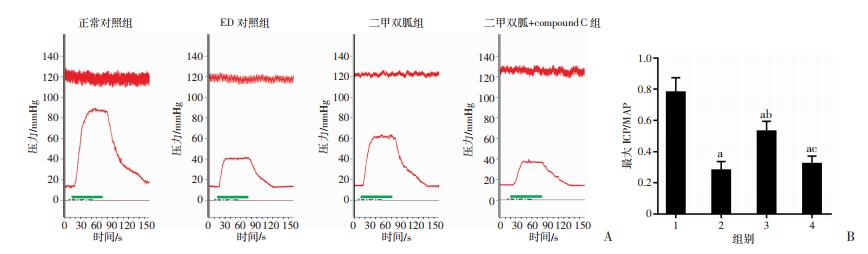
|
| A:阴茎海绵体内压(ICP)和平均动脉压(MAP)变化情况;B:最大ICP/MAP值1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组(对照组)比较;b:P < 0.05,与B组比较;c:P < 0.05,与C组比较 图 2 二甲双胍对大鼠勃起功能的影响 |
2.2 二甲双胍改善老年ED大鼠阴茎海绵体纤维化
通过Masson染色计算大鼠阴茎海绵体横截面平滑肌面积/胶原面积的值,评价纤维化情况。与A组比较,B组大鼠阴茎海绵体纤维化明显加重(P < 0.05),C组老年大鼠纤维化状况显著改善(P < 0.05),但与A组青年大鼠相比仍有差异(P < 0.05)。D组纤维化情况较A组和C组严重(P < 0.05),与B组差异无统计学意义(P > 0.05,图 3)。
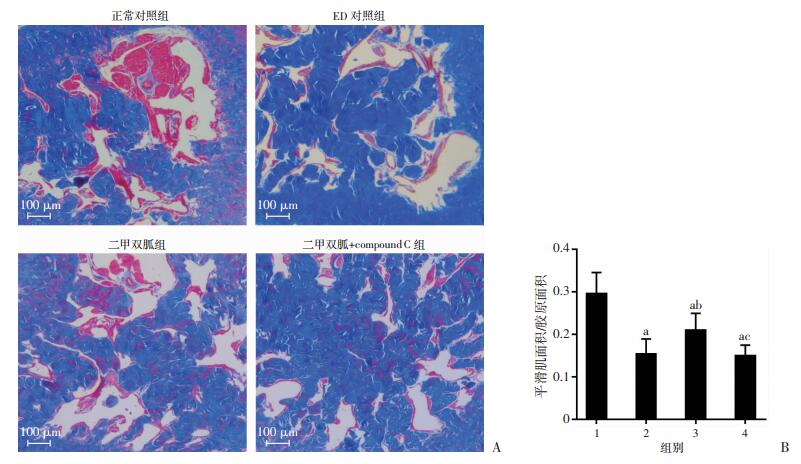
|
| A:阴茎海绵体Masson染色红色为平滑肌;蓝色为胶原;B:平滑肌面积/胶原面积1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组比较;b:P < 0.05,与B组比较;c:P < 0.05,与C组比较 图 3 二甲双胍对大鼠阴茎海绵体纤维化的影响 |
2.3 二甲双胍增强老年ED大鼠阴茎海绵体自噬
Western blot检测自噬相关指标p62蛋白、LC3-Ⅱ/ LC3-Ⅰ蛋白的表达,结果显示:与A组比较,B组p62蛋白表达水平升高(P < 0.05),LC3-Ⅱ表达降低(P < 0.05)。与B组比较,C组p62蛋白表达水平降低(P < 0.05),LC3-Ⅱ表达增加(P < 0.05);但二者仍未达到A组水平(P < 0.05)。D组p62、LC3-Ⅱ表达与B组相比差异无统计学意义;p62表达高于A组和C组(P < 0.05),LC3-Ⅱ表达低于A组和C组(P < 0.05,图 4A~C)。
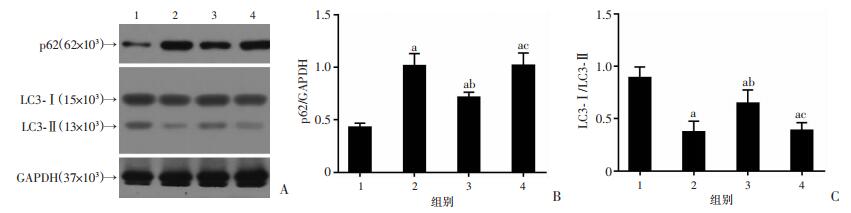
|
| 1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组比较;b:P < 0.05,与B组比较;c:P < 0.05,与C组比较 A:Western blot检测结果;B:p62相对表达量;C:LC3-Ⅱ/LC3-Ⅰ相对表达量 图 4 Western blot检测各组大鼠阴茎海绵体组织自噬相关蛋白的表达 |
统计各组大鼠阴茎海绵体组织透射电镜图片随机视野中每个CSMC自噬小体的数量。结果显示:A组可见数个聚集成团的自噬小体;C组可见单独出现的自噬小体,较A组显著减少(P < 0.05);B组和D组几乎没有发现自噬小体,均较A组和C组明显降低(P < 0.05,图 5A、B)。

|
| A:阴茎海绵体中海绵体平滑肌细胞(CSMCs)形态↑:示自噬小体;B:透射电镜下每视野中CSMCs自噬小体数量1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组比较;b:Pv0.05,与B组比较;c:P < 0.05,与C组比较 图 5 透射电镜观察各组大鼠阴茎海绵体自噬情况 |
2.4 二甲双胍上调老年ED大鼠阴茎海绵体中AMPK/mTOR通路
Western blot检测AMPK/mTOR通路中p-AMPK、p-mTOR蛋白的表达水平,结果发现:与A组比较,B组p62蛋白表达显著升高(P < 0.05),LC3-Ⅱ表达显著降低(P < 0.05)。C组较B组p62表达显著降低(P < 0.05),LC3-Ⅱ表达显著增加(P < 0.05);但二者仍未达到A组水平(P < 0.05)。D组p62蛋白、LC3-Ⅱ表达与B组差异无统计学意义(P > 0.05);p62蛋白表达显著高于A组和C组(P < 0.05),LC3-Ⅱ表达显著低于A组和C组(P < 0.05,图 6A~C)。
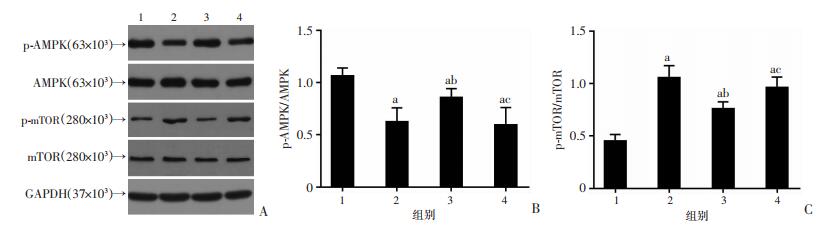
|
| 1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组比较;b:P < 0.05,与B组比较;c:P < 0.05,与C组比较 A:Western blot检测结果;B:p-AMPK/AMPK相对表达量;C:p-mTOR/mTOR相对表达量 图 6 Western blot检测各组大鼠阴茎海绵体组织AMPK/mTOR通路蛋白的表达 |
免疫荧光染色检测p-mTOR表达,结果显示:与A组比较,B组p-mTOR平均荧光强度显著升高(P < 0.05)。C组较B组p-mTOR平均荧光强度显著减少(P < 0.05),但仍高于A组(P < 0.05)。D组p-mTOR平均荧光强度与B组差异无统计学意义(P > 0.05,图 7A、B)。
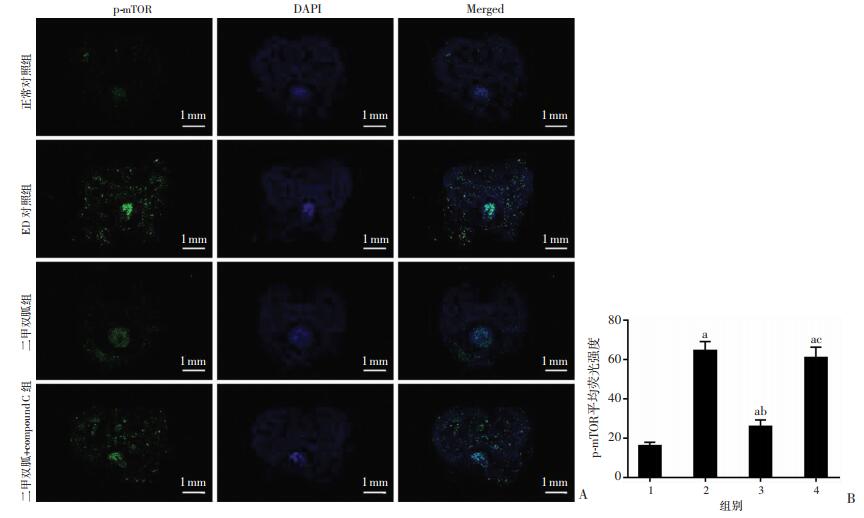
|
| A:免疫荧光染色结果;B:各组p-mTOR平均荧光强度1:A组(正常对照组);2:B组(ED对照组);3:C组(二甲双胍组);4:D组(二甲双胍+compound C组);a:P < 0.05,与A组比较;b:P < 0.05,与B组比较;c:P < 0.05,与C组比较 图 7 免疫荧光染色观测各组大鼠阴茎海绵体mTOR的表达 |
3 讨论
现阶段,ED治疗的一线方案主要是使用PDE5I[10]。但该药物只能暂时起到增强勃起功能的作用,无法从根本上改变ED患者的本质。老年ED患者中,衰老过程通过损害海绵体平滑肌细胞松弛、降低阴茎弹性、顺应性和促进纤维化来影响阴茎血流动力学,最终导致ED[1]。最新研究表明,细胞自噬与机体衰老密切相关,在衰老机制研究中,随着年龄增长,自噬功能逐渐丧失,自噬效率也相应降低[11]。近年来,已有部分研究聚焦于通过调节自噬治疗老年ED[12]。寻找一种合理安全的自噬增强剂也许可解决此问题。
二甲双胍作为目前治疗2型糖尿病的一线药物,同时也是一种AMPK和自噬激动剂[13],近年有研究报道二甲双胍具有延缓衰老和缓解ED的能力[14],同时也具有逆转纤维化的功能[15]。其可能的机制有加强内皮依赖性的血管舒张和控制交感神经活动[14],但其具体机制尚未完全阐明。本研究检测各组大鼠阴茎海绵体纤维化的情况,发现二甲双胍在一定程度上抑制了老年ED大鼠阴茎海绵体纤维化进程。其具体机制可能是通过增强自噬,抑制了成纤维细胞活性,同时增强CSMCs活性。
AMPK/mTOR信号通路在调控细胞自噬和衰老中被认为发挥了很重要的作用。AMPK和mTOR经蛋白磷酸化可调节细胞代谢与自噬水平,抑制mTOR激酶信号通路、激活AMPK信号通路都能诱导细胞自噬来延缓衰老,延长生物体寿命。有关AMPK和mTOR与ED的研究已有不少报道。一种AMPK激动剂拉帕酮(β-lapachone)对兔海绵体平滑肌有很强的松弛作用,可能对治疗ED发挥潜在作用[16]。ZHU等[17]报道低剂量冲击波联合间充质干细胞,通过PI3K/AKT/mTOR通路激活自噬,对ED有更好的治疗作用。本研究显示,与青年大鼠比较,老年ED大鼠阴茎海绵体组织中p-AMPK的表达明显降低,p-mTOR表达升高,同时伴随着自噬水平的降低。这表明衰老导致了AMPK/mTOR通路被抑制,以及随之而来的自噬缺乏。因此,AMPK/mTOR可能成为治疗ED的一个潜在靶点。
综上所述,老年大鼠勃起功能得到缓解,纤维化得到改善,可能是二甲双胍通过激活AMPK/mTOR通路,进而激活自噬导致的。本研究为治疗老年ED提供了一种可能的思路。二甲双胍联合其他药物,例如PDE5Is等是否对老年ED有更好的疗效还需要进一步研究。
| [1] |
KAYA E, SIKKA S C, KADOWITZ P J, et al. Aging and sexual health: getting to the problem[J]. Aging Male, 2017, 20(2): 65-80. DOI:10.1080/13685538.2017.1295435 |
| [2] |
LEE M, SHARIFI R. Non-invasive management options for erectile dysfunction when a phosphodiesterase type 5 inhibitor fails[J]. Drugs Aging, 2018, 35(3): 175-187. DOI:10.1007/s40266-018-0528-4 |
| [3] |
YAFI F A, JENKINS L, ALBERSEN M, et al. Erectile dysfunction[J]. Nat Rev Dis, 2016, 2: 16003. DOI:10.1038/nrdp.2016.3 |
| [4] |
GALLUZZI L, GREEN D R. Autophagy-independent functions of the autophagy machinery[J]. Cell, 2019, 177(7): 1682-1699. DOI:10.1016/j.cell.2019.05.026 |
| [5] |
ZHANG J, WU X J, ZHUO D X, et al. Effect of tankyrase 1 on autophagy in the corpus cavernosum smooth muscle cells from ageing rats with erectile dysfunction and its potential mechanism[J]. Asian J Androl, 2010, 12(5): 744-752. DOI:10.1038/aja.2010.44 |
| [6] |
BARZILAI N, CRANDALL J P, KRITCHEVSKY S B, et al. Metformin as a tool to target aging[J]. Cell Metab, 2016, 23(6): 1060-1065. DOI:10.1016/j.cmet.2016.05.011 |
| [7] |
ZHANG Z, ZHANG H Y, ZHANG Y, et al. Inactivation of the Ras/MAPK/PPARγ signaling Axis alleviates diabetic mellitus-induced erectile dysfunction through suppression of corpus cavernosal endothelial cell apoptosis by inhibiting HMGCS2 expression[J]. Endocrine, 2019, 63(3): 615-631. DOI:10.1007/s12020-018-1810-2 |
| [8] |
SILVA F H, ALEXANDRE E C, CALMASINI F B, et al. Treatment with metformin improves erectile dysfunction in a murine model of obesity associated with insulin resistance[J]. Urology, 2015, 86(2): 423.e1-423.e6. DOI:10.1016/j.urology.2015.04.035 |
| [9] |
KIM Y M, KIM M Y, KIM H J, et al. Compound C independent of AMPK inhibits ICAM-1 and VCAM-1 expression in inflammatory stimulants-activated endothelial cells in vitro and in vivo[J]. Atherosclerosis, 2011, 219(1): 57-64. DOI:10.1016/j.atherosclerosis.2011.06.043 |
| [10] |
CHEN L, STAUBLI S E, SCHNEIDER M P, et al. Phosphodiesterase 5 inhibitors for the treatment of erectile dysfunction: a trade-off network meta-analysis[J]. Eur Urol, 2015, 68(4): 674-680. DOI:10.1016/j.eururo.2015.03.031 |
| [11] |
ESCOBAR K A, COLE N H, MERMIER C M, et al. Autophagy and aging: Maintaining the proteome through exercise and caloric restriction[J]. Aging cell, 2019, 18(1): e12876. DOI:10.1111/acel.12876 |
| [12] |
TANG Z, CUI K, LUAN Y, et al. Human tissue kallikrein 1 ameliorates erectile function via modulation of macroautophagy in aged transgenic rats[J]. Andrology, 2018, 6(5): 766-774. DOI:10.1111/andr.12512 |
| [13] |
REN J, ZHANG Y. Targeting autophagy in aging and aging-related cardiovascular diseases[J]. Trends Pharmacol Sci, 2018, 39(12): 1064-1076. DOI:10.1016/j.tips.2018.10.005 |
| [14] |
PATEL J P, LEE E H, MENA C I, et al. Effects of metformin on endothelial health and erectile dysfunction[J]. Transl Androl Urol, 2017, 6(3): 556-565. DOI:10.21037/tau.2017.03.52 |
| [15] |
RANGARAJAN S, BONE N B, ZMIJEWSKA A A, et al. Metformin reverses established lung fibrosis in a bleomycin model[J]. Nat Med, 2018, 24(8): 1121-1127. DOI:10.1038/s41591-018-0087-6 |
| [16] |
BAE J H, KIM J W, KWEON G R, et al. Corpus cavernosal smooth muscle relaxation effect of a novel AMPK activator, beta-lapachone[J]. J Sex Med, 2011, 8(8): 2205-2214. DOI:10.1111/j.1743-6109.2010.01809.x |
| [17] |
ZHU G Q, JEON S H, BAE W J, et al. Efficient promotion of autophagy and angiogenesis using mesenchymal stem cell therapy enhanced by the low-energy shock waves in the treatment of erectile dysfunction[J]. Stem cells Int, 2018, 2018: 1302672. DOI:10.1155/2018/1302672 |



