2. 550004 贵阳,贵州中医药大学第二附属医院检验科;
3. 550004 贵阳,贵州省人民医院病理科
2. Department of Clinical Laboratory, the Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang, Guizhou Province, 550004;
3. Department of Pathology, Guizhou People's Hospital, Guiyang, Guizhou Province, 550004
肺癌是常见的恶性肿瘤之一,以非小细胞肺癌(non-small cell lung cancer, NSCLC)发病率最高,占据肺癌发病率的80%以上[1]。目前,NSCLC的临床治疗主要以手术切除、化疗、放疗为主,但预后不理想。自噬(autophagy),即Ⅱ型程序性死亡,是一种新的细胞程序性死亡方式,对维持细胞内环境的稳定有重要作用[2-3]。miRNA是一类内源性表达的非编码RNA,能通过与靶基因相互作用调节基因表达,参与肿瘤细胞的生物学进程[4-5]。miR-92a是miRNA家族重要成员,对多种肿瘤细胞的生物学行为有调控作用[6-7]。研究证实[8]miR-92a对NSCLC细胞的顺铂耐药性有调控作用,但其对NSCLC细胞自噬过程是否有影响尚不清楚。因此,本研究探讨miR-92a对NSCLC细胞自噬过程的影响及其可能的作用机制,以期待为肺癌的临床治疗和诊断提供新的靶点。
1 资料与方法 1.1 临床资料选取2016年1月至2018年12月贵州中医药大学第二附属医院就诊并进行手术治疗的NSCLC患者53例,术中取切除的新鲜肺癌组织标本和距癌组织5 cm以上距离的手术远端切缘的正常肺上皮组织,患者均经组织病理学确诊为NSCLC并首次进行切除手术,术前未经放疗、化疗等辅助治疗。纳入研究的患者基线资料:年龄(64.1±8.3)岁,其中≥60岁23例(43.4%),<60岁30例(56.6%);男性46例(86.8%),女性7例(13.2%)。按照国际抗癌联盟(union for international cancer control,UICC)与美国癌症联合会(American joint committee on cancer,AJCC)2017年联合发布的第8版TNM分期标准分期:Ⅰ~Ⅱ期:18例(34.0%),Ⅲ~Ⅳ期35例(66.0%);组织分化程度:低分化16例(30.2%),中高分化37例(69.8%);有淋巴结转移者22例(41.5%),无淋巴结转移者31例(58.5%)。将所取病理组织一部分用10%中性福尔马林固定,另一部分于-80℃冰箱内保存。研究进行前患者均自愿签署知情同意书。本研究于2015年12月21日通过贵州中医药大学第二附属医院医学伦理委员会批准。
1.2 实验试剂和器材人源性非小细胞肺癌A549细胞系购自中国科学院上海细胞库;miR-92a mimic、miR-92a inhibitor、miR-92a NC及miR-92a引物序列由广州锐博生物公司合成;Lipofectamine 2000、TRIzol、逆转录试剂盒购自美国Sigma公司;TRIzol、逆转录试剂盒购自美国Invitrogen公司;兔抗人p-PI3K、p-Akt、PTEN、LC3-Ⅱ一抗购自上海艾博抗贸易有限公司,鼠抗人β-actin购自碧云天生物技术有限公司;兔抗PTEN、p-PI3K、p-Akt、LC3-Ⅱ一抗购自美国Invitrogen公司。
1.3 细胞复苏与转染将冻存的A549细胞解冻、复苏,接种于含10%胎牛血清和1%双抗的1640培养液,置于37 ℃、5% CO2环境的恒温培养箱中,待其贴壁。取对数生长期细胞,胰蛋白酶消化细胞,制备单细胞悬液,调整细胞密度为2×105个/mL,接种于6孔板,继续培养24 h,待细胞汇合度达到70%左右时,按照说明书要求,用Lipofectamine2000将miR-92a类似物(miR-92a mimic)、miR-92a抑制物(miR-92a inhibitor)和阴性对照(miR-92a normal control,miR-92a NC)转染至A549细胞,Opti-MEM培养液替换常规培养液,转染8 h后换为常规培养液。
1.4 吖啶橙染色收集各组转染后细胞,按5×104个/mL接种于24孔板,每孔1 mL,培养箱中孵育48 h,用终浓度为1 mg/L的吖啶橙溶液避光染色15 min,用PBS洗涤染色后的细胞,置于倒置荧光显微镜下观察并拍照。每组设置5个复孔,取平均值。
1.5 免疫组织化学染色检测病理组织内相关蛋白表达将病理组织石蜡切片用0.3% H2O2处理标本30 min,枸橼酸钠缓冲液中加热20 min以修复抗原,加入一抗p-PI3K(1:200)、p-Akt(1:200)、LC3-Ⅱ(1:200)、PTEN(1:200),4 ℃孵育过夜,加入二抗37 ℃孵育30 min,DAB显色,苏木精复染,1%盐酸乙醇分化、脱水、封固,每批实验设立空白对照,PBS代替一抗作为阴性对照。标本染色后由经验丰富的病理科医师进行评分,采用双盲法在每张切片上随机选取5个视野,计算阳性细胞数与总细胞数的比值。实验重复3次。用双盲法在每张切片上随机选取5个视野,每个视野内计数100个细胞,根据细胞染色强度评分,无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,评分0~2为低表达,>2为高表达。
1.6 RT-PCR检测miR-92a表达取冻存的癌组织和癌旁组织于液氮预冷的研钵中研磨成粉末,加1 mL TRIzol,按说明书中所示步骤提取总RNA,行逆转录反应。取2 μL RNA进行PCR扩增:内参β-actin引物序列:正义链:5′-CGTAGGG-CTAGCCATAGCCAT-3′,反义链:5′-TGTTGCTAGCC-ATAGCAACA-3′,miR-92a引物序列:正义链:5′-TAGCGGCTAGGCTAGGCTAC-3′,反义链: 5′-TGCCAT-GCCGTTAGCTTAGC-3′,扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。取5 μL PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,Image Pro Plus 6.0分析目的基因和参比基因的条带灰度值比值。
1.7 Western blot检测细胞内相关蛋白表达将各组细胞转染48 h后,RIPA裂解液提取总蛋白,将蛋白样品加入SDS-PAGE凝胶加样孔进行电泳,使蛋白转移至PVDF膜,5%脱脂奶室温封闭2 h,TBST温和洗膜3 min后加入相对应的一抗,4 ℃孵育过夜,TBST洗涤10 min×3次,加入二抗,室温下孵育1 h,TBST洗涤10 min×3次,加入配制好的ECL发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息,图片用Image pro plus 6.0软件进行灰度分析。每个实验结果独立重复3次。
1.8 靶基因预测及双荧光素酶报告基因分析利用miRanda、TargetScan数据库预测了miR-92a的潜在靶基因,其中PTEN在miR-92a的3′UTR上有结合位点。将对数期细胞以2×105/孔的密度接种于24孔板,用LipofectamineTM 2000将荧光素酶报告载体(PTEN-3'-UTR-WT或PTEN-3'UTR-MT)与miR-92a-mimics/inhibitor/NC共转染细胞,以Renilla荧光素酶质粒(100 ng/孔)为对照,与载体共转染。转染24 h后,用双荧光素酶报告分析系统(Promega)检测荧光素酶活性。
1.9 统计学分析采用SPSS 20.0统计软件进行分析;计数资料以例(%)表示,采用χ2检验,计量资料以x±s表示,多组计量资料间的比较用单因素方差分析检验,组内两两比较用LSD-t检验。检验水准α=0.05。
2 结果 2.1 病理组织内miR-92a的表达癌组织内miR-92a的mRNA相对表达量为(0.89±0.07),癌旁肺组织内miR-92a的mRNA相对表达量为(0.25±0.01),显著低于NSCLC病理组织(P < 0.001)。
2.2 病理组织内PTEN、PI3K、p-Akt和LC3-Ⅱ蛋白表达癌组织内p-PI3K、p-Akt阳性细胞率显著高于癌旁肺组织(P < 0.001),PTEN、LC3-Ⅱ阳性细胞率显著低于癌旁肺组织(图 1、2)。
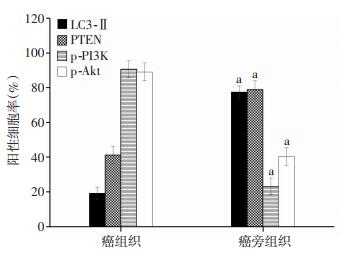
|
| a:P < 0.05,与癌组织比较 图 1 免疫组化检测PTEN、p-PI3K、p-Akt和LC3-Ⅱ在癌组织和癌旁组织中的表达 |
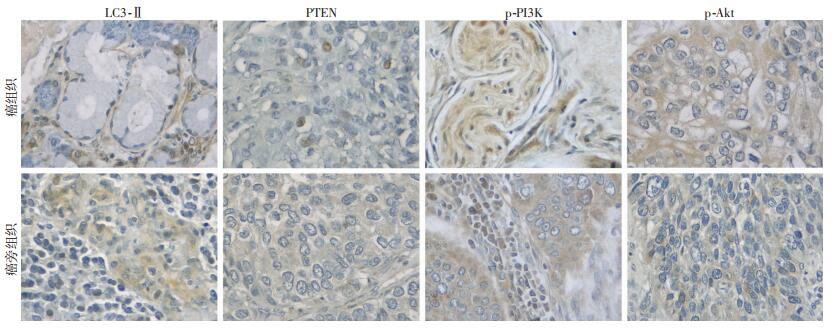
|
| 图 2 免疫组化检测PTEN、p-PI3K、p-Akt和LC3-Ⅱ在癌组织和癌旁组织中的表达(×400) |
2.3 miR-92a、PTEN和LC3-Ⅱ与患者人口学基本信息及NSCLC临床病理特征相关性
以癌组织内miR-92a的平均表达量0.89为截点将癌组织分为miR-92a高表达组和miR-92a低表达组,结果显示,miR-92a在不同性别、年龄中的表达差异无统计学意义,而在存在淋巴结转移、TNM Ⅲ~Ⅳ期及分化程度较低的病灶中,miR-92a高表达者显著多于无淋巴结转移、TNMⅠ~Ⅱ期及分化程度较高的病灶。PTEN和LC3-Ⅱ在不同性别、年龄中的表达差异无统计学意义,在存在淋巴结转移、TNM Ⅲ~Ⅳ期及分化程度较低的病灶中,PTEN、LC3-Ⅱ高表达者显著少于无淋巴结转移、TNM Ⅰ~Ⅱ期及分化程度较高的病灶。见表 1。
| 参数 | 例数(n) | miR-92a | χ2 | P | PTEN | χ2 | P | LC3-Ⅱ | χ2 | P | |||
| 高表达 | 低表达 | 高表达 | 低表达 | 高表达 | 低表达 | ||||||||
| 性别 | |||||||||||||
| 男 | 46 | 31 | 15 | 0.057 | 0.960 | 8 | 38 | 1.931 | 0.243 | 10 | 36 | 0.219 | 0.973 |
| 女 | 7 | 5 | 2 | 0 | 7 | 1 | 6 | ||||||
| 年龄 | |||||||||||||
| < 60岁 | 30 | 20 | 10 | 0.010 | 1.023 | 3 | 27 | 0.728 | 0.415 | 8 | 22 | 0.142 | 0.622 |
| ≥60岁 | 23 | 16 | 7 | 5 | 18 | 3 | 20 | ||||||
| 淋巴结转移 | |||||||||||||
| 有 | 22 | 9 | 13 | 8.301 | 0.002 | 0 | 22 | 12.301 | 0.000 | 10 | 12 | 6.320 | 0.005 |
| 无 | 31 | 27 | 4 | 8 | 23 | 1 | 30 | ||||||
| TNM分期 | |||||||||||||
| Ⅰ~Ⅱ期 | 18 | 4 | 14 | 10.964 | 0.000 | 8 | 10 | 14.39l | 0.000 | 9 | 9 | 11.032 | 0.000 |
| Ⅲ~Ⅳ期 | 35 | 32 | 3 | 0 | 35 | 2 | 33 | ||||||
| 分化程度 | |||||||||||||
| 低分化 | 16 | 16 | 0 | 6.935 | 0.000 | 6 | 10 | 7.403 | 0.000 | 7 | 9 | 9.113 | 0.000 |
| 中高分化 | 37 | 20 | 17 | 2 | 35 | 4 | 33 | ||||||
2.4 各转染组细胞内自噬溶酶体的表达
吖啶橙染色使细胞中的酸性自噬泡发出红色荧光。结果显示,转染miR-92a-mimics的细胞内有荧光微弱,有少量酸性自噬泡的存在,miR-92a-NC组细胞内荧光强度强于miR-92a-mimics,而转染miR-92a-inhibitor的细胞内荧光强度最强。见图 3。
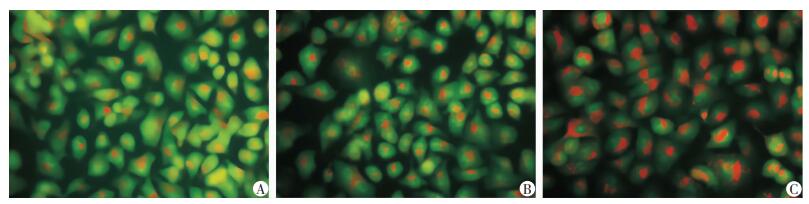
|
| 图 3 吖啶橙染色检测在A549细胞中分别共转染miR-92a mimics(A)、miR-92a NC(B)、miR-92a inhibitor(C)后细胞的自噬(×400) |
2.5 miR-92a靶基因预测
预测发现miR-92a与PTEN在3'-UTR区可能具有靶向调节关系,PTEN为miR-92a的一个潜在作用靶点。双荧光素酶报告系统结果显示,miR-92a能与PTEN基因3'-UTR结合,并抑制荧光素的表达,而在转染突变载体的细胞内没有观察到明显的荧光素酶活性改变,表明PTEN是miR-92a的直接靶向蛋白。转染了miR-92a类似物的细胞内PTEN的表达显著低于转染空白质粒组细胞(P < 0.05),而转染miR-92a抑制剂的细胞内PTEN的表达显著高于其他两组(P < 0.05,图 4)。
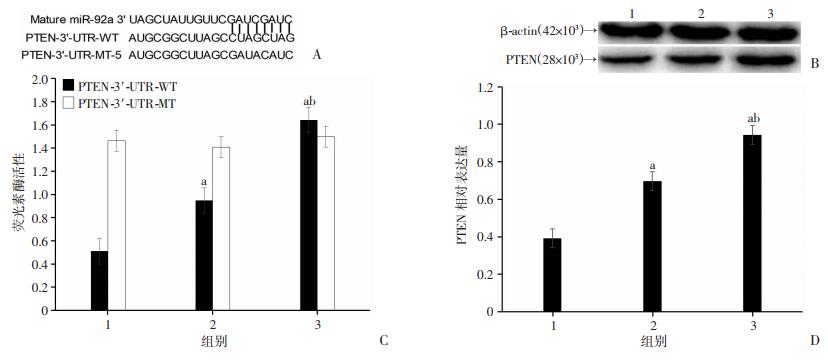
|
| A: miRanda、TargetScan数据库预测miR-92a的潜在靶基因;C:双荧光素酶报告基因实验检测在A549细胞中分别共转染miR-92a mimics、miR-92a NC、miR-92a inhibitor和PTEN-3'-UTR-WT及分别共转染miR-92a mimics、miR-92a NC、miR-92a inhibitor和PTEN-3'-UTR-MT后荧光素酶活性;B、D:Western blot检测结果与半定量分析1:miR-92a mimics组;2:miR-92a NC组;3:miR-92a inhibitor组a: P < 0.05,与miR-92a mimics组相比;b: P < 0.05,与miR-92a NC组相比 图 4 miR-92a靶基因预测和双荧光素酶报告基因实验检测及Western blot检测结果 |
2.6 各转染组细胞内p-PI3K、p-Akt、和LC3-Ⅱ的蛋白表达
miR-92a-mimics组细胞内p-Akt、p-PI3K蛋白表达显著高于其他两组(P < 0.05),LC3-Ⅱ蛋白表达显著弱于其他两组(P < 0.05),miR-92a-inhibitor组细胞内p-Akt、p-PI3K蛋白表达显著弱于其他两组(P < 0.05),LC3-Ⅱ蛋白表达显著高于其他两组(P < 0.05,图 5)。
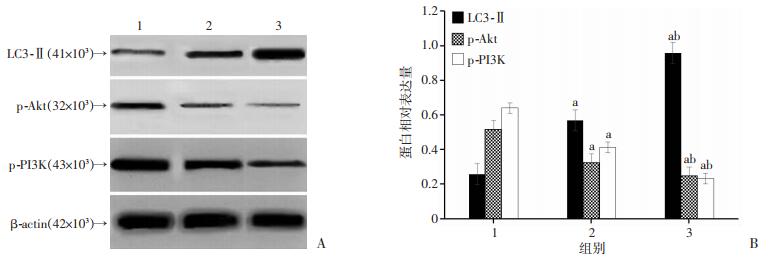
|
| A: Western blot检测结果;B:半定量分析1:miR-92a mimics组;2:miR-92a NC组;3:miR-92a inhibitor组;a: P < 0.05,与miR-92a mimics组相比;b: P < 0.05,与miR-92a NC组相比 图 5 Western blot检测在A549细胞中分别共转染miR-92a mimics、miR-92a NC、miR-92a inhibitor后p-PI3K、p-Akt和LC3-Ⅱ的蛋白表达 |
3 讨论
miR-92a属于miIR-17-92a家族成员,作为癌基因或抑癌基因在多种恶性肿瘤的发生、发展中发挥作用。WANG等[6]报道miR-92a在肝癌中发挥原癌基因的作用;CHEN等[7]证实miR-92a在食管鳞癌中呈高表达。本研究发现,miR-92a在癌组织内的表达显著高于正常肺组织,且在TNM分期较高、存在淋巴结转移、低分化的病理组织内呈现异常高表达,这一结果与ZHU等[9]的研究结果是一致的,提示miR-92a在NSCLC中可能作为癌基因发挥作用。
细胞自噬是细胞非选择性的降解,在肿瘤形成初期,自噬能阻止影响正常细胞的各种退行性过程,抑制肿瘤的发展[10-11]。ZHOU等[12]证实miR-92a通过FBXW7调控胶质瘤细胞的自噬,但对NSCLC细胞的自噬是否有调控作用尚未可知。LC3-Ⅱ(Microtubule-associated protein 1A/1B light chain 3)蛋白位于自噬小体细胞质表面,是自噬小体形成的标志,也是自噬研究中常用的标志物[13]。本研究发现,癌组织内LC3-Ⅱ表达低于正常组织,其在TNM分期较高、存在淋巴结转移、低分化的病理组织内呈现异常低表达,提示在NSCLC的发展过程中自噬小体生成减少,自噬活性降低,推动了癌症的进展。这与孙雨晴等[14]的研究结果基本一致。同时,体外实验证实,在miR-92a高表达的细胞内,自噬溶酶体数量很少,LC3-Ⅱ蛋白表达很弱,抑制miR-92a表达后,自噬溶酶体大量生成,LC3-Ⅱ蛋白表达显著增加,以上实验结果提示,miR-92a可能是通过抑制肺癌细胞的自噬活性而发挥癌基因的作用。
为了进一步探讨miR-92a抑制肺癌细胞的自噬活性的可能的作用机制,本研究检测了其与第10号染色体缺失的磷酸酶和张力蛋白同源基因(PTEN)是否存在靶向关系。PTEN是一种重要的抑癌基因,能通过负向调控PI3K/Akt信号通路活性而对肿瘤细胞的增殖、凋亡、自噬等生物学活性产生影响。ZHAO等[15]报道吉非替尼能通过阻断该通路活性而诱导肺癌细胞的自噬和凋亡,从而起到抑制肿瘤的作用,另有研究证实[16-17],阻断该通路能促进肿瘤细胞自噬,而激活该通路能抑制肿瘤细胞的自噬。赵靓等[18]研究发现,miR-92a能靶向PTEN/Akt信号通路对鼻咽癌细胞的增殖与凋亡产生影响,王秀等[19]报道miR-92a可能通过抑制直肠癌细胞PTEN的表达发挥促进结直肠癌血管新生,从而影响结肠癌患者的预后,本研究发现,miR-92a在NSCLC细胞中,能靶向抑制PTEN的表达,继而上调PI3K/Akt通路活性,引发其下游活化蛋白表达的增加。
综上,miR-92a在NSCLC中发挥癌基因的作用,可能与抑制NSCLC细胞的自噬有关,而这种抑制作用可能是通过靶向PTEN,从而激活PI3K/Akt信号通路的活性而实现的。
| [1] |
田崇梅, 夏道宗, 邢梦雨, 等. 亚硒酸钠通过Keap1/Nrf2/ARE信号通路诱导人肺腺癌A549细胞凋亡[J]. 中国药理学通报, 2019, 35(2): 181-186. TIAN C M, XIA D Z, XING M Y, et al. Sodium selenite induced human lung cancer A549 cells apoptosis through Keap1/Nrf2/ARE signaling pathway[J]. Chin Pharmacol Bull, 2019, 35(2): 181-186. DOI:10.3969/j.issn.1001-1978.2019.02.008 |
| [2] |
LU H Y, CHANG Y J, FAN N C, et al. Synergism through combination of chemotherapy and oxidative stress-induced autophagy in A549 lung cancer cells using redox-responsive nanohybrids: a new strategy for cancer therapy[J]. Biomaterials, 2015, 42: 30-41. DOI:10.1016/j.biomaterials.2014.11.029 |
| [3] |
LI Y J, LEI Y H, YAO N, et al. Autophagy and multidrug resistance in cancer[J]. Chin J Cancer, 2017, 36(1): 52. DOI:10.1186/s40880-017-0219-2 |
| [4] |
MINGARDI J, MUSAZZI L, DE PETRO G, et al. MiRNA editing: new insights into the fast control of gene expression in health and disease[J]. Mol Neurobiol, 2018, 55(10): 7717-7727. DOI:10.1007/s12035-018-0951-x |
| [5] |
LU T X, ROTHENBERG M E. MicroRNA[J]. J Allergy Clin Immunol, 2018, 141(4): 1202-1207. DOI:10.1016/j.jaci.2017.08.034 |
| [6] |
WANG L, WU J H, XIE C G. MiR-92a promotes hepatocellular carcinoma cells proliferation and invasion by FOXA2 targeting[J]. Iran J Basic Med Sci, 2017, 20(7): 783-790. DOI:10.22038/IJBMS.2017.9010 |
| [7] |
CHEN Z L, ZHAO X H, WANG J W, et al. MicroRNA-92a promotes lymph node metastasis of human esophageal squamous cell carcinoma via E-cadherin[J]. J Biol Chem, 2011, 286(12): 10725-10734. DOI:10.1074/jbc.M110.165654 |
| [8] |
ZHAO J, FU W F, LIAO H Y, et al. The regulatory and predictive functions of miR-17 and miR-92 families on cisplatin resistance of non-small cell lung cancer[J]. BMC Cancer, 2015, 15: 731. DOI:10.1186/s12885-015-1713-z |
| [9] |
ZHU Q, ZANG Q, JIANG Z M. Enhanced expression of non coding miR 92a expression is implicated in the development of lung cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22(4): 1028-1034. DOI:10.26355/eurrev_201802_14385 |
| [10] |
MATTEONI S, ABBRUZZESE C, MATARRESE P, et al. The kinase inhibitor SI113 induces autophagy and synergizes with quinacrine in hindering the growth of human glioblastoma multiforme cells[J]. J Exp Clin Cancer Res, 2019, 38(1): 202. DOI:10.1186/s13046-019-1212-1 |
| [11] |
MAITI P, PERUZZARO S, KOLLI N, et al. Transplantation of mesenchymal stem cells overexpressing interleukin-10 induces autophagy response and promotes neuroprotection in a rat model of TBI[J]. J Cell Mol Med, 2019, 23(8): 5211-5224. DOI:10.1111/jcmm.14396 |
| [12] |
ZHOU C Y, SHEN L F, MAO L, et al. MiR-92a is upregulated in cervical cancer and promotes cell proliferation and invasion by targeting FBXW7[J]. Biochem Biophys Res Commun, 2015, 458(1): 63-69. DOI:10.1016/j.bbrc.2015.01.066 |
| [13] |
RUNWAL G, STAMATAKOU E, SIDDIQI F H, et al. LC3-positive structures are prominent in autophagy-deficient cells[J]. Sci Rep, 2019, 9(1): 10147. DOI:10.1038/s41598-019-46657-z |
| [14] |
孙雨晴, 程朋朋, 於海洋, 等. 自噬相关蛋白及基因在非小细胞肺癌中的表达及其意义[J]. 中国呼吸与危重监护杂志, 2019, 18(5): 447-451. SUNY Q, CHENG P P, YU H Y, et al. Expression of autophagy-related proteins and genes in patients with non-small cell lung cancer[J]. Chin J Respir Crit Care Med, 2019, 18(5): 447-451. DOI:10.7507/1671-6205.201811038 |
| [15] |
ZHAO Z Q, YU Z Y, LI J, et al. Gefitinib induces lung cancer cell autophagy and apoptosis via blockade of the PI3K/AKT/mTOR pathway[J]. Oncol Lett, 2016, 12(1): 63-68. DOI:10.3892/ol.2016.4606 |
| [16] |
DATTA K, SUMAN S, FORNACE A J Jr. Radiation persistently promoted oxidative stress, activated mTOR via PI3K/Akt, and downregulated autophagy pathway in mouse intestine[J]. Int J Biochem Cell Biol, 2014, 57: 167-176. DOI:10.1016/j.biocel.2014.10.022 |
| [17] |
WANG C, ZHANG X, TENG Z P, et al. Downregulation of PI3K/Akt/mTOR signaling pathway in curcumin-induced autophagy in APP/PS1 double transgenic mice[J]. Eur J Pharmacol, 2014, 740: 312-320. DOI:10.1016/j.ejphar.2014.06.051 |
| [18] |
赵靓, 吴堂兵, 夏春军, 等. 微小RNA-92a靶向PTEN/Akt信号通路对鼻咽癌细胞增殖与凋亡的影响[J]. 临床肿瘤学杂志, 2017, 22(8): 673-677. ZHAO L, WU T B, XIA C J, et al. Effect of miR-92a targeting PTEN/Akt signaling pathway on proliferation and apoptosis of nasopharyngeal carcinoma cells[J]. Chin Clin Oncol, 2017, 22(8): 673-677. DOI:10.3969/j.issn.1009-0460.2017.08.001 |
| [19] |
王秀, 杜冀晖, 黄虞, 等. miR-92a在结直肠癌中的表达及其对肿瘤血管生成的作用[J]. 中国肿瘤临床, 2016, 43(6): 223-227. WANG X, DU J H, HUANG Y, et al. Expression of miR-92a in colorectal cancer and its effect on tumor angiogenesis[J]. Chin J Clin Oncol, 2016, 43(6): 223-227. DOI:10.3969/j.issn.1000-8179.2016.06.012 |



