2. 400038 重庆,陆军军医大学 野战外科研究所第二研究室
2. Second Research Department, Institute of Surgery Research, Army Medical University (Third Military Medical University), Chongqing, 400038, China
失血休克是创伤后45岁以下人群的第一位死因,其发生率及死亡率居高不下[1-2]。创伤失血所致机体循环血量减少,组织缺血缺氧,以及体温降低,易引起“致死三联症”即“低体温、凝血障碍、酸中毒”,是创伤失血后重要病理生理过程,也是导致器官功能损伤甚至死亡的重要原因[3-4]。海上冲突是我国未来主要的作战方向,此外海上作业事故也时常发生。伤员遭受到低温海水、失血带来的双重打击,其“致死三联征”及器官功能障碍的发生与常规环境有何差异,目前不清楚。为此,本实验构建了大鼠创伤失血休克合并低温海水浸泡模型,观察低温海水浸泡对失血休克大鼠的致死三联征、器官功能障碍、存活时间的影响,为低温海水浸泡合并失血休克损伤的早期救治提供实验依据。
1 材料与方法 1.1 实验动物及分组SPF级SD大鼠128只,雄性,12-14周龄,体质量(220±20)g,禁食过夜,自由饮水,由陆军特色医学中心实验动物中心提供。采用随机数字表法分为4组,每组32只,分别是正常对照组(Ctl组)、失血休克组(Shock组)、单纯海水浸泡组(Sea组)、海水浸泡合并失血休克组(Sea-Shock组),大鼠饲养与实验过程中严格遵守实验动物管理与保护准则。
1.2 实验方法 1.2.1 人工海水配置采用国家海洋局第三研究所配方,海盐浓度为2.535%。其主要指标:渗透压(12 501±1.52) mmol/L,pH 8.2,钠离子浓度(630±5.33)mmol/L,钾离子浓度(10.88±0.68)mmol/L,氯离子浓度(658.8±5.25)mmol/L,海水温度15 ℃。
1.2.2 动物模型制备SD大鼠用3%戊巴比妥钠(30~50 mg/kg)腹腔注射麻醉,右颈动脉插管用于放血,同侧颈总动脉放置温度探头测定核心体温。大鼠稳定10 min后,海水浸泡合并失血休克组大鼠浸泡入15 ℃的人工海水,保持其正常呼吸,自大鼠入水起开始放血,40 min内将失血量放至全身血量的40%,持续浸泡2 h,取出后4 h检测血气分析、凝血功能及心脏功能、肝脏功能、肾脏功能,并观察大鼠72 h存活情况;单纯失血休克组仅进行40%控制性失血处理;单纯海水浸泡组仅进行低温海水浸泡处理;正常对照组插管后直接指标检测。
1.3 观察指标 1.3.1 血液指标检测大鼠出水后4 h,分别抽取0.5 mL动脉血用于血气分析[酸碱度(potential of hydrogen, PH)、二氧化碳分压(partial pressure of carbon dioxide, PCO2)、剩余碱(base excess,BE)、HCO3-];3 mL动脉血送陆军特色医学中心检验科检测凝血功能[血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、国际标准化比值(international normalized ratio,INR)、纤维蛋白原(fibrinogen、FIB)];5 mL动脉血用于检测肝脏功能[谷草转氨酶(aspartate aminotrans-ferase,AST)、谷丙转氨酶(alanine transaminase,ALT)、总胆红素(total bilirubin,TBIL)]、肾脏功能[尿素(urease,urea)、血肌酐(serum creatinine,Crea)]、心脏功能[乳酸脱氢酶(lactate dehydrogenase,LDH)、磷酸肌酸同工酶MB (Creatine phosphokinase-isoenzyme-MB,CK-MB)、肌钙蛋白T(troponinc-T,TnT)]。
1.3.2 大鼠存活时间和存活率观察造模成功后,结扎颈动脉,缝合肌肉层和皮肤层。分别于休克前、放血后给予肌肉注射(10万U/kg)青霉素、链霉素,观察大鼠72 h内的存活时间和存活率。
1.4 统计分析采用SPSS19.0统计软件分析数据,计量资料以x±s表示,多组间比较采用单因素方差分析,方差齐采用LSD进行多重比较。生存率分析采用Kaplan-Meier法进行分析,各组间的差异用long-rank验证。以P < 0.05为差异有统计学意义。
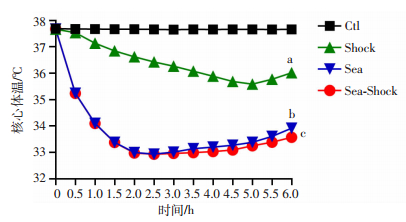
2 结果 2.1 低温海水浸泡合并失血休克大鼠致死三联征的发生情况 2.1.1 核心体温40%失血休克后大鼠的核心体温缓慢降低,最终波动在36 ℃左右;单纯低温海水浸泡后大鼠的核心体温在浸泡60 min内呈现断崖式下降,体温从37.7 ℃降至34 ℃左右,随后核心体温下降幅度趋缓,出水后4 h内未明显回升(与失血休克组比较,P < 0.05);海水浸泡合并失血休克大鼠的核心体温下降趋势与单纯低温海水浸泡相似,但下降幅度更显著,核心体温仅维持在33 ℃(与单纯低温海水浸泡组比较,P < 0.05, 图 1)。
|
|
Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组 a:P < 0.05,与正常对照组比较;b:P < 0.05,与40%失血休克组比较;c:P < 0.05,与单纯低温海水浸泡组比较 图 1 低温海水浸泡合并失血休克大鼠的核心体温 |
2.1.2 酸中毒
40%失血休克后大鼠的PH轻微增高;单纯低温海水浸泡后大鼠PH降至7.30,显著低于单纯失血休克大鼠,呈代谢性酸中毒状态;低温海水浸泡合并失血休克后大鼠酸中毒程度最严重,PH、PCO2、HCO3、BE分别降至7.17、24.75 mmHg、14.03 mmol/L、15.01,较单纯海水浸泡组存在显著性差异(P < 0.05, 表 1)。
| 分组 | PH | PCO2 /mmHg |
HCO3- /mmol·L-1 |
BE |
| Ctl组 | 7.37±0.08 | 39.70±6.03 | 25.53±0.63 | 2.09±0.82 |
| Shock组 | 7.49±0.04a | 24.98±3.26a | 19.96±2.99a | -7.09±3.64a |
| Sea组 | 7.30±0.13b | 34.60±10.28b | 17.22±1.96ab | -10.62±3.89ab |
| Sea-Shock组 | 7.17±0.13abc | 24.75±7.58ac | 14.03±2.85abc | -15.01±4.19abc |
| Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组 a:P < 0.05,与正常对照组比较;b:P < 0.05,与40%失血休克组比较;c:P < 0.05,与单纯低温海水浸泡组比较 |
||||
2.1.3 凝血功能
与正常对照组比较,40%失血休克组大鼠的APTT、PT明显延长,INR显著增高,FIB异常降低(P 0.05);与单纯失血休克比较,单纯低温海水浸泡大鼠的凝血指标均有显著差异(P 0.05);低温海水浸泡合并失血休克大鼠凝血功能障碍情况最为严重,其中INR、PT、APTT、FIB可达1.78、29.59 s、81.15 s、0.44,与其余三组均有显著性差异, (P < 0.05,见表 2)。
| 分组 | INR | PT/s | APTT/s | FIB/g·L-1 |
| Ctl组 | 1.00±0.08 | 10.96±1.28 | 1.83±2.78 | 1.03±0.16 |
| Shock组 | 1.32±0.11a | 18.66±4.12a | 46.96±7.66a | 0.70±0.14a |
| Sea组 | 1.60±0.15ab | 25.61±4.83ab | 73.91±7.61ab | 0.53±0.15ab |
| Sea-Shock组 | 1.78±0.17abc | 29.59±6.28ab | 81.15±8.85ab | 0.44±0.11ab |
| Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组 a:P < 0.05,与正常对照组比较;b:P < 0.05,与40%失血休克组比较;c:P < 0.05,与单纯低温海水浸泡组比较 |
||||
2.2 低温海水浸泡合并失血休克对大鼠心脏功能的影响
40%失血休克后大鼠的心脏功能部分损伤,表现为CK-MB、LDH升高(P < 0.05);单纯低温海水也可导致大鼠心脏功能受损,与失血休克组比较,海水浸泡大鼠的心损指标明显增高,其中LDH、cTnT差异有统计学意义(P < 0.05)。低温海水浸泡可导致失血休克大鼠的心脏功能严重受损,心损指标(CK-MB、LDH、cTnT)分别增至4 730.51 U/L、2 465.00 U/L、8.68 μg/L(见表 3)。
| 分组 | CK-MB/U·L-1 | LDH/U·L-1 | cTnT/μg·L-1 |
| Ctl组 | 622.61±102.81 | 165.46±31.56 | 0.02±0.01 |
| Shock组 | 2 468.09±612.50a | 751.05±361.89a | 0.31±0.09 |
| Sea组 | 3 215.94±781.09a | 2 508.66±672.75ab | 6.35±2.53ab |
| Sea-Shock组 | 4 730.51±1273.36abc | 2 465.00±627.90ab | 8.68±1.76abc |
| Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组 a:P < 0.05,与正常对照组比较;b:P < 0.05,与40%失血休克组比较;c:P < 0.05,与单纯低温海水浸泡组比较 |
|||
2.3 低温海水浸泡合并失血休克对大鼠肝、肾功能的影响
40%失血休克后大鼠的肝脏、肾脏功能指标明显升高,其中ALT、AST、Urea、Crea均高于正常对照组(P < 0.05);低温海水浸泡导致大鼠的肝脏、肾脏指标升高,与40%失血休克组比较,单纯低温海水浸泡大鼠的肝功能受损最严重,ALT、AST、TBIL均明显增高(P < 0.05);低温海水浸泡合并失血休克大鼠的肝脏、肾脏功能指标均明显增高,其中肝功指标增高更显著,AST甚至增高至正常值的6倍左右,较单纯低温海水浸泡组差异有统计学意义(P < 0.05,表 4)。
| 分组 | AST/U·L-1 | ALT/U·L-1 | TBIL/μmol·L-1 | Urea/mmol·L-1 | Crea/μmol·L-1 |
| Ctl组 | 85.90±8.14 | 40.41±9.22 | 5.48±0.88 | 5.50±0.75 | 17.28±1.69 |
| Shock组 | 305.23±94.41a | 77.26±20.70a | 6.45±0.80 | 13.43±2.76a | 41.23±14.59a |
| Sea组 | 384.90±82.60ab | 117.90±23.08ab | 10.84±1.66ab | 11.41±1.38ab | 43.75±16.43a |
| Sea-Shock组 | 480.63±65.20abc | 124.85±22.49ab | 10.23±1.33ab | 8.46±1.62abc | 52.14±10.02a |
| Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组a:P < 0.05,与正常对照组比较;b:P 0.05,与40%失血休克组比较;c:P < 0.05,与单纯低温海水浸泡组比较 | |||||
2.4 低温海水浸泡合并失血休克大鼠的存活时间及存活率
40%失血休克后大鼠72 h存活率为87.5%,平均存活时间为66.6 h;单纯低温海水浸泡也可导致大鼠的死亡,其72 h存活率降低至81.25%;低温海水浸泡严重影响失血休克损伤大鼠存活:仅3只大鼠存活超过72 h,平均存活时间缩短至21.7 h(P < 0.05,图 2)。

|
|
Ctl:正常对照组;Shock:40%失血休克组;Sea:单纯低温海水浸泡组;Sea-Shock:低温海水浸泡合并失血休克组 a:P < 0.05,与正常对照组比较;b:P < 0.05,与单纯低温海水浸泡组比较 图 2 低温海水浸泡合并失血休克大鼠的存活率(A)和存活时间(B) |
3 讨论
本研究发现低温和失血带来的双重打击,导致低温海水浸泡合并失血休克大鼠的循环血量减少、组织缺血缺氧,引起“致死三联征”高发、重要脏器严重受损,死亡率明显增高。既往研究[5-7]关注的重点是由内毒素、炎症或缺血缺氧诱导的全身性炎症反应对器官功能的影响。而本实验发现低温海水浸泡合并失血休克大鼠的器官功能损伤与“致死三联征”存在关联性,两者可相互作用导致死亡率增高。
低温海水浸泡导致失血休克大鼠的“致死三联征”的程度非常重,但相关研究较少。低体温是海水浸泡伤的一个重要特点[8],本研究中低温海水浸泡处理大鼠的核心体温在浸泡后呈断崖式下降,其主要原因是水的高比热和热传导率[9],导致体温快速降低;而降低的核心体温又会导致体温调节中枢失灵,机体代偿机制无法发挥作用,形成恶性循环[10]。本研究中PH、PCO2、HCO3、BE都显著降低,机体呈酸中毒状态,其主要原因是低温和失血导致机体循环血量锐减,组织灌注不足,缺血缺氧加重[3, 11],为满足机体需求,无氧代谢占据主导,引起酸性产物堆积[12]。同时,酸中毒也可以直接损伤血管内皮细胞,启动外源性凝血系统,消耗凝血因子及血小板,加速血栓形成,引起凝血功能障碍[13-14],符合本实验中PT时间延长。低体温在与凝血功能障碍的关系中同样占据主导地位,其主要机制是:核心体温降低可导致凝血因子活性降低,凝血级联反应中FIB的反应速度减慢,并将血小板隔离在肝脏,抑制其功能,导致FIB与血小板无法有效结合,从而引起凝血功能障碍[3, 15-17],与本研究中APTT、PT明显延长,INR显著增高,FIB异常降低现象相符。然而,低温海水浸泡合并失血休克损伤中究竟是何种因素主导“致死三联征”的发生,仍需进一步研究。
本研究中海水浸泡合并失血休克大鼠的心、肝、肾功能指标明显升高,重要脏器功能出现严重损害。既往认为海水浸泡伤的器官功能损害完全来自循环血量不足[18],然而本研究发现在器官功能损伤过程中,“致死三联征”同样起到非常重要作用[19]。其原因可能是,凝血功能障碍可引起大量纤维蛋白生成、沉积,重要脏器的血管内微血栓广泛形成,诱发多脏器功能受损[20-21]。相关病理结果[8, 18]显示,微血管内大量血栓形成,心间质充血、水肿;肝窦瘀血、间质散在出血;肾小球肿胀,肾小管斑片状坏死等。同时某些参与凝血的因子本身也是炎性介质,可以通过其他途径加重器官功能损伤[22-23]。并且低体温引起的缺氧、酸中毒也可激活凝血系统,加速血栓形成,影响脏器功能[13-14, 24]。同时重要脏器功能受损后,机体产能降低,核心体温难以维持,蛋白合成减少,凝血酶缺乏,酸性产物无法顺利代谢,机体进入恶性循环[1, 14, 25]。
低温海水浸泡导致失血休克大鼠致死三联征高发、器官功能严重受损,死亡率增高。及早给予有效的复温、补液、稳定内环境、保护器官功能等措施可有效降低死亡率。然而,目前关于此类患者的救治措施研究不足。既往认为,低体温患者应快速复温,但该方法易导致复温性休克,加重患者损伤;而且常用的液体在此类患者中复苏效果不佳,探索更加有效的复温方案及复苏液体将是我们下一步研究的主要方向。
| [1] |
李小刚, 张牧. 创伤失血性休克诊治中的低体温管理[J]. 中华急诊医学杂志, 2018, 27(11): 1191-1194. LI X G, ZHANG M. Management of hypothermia in the diagnosis and treatment of traumatic hemorrhagicshock[J]. Chin J Emerg Med, 2018, 27(11): 1191-1194. DOI:10.3760/cma.j.issn.1671-0282.2018.11.002 |
| [2] |
刘良明. 创伤失血性休克早期救治规范解读[J]. 创伤外科杂志, 2017, 19(12): 884-887. LIU L M. Interpretation of early treatment of traumatic hemorrhagic shock[J]. J Trauma Surg, 2017, 19(12): 884-887. DOI:10.3969/j.issn.1009-4237.2017.12.002 |
| [3] |
齐志伟, 于学忠. 多发伤的治疗进展[J]. 中国急救医学, 2010, 30(3): 208-211. QI Z W, YU X Z. Progress in the treatment of multiple trauma[J]. Chin J Crit Care Med, 2010, 30(3): 208-211. DOI:10.3969/j.issn.1002-1949.2010.03.005 |
| [4] |
张为, 赵晓东. 创伤失血性休克中的液体复苏[J]. 中华急诊医学杂志, 2019, 28(2): 144-147. ZHANG W, ZHAO X D. Fluid resuscitation in traumatic hemorrhagicshock[J]. Chin J Emerg Med, 2019, 28(2): 144-147. DOI:10.3760/cma.j.issn.1671-0282.2019.02.003 |
| [5] |
冯冬梅, 赵自刚, 牛春雨. 炎症反应在重症休克后多器官损伤中的作用[J]. 中国老年学杂志, 2016, 36(16): 4119-4121. FENG D M, ZHAO Z G, NIU C Y. Role of inflammatory response in multiple organ injury after severe shock[J]. Chin J Gerontol, 2016, 36(16): 4119-4121. DOI:10.3969/j.issn.1005-9202.2016.16.116 |
| [6] |
薛明, 谢剑锋. 感染性休克的复苏目标:从血流动力学到细胞与器官[J]. 医学研究生学报, 2017, 30(10): 1108-1111. XUE M, XIE J F. Resuscitation goals of septic shock: from hemodynamics to cells and organs[J]. J Med Postgraduates, 2017, 30(10): 1108-1111. DOI:10.16571/j.cnki.1008-8199.2017.10.021 |
| [7] |
栾樱译, 姚咏明. 创伤失血性休克诊治中的病理生理机制[J]. 中华急诊医学杂志, 2018, 27(11): 1189-1191. LUAN Y Y, YAO Y M. Pathophysiology in the diagnosis and treatment of traumatic hemorrhagic shock[J]. Chin J Emerg Med, 2018, 27(11): 1189-1191. DOI:10.3760/cma.j.issn.1671-0282.2018.11.001 |
| [8] |
程浩, 奂剑波, 陈丽娜, 等. 长时程海水浸泡体温过低大鼠的病理学和血液学观察[J]. 中华航海医学与高气压医学杂志, 2018, 25(5): 281-288. CHENG H, HUAN J B, CHEN L N, et al. Observation on the pathological and hematological parameters of the rats with hypothermia induced by prolonged seawater immersion[J]. Chin J Naut Med Hyperb Med, 2018, 25(5): 281-288. DOI:10.3760/cma.j.issn.1009-6906.2018.05.002 |
| [9] |
李恒宇, 杨兴东. 落水伤员体温过低的研究进展[J]. 海军总医院学报, 2005, 18(3): 165-169. LI H Y, YANG X D. Research progress on hypothermia of the wounded[J]. J Nav Gen Hosp PLA, 2005, 18(3): 165-169. DOI:10.3969/j.issn.1009-3427.2005.03.012 |
| [10] |
于晓凤, 任辉, 张翠华. 创伤失血性休克自发性低体温的研究进展[J]. 局解手术学杂志, 2015, 24(2): 206-208. YU X F, REN H, ZHANG C H. Summary of hypothermia in hemorrhagic traumatic shock[J]. J Reg Anat Oper Surg, 2015, 24(2): 206-208. DOI:10.11659/jjssx.12E014034 |
| [11] |
杜薇, 刁玉刚, 周锦, 等. 低温环境暴露对失血性休克猪全麻期间血流动力学和氧代谢的影响[J]. 中华麻醉学杂志, 2017, 37(2): 247-250. DU W, DIAO Y G, ZHOU J, et al. Effect of environmental hypothermia exposure on hemodynamics and oxygen metabolism during general anesthesia in a pig model of hemorrhagic shock[J]. Chin J Anesthesiol, 2017, 37(2): 247-250. DOI:10.3760/cma.j.issn.0254-1416.2017.02.031 |
| [12] |
BUSE S, BLANCHER M, VIGLINO D, et al. The impact of hypothermia on serum potassium concentration: a systematicreview[J]. Resuscitation, 2017, 118: 35-42. DOI:10.1016/j.resuscitation.2017.07.003 |
| [13] |
乔沐, 冯杰. 严重创伤休克患者的损伤控制性复苏治疗[J]. 世界最新医学信息文摘, 2018, 18(28): 52-53. QIAO M, FENG J. Injury-controlled resuscitation in severe traumatic shock patients[J]. World Latest Med Inf, 2018, 18(28): 52-53. DOI:10.19613/j.cnki.1671-3141.2018.28.021 |
| [14] |
海霖, 余姣. 失血性休克致死性三联征的筛查及救治[J]. 中国急救医学, 2019, 39(7): 700-703. HAI L, YU J. Screening and treatment of lethal triad of hemorrhagic shock[J]. Chin J Crit Care Med, 2019, 39(7): 700-703. DOI:10.3969/j.issn.1002-1949.2019.07.018 |
| [15] |
LILITSIS E, XENAKI S, ATHANASAKIS E, et al. Guiding management in severe trauma: reviewing factors predicting outcome in vastly injured patients[J]. J Emerg Trauma Shock, 2018, 11(2): 80-87. DOI:10.4103/JETS.JETS_74_17 |
| [16] |
DE VRIJ E L, VOGELAAR P C, GORIS M, et al. Platelet dynamics during natural and pharmacologically induced torpor and forced hypothermia[J]. PLoS ONE, 2014, 9(4): e93218. DOI:10.1371/journal.pone.0093218 |
| [17] |
王绍鸣, 范志强, 张才明, 等. 低体温对严重创伤患者凝血功能及预后的影响研究[J]. 东南大学学报(医学版), 2014, 33(5): 616-618. WANG S M, FAN Z Q, ZHANG C M, et al. Study on the effect of coagulation function and prognosis of patient with severe trauma because of low temperature[J]. J Southeast Univ Med Sci Ed, 2014, 33(5): 616-618. DOI:10.3969/j.issn.1671-6264.2014.05.018 |
| [18] |
陈丽娜, 奂剑波, 史成和, 等. 海水浸泡对大鼠血液指标和主要脏器组织结构的影响[J]. 动物医学进展, 2018, 39(5): 64-68. CHEN L N, HUAN J B, SHI C H, et al. Effects of cold seawater immersion on hematology and histopathology of some important organs in rats[J]. Prog Vet Med, 2018, 39(5): 64-68. DOI:10.16437/j.cnki.1007-5038.2018.05.012 |
| [19] |
TAKADA S, FUJIWARA S, INOUE T, et al. Meningococcemia in adults: a review of theliterature[J]. Intern Med, 2016, 55(6): 567-572. DOI:10.2169/internalmedicine.55.3272 |
| [20] |
RAE L, FIDLER P, GIBRAN N. The physiologic basis of burn shock and the need for aggressive fluidresuscitation[J]. Crit Care Clin, 2016, 32(4): 491-505. DOI:10.1016/j.ccc.2016.06.001 |
| [21] |
何联义, 刘海兰, 唐喜宁, 等. 连续性血液净化对多器官功能障碍综合征患者炎性介质、血流动力和凝血功能的影响[J]. 中国医学装备, 2018, 15(8): 76-80. HE L Y, LIU H L, TANG X N, et al. Effects of continuous hemopurification on inflammatory mediator, hemodynamics and coagulation function of patients with multiple organ dysfunction syndrome[J]. China Med Equip, 2018, 15(8): 76-80. DOI:10.3969/J.ISSN.1672-8270.2018.08.022 |
| [22] |
CHOI G, SCHULTZ M J, LEVI M, et al. The relationship between inflammation and the coagulation system[J]. Swiss Med Wkly, 2006, 136(9/10): 139-144. |
| [23] |
付阳, 金亚雄, 刘玉梅, 等. 凝血标志物在危重症血栓性疾病患者诊断中的应用及与炎性因子的相关性研究[J]. 中国实验血液学杂志, 2017, 25(6): 1776-1780. FU Y, JIN Y X, LIU Y M, et al. Clinical significance of coagulation indicators and their correlation with inflammatory factors in critical patients with thromboembolism[J]. J Exp Hematol, 2017, 25(6): 1776-1780. DOI:10.7534/j.issn.1009-2137.2017.06.036 |
| [24] |
李亚博, 王佩, 陈一, 等. 缺氧诱导血管内皮细胞损伤的机制研究[J]. 中国实验诊断学, 2019, 23(5): 871-873. LI Y B, WANG P, CHEN Y, et al. Study on the mechanism of hypoxia-induced vascular endothelial cell injury[J]. Chin J Lab Diagn, 2019, 23(5): 871-873. DOI:10.3969/j.issn.1007-4287.2019.05.035 |
| [25] |
BERNAL W, WENDON J. Acute liver failure[J]. N Engl J Med, 2013, 369(26): 2525-2534. DOI:10.1056/nejmra1208937 |



