2. 610041 成都,华西医院胃肠外科;
3. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系微生物与生化药学教研室
2. Department of Gastrointestinal Surgery, West China Hospital Affiliated to Sichuan University Medical College, Chengdu, Sichuan Province, 610041;
3. Department of Microbiology and Biochemical Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
胃癌是全球常见的引起人类死亡的重要恶性肿瘤之一,严重威胁着我国人民的健康[1-2]。胃癌的发病机制非常复杂,在疾病的进程中又涉及基因、环境、免疫等多个相关因素的影响[3]。其中免疫因素,特别是免疫细胞与肿瘤细胞的相互作用决定着胃癌的临床转归,而抗肿瘤免疫细胞的功能抑制则是导致胃癌进展及预后不良的关键[4-5]。我们前期的研究发现,在胃癌组织微环境中存在一群表达CD56分子的CD3+ T细胞即CD3+CD56+ NKT样细胞,其在肿瘤中浸润的水平与胃癌患者的生存时间成正相关;但功能学分析显示这群细胞在胃癌组织中产生抗肿瘤效应因子的能力显著低于正常组织[6],提示胃癌微环境抑制了CD3+CD56+ NKT样细胞的抗肿瘤功能。然而,这群细胞在胃癌患者外周血中介导的系统性免疫应答及其功能调控尚不清楚。因此,为了阐明CD3+CD56+ NKT样细胞在胃癌患者外周血中的应答水平及其功能的免疫调控,本研究拟通过收集胃癌患者的外周血,分析CD3+CD56+ NKT样细胞的比例及功能,同时利用患者的外周血浆刺激,初步探讨其功能受抑的机制。
1 资料与方法 1.1 研究对象收集2018年7月至2019年9月在江油市九○三医院普外科住院的30例胃癌患者外周血,其中男性20例,女性10例,年龄28~71岁,平均54.3岁。入组的患者根据国际抗癌联盟第8版恶性肿瘤淋巴结转移(tmmor node metastasis, TNM)分期标准进行分组,Ⅰ~Ⅱ期14例,Ⅲ~Ⅳ期16例。纳入标准:患者均经术前胃镜活检病理学检查确诊,未经药物或其他手段治疗;排除标准:合并感染性疾病、自身免疫性疾病以及多发肿瘤的胃癌患者;同时收集30例体检健康人的外周血作为正常对照,其中男性19例,女性11例,年龄25~70岁,平均52.1岁;此外,收集30例胃溃疡患者的外周血作为胃良性疾病患者对照,其中男性18例,女性12例,年龄22~68岁,平均51.5岁;本研究遵循医学伦理学标准并于2018年5月获得本院伦理委员会的批准(JY201805),标本的采集获得受试者的知情同意,各组受试者间的性别、年龄差异无统计学意义。
1.2 实验材料APC标记的抗人CD3抗体、淋巴细胞刺激剂和细胞固定通透剂购自美国BD Bioscience公司,PE-Cy7标记的抗人CD56抗体、PE标记的抗人TNF-α抗体、FITC标记的抗人IFN-γ抗体购自美国Biolegend公司,0.01 mol/L的PBS、RPMI1640培养基和胎牛血清购自美国HyClone公司,淋巴细胞分离液购自美国GE Healthcare公司,抗TGF-β1中和抗体及同型对照的IgG抗体购自美国Abcam公司,TGF-β1 ELISA检测试剂盒购自深圳达科为公司。
1.3 细胞刺激采集胃癌患者、胃溃疡患者和体检健康人的外周血5 mL到肝素抗凝管中并尽快运回实验室,经离心后收集上层血浆并冻存于-80 ℃冰箱备用,下层血细胞按1 :1的比例经PBS重悬稀释,随后用淋巴细胞液进行密度梯度离心,并收集单个核细胞至含10%胎牛血清的1640培养基中,然后以200 μL/孔的体积加入至96孔细胞培养板,同时向培养孔中加入淋巴细胞活化剂0.4 μL刺激活化5 h,收集细胞进行流式细胞染色分析。此外,一部分健康人来源的单个核细胞用含50%体积外周血浆刺激24 h,分为健康人血浆组、胃溃疡患者血浆组或胃癌患者血浆组;或在胃癌患者血浆中预先加入TGF-β1中和抗体或IgG同型抗体孵育30 min后再刺激细胞24 h,分为未刺激组、胃癌患者血浆组、胃癌患者血浆+IgG同型抗体组、胃癌患者血浆+TGF-β1抗体组,最后各组均加入淋巴细胞活化剂0.4 μL刺激活化5 h,收集细胞进行流式细胞染色分析。
1.4 流式细胞术染色及检测刺激的单个核细胞加入APC标记的抗人CD3抗体、PE-Cy7标记的抗人CD56抗体4 ℃避光染色30 min,经PBS清洗2次后加入固定通透剂孵育20 min,离心后加入PE标记的抗人TNF-α抗体和FITC标记的抗人IFN-γ抗体4 ℃避光继续染色30 min,经PBS洗涤后,利用BD流式细胞仪进行检测,然后用Flowjo分析软件对数据进行分析。
1.5 ELISA检测收集的血浆根据TGF-β1酶联免疫吸附试验(ELISA)检测试剂盒的说明进行操作分析。
1.6 统计学分析数据用x±s表示,采用GraphPad Prism 5软件进行数据处理和统计学分析,两组之间的比较采用独立样本t检验,多组内的比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 胃癌患者外周血CD3+CD56+ NKT样细胞的检测外周血经抗人CD3和CD56抗体进行染色及流式细胞仪检测后,分析每个个体CD3+CD56+ NKT样细胞占所有淋巴细胞的比例,并对30例胃癌患者、30例胃溃疡患者、30例健康人(正常对照)进行统计学比较分析显示:与正常对照组(2.3%)和胃溃疡患者组(2.2%)相比,胃癌患者外周血中CD3+CD56+ NKT样细胞的比例(2.4%)差异无统计学意义(P>0.05, 图 1)。
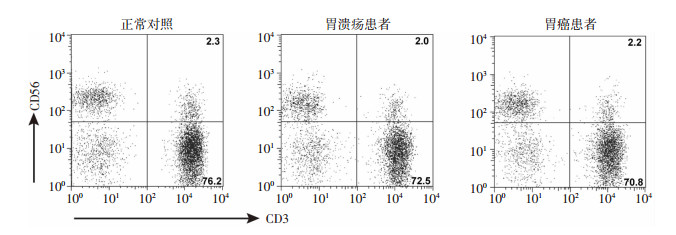
|
| 图 1 流式细胞术检测3组外周血标本中单个核细胞表达CD3和CD56 |
2.2 胃癌患者外周血CD3+CD56+ NKT样细胞的功能检测
IFN-γ和TNF-α是CD3+CD56+ NKT样细胞靶向杀伤肿瘤细胞的功能因子,通过流式细胞染色结果分析显示:胃癌患者外周血中CD3+CD56+ NKT样细胞表达的IFN-γ水平(26.4%)显著低于正常对照组(33.3%)和胃溃疡患者组(33.7%,P < 0.05);此外,与正常对照组(38.9%)和胃溃疡患者组(37.9%)相比,胃癌患者外周血中表达TNF-α的CD3+CD56+ NKT样细胞比例(27.5%)也明显下降,差异具有统计学意义(P < 0.05, 图 2)。
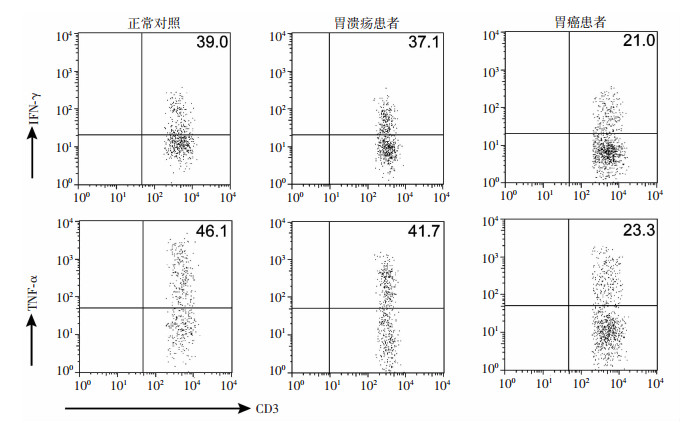
|
| 图 2 流式细胞术检测3组外周血标本中CD3+CD56+ NKT样细胞表达IFN-γ和TNF-α |
2.3 胃癌患者外周血浆对CD3+CD56+ NKT样细胞的功能调控
体外培养结果显示:胃癌患者外周血浆刺激组中的CD3+CD56+ NKT样细胞表达的IFN-γ和TNF-α水平显著低于正常对照或胃溃疡患者血浆刺激组(P < 0.05, 图 3A);ELISA结果显示:胃癌患者组外周血浆中的TGF-β1浓度则显著高于正常对照组和胃溃疡患者组(P < 0.05, 图 3B);进一步分别加入未经抗体处理、经IgG同型抗体或TGF-β1中和抗体处理的胃癌患者血浆刺激,结果显示经TGF-β1中和抗体处理的胃癌患者血浆刺激组中CD3+CD56+ NKT样细胞表达的IFN-γ和TNF-α水平明显高于未经抗体处理或经IgG同型抗体处理的胃癌患者血浆刺激组(P < 0.05, 图 3C)。
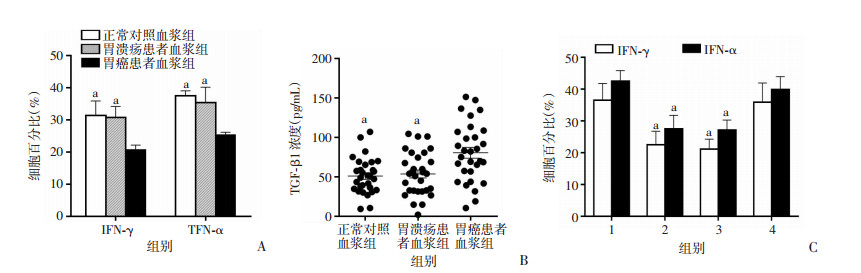
|
| A:健康人、胃溃疡患者和胃癌患者血浆对CD3+CD56+ NKT样细胞表达IFN-γ和TNF-α的影响(n=5,x±s) a: P < 0.05,与胃癌患者血浆组比较;B:健康人、胃溃疡患者和胃癌患者血浆中TGF-β1的浓度检测(n=30,x±s) a: P < 0.05,与胃癌患者比较;C:胃癌患者血浆中加入TGF-β1中和抗体后对CD3+CD56+ NKT样细胞表达IFN-γ和TNF-α的影响(n=5,x±s) 1:未刺激组;2:胃癌患者血浆刺激组;3:胃癌患者血浆刺激+IgG同型抗体组;4:胃癌患者血浆刺激+ TGF-β1中和抗体组a: P < 0.05,与胃癌患者血浆刺激+ TGF-β1中和抗体组比较 图 3 胃癌患者外周血中的TGF-β1诱导CD3+CD56+ NKT样细胞下调表达IFN-γ和TNF-α |
2.4 胃癌患者外周血CD3+CD56+ NKT样细胞的比例及其功能在不同临床分期间的比较
根据胃癌患者的TNM分期,我们将胃癌患者分为早期(Ⅰ+Ⅱ期)和晚期(Ⅲ+Ⅳ期)两组,然后比较两组间CD3+CD56+ NKT样细胞水平及功能的差异。结果显示:晚期胃癌患者外周血中CD3+CD56+ NKT样细胞比例与早期患者相比无统计学差异;而晚期胃癌患者外周血中表达IFN-γ及TNF-α的CD3+CD56+ NKT样细胞比例则均显著低于早期患者(P < 0.05, 图 4)。
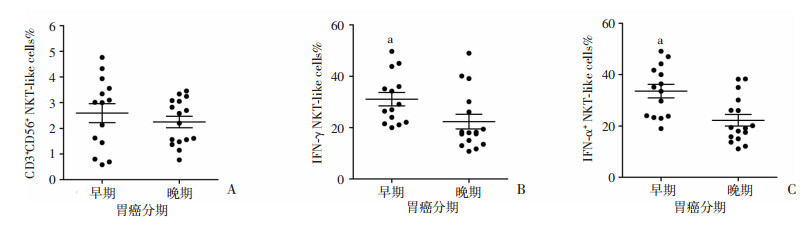
|
| A:CD3+CD56+ NKT样细胞水平;B:表达IFN-γ的CD3+CD56+ NKT样细胞水平a: P < 0.05,与晚期比较;C:表达TNF-α的CD3+CD56+ NKT样细胞的水平a: P < 0.01,与晚期比较 图 4 早期和晚期胃癌患者的CD3+CD56+ NKT样细胞及其表达的IFN-γ和TNF-α水平比较 (n=30,x±s) |
3 讨论
在肿瘤的发生、发展过程中,机体一直伴随着一系列复杂的细胞免疫反应。其中T细胞介导的抗肿瘤适应性免疫应答一直是人们关注和研究的重点[7-8]。近年来随着对肿瘤患者免疫系统的深入研究发现,一群新型的CD3+CD56+ NKT样细胞介导了机体抵抗肿瘤的功能活性,其在肿瘤微环境的增加常预示着患者对治疗具有良好的应答效果,同时存活时间也会显著延长[9];此外,将体外诱导分化产生的该细胞亚群过继入小鼠体内可显著抑制肿瘤的生长和转移[10]。因此,深入探讨CD3+CD56+ NKT样细胞在胃癌进展中的功能调控可为其临床免疫防治提供实验基础。
本研究发现,与健康人和胃溃疡患者外周血相比,CD3+CD56+ NKT样细胞占胃癌患者外周血淋巴细胞的比例并无显著统计学差异,这与课题组前期的研究结果一致[6]。此外,最新研究显示在结直肠癌和肝癌患者中,也未观察到这群细胞在外周血中的比例出现明显的改变[11-13]。然而,早期文献报道,在急性白血病患者外周血中的CD3+CD56+ NKT样细胞比例却显著增加[14],这可能与研究的对象不同有关。白血病属于血液系统相关的疾病,可直接影响患者外周血中免疫细胞的发育与分化;而胃癌属于消化道组织局部的肿瘤,对外周血免疫细胞的存活影响较小。事实上,本研究结果显示早期胃癌患者与晚期胃癌患者外周血中的CD3+CD56+ NKT样细胞比例差异也无统计学意义。因此,这些结果提示胃癌的进展并未改变患者外周血CD3+CD56+ NKT样细胞的应答水平。
IFN-γ和TNF-α已被公认为机体抵抗肿瘤的功能性细胞因子[15]。尽管胃癌患者外周血中CD3+CD56+ NKT样细胞的应答水平正常,但功能学分析显示其表达的IFN-γ和TNF-α水平显著低于健康人和胃溃疡患者;而且与早期胃癌患者相比,其在晚期胃癌患者中产生IFN-γ和TNF-α的水平更低,由此提示胃癌患者外周血中CD3+CD56+ NKT样细胞的抗肿瘤功能下降,且随着疾病的进程,其功能亦随之逐渐下降。那么,是什么因素导致了CD3+CD56+ NKT样细胞的功能下降呢?本研究利用不同人群来源的外周血浆进行体外刺激,观察到胃癌患者的血浆可明显抑制CD3+CD56+ NKT样细胞产生IFN-γ和TNF-α,提示胃癌患者外周血来源的可溶性因子很可能诱导了CD3+CD56+ NKT样细胞的功能抑制。x±s报道调节性细胞因子TGF-β1可影响免疫细胞的系统性免疫应答,并在肿瘤的进程中发挥重要作用。因此,本研究进一步检测了外周血中的TGF-β1浓度,发现在胃癌患者血浆中的TGF-β1水平明显高于健康人和胃溃疡患者;随后利用中和抗体阻断TGF-β1信号,可观察到胃癌患者血浆对CD3+CD56+ NKT样细胞产生IFN-γ和TNF-α的抑制效果显著下降,这些结果表明TGF-β1除了在组织局部直接发挥促瘤作用,还能够通过抑制外周血中CD3+CD56+ NKT样细胞产生IFN-γ和TNF-α,进而导致抗肿瘤免疫抑制,最终促进了胃癌的疾病进程。
总之,CD3+CD56+ NKT样细胞在胃癌患者外周血中的功能显著下降,并与疾病的进展密切相关;此外,研究还发现CD3+CD56+ NKT样细胞的功能抑制很可能由外周血来源的TGF-β1所介导,进一步深入探讨TGF-β1诱导CD3+CD56+ NKT样细胞抗肿瘤免疫抑制的分子机制,将为临床设计胃癌的免疫治疗方案提供新的实验证据。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
VAN CUTSEM E, SAGAERT X, TOPAL B, et al. Gastric cancer[J]. Lancet, 2016, 388(10060): 2654-2664. DOI:10.1016/s0140-6736(16)30354-3 |
| [3] |
LYONS K, LE L C, PHAM Y T, et al. Gastric cancer: epidemiology, biology, and prevention: a mini review[J]. Eur J Cancer Prev, 2019, 28(5): 397-412. DOI:10.1097/CEJ.0000000000000480 |
| [4] |
DU Y, WEI Y C. Therapeutic potential of natural killer cells in gastric cancer[J]. Front Immunol, 2018, 9: 3095. DOI:10.3389/fimmu.2018.03095 |
| [5] |
SASAKI S, NISHIKAWA J, SAKAI K, et al. EBV-associated gastric cancer evades T-cell immunity by PD-1/PD-L1 interactions[J]. Gastric Cancer, 2019, 22(3): 486-496. DOI:10.1007/s10120-018-0880-4 |
| [6] |
PENG L S, MAO F Y, ZHAO Y L, et al. Altered phenotypic and functional characteristics of CD3+CD56+ NKT-like cells in human gastric cancer[J]. Oncotarget, 2016, 7(34): 55222-55230. DOI:10.18632/oncotarget.10484 |
| [7] |
KATZ S G, RABINOVICH P M. T cell reprogramming against cancer[J]. Methods Mol Biol, 2020, 2097: 3-44. DOI:10.1007/978-1-0716-0203-4_1 |
| [8] |
YANG L H, WANG Y X, WANG H F. Use of immunotherapy in the treatment of gastric cancer[J]. Oncol Lett, 2019, 18(6): 5681-5690. DOI:10.3892/ol.2019.10935 |
| [9] |
GAO X C, MI Y J, GUO N, et al. Cytokine-induced killer cells as pharmacological tools for cancer immunotherapy[J]. Front Immunol, 2017, 8: 774. DOI:10.3389/fimmu.2017.00774 |
| [10] |
MATA-MOLANES J J, SUREDA GONZÁLEZ M, VALENZUELA JIMÉNEZ B, et al. Cancer immunotherapy with cytokine-induced killer cells[J]. Targ Oncol, 2017, 12(3): 289-299. DOI:10.1007/s11523-017-0489-2 |
| [11] |
GHARAGOZLOO M, REZAEI A, KALANTARI H, et al. Decline in peripheral blood NKG2D+CD3+CD56+ NKT cells in metastatic colorectal cancer patients[J]. Bratisl Lek Listy, 2018, 119(1): 6-11. DOI:10.4149/BLL_2018_002 |
| [12] |
KRIJGSMAN D, DE VRIES N L, SKOVBO A, et al. Characterization of circulating T-, NK-, and NKT cell subsets in patients with colorectal cancer: the peripheral blood immune cell profile[J]. Cancer Immunol Immunother, 2019, 68(6): 1011-1024. DOI:10.1007/s00262-019-02343-7 |
| [13] |
LI X F, DAI D, SONG X Y, et al. A different representation of natural T cells and natural killer cells between tumor-infiltrating and periphery lymphocytes in human hepatocellular carcinoma[J]. Oncol Lett, 2017, 13(5): 3291-3298. DOI:10.3892/ol.2017.5808 |
| [14] |
GUO W J, XING C, DONG A S, et al. Numbers and cytotoxicities of CD3+CD56+ T lymphocytes in peripheral blood of patients with acute myeloid leukemia and acute lymphocytic leukemia[J]. Cancer Biol Ther, 2013, 14(10): 916-921. DOI:10.4161/cbt.25938 |
| [15] |
LI J, ZHANG Y X, CHEN L Y, et al. Cervical cancer HeLa cell autocrine apoptosis induced by coimmobilized IFN-γ plus TNF-α biomaterials[J]. ACS Appl Mater Interfaces, 2018, 10(10): 8451-8464. DOI:10.1021/acsami.7b18277 |
| [16] |
HAN B, MAO F Y, ZHAO Y L, et al. Altered NKp30, NKp46, NKG2D, and DNAM-1 expression on circulating NK cells is associated with tumor progression in human gastric cancer[J]. J Immunol Res, 2018, 2018: 6248590. DOI:10.1155/2018/6248590 |



