肺癌是全球发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占80%[1-2]。表皮生长因子受体(epidermal growth factor receptor, EGFR)异常突变与NSCLC的发生和进展有关,亦是其治疗的重要靶标。目前已开发和研究出了多种抗EGFR抑制剂用于临床,包括单克隆抗体和小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)。第一代EGFR-TKI厄洛替尼用于存在EGFR敏感突变(19号外显子缺失或21号外显子L858R突变)的晚期NSCLC的一线治疗,且其疗效明显优于传统的化疗[3-4]。然而,使用TKI治疗的患者将不可避免出现耐药,已发现的TKI耐药机制包括EGFR二次突变T790M、旁路激活、表型转化等[5-7]。但还有相当部分耐药机制尚未阐明。因此,为改善这一部分患者的生存,进一步探索合适、有效的策略来逆转TKI耐药具有重要的意义。
越来越多的证据表明细胞能量代谢在肿瘤的发生、发展过程中发挥了重要作用。与正常组织的供能方式不同,无论是有氧或无氧状态,肿瘤细胞均以糖酵解为主要能量来源,即有氧酵解或称为“Warburg效应”[8]。糖酵解不仅为肿瘤细胞增殖提供了能量,其产生的中间产物乳酸、丙酮酸等也是合成肿瘤细胞所需的重要原料[9],抑制糖酵解可以增强NSCLC对EGFR-TKI的敏感性,并防止耐药的产生[10]。己糖激酶(hexokinases, HKs)是催化糖酵解的第一个重要的限速酶,主要有4种不同的亚型在哺乳动物组织中表达,分别为HK1、HK2、HK3和HK4[11]。除己糖激酶家族其他成员外,HK2在人类癌症和胚胎组织中过表达[12],但在正常的成人组织中表达数量较低[13]。鉴于此,HK2有望成为潜在的癌症治疗靶标[14-15],但HK2是否与NSCLC厄洛替尼耐药有关,是否能成为治疗厄洛替尼耐药的靶标,目前尚不清楚。
为了探索HK2在NSCLC厄洛替尼耐药中的作用,本研究首先通过在线网站分析肺癌和肺腺癌组织中HK2的表达与预后的关系;其次通过GEO DataSets数据库研究厄洛替尼对NSCLC细胞中HK2基因差异表达的影响,然后采用q-PCR和Western blot进行体外验证实验,检测在厄洛替尼干预下NSCLC厄洛替尼耐药细胞和敏感细胞中HK2的表达差异,并采用抑制HK2表达的手段,观察HK2对NSCLC细胞厄洛替尼耐药及细胞增殖的影响。
1 材料与方法 1.1 材料肺腺癌厄洛替尼敏感细胞PC9购自上海生物化学与细胞生物学研究所(中国上海),耐药细胞PC9/ER由本课题组韩静博士诱导;厄洛替尼敏感细胞HCC827购自ATCC细胞库,人正常肺上皮细胞BEAS-2B由华中科技大学黄珊珊博士赠送;RPMI1640培养基、胎牛血清、胰蛋白酶消化液均购自HyClone公司(美国);CCK-8试剂购自同仁化学研究所(日本);q-PCR反转录试剂盒购自TaKaRa公司(日本);细胞增殖试剂盒购自GeneCopoeia公司(美国);RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE电泳液和转膜液均购自碧云天公司(中国上海);厄洛替尼、HK2抑制剂(Bromopyruvic acid,3-溴丙酮酸)购自SelleckChem公司(美国);HK2抗体购自Cell Signaling Technology公司(美国);β-actin抗体购自中杉金桥公司(中国北京)。
1.2 方法 1.2.1 肺癌组织中HK2的表达与预后分析① 登录Kaplan-Meier Plotter网站(http://kmplot.com/analysis/index.php),选择肺癌,输入“HK2”,获取预后分析数据;②登录GEPIA网站(http://gepia.cancer-pku.cn),进入Survival Plots,输入基因“HK2”并选择肺腺癌,点击“Plot”获取预后分析数据。
1.2.2 厄洛替尼对NSCLC细胞中HK2基因差异表达的影响登录GEO DataSets网站,输入“HK2、erlotinib”, 筛选出数据库(GSE 67051),获取数据并统计分析结果。
1.2.3 CCK-8法检测细胞增殖将处于对数生长期的PC9、PC9/ER细胞以5000个/孔接种于96孔板,每个浓度设置3个平行孔,于37 ℃、5%CO2培养箱中培养24 h,以含有50 μmol/L 3-溴丙酮酸的不同浓度厄洛替尼(0、0.001、0.01、0.1、1、10 μmol/L)处理细胞48 h,每孔加入10 μL CCK-8试剂于细胞培养箱中继续培养1 h,然后在酶标仪上测定波长450 nm处的光密度值[D(450)],计算生存率,并得出IC50值。
1.2.4 细胞分组体外实验:PC9、PC9/ER细胞均分为2组,用1 μmol/L厄洛替尼处理的为厄洛替尼处理组,未用厄洛替尼处理的为对照组。抑制实验:以含有1 μmol/L厄洛替尼的不同浓度3-溴丙酮酸(0、20、50 μmol/L)处理PC9/ER细胞,分别为0、20、50 μmol/L 3-溴丙酮酸组。
1.2.5 实时定量PCR(q-PCR)检测采用TRIzol试剂盒提取细胞总RNA,超微量分光光度计测定总RNA浓度,经逆转录反应合成cDNA,以β-actin作为内参,使用SYBR试剂盒在CFX384荧光定量PCR仪上检测基因表达情况。引物序列:β-actin上游5′-GCGAGCACAGAGCCTCGCCTT-3′,下游5′-CATCATCCATGGTGAGCTGGCGG-3′;HK2上游5′-GAGCCACCACTCACCCTACT-3′,下游5′-CCAGGCATTCGGCAATGTG-3′。
1.2.6 Western blot检测含有蛋白酶抑制剂的RIPA裂解液提取细胞总蛋白,BCA试剂盒测定总蛋白浓度;通过SDS-PAGE分离等量的蛋白质,然后转移到PVDF膜上;用5%蛋白质粉封闭膜,并在4 ℃下与特异性一抗一起孵育过夜,使用山羊抗兔IgG抗体和化学发光检测系统检测蛋白质。
1.2.7 EdU法检测细胞增殖将PC9/ER细胞以3×105个/孔接种于六孔板,每个浓度设置3个平行孔,置于37 ℃、5%CO2培养箱培养24 h,以含有1 μmol/L厄洛替尼的不同浓度3-溴丙酮酸(0、50 μmol/L)处理细胞48 h,然后根据EdU检测试剂盒说明书进行检测。
1.3 统计学分析数据以 x±s表示,采用Graphpad prism 5.01软件进行分析,两组间变量资料比较采用配对t检验,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 HK2高表达与肺癌及肺腺癌患者预后不良相关为了探索HK2与肺癌和肺腺癌患者的预后关系,使用Kaplan-Meier Plotter获取了1 908例肺癌患者的生存数据,并在GEPIA网站获取了478例肺腺癌患者的生存数据。分析显示,HK2在肺癌、肺腺癌组织中高表达,并与患者的总体生存期(overall survival, OS)差异显著相关,HK2高表达组患者的OS较低表达组明显缩短(P < 0.05,图 1A、B)。进一步在人正常肺上皮细胞株和人肺腺癌细胞株中验证了HK2的表达,结果显示与正常人肺上皮细胞相比,HK2在肺腺癌细胞中的表达更高(P < 0.01,图 1C)。提示HK2高表达可能是肺癌尤其肺腺癌患者的不良预后因子。
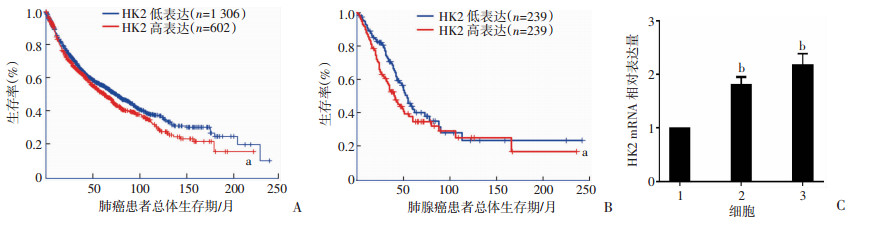
|
| a:P < 0.05,与HK2低表达比较;b:P < 0.01, 与正常人肺上皮细胞BEAS-2B比较; A:肺癌患者总体生存期;B:肺腺癌患者总体生存期;C:q-PCR检测HK2 mRNA的表达1:正常人肺上皮细胞BEAS-2B;2:人肺腺癌细胞PC9;3:人肺腺癌细胞HCC827 图 1 不同HK2表达的肺癌及肺腺癌患者生存情况及不同细胞中HK2的表达 |
2.2 厄洛替尼可下调NSCLC敏感细胞中HK2的表达
为了探究厄洛替尼对肺腺癌基因表达的影响,利用GEO DataSets数据库分析厄洛替尼对NSCLC细胞中HK2基因差异表达的影响。结果发现,在厄洛替尼(1 μmol/L)的作用下,厄洛替尼敏感NSCLC细胞中HK2的表达相对下调[PC9细胞:(1 420.767±85.014) vs (618.233±48.183),P=0.009;HCC827细胞:(1 388.333±47.579) vs (954.733±22.056),P=0.001]。说明在厄洛替尼干预TKI敏感NSCLC细胞PC9和HCC827的过程中,HK2的表达相应减少,提示厄洛替尼对敏感细胞的抑制作用可能与其诱导的HK2下调有关。
2.3 厄洛替尼对TKI敏感和耐药NSCLC细胞HK2表达的不同影响CCK-8检测结果见图 2A,得到NSCLC细胞厄洛替尼的IC50值为:PC9 vs PC9/ER为(0.012±0.002)μmol/L vs (3.560±0.763)μmol/L(P=0.015),说明两者对厄洛替尼的敏感性差异甚大。q-PCR和Western blot检测结果显示厄洛替尼耐药细胞中HK2的表达明显高于敏感细胞(P < 0.01, 图 2B~D),提示耐药细胞中HK2的相对高表达可能与厄洛替尼耐药相关。与GEO DataSets数据库分析结果一致,无论在基因水平还是蛋白水平,厄洛替尼可降低敏感细胞PC9中HK2的表达,但对耐药细胞中HK2的表达无显著影响。
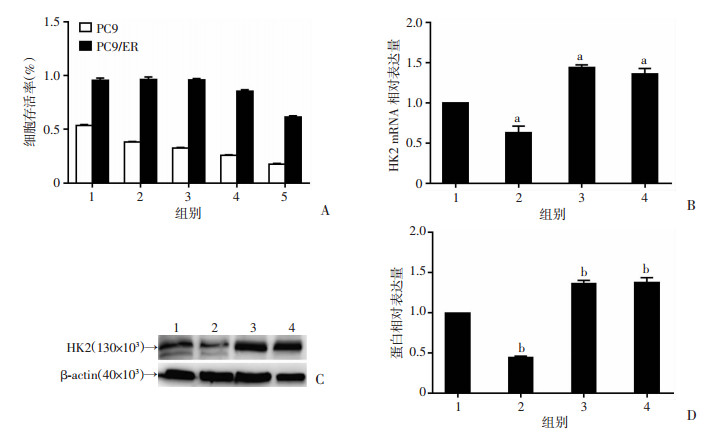
|
| A:CCK-8检测结果1~5:分别为0.001、0.01、0.1、1、10 μmol/L厄洛替尼处理组;B:q-PCR检测结果1、2:分别为PC9细胞对照组和厄洛替尼组;3、4:分别为PC9/ER细胞对照组和厄洛替尼组;a:P < 0.01,与PC9细胞对照组比较;C、D:Western blot检测结果及半定量分析1、2:分别为PC9细胞对照组和厄洛替尼组;3、4:分别为PC9/ER细胞对照组和厄洛替尼组;b:P < 0.01,与PC9细胞对照组比较 图 2 厄洛替尼干预PC9、PC9/ER细胞HK2的表达 |
2.4 3-溴丙酮酸可明显抑制耐药细胞中HK2的表达
由于HK2在厄洛替尼耐药细胞中的表达高于敏感细胞,进一步使用不同浓度3-溴丙酮酸来抑制其在耐药细胞中的表达。结果表明,无论在基因还是蛋白水平,3-溴丙酮酸可成功抑制耐药细胞中HK2的表达,且3-溴丙酮酸浓度越高,其对HK2的抑制效果越明显(P < 0.01,图 3)。提示3-溴丙酮酸亦是厄洛替尼耐药细胞HK2的抑制剂。

|
| 1~3:分别为0、20、50 μmol/L 3-溴丙酮酸组;a:P < 0.01,与0 μmol/L 3-溴丙酮酸组比较; A:q-PCR检测结果;B、C:Western blot检测结果及半定量分析 图 3 3-溴丙酮酸可抑制耐药细胞PC9/ER中HK2的表达 |
2.5 抑制HK2可恢复耐药细胞对厄洛替尼的敏感性
在使用3-溴丙酮酸成功抑制HK2表达的同时,采用CCK-8法检测耐药细胞的IC50值(图 4)。结果显示,与0 μmol/L 3-溴丙酮酸组比较,50 μmol/L 3-溴丙酮酸组细胞厄洛替尼IC50值明显降低[(0.005±0.001) vs (1.967±0.436)μmol/L,P=0.016]。表明3-溴丙酮酸成功抑制HK2的表达后,NSCLC耐药细胞对厄洛替尼的敏感性得以恢复,提示HK2抑制剂能够加强厄洛替尼对耐药NSCLC细胞的抑制作用。
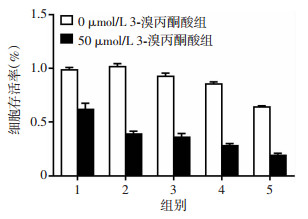
|
| 1~5:分别为0.001、0.01、0.1、1、10 μmol/L厄洛替尼处理组 图 4 CCK-8检测3-溴丙酮酸影响厄洛替尼对PC9/ER细胞的抑制 |
2.6 HK2可促进细胞增殖
在证实抑制HK2可增强耐药细胞对厄洛替尼的敏感性后,进一步分析HK2对NSCLC细胞耐药表型的影响。结果发现厄洛替尼(1 μmol/L)联合3-溴丙酮酸组(50 μmol/L)的EdU阳性细胞的比例低于单用厄洛替尼组[(14.1±0.8)% vs(30.4±2.3)%,P=0.008,图 5],说明3-溴丙酮酸可以加强厄洛替尼抑制细胞增殖的作用。在厄洛替尼无法有效抑制耐药细胞增殖的情况下,联合HK2抑制剂可以增强抗细胞增殖的作用,进而提示HK2可促进细胞增殖。
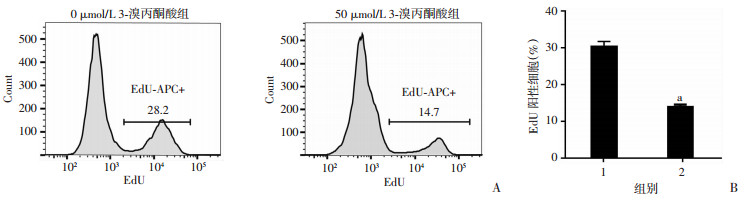
|
| A:EdU检测结果;B:EdU阳性细胞比例1:0 μmol/L 3-溴丙酮酸组;2:50 μmol/L 3-溴丙酮酸组;a:P < 0.01,与0 μmol/L 3-溴丙酮酸组比较 图 5 抑制HK2可降低PC9/ER细胞的增殖 |
3 讨论
EGFR-TKI靶向治疗一直是存在EGFR敏感突变的晚期NSCLC患者的首选治疗方式,与使用传统放、化疗的患者相比,使用EGFR-TKI治疗的患者临床获益更佳,但患者终会因耐药而使临床获益受限。因此,寻找逆转TKI耐药的策略对改善患者的生存至关重要。本研究首先通过在线数据库发现HK2与肺癌患者的预后相关,HK2高表达的肺癌、肺腺癌患者总体生存期更短;体外实验也证实肺腺癌细胞中HK2较人正常肺上皮细胞高表达,提示HK2在肺癌尤其是肺腺癌中发挥着促癌作用,是肺腺癌的不良预后因子。但HK2是否与NSCLC厄洛替尼耐药相关有待进一步研究。
本课题组前期研究发现,在同样的生存环境下NSCLC厄洛替尼耐药细胞较敏感细胞产酸、产ATP的能力更强,意味着耐药细胞更倾向于依赖糖酵解供能。糖酵解是肿瘤细胞的核心表型之一,可通过多种机制参与耐药。己糖激酶是一种组织特异性同工酶,是催化糖酵解途径的第一个重要的限速酶,而HK2则是催化过程中必不可少的一个己糖激酶亚型[16-17],并且HK2在肿瘤中过表达对糖酵解至关重要[18]。本研究发现厄洛替尼可抑制NSCLC敏感细胞中HK2的表达,q-PCR和Western blot也证实HK2在耐药细胞中相对高表达,且厄洛替尼不能抑制耐药细胞中HK2的上调。提示我们耐药细胞对厄洛替尼的抵抗作用可能与HK2的过表达有关,HK2过表达促进耐药细胞糖酵解,继而诱导NSCLC厄洛替尼耐药。
HK2过表达可通过促进糖酵解来诱导肿瘤进展[19],抑制HK2可在癌细胞中诱导凋亡、辅助抗癌药物渗透肿瘤细胞,提高肿瘤细胞对抗癌药物的敏感性[20-22]。HK2敲低后,癌细胞中的葡萄糖消耗和乳酸产量显著降低,而厄洛替尼耐药NSCLC细胞中HK2上调加强了细胞糖酵解,继而产生大量乳酸造成肿瘤微环境的酸化,微环境酸中毒是癌症进化和恶性进展的关键因素,酸化的微环境还提供了强大的进化选择压力,从而促进了侵略性和抗治疗性克隆的出现[23]。我们前期的研究发现厄洛替尼耐药细胞产生的乳酸含量高于敏感细胞,表明在酸性环境中耐药细胞具有更强的生存优势,耐酸的厄洛替尼抗性细胞逐渐被选择出来。同时,糖酵解增强造成的酸中毒会引起基因组不稳定,肿瘤细胞将出现更多突变以适应不断变化的肿瘤微环境,进而导致新生的癌细胞对治疗产生抵抗[24]。增强的糖酵解会产生大量的ATP,从而为耐药细胞合成生物大分子提供丰富的能量,糖酵解途径的中间代谢产物也用以合成耐药细胞进而驱动肿瘤生长,此外,糖酵解还可通过促进表型转化赋予癌细胞转移优势导致细胞耐药[25]。P糖蛋白是一种外排转运蛋白,可将抗肿瘤药物排出胞外,增多的乳酸使细胞外环境酸化加强了P糖蛋白作为外排泵的功能,同时细胞膜两侧形成的pH梯度也会减少弱碱性抗癌药物向细胞内的扩散[26]。HK2的许多抑制剂,如3-溴丙酮酸、2-脱氧葡萄糖等可成功抑制多个瘤种的糖酵解并初步显示出抗癌功效[27]。本研究表明HK2在厄洛替尼耐药细胞中的表达更高,使用3-溴丙酮酸可成功抑制厄洛替尼耐药细胞HK2的表达。当HK2被成功抑制后,厄洛替尼耐药细胞对厄洛替尼的敏感性得以恢复。研究表明HK2在癌症中过表达可通过调节糖酵解促进肿瘤增殖[28],本研究也证实经3-溴丙酮酸干预后,耐药细胞EdU-APC+细胞的比例显著下降,表明抑制HK2可降低细胞的增殖能力,HK2可通过调节糖酵解促进耐药细胞增殖。
本研究表明HK2与肺腺癌患者的生存预后呈显著负相关,HK2高表达组患者的OS明显降低,并证实HK2在肺腺癌细胞中明显高表达,表明HK2可能是肺腺癌的标志物并与不良预后密切相关,提示HK2在肺腺癌的发生进展中发挥了重要作用。体外联合HK2抑制剂能够显著提高厄洛替尼对耐药细胞的抑制作用,提高耐药细胞对厄洛替尼的敏感性,抑制耐药细胞的增殖。因此,HK2可作为治疗NSCLC患者EGFR-TKI耐药后的一个有效新靶点,HK2抑制剂单用或与EGFR-TKI组合应用可能是应对EGFR-TKI治疗后出现耐药的一种新策略。
综上所述,HK2上调促进糖酵解在NSCLC厄洛替尼耐药机制中发挥重要作用,其具体作用机制还需进一步探讨,但抑制其表达降低糖酵解水平有望成为逆转NSCLC厄洛替尼耐药的有效策略。
| [1] |
TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
ROSELL R, CARCERENY E, GERVAIS R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(3): 239-246. DOI:10.1016/S1470-2045(11)70393-X |
| [4] |
WU Y L, ZHOU C, LIAM C K, et al. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase Ⅲ, randomized, open-label, ENSURE study[J]. Ann Oncol, 2015, 26(9): 1883-1889. DOI:10.1093/annonc/mdv270 |
| [5] |
NEEL D S, BIVONA T G. Resistance is futile: overcoming resistance to targeted therapies in lung adenocarcinoma[J]. NPJ Precis Oncol, 2017, 1: 3. DOI:10.1038/s41698-017-0007-0 |
| [6] |
CHABON J J, SIMMONS A D, LOVEJOY A F, et al. Corrigendum: Circulating tumour DNA profiling reveals heterogeneity of EGFR inhibitor resistance mechanisms in lung cancer patients[J]. Nat Commun, 2016, 7: 13513. DOI:10.1038/ncomms13513 |
| [7] |
YU H A, ARCILA M E, REKHTMAN N, et al. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers[J]. Clin Cancer Res, 2013, 19(8): 2240-2247. DOI:10.1158/1078-0432.CCR-12-2246 |
| [8] |
LIBERTI M V, LOCASALE J W. The Warburg effect: how does it benefit cancer cells?[J]. Trends Biochem Sci, 2016, 41(3): 211-218. DOI:10.1016/j.tibs.2015.12.001 |
| [9] |
PAVLOVA N N, THOMPSON C B. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23(1): 27-47. DOI:10.1016/j.cmet.2015.12.006 |
| [10] |
WANG H, SHEEHAN R P, PALMER A C, et al. Adaptation of human iPSC-derived cardiomyocytes to tyrosine kinase inhibitors reduces acute cardiotoxicity via metabolic reprogramming[J]. Cell Syst, 2019, 8(5): 412-426. DOI:10.1016/j.cels.2019.03.009 |
| [11] |
ROBERTS D J, MIYAMOTO S. Hexokinase Ⅱ integrates energy metabolism and cellular protection: Akting on mitochondria and TORCing to autophagy[J]. Cell Death Differ, 2015, 22(2): 364. DOI:10.1038/cdd.2014.208 |
| [12] |
DEWAAL D, NOGUEIRA V, TERRY A R, et al. Hexokinase-2 depletion inhibits glycolysis and induces oxidative phosphorylation in hepatocellular carcinoma and sensitizes to metformin[J]. Nat Commun, 2018, 9(1): 446. DOI:10.1038/s41467-017-02733-4 |
| [13] |
LEE H J, LI C F, RUAN D, et al. Non-proteolytic ubiquitination of hexokinase 2 by HectH9 controls tumor metabolism and cancer stem cell expansion[J]. Nat Commun, 2019, 10(1): 2625. DOI:10.1038/s41467-019-10374-y |
| [14] |
WANG L, WANG J, XIONG H, et al. Co-targeting hexokinase 2-mediated Warburg effect and ULK1-dependent autophagy suppresses tumor growth of PTEN- and TP53-deficiency-driven castration-resistant prostate cancer[J]. EBio Medicine, 2016, 7: 50-61. DOI:10.1016/j.ebiom.2016.03.022 |
| [15] |
ZHOU L, LI M, YU X Y, et al. Repression of hexokinases Ⅱ-mediated glycolysis contributes to piperlongumine-induced tumor suppression in non-small cell lung cancer cells[J]. Int J Biol Sci, 2019, 15(4): 826-837. DOI:10.7150/ijbs.31749 |
| [16] |
LIS P, DYLAG M, NIEDZWIECKA K, et al. The HK2 dependent "Warburg effect" and mitochondrial oxidative phosphorylation in cancer: targets for effective therapy with 3-bromopyruvate[J]. Molecules, 2016, 21(12): E1730. DOI:10.3390/molecules21121730 |
| [17] |
JIAO L, ZHANG H L, LI D D, et al. Regulation of glycolytic metabolism by autophagy in liver cancer involves selective autophagic degradation of HK2 (hexokinase 2)[J]. Autophagy, 2018, 14(4): 671-684. DOI:10.1080/15548627.2017.1381804 |
| [18] |
WOLF A, AGNIHOTRI S, MICALLEF J, et al. Hexokinase 2 is a key mediator of aerobic glycolysis and promotes tumor growth in human glioblastoma multiforme[J]. J Exp Med, 2011, 208(2): 313-326. DOI:10.1084/jem.20101470 |
| [19] |
GUO W, QIU Z, WANG Z, et al. MiR-199a-5p is negatively associated with malignancies and regulates glycolysis and lactate production by targeting hexokinase 2 in liver cancer[J]. Hepatology, 2015, 62(4): 1132-1144. DOI:10.1002/hep.27929 |
| [20] |
KWIATKOWSKA E, WOJTALA M, GAJEWSKA A, et al. Effect of 3-bromopyruvate acid on the redox equilibrium in non-invasive MCF-7 and invasive MDA-MB-231 breast cancer cells[J]. J Bioenerg Biomembr, 2016, 48(1): 23-32. DOI:10.1007/s10863-015-9637-5 |
| [21] |
SUN Y M, LIU Z, ZOU X, et al. Mechanisms underlying 3-bromopyruvate-induced cell death in colon cancer[J]. J Bioenerg Biomembr, 2015, 47(4): 319-329. DOI:10.1007/s10863-015-9612-1 |
| [22] |
AKINS N S, NIELSON T C, LE H V. Inhibition of glycolysis and glutaminolysis: an emerging drug discovery approach to combat cancer[J]. Curr Top Med Chem, 2018, 18(6): 494-504. DOI:10.2174/1568026618666180523111351 |
| [23] |
PILLAI S R, DAMAGHI M, MARUNAKA Y, et al. Causes, consequences, and therapy of tumors acidosis[J]. Cancer Metastasis Rev, 2019, 38(1/2): 205-222. DOI:10.1007/s10555-019-09792-7 |
| [24] |
GILLIES R J, VERDUZCO D, GATENBY R A. Evolutionary dynamics of carcinogenesis and why targeted therapy does not work[J]. Nat Rev Cancer, 2012, 12(7): 487-493. DOI:10.1038/nrc3298 |
| [25] |
ZHANG M, CONG Q, ZHANG X Y, et al. Pyruvate dehydrogenase kinase 1 contributes to cisplatin resistance of ovarian cancer through EGFR activation[J]. J Cell Physiol, 2019, 234(5): 6361-6370. DOI:10.1002/jcp.27369 |
| [26] |
ICARD P, SHULMAN S, FARHAT D, et al. How the Warburg effect supports aggressiveness and drug resistance of cancer cells?[J]. Drug Resist Updat, 2018, 38: 1-11. DOI:10.1016/j.drup.2018.03.001 |
| [27] |
ZHANG Q W, ZHANG Y Y, ZHANG P, et al. Hexokinase Ⅱ inhibitor, 3-BrPA induced autophagy by stimulating ROS formation in human breast cancer cells[J]. Genes Cancer, 2014, 5(3/4): 100-112. DOI:10.18632/genesandcancer.9 |
| [28] |
ZHOU P, CHEN W G, LI X W. MicroRNA-143 acts as a tumor suppressor by targeting hexokinase 2 in human prostate cancer[J]. Am J Cancer Res, 2015, 5(6): 2056-2063. |



