2. 401120 重庆,重庆医科大学附属第三医院骨与创伤中心
2. Department of Orthopedics, the Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
椎间盘退变是引发下腰痛的主要原因之一,严重影响社会人群的正常生活和学习工作,给社会和医疗系统带来了巨大的经济负担[1]。目前,针对椎间盘退变的治疗如卧床休息、功能锻炼、理疗和手术治疗等,都只能缓解疼痛症状而未解决椎间盘退变病因[2]。因此,深入研究椎间盘退变的病理生理机制,将为生物学策略修复退变椎间盘提供理论依据。
细胞凋亡是细胞的程序性死亡,在椎间盘退变过程中发挥重要作用,直接降低髓核细胞数量,进而影响胶原蛋白、蛋白聚糖等椎间盘髓核组织的胞外基质合成[3-5]。椎间盘由上下终板软骨、外层纤维环和内部的髓核组织构成,髓核组织因富含带负电荷的糖胺多糖具有高亲水性,由于脊柱的日常活动和姿势变化,髓核组织承受不断变化的轴向压应力,导致水分进入或流出髓核组织,使得髓核组织的原位渗透压在450~ 550 mOsm/kg波动[6]。课题组和既往研究表明高渗透压环境促进髓核细胞凋亡[7],但相关机制目前不明确。
水通道蛋白(aquaporin-3,AQPs)是一种跨细胞膜的水孔蛋白,可以调控细胞对水和其他小分子的通透性[8-9]。既往研究报道小鼠椎间盘脊索细胞中AQPs表达受渗透压环境影响,且参与调控脊索细胞分化和凋亡[10]。AQP-3是水通道蛋白家族中的重要成员之一,在大鼠和人的髓核组织以及纤维环组织中都有表达,有研究证实相比于正常的椎间盘,退变椎间盘中的AQP-3表达显著降低[11-13]。本研究旨在探讨不同渗透压环境下髓核细胞AQP-3表达与髓核细胞凋亡的关系,并探讨AQP-3是否参与高渗透压诱导髓核细胞凋亡。
1 材料与方法 1.1 材料 1.1.1 动物SD大鼠30只,12周龄,雌性,体质量约300 g,购自陆军军医大学实验动物中心。所有动物实验均获得陆军军医大学第一附属医院动物伦理委员会批准[SYXK(YU)2012-0012]。
1.1.2 主要试剂及仪器试剂:DMEM/F-12培养基(Gibco公司,美国),胎牛血清(Gibco公司,美国),青霉素-链霉素(Gibco公司,美国),0.2%胰酶(Gibco公司,美国),Ⅱ型胶原酶(Sigma公司,美国),氯化钠(Sigma公司,美国),AQP-3过表达慢病毒(上海吉玛公司),U0126(上海碧云天),RNA逆转录试剂盒(Roche公司,美国),荧光定量PCR试剂盒(Roche公司,美国),PCR引物(上海英骏公司),cleaved caspase3抗体(Cell Signaling Technology公司,美国),Bcl-2抗体(ProteinTech公司, 美国),Bax抗体(ProteinTech公司, 美国),β-actin抗体(ProteinTech公司, 美国),AQP-3抗体(abcam公司,美国),BCA蛋白试剂盒(上海碧云天),RIPA裂解液(上海碧云天),Annexin V-APC/PI(南京凯基生物)。
仪器:多功能酶标仪(Thermo公司,美国),流式细胞仪(NovoCyte公司,美国),定量PCR仪器(Bio-Rad公司,美国),显微镜(Olympus BX51,日本),凝胶成像系统(Bio-Rad公司,美国)。
1.2 方法 1.2.1 大鼠髓核细胞的提取与培养通过过量CO2吸入将大鼠处死,在无菌条件下分离大鼠腰椎(L1~L5)椎间盘, 用11号尖刀片获取椎间盘内部髓核组织后,相继在37 ℃培养箱中进行酶消化处理(0.25%胰酶消化3~5 min,0.25%Ⅱ型胶原酶消化5~10 min),再由200目的细胞筛网进行过滤,用含有10%胎牛血清和1%青霉素-链霉素的DMEM/F12培养基悬浮细胞,放入37 ℃、5%CO2的孵箱中进行培养。待细胞扩增至80%~90%后进行传代。取P2代髓核细胞进行相关实验。
1.2.2 髓核细胞过表达慢病毒的转染将髓核细胞接种于6孔板中,待细胞扩增至50%,更换培养基并加入过表达慢病毒LV5-AQP-3和阴性对照(空载病毒),培养48 h后进行传代,并使用含有1 μg/mL嘌呤霉素的完全培养基进行加压筛选,获得AQP-3过表达的髓核细胞(NP-AQP-3)和阴性对照髓核细胞(NP-AQP-3-NC),并通过定量PCR和Western blot验证过表达效果。
1.2.3 CCK-8法检测髓核细胞增殖髓核细胞以2×103接种至96孔板中,待细胞贴壁后,分别更换330和550 mOsm/kg的培养基,待培养12、24、48、72 h后,添加10 μL的CCK-8试剂,37 ℃中孵育2 h后,使用多功能酶标仪读取450 nm的光密度值[D(450)]。
1.2.4 流式细胞仪检测髓核细胞凋亡率髓核细胞在不同渗透压条件培养后,通过胰酶消化法获取髓核细胞悬液,并使用Annexin V-APC/PI(凯基生物)双染细胞凋亡检测试剂盒,将细胞悬液离心后,加入结合液重悬细胞,并加入5 μL Annexin V-APC和10 μL的PI染色液,避光冰上孵育20 min后,使用流式细胞仪进行上机检测,将双染的晚期凋亡细胞和Annexin V-APC单染的早期凋亡细胞计为凋亡细胞。
1.2.5 免疫细胞化学法检测髓核细胞AQP-3表达髓核细胞以2×104接种至24孔板中的细胞爬片,在不同渗透压下培养细胞融合度至60%~70%后,使用4%多聚甲醛固定髓核细胞,并用5%胎牛血清进行封闭,使用一抗AQP-3(Abcam,ab125219,1 :100稀释)4 ℃孵育过夜,再用相应的HRP二抗(ZSGB-BIO,1 :200稀释)37 ℃孵育1 h,经DAB显色,并通过显微镜获取图像(Olympus BX51,日本)。
1.2.6 RNA提取和定量PCR检测使用TRIzol法(Invitrogen)提取髓核细胞的总RNA,并按照Roche逆转录试剂盒(4897030001)进行cDNA的合成。以cDNA、引物(表 1)以及SYBR混合物(Roche, 6924204001)配置10 μL的反应体系进行定量PCR的检测。将β-actin作为内参基因,使用2-ΔΔCt法计算基因的相对表达量。
| 基因 | 引物序列(5′→3′) |
| β-actin | 正义链 CCGCGAGTACAACCTTCTTG |
| 反义链 TGACCCATACCCACCATCAC | |
| Bcl-2 | 正义链 GGGGCTACGAGTGGGATACT |
| 反义链 GACGGTAGCGACGAGAGAAG | |
| Bax | 正义链 GGCGAATTGGCGATGAACTG |
| 反义链 CCCAGTTGAAGTTGCCGTCT | |
| Caspase3 | 正义链 GGAGCTTGGAACGCGAAGA |
| 反义链 ACACAAGCCCATTTCAGGGT | |
| AQP-3 | 正义链 AGAAGGAGTTGATGAACCGTTGCG |
| 反义链 AACCACAGCCGAACATCACAAGG |
1.2.7 Western blot检测
使用RIPA裂解液提取各组髓核细胞的总蛋白,并测定蛋白浓度。通过SDS-PAGE电泳分离蛋白,并转印至PVDF膜上,室温条件下5%脱脂奶粉封闭2 h,加入特异性一抗4 ℃过夜(GAPDH: Proteintech, 60004-1-Ig;Bax:Proteintech, 60267-1;Bcl-2: Proteintech, 12789-1-AP;cleaved-caspase3: CST, 9661T,一抗以1 :1 000稀释),并用相应的二抗室温孵育2 h,使用ECL超敏发光液检测蛋白条带。以GAPDH作为对照,使用Image J软件分析蛋白条带灰度值,计算蛋白相对表达。
1.2.8 统计学分析使用SPSS 20.0软件进行统计学分析,计量资料以x±s表示,两样本组间比较采用t检验,多样本比较采用单因素方差分析,各组间的两两比较采用LSD法。检验水准α=0.05。
2 结果 2.1 高渗透压条件下髓核细胞增殖降低CCK-8结果显示:相比于330 mOsm/kg渗透压培养的髓核细胞,在550 mOsm/kg渗透压条件下,髓核细胞培养12、24、48、72 h时的细胞增殖明显降低(P < 0.05,图 1)。
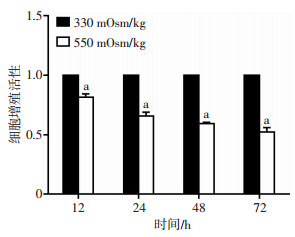
|
| a:P < 0.05,与330 mOsm/kg比较 图 1 CCK-8检测髓核细胞在不同渗透压环境培养12、24、48、72 h的增殖活性(n=3) |
2.2 高渗透压条件下髓核细胞凋亡增加
流式细胞分析结果显示:与330 mOsm/kg渗透压比较,550 mOsm/kg渗透压条件下,髓核细胞凋亡率显著增加(P < 0.05,图 2A)。同时,Western blot(图 2B)和定量PCR(图 2C)检测结果显示:与330 mOsm/kg渗透压相比,550 mOsm/kg渗透压条件下髓核细胞的抗凋亡分子Bcl-2表达显著降低(P < 0.05),促凋亡分子Bax和cleaved caspase 3/caspase 3表达明显增多(P < 0.05)。提示高渗透压条件促进髓核细胞凋亡。
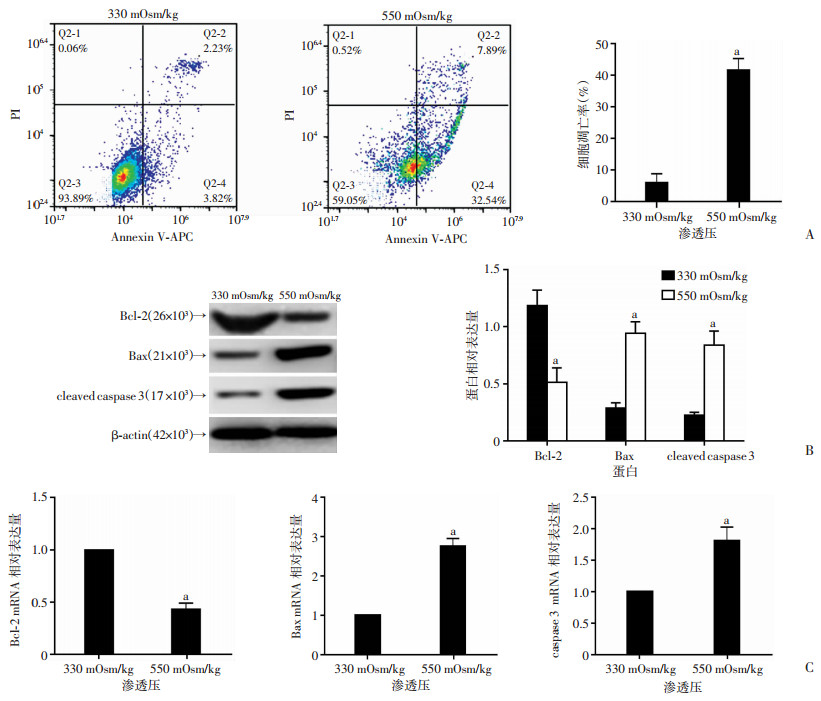
|
| A:流式细胞分析不同渗透压环境的髓核细胞凋亡及统计分析;B:Western blot检测凋亡相关分子及定量分析;C:定量PCR分析凋亡相关分子Bcl-2、Bax、caspase 3的表达;a: P < 0.05,与330 mOsm/kg比较 图 2 流式细胞、定量PCR及Western blot检测不同渗透压条件髓核细胞凋亡 |
2.3 高渗透压条件下髓核细胞AQP-3表达下降
采用免疫组化检测550和330 mOsm/kg渗透压中髓核细胞AQP-3的表达,结果显示:与330 mOsm/kg渗透压比较,550 mOsm/kg渗透压下髓核细胞的AQP-3表达明显减少(图 3A),并且Western blot和定量PCR提示550 mOsm/kg渗透压下髓核细胞AQP-3的基因表达(图 3B)和蛋白表达(图 3C)均明显减少(P < 0.05)。上述结果提示高渗透压环境降低髓核细胞AQP-3表达。
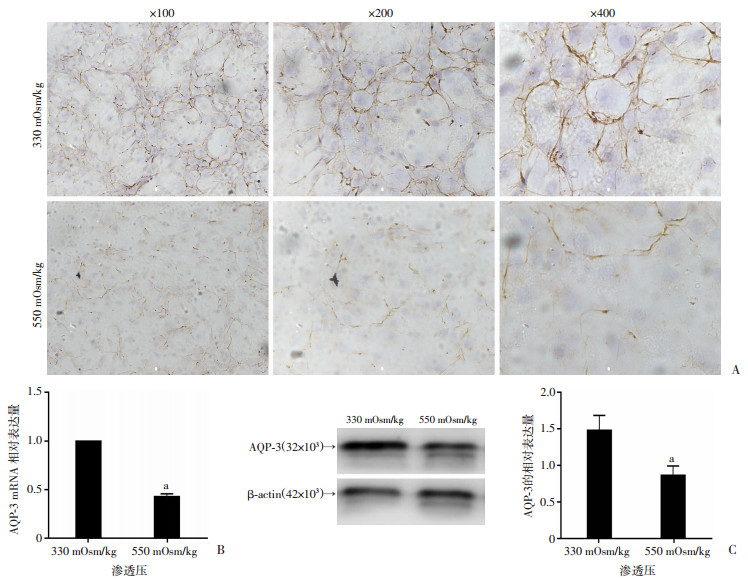
|
| A:免疫细胞化学检测细胞膜蛋白AQP-3的表达;B:定量PCR分析不同渗透压环境AQP-3 mRNA的表达;C:Western blot检测AQP-3的表达及定量分析;a: P < 0.05,与330 mOsm/kg比较 图 3 免疫组化、定量PCR及Western blot检测不同渗透压条件下髓核细胞AQP-3表达 |
2.4 髓核细胞AQP-3过表达效果验证
髓核细胞转染AQP-3过表达慢病毒NP-AQP-3后,AQP-3的mRNA和蛋白表达水平明显高于空载慢病毒转染的髓核细胞NP-AQP-3-NC和空白对照组髓核细胞NP-CN(P < 0.05),并且NP-AQP-3-NC和NP-CN的AQP-3 mRNA和蛋白表达水平无统计学差异(图 4)。
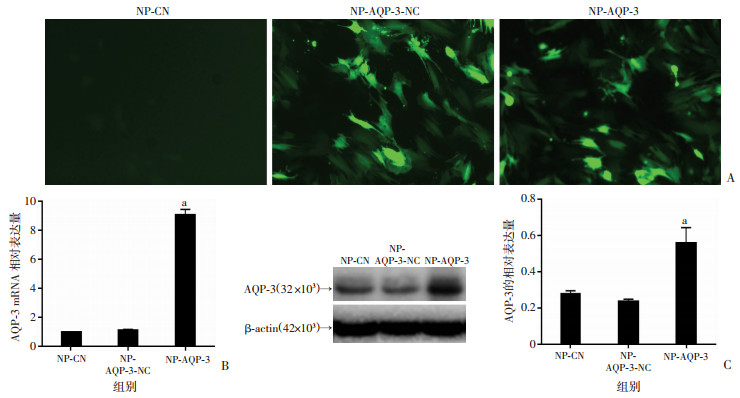
|
| A:荧光显微镜观察AQP-3过表达慢病毒感染效率(×100);B:定量PCR分析AQP-3的表达(n=3);C:Western blot检测AQP-3表达及定量分析(n=3);a: P < 0.05,与NP-CN比较 图 4 定量PCR、Western blot检测髓核细胞AQP-3过表达效果 |
2.5 过表达AQP-3可缓解高渗透压环境中髓核细胞凋亡
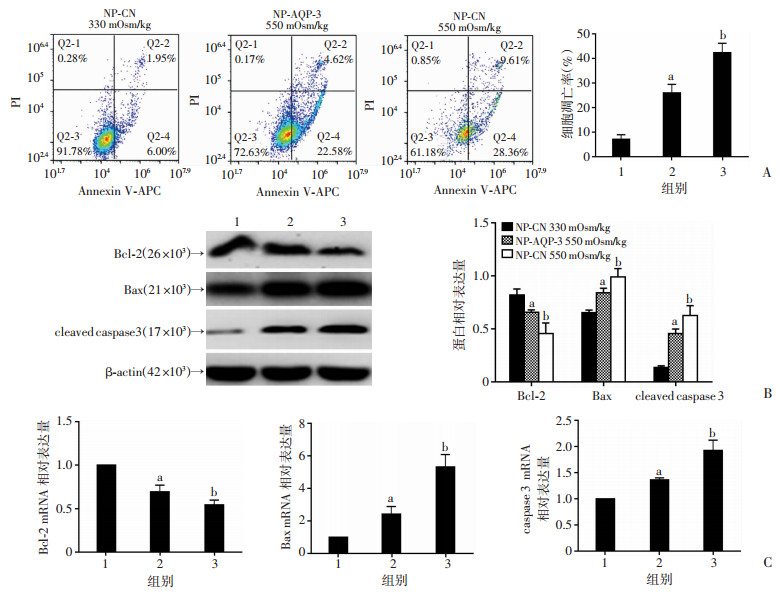
流式细胞分析结果显示:相比于NP-AQP-3-NC,AQP-3过表达的髓核细胞NP-AQP-3在550 mOsm/kg渗透压条件下,细胞凋亡率降低(图 5A)。Western blot(图 5B)和定量PCR(图 5C)检测结果显示髓核细胞的抗凋亡分子Bcl-2表达显著增加(P < 0.05),促凋亡分子Bax和cleaved caspase 3/caspase 3表达显著降低(P < 0.05)。但与330 mOsm/kg渗透压条件比较,550 mOsm/kg渗透压条件下髓核细胞AQP-3过表达后,髓核细胞凋亡率仍明显增加,且抗凋亡分子Bcl-2表达明显降低,促凋亡分子Bax和cleaved caspase 3/caspase 3表达明显增高(P < 0.05)。
|
| A:流式细胞分析不同渗透压环境的髓核细胞凋亡及统计结果;B:Western blot检测凋亡相关分子的表达及定量分析;C:定量PCR分析凋亡相关分子Bcl-2、Bax及caspase3 mRNA的表达;1:NP-CN 330 mOsm/kg;2:NP-AQP-3 550 mOsm/kg;3:NP-CN 550 mOsm/kg;a:P < 0.05,与NP-CN 330 mOsm/kg比较;b: P < 0.05,与NP-AQP-3 550 mOsm/kg比较 图 5 流式细胞分析、定量PCR及Western blot检测AQP-3过表达髓核细胞凋亡 |
3 讨论
椎间盘退行性改变是腰痛的主要病因之一。椎间盘由终板软骨、纤维环和髓核三部分组成,受到年龄、遗传、脊柱生物力学、糖尿病、自身免疫等多种因素影响而发生退行性改变。髓核组织退变主要表现为髓核细胞凋亡、衰老,胞外基质合成减少、分解增加,以及炎症因子等微环境的改变[14-15]。髓核组织是一具有高亲水特性的凝胶状组织,因日常活动中椎间盘受轴向压应力大小的不同,髓核组织的渗透压在450~550 mOsm/kg间波动,远高于人体其他细胞外液的正常渗透压。既往研究报道550 mOsm/kg高渗透压会导致核碎片、染色质浓缩和细胞器破坏等细胞凋亡样病理改变,而与髓核组织原位渗透压接近的450 mOsm/kg渗透压环境对髓核细胞凋亡影响较小[16]。本研究主要观察了不同渗透压环境中髓核细胞凋亡和AQP-3表达情况,并探讨了AQP-3是否参与高渗透压诱导髓核细胞凋亡。结果表明高渗透压显著促进髓核细胞的凋亡并降低AQP-3的表达;但过表达AQP-3可缓解高渗透压环境下髓核细胞凋亡。本研究揭示了AQP-3在高渗透压环境介导髓核细胞凋亡中的作用,为进一步认识AQP-3在椎间盘退变中的作用奠定了理论基础。
水通蛋白3(AQP-3)作为跨膜转运蛋白,对水、甘油等小分子具有通透性而称水甘油通道,借助细胞内外渗透压差实现水分子转运[8]。既往研究指出AQP-3在调控某些细胞凋亡中发挥作用,如敲除AQP-3可促进小鼠结肠炎模型中上皮细胞凋亡[17]。人退变椎间盘髓核组织细胞中AQP-3的表达明显低于人正常椎间盘髓核组织[13],近年来在角质形成细胞中证实AQP-3可以转运H2O2而加速银屑病的进展[18],而H2O2可以刺激细胞产生氧化应激进而发生髓核细胞凋亡,过表达AQP-3可以缓解H2O2诱导的大鼠髓核细胞凋亡[19]。以上研究提示AQP-3与细胞凋亡密切相关。
本实验选取人体细胞外液渗透压330 mOsm/kg作为对照组(低渗透压),550 mOsm/kg作为实验组(高渗透压),分别培养髓核细胞3 d。结果显示550 mOsm/kg的高渗透压环境中,髓核细胞增殖降低,流式细胞分析中细胞凋亡率增加,Western blot和定量PCR检测示髓核细胞促凋亡分子Bax和cleaved caspase 3/caspase 3表达增高,抗凋亡分子Bcl-2表达降低, 以上结果提示高渗透压环境促进髓核细胞凋亡。本课题组前期在猪椎间盘器官培养模型中同样发现550 mOsm/kg的高渗透压环境可减少髓核细胞蛋白聚糖、Ⅱ型胶原等胞外基质的合成,并促进髓核细胞发生凋亡[6-7]。同样,JIAO等[20]的一项研究结果与本研究结果相一致,但其在实验中选取430 mOsm/kg渗透压作为对照,考虑到430 mOsm/kg的渗透压相对于人体其他组织渗透压而言,仍属于轻度增高,所以本研究选择更接近人体细胞外液渗透压的330 mOsm/kg作为对照,发现550 mOsm/kg的高渗透压可诱导髓核细胞发生凋亡。本研究同时发现与330 mOsm/kg的低渗透压环境中髓核细胞比较,550 mOsm/kg的高渗透压环境中髓核细胞AQP-3的基因和蛋白表达水平明显降低,因此我们推测高渗透压环境中,AQP-3表达降低可能与髓核细胞凋亡相关。既往PALACIO-MANCHENO等[10]发现C57BL/6小鼠的椎间盘在高渗环境中培养14 d后,其脊索细胞中AQP-3的表达上调,这与本研究结果不一致。由于脊索细胞对渗透压的敏感性不同于髓核细胞,我们推测细胞种类不同可能是导致不同研究结果的原因[21],但这需要进一步的对比实验证明。为了探讨高渗透压环境下,AQP-3表达与髓核细胞凋亡是否相关,我们借助具有低细胞毒性和高表达效果的慢病毒进一步获得AQP-3过表达的髓核细胞。结果显示在550 mOsm/kg的环境中,相比于正常的髓核细胞,AQP-3过表达后髓核细胞的凋亡率降低,并且Western blot和定量PCR显示AQP-3过表达的髓核细胞促凋亡分子Bax和cleaved caspase 3/caspase 3表达降低,抗凋亡分子Bcl-2表达增高。进一步表明在高渗环境下,髓核细胞凋亡与AQP-3表达下调密切相关,过表达髓核细胞AQP-3可减轻高渗环境中髓核细胞凋亡。
本研究仍有一定的局限性:①本研究选取大鼠的髓核细胞进行实验,而大鼠髓核组织中含有较多的脊索细胞,成人的椎间盘组织却并非如此,脊索细胞在不同渗透压环境中的分化和凋亡影响也不完全和髓核细胞一致[21],因此混杂的脊索细胞可能会对本研究结果造成干扰。②本实验仅从体外细胞水平证明AQP-3过表达可以缓解高渗环境导致的髓核细胞凋亡,由于高渗诱导髓核细胞凋亡的动物模型目前尚未建立[22],本实验结果没有在体内进行验证。③近年来,为深入研究椎间盘退变的机制,髓核细胞的凋亡、焦亡等细胞死亡现象广受关注,同时髓核组织的微环境作用也越来越被重视[23]。在炎症因子、氧含量、氧化应激产物、生长因子、周期性压应力等微环境变化与髓核细胞命运改变的关系研究中取得较多进展[24]。AQP-3位于细胞膜,直接受微环境影响,并通过通道转运、信号转导和细胞内发生联系,但本研究中AQP-3调控高渗透压环境中髓核细胞凋亡的具体信号传导机制尚需要进一步研究。
综上所述,本研究观察了不同渗透压环境中髓核细胞凋亡和AQP-3表达情况,并探讨了AQP-3是否参与高渗透压诱导髓核细胞凋亡。结果表明:高渗透压显著促进髓核细胞的凋亡并降低AQP-3的表达,增强髓核细胞AQP-3表达可缓解高渗透压环境下髓核细胞凋亡。本研究揭示了AQP-3在高渗透压环境介导髓核细胞凋亡中的作用,为进一步认识AQP-3在椎间盘退变中的作用奠定了理论基础,也为椎间盘退变的生物治疗提供了参考治疗靶点。
| [1] |
LUOMA K, RⅡHIMÄKI H, LUUKKONEN R, et al. Low back pain in relation to lumbar disc degeneration[J]. Spine, 2000, 25(4): 487-492. DOI:10.1097/00007632-200002150-00016 |
| [2] |
DI MARTINO A, VACCARO A R, LEE J Y, et al. Nucleus pulposus replacement: basic science and indications for clinical use[J]. Spine, 2005, 30(16 Suppl): S16-S22. DOI:10.1097/01.brs.0000174530.88585.32 |
| [3] |
PARK J B, PARK I C, PARK S J, et al. Anti-apoptotic effects of caspase inhibitors on rat intervertebral disc cells[J]. J Bone Joint Surg Am, 2006, 88(4): 771-779. DOI:10.2106/JBJS.E.00762 |
| [4] |
FAN D, SHAO Z W, XIONG L M. Cell death in intervertebral disc degeneration[J]. Apoptosis, 2013, 18(7): 777-785. DOI:10.1007/s10495-013-0839-1 |
| [5] |
SUDO H, MINAMI A. Regulation of apoptosis in nucleus pulposus cells by optimized exogenous Bcl-2 overexpression[J]. J Orthop Res, 2010, 28(12): 1608-1613. DOI:10.1002/jor.21185 |
| [6] |
LI P, GAN Y B, XU Y, et al. Osmolarity affects matrix synthesis in the nucleus pulposus associated with the involvement of MAPK pathways: a study of ex vivo disc organ culture system[J]. J Orthop Res, 2016, 34(6): 1092-1100. DOI:10.1002/jor.23106 |
| [7] |
LI P, GAN Y B, WANG H M, et al. Role of the ERK1/2 pathway in osmolarity effects on nucleus pulposus cell apoptosis in a disc perfusion culture[J]. J Orthop Res, 2017, 35(1): 86-92. DOI:10.1002/jor.23249 |
| [8] |
CHEN Q, PENG H Y, LEI L, et al. Aquaporin3 is a sperm water channel essential for postcopulatory sperm osmoadaptation and migration[J]. Cell Res, 2011, 21(6): 922-933. DOI:10.1038/cr.2010.169 |
| [9] |
DAI J Y, LIN W H, ZHENG M Y, et al. Alterations in AQP4 expression and polarization in the course of motor neuron degeneration in SOD1G93A mice[J]. Mol Med Rep, 2017, 16(2): 1739-1746. DOI:10.3892/mmr.2017.6786 |
| [10] |
PALACIO-MANCHENO P E, EVASHWICK-ROGLER T W, LAUDIER D M, et al. Hyperosmolarity induces notochordal cell differentiation with aquaporin3 upregulation and reduced N-cadherin expression[J]. J Orthop Res, 2018, 36(2): 788-798. DOI:10.1002/jor.23715 |
| [11] |
RICHARDSON S M, KNOWLES R, MARPLES D, et al. Aquaporin expression in the human intervertebral disc[J]. J Mol Histol, 2008, 39(3): 303-309. DOI:10.1007/s10735-008-9166-1 |
| [12] |
TAŞ U, CAYLı S, INANıR A, et al. Aquaporin-1 and aquaporin-3 expressions in the intervertebral disc of rats with aging[J]. Balkan Med J, 2012, 29(4): 349-353. DOI:10.5152/balkanmedj.2012.079 |
| [13] |
LI S B, YANG K S, ZHANG Y T. Expression of aquaporins 1 and 3 in degenerative tissue of the lumbar intervertebral disc[J]. Genet Mol Res, 2014, 13(4): 8225-8233. DOI:10.4238/2014.October.8.4 |
| [14] |
ZHANG F, ZHAO X L, SHEN H X, et al. Molecular mechanisms of cell death in intervertebral disc degeneration (Review)[J]. Int J Mol Med, 2016, 37(6): 1439-1448. DOI:10.3892/ijmm.2016.2573 |
| [15] |
DOWDELL J, ERWIN M, CHOMA T, et al. Intervertebral disk degeneration and repair[J]. Neurosurgery, 2017, 80(3S): S46-S54. DOI:10.1093/neuros/nyw078 |
| [16] |
TAKENO K, KOBAYASHI S, NEGORO K, et al. Physical limitations to tissue engineering of intervertebral disc cells: effect of extracellular osmotic change on glycosaminoglycan production and cell metabolism. Laboratory investigation[J]. J Neurosurg Spine, 2007, 7(6): 637-644. DOI:10.3171/SPI-07/12/637 |
| [17] |
THIAGARAJAH J R, ZHAO D, VERKMAN A S. Impaired enterocyte proliferation in aquaporin-3 deficiency in mouse models of colitis[J]. Gut, 2007, 56(11): 1529-1535. DOI:10.1136/gut.2006.104620 |
| [18] |
HARA-CHIKUMA M, SATOOKA H, WATANABE S, et al. Aquaporin-3-mediated hydrogen peroxide transport is required for NF-κB signalling in keratinocytes and development of psoriasis[J]. Nat Commun, 2015, 6: 7454. DOI:10.1038/ncomms8454 |
| [19] |
XU Y C, YAO H, WANG Q Y, et al. Aquaporin-3 attenuates oxidative stress-induced nucleus pulposus cell apoptosis through regulating the P38 MAPK pathway[J]. Cell Physiol Biochem, 2018, 50(5): 1687-1697. DOI:10.1159/000494788 |
| [20] |
JIAO S G, LI J X, LIU B B, et al. Nucleus pulposus cell apoptosis is attenuated by CDMP-2 through regulating oxidative damage under the hyperosmotic environment[J]. Biosci Rep, 2018, 38(5): BSR20181176. DOI:10.1042/BSR20181176 |
| [21] |
PALACIO-MANCHENO P E, EVASHWICK-ROGLER T W, LAUDIER D M, et al. Hyperosmolarity induces notochordal cell differentiation with aquaporin3 upregulation and reduced N-cadherin expression[J]. J Orthop Res, 2018, 36(2): 788-798. DOI:10.1002/jor.23715 |
| [22] |
CUNHA C, LAMAS S, GONÇALVES R M, et al. Joint analysis of IVD herniation and degeneration by rat caudal needle puncture model[J]. J Orthop Res, 2017, 35(2): 258-268. DOI:10.1002/jor.23114 |
| [23] |
MA K, CHEN S, LI Z, et al. Mechanisms of endogenous repair failure during intervertebral disc degeneration[J]. Osteoarthr Cartil, 2019, 27(1): 41-48. DOI:10.1016/j.joca.2018.08.021 |
| [24] |
WALTER B A, PURMESSUR D, LIKHITPANICHKUL M, et al. Inflammatory kinetics and efficacy of anti-inflammatory treatments on human nucleus pulposus cells[J]. Spine, 2015, 40(13): 955-963. DOI:10.1097/BRS.0000000000000932 |



