2. 473009 河南 南阳,河南省南阳市中心医院:肿瘤内科
2. Department of Oncology, Nanyang Central Hospital, Nanyang, Henan Province, 473009, China
MicroRNAs(miRNA)是一类内源性的单链非编码单链小分子RNA,其通常长度为17~24个核苷酸,其能够与靶基因的mRNA互补序列结合从而引起mRNA的降解或抑制翻译过程[1]。研究发现,miRNA在多种肿瘤中发挥至关重要的作用,广泛参与肿瘤的细胞增殖、血管形成、细胞凋亡、侵袭及转移等生物学过程[2]。miR-124在已被证实在多种肿瘤中发挥类似抑瘤基因的功能,但其在膀胱癌中的生物学功能及作用机制仍未见相关报道[3-4]。因此,本研究拟通过用实时荧光定量聚合酶链反应(real-time quantitative polymerasechain reaction, RT-qPCR)和原位杂交技术检测114例膀胱癌细胞及组织中的表达情况,探讨其表达水平与膀胱癌临床病理特征及预后的关系,分析miR-124表达改变对生物学功能的影响并探讨其相关机制,旨在为膀胱癌的治疗、诊断及预后标志物的开发提供参考来源和理论基础。
1 材料与方法 1.1 检测对象人正常膀胱上皮细胞SV-HUC-1及膀胱癌细胞株5637、J82、T24、TCCSUP、UMUC3均购于中国科学院细胞库。临床标本取自2013年1月至2016年1月我院114例行根治性膀胱切除术,纳入患者术前均未行放化疗及免疫治疗等治疗,均经组织病理学证实为膀胱尿路上皮癌及癌旁组织(癌旁组织选择距癌灶边缘5 cm以上),患者住院资料均完整。其中男性74例,女性40例,年龄35~77(62.5±8.3)岁;TNM分期Ⅰ~Ⅱ期患者69例,Ⅲ~Ⅳ期患者45例;高、中分化患者63例,低分化患者51例。所有的组织样本采集后均立即置于液氮中保存。本研究经我院伦理委员会批准(批件号:2012-0064)。
1.2 主要试剂RPMI 1640、DMEM、F12K培养液及PBS购自美国GIBCO公司;胎牛血清购于杭四季青公司;TRIzol试剂购自美国Invitrogen公司;DEPC水购自武汉塞维尔生物技术有限公司;反转录及miRNA荧光定量检测试剂盒(SYBR Green)购自大连宝生物公司,miR-124原位杂交探针序列、miR-124模拟物(miR-124 mimic)、miR-124抑制剂(miR-124 inhibitor)及其阴性对照(miRNA-NC)均购自广州锐博生物公司;封闭液和预杂交液均购自福州迈新生物公司。脂质体Lipofectamine 2000均购自美国Invitrogen公司。CCK-8细胞增殖试剂盒购自碧云天生物科技有限公司;兔抗人PCNA、Ki-67、AKT、p-AKT和β-actin单克隆抗体以及辣根过氧化物标记的二抗均购自美国CST公司。
1.3 方法 1.3.1 细胞培养SV-HUC-1细胞使用含有10%胎牛血清和1%青霉素链霉素的F12K培养基培养;J82细胞使用含有10%胎牛血清和1%青霉素链霉素的DMEM培养;5637、T24、TCCSUP、UMUC-3细胞于含10%胎牛血清和1%青霉素链霉素的RPMI 1640培养基中培养;细胞置于37 ℃、5% CO2的恒温培养箱中培养。
1.3.2 实时荧光定量PCR用TRIzol® RNA提取试剂(Invitrogen公司)提取总RNA,采用PTC-100/PTC-200型PCR仪按RT试剂盒说明反转录合成cDNA链;采用Applied Biosystems7500 RT-PCR system按说明进行PCR检测,设3个复孔,以看家基因GAPDH和U6作为内参,miR-124及U6引物序列为:miR-124上游引物序列为5′- ATGGCGGATGAAGTAATCGCG-3′,下游引物序列为5′-GAAACTCACAACTTGATCAGTTC-3′;U6上游引物序列为5′-ACAGCGTGCTAGATCATCAGC-3′;下游引物序列为5′-GGTCATGAGTCAGCCACGAT-3′。反应条件:95 ℃ 3 min;95 ℃ 15 s、60 ℃ 35 s,循环40次;计算各组CT值,采用定量PCR中的相对定量法及2-△△Ct计算miRNA的表达水平。
1.3.3 原位杂交将切除的新鲜标本尽快在4%多聚甲醛中固定4 h,以免mRNA降解,制作石蜡切片并切厚度为4 μm的连续切片;将石蜡切片行二甲苯脱蜡,水洗,3%H2O2室温作用10 min,水洗2次;在切片上加入1 mL 3%柠檬酸和2滴胃蛋白酶,混匀37 ℃消化20 min;PBS洗3次,每次5 min,再水洗1次;湿盒底部加20%甘油保湿,每个蜡块20 μL预杂交液,置于38 ℃恒温箱3 h;每个蜡块20 μL杂交液,将原位杂交专用盖玻片盖在切片上,在杂交仪中42 ℃杂交过夜;依次置于2×柠檬酸盐缓冲盐酸液(Saline sodium citrate buffer, SSC)液5 min、0.5×SSC液15 min、0.2×SSC液15 min洗涤;滴加封闭液,37 ℃恒温孵育30 min;滴加生物素化鼠抗地高辛,37 ℃恒温孵育60 min;PBS洗4次,每次5 min;加DAB显色液,苏木精复染,酒精脱水,二甲苯透明;最后中性树胶封片,显微镜观察。
1.3.4 原位杂交结果分析根据组织阳性着色程度评分:无着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分;根据组织中的阳性细胞数计分:0%~10%为1分;>10%~50%为2分;>50%~75%为3分;>75%为4分。两种评分方法乘积得到判定阳性结果:两者乘积 < 8为低表达,≥8为高表达。
1.3.5 病例随访随访调查患者死亡时间及原因以及发生远处转移的时间,观测患者总生存期(overall survival, OS)及无病生存期(disease-free survival, DFS)。随访从第一次明确诊断开始,到发生远处转移时间或死亡时间或末次随访时间;发现患者死亡或转移随访即终结,随访截止时间为2019年1月1日。
1.3.6 CCK-8增殖试验严格参照CCK-8试剂盒说明书的步骤进行试验,分为3组:分别将miRNA-NC(miRNA-NC组)、miRNA-124 mimics(miRNA-124 mimics组)和miR-124 inhibitor(miR-124 inhibitor组)转染至膀胱癌T24细胞,并转染后的细胞接种于96孔板中并置于恒温培养箱培养,待细胞贴壁后,分别于0、24、48、72 h时间点加入10 μL CCK-8,继续置于37 ℃恒温培养箱培养2~4 h,使用酶联免疫检测仪于450 nm波长处检测各组的细胞光密度值[D(450)],计算增殖率。
1.3.7 蛋白质免疫印迹(Western blot)试验经过处理的细胞铺种在6孔板中,待细胞生长良好吸去旧培养基,PBS冲洗细胞1~2次。加入含蛋白酶抑制剂(PMSF)的RIPA裂解液,细胞刮刀将细胞刮下收集至EP管中,冰上裂解细胞30 min,高速离心并收集上清,即为细胞的总蛋白,并置于-80 ℃冰箱保存;BCA法对蛋白进行定量,完成后加入上样缓冲液混匀,煮沸5 min变性。配置的相应浓度的分离胶和浓缩胶,加样并进行电泳,后进行转膜操作,转膜完成后用10%脱脂牛奶封闭1 h,TBST洗膜1~2次,裁剪条带后加入一抗4 ℃过夜孵育。第二日取出PVDF膜并用TBST洗涤3~5次,每次5 min;随后加入二抗孵育1 h,TBST洗涤3~5次,ECL发光试剂盒进行显影,化学发光仪检测并拍照。
1.4 统计学处理采用SPSS 20.0统计软件,计量资料以x±s表示,多组间比较采用单因素方差分析和LSD-t检验;计数资料以百分数表示,采用χ2检验。使用Kaplan-Meier绘制生存曲线,采用Log-rank分析miR-124与膀胱癌患者临床预后的关系。
2 结果 2.1 miR-124在人正常膀胱尿路上皮及膀胱癌细胞中的表达qPCR检测miR-124在人正常膀胱尿路上皮细胞及膀胱癌细胞中的表达,结果发现,与人正常膀胱尿路上皮细胞SV-HUC-1比较,膀胱癌细胞5637、J82、T24、TCCSUP、UMUC3中miR-124的表达水平明显降低(t= 16.37, P < 0.01; t=29.99, P < 0.01; t=50.84, P < 0.01; t=28.3, P < 0.01;t=56.95, P < 0.01,图 1)。
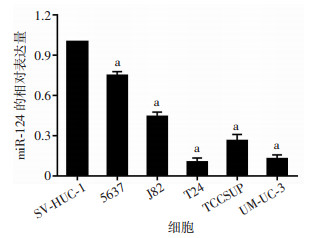
|
| a:P < 0.01,与SV-HUC-1比较 图 1 qPCR检测miR-124在人正常膀胱尿路上皮及膀胱癌细胞中的表达(n=3,x±s) |
2.2 miR-124在膀胱癌组织中的表达及与临床病理参数的关系
采用原位杂交技术检测114例膀胱癌组织及癌旁正常组织中miR-124的表达。结果显示,miR-124蛋白主要定位于细胞质,染色呈棕褐色,在正常膀胱组织中明显高表达,在癌组织中显著低表达(图 2);miR-124正常膀胱组织呈阳性表达有81例,在膀胱癌组织呈阳性表达有42例,miR-124在正常膀胱组织的阳性表达显著高于膀胱癌组织(P < 0.001)。相关性分析表明,miR-124低表达与膀胱癌临床T分期、淋巴结转移及肿瘤分化程度密切相关(P < 0.05),但与性别、年龄、远处转移等无明显相关性(P>0.05),见表 2。
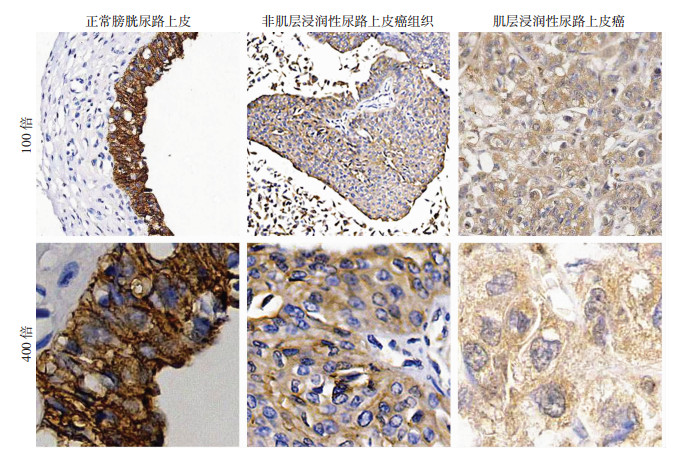
|
| 图 2 原位杂交技术检测miR-124在正常膀胱组织、非浸润性及浸润性膀胱癌组织中的表达 |
| 临床病理参数 | n | 低表达组 | 高表达组 | χ2 | P |
| 性别 | |||||
| 男 | 74 | 46(45.61) | 28(54.39) | 0.090 | 0.764 |
| 女 | 40 | 26(66.67) | 14(33.33) | ||
| 年龄/岁 | |||||
| ≤60 | 67 | 46(43.59) | 21(56.41) | 2.122 | 0.146 |
| >60 | 47 | 26(62.5) | 21(37.5) | ||
| TNM分期 | |||||
| T1-T2 | 69 | 37(64.44) | 32(35.56) | 6.829 | 0.009 |
| T3-T4 | 45 | 35(22.22) | 10(77.78) | ||
| 淋巴结转移 | |||||
| N0 | 78 | 43(59.18) | 35(40.81) | 6.844 | 0.009 |
| N1-N3 | 36 | 29(21.42) | 7(78.57) | ||
| 远处转移 | |||||
| M0 | 86 | 57(53.45) | 29(46.55) | 1.466 | 0.226 |
| M1 | 28 | 15(33.33) | 13(66.67) | ||
| 分化程度 | |||||
| 中高分化 | 63 | 34(54.35) | 29(45.65) | 5.111 | 0.024 |
| 低分化 | 51 | 38(23.53) | 13(76.47) | ||
2.3 miR-124表达与膀胱癌患者预后的关系
将所收集的膀胱癌样本分成miR-124高表达组和miR-124低表达组,通过Kaplan-Meier法通过绘制生存曲线,分析miR-124表达与膀胱癌预后的关系,结果发现,miR-124高表达的膀胱癌患者中,3年患者随访中出现5例失访;miR-124低表达膀胱癌患者中,3年患者随访中出现4例失访;miR-124低表达组患者的总生存期(overall survival, OS)明显短于高表达组患者(χ2=22.7, P < 0.01);miR-124低表达组患者的无病生存期(disease-free survival, DFS)也明显短于高表达组患者(χ2=26.57, P < 0.01)。提示miR-124表达越低,膀胱癌患者预后越差。多因素分析结果提示,miR-124在膀胱中低表达是影响膀胱癌患者预后的独立危险因素(OS HR=4.63; 95% CI: 1.39~7.23; P=0.007; DFS HR=5.82; 95% CI: 1.56~11.42; P=0.003)。见图 3。
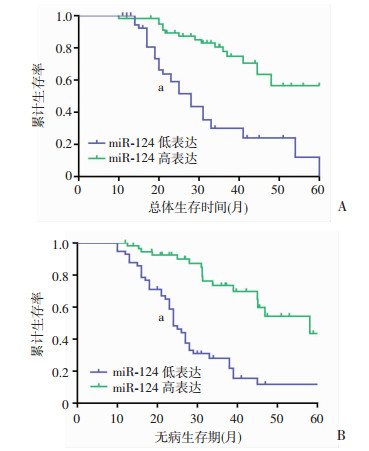
|
| A:总体生存期;B:无病生存期a:P < 0.01,与miR-124高表达组比较 图 3 miR-124表达水平与膀胱癌患者总生存期及无病生存期的关系 |
2.4 CCK-8法检测miR-124表达改变对膀胱癌细胞T24增殖能力的影响
采用CCK-8增殖试验检测3组T24细胞在0、24、48、72 h各时间点的增殖情况。结果表明,与对照组(miRNA-NC)相比,miR-124 mimics组各时间点的细胞增殖能力明显降低(P < 0.05);而miR-124 inhibitor组细胞增殖能力明显升高,差异均有统计学意义(P < 0.05,图 4)。
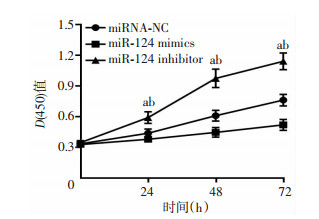
|
| a:P < 0.05,与miRNA-NC组比较;b:P < 0.05,与miR-124 mimics组比较 图 4 CCK-8检测各组膀胱癌细胞的增殖能力 (n=3,x±s) |
2.5 miR-124表达改变对膀胱癌细胞增殖相关蛋白及AKT信号通路的影响
为明确上调miR-124表达后,膀胱癌细胞增殖能力降低的潜在调控机制,采用Western blot检测miR-124表达改变后增殖相关蛋白PCNA、Ki-67及AKT信号通路蛋白的表达水平。结果显示,与miRNA-NC组比较,miR-124 mimics组T24细胞的增殖相关蛋白PCNA、Ki-67以及磷酸化的p-AKT蛋白表达水平降低(P < 0.05),而AKT蛋白表达水平未发生变化(P> 0.05);miR-124 inhibitor组中的PCNA、Ki-67及p-AKT的蛋白表达水平较miRNA-NC组和miR-124 mimics组升高(P < 0.05),而AKT蛋白表达水平未发生变化(P> 0.05),见图 5。
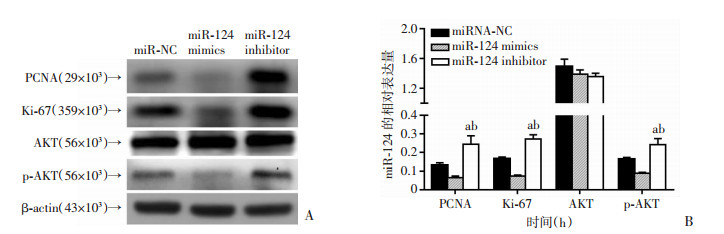
|
| A:Western blot检测结果;B:PCNA、Ki-67、AKT及p-AKT蛋白半定量分析(n=3,x±s) a:P < 0.05,与miRNA-NC组比较;b:P < 0.05,与miR-124 mimics组比较 图 5 Western blot检测PCNA、Ki-67、AKT及p-AKT蛋白的表达水平 |
3 讨论
膀胱癌是常见的癌症[5]。在我国,随着诊疗技术及筛查手段的提高,膀胱癌的发病率呈逐年递增趋势,男性膀胱癌的患病率是女性的3~4倍,现已位居全部恶性肿瘤中第十位[6]。早期膀胱癌患者症状不典型,多因出现血尿后前来就诊,往往大多数患者被确诊为膀胱癌时已发生转移,导致膀胱癌患者疗效欠佳且预后较差[7]。有研究指出,由于膀胱癌新的治疗药物进展缓慢以及治疗手段未有明显改进,导致膀胱癌近30年来生存率未得到明显改善[8]。因此,深入探究膀胱癌的分子机制及发病机理,寻找新的诊断标志物及分子治疗靶点,一直是目前研究重点与难点,对改善膀胱癌治疗效果、降低死亡率及改善患者预后具有至关重要的临床意义[9]。
miRNA作为生命过程的重要调控分子,与肿瘤的发生、发展关系密切[10]。研究发现,miRNA在多种肿瘤表型差异表达明显,提示其可作为肿瘤的诊断及预后标志物[11]。ZHANG等[12]采用miRNA表达谱确定了miR-191、miR-23-3p、miR-145、miR-328和miR-18a这5个血清miRNAs与非小细胞肺癌(non-small cell lung Cancer, NSCLC)患者的3年总生存率显著相关,提示他们可以作为晚期NSCLC患者的预后预测因子。研究报道,胃癌患者血清中高表达的miR-451和miR-16将预示着更高的总体生存率[13]。在ZHU等[14]采用表达谱芯片共筛选出了miR-16、miR-25、miR-92a、miR-451和miR-486-5p共5个miRNA在非贲门腺癌患者血浆中的水平持续升高,并被作为检测早期非贲门腺癌的潜在无创生物标志物。上述结果表明,miRNA在多种肿瘤进展过程中发挥重要作用,并可作为肿瘤的早期诊断及预后评判指标。miR-124作为抑瘤因子在多种肿瘤中发挥抑瘤作用[15]。在NSCLC细胞中,miR-124表达水平明显低于正常肺上皮BEAS-2E细胞;且miR-124在NSCLC组织的表达水平明显低于正常肺组织,miR-124的表达水平与肿瘤转移(TNM)的分期、分化程度和淋巴结转移显著相关。本研究结果显示,miR-124在人膀胱癌细胞5637、J82、T24、TCCSUP、UMUC3中的表达水平均明显低于SV-HUC-1(P < 0.01);与miR-124在膀胱癌细胞中的表达趋势相一致的是,原位杂交技术结果表明miR-124在正常膀胱组织中呈强阳性表达,在非浸润性膀胱癌组织中表达降低,在浸润性膀胱癌组织中的表达较前两者更低。说明miR-124可能参与了膀胱癌发生、发展过程。miR-124低表达与膀胱癌临床T分期、淋巴结转移及肿瘤分化程度密切相关(P < 0.05),但与性别、年龄、远处转移等无明显相关性(P>0.05)。miR-124低表达可能与膀胱癌的恶性程度及不良预后呈正相关,提示其可能参与了膀胱癌发生的恶性进程。
有研究发现,与正常肺细胞和组织相比,miR-124在NSCLC细胞株SPC-A1、NCI-H1650及NSCLC组织的表达下调。miR-124低表达患者的OS和PFS明显缩短。进一步机制探讨发现,肿瘤抑制因子miR-124通过抑制靶基因泛素特异性蛋白酶14(Ubiquitin-specific protease 14, USP4)的表达,负调控NSCLC细胞生长和自我更新,进而提高NSCLC细胞对吉非替尼的敏感性[16]。本研究分析miR-124表达与膀胱癌患者预后之间的关系,Kaplan-Meier结果显示,miR-124低表达组患者的OS和DFS明显短于高表达组患者(P < 0.01);多因素分析结果提示,miR-124在膀胱中低表达是影响膀胱癌患者预后的独立危险因素。提示miR-124表达越低,膀胱癌患者预后越差,有望成为膀胱癌新的预后标志物。
miR-124在胃癌组织样品和细胞系中的表达都显著降低,且过表达miR-124(miR-124 mimics)可明显抑制了胃癌细胞的增殖、迁移和侵袭能力[17]。有研究报道,与miR-NC组比较,过表达miR-124(miR-124 mimics)可显著降低结直肠癌细胞的活力,明显诱导细胞凋亡和抑制细胞侵袭能力(P < 0.05);并且明显增强了Wnt4的表达。由此提出miR-124可能通过调控Wnt/β-catenin信号通路,抑制肿瘤细胞的增殖并促进其凋亡[18]。本研究采用Lipofectamine 2000将miR-124 mimic、miR-124 inhibitor及miRNA-NC转染至T24细胞中,CCK-8检测细胞增殖能力,结果发现,与miRNA-NC组相比,miR-124 mimics组T24细胞增殖能力明显下降(P < 0.05),而miR-124 inhibitor组中T24细胞增殖能力增强(P < 0.05)。说明上调miR-124可抑制T24细胞的增殖能力。这与CAO等[19]研究结果相一致。PI3K/Akt信号通路作为细胞内重要信号转导通路之一,其通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,与多种实体肿瘤的发生、发展关系密切[20-21]。本研究采用Western blot检测增殖相关蛋白(PCNA、Ki-67)及PI3K/AKT通路中AKT以及磷酸化的p-AKT的表达水平,结果表明,与miRNA-NC比较,miR-124 mimics组中的PCNA、Ki-67及p-AKT蛋白表达量降低(P < 0.05);miR-124 inhibitor组中的PCNA、Ki-67及p-AKT的蛋白表达量较miRNA-NC组和miR-124 mimics组升高(P < 0.05),而总AKT蛋白表达量未发生变化(P>0.05)。提示上调miR-124有效抑制T24细胞的增殖和PI3K/AKT通路的活化,miR-124可能通过AKT信号通路调控膀胱癌细胞的增殖,进而影响肿瘤的恶性进程。
综上所述,miR-124在膀胱癌组织与癌细胞中均明显降低,与膀胱癌临床T分期、淋巴结转移及肿瘤分化程度及不良预后密切相关,上调miR-124可显著减少细胞增殖,其机制可能与AKT信号通路有关,有望为膀胱癌的预后评判和治疗提供新的标志物和治疗靶点。
| [1] |
CUI J, ZHOU B, ROSS S A, et al. Nutrition, microRNAs, and human health[J]. Adv Nutr, 2017, 8(1): 105-112. DOI:10.3945/an.116.013839 |
| [2] |
ZENDJABIL M, FAVARD S, TSE C, et al. The microRNAs as biomarkers: What prospects?[J]. C R Biol, 2017, 340(2): 114-131. DOI:10.1016/j.crvi.2016.12.001 |
| [3] |
SHI P, CHEN C, LI X, et al. MicroRNA-124 suppresses cell proliferation and invasion of triple negative breast cancer cells by targeting STAT3[J]. Mol Med Rep, 2019, 19(5): 3667-3675. DOI:10.3892/mmr.2019.10044 |
| [4] |
JIA X, WANG X, GUO X, et al. MicroRNA-124: An emerging therapeutic target in cancer[J]. Cancer Med, 2019, 8(12): 5638-5650. DOI:10.1002/cam4.2489 |
| [5] |
THOMA C. Combining epigenetic and immune checkpoint inhibitors in bladder cancer[J]. Nat Rev Urol, 2019, 16(9): 507. DOI:10.1038/s41585-019-0221-3 |
| [6] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [7] |
DESANTIS C E, MILLER K D, DALE W, et al. Cancer statistics for adults aged 85 years and older, 2019[J]. CA Cancer J Clin, 2019, 69(6): 452-467. DOI:10.3322/caac.21577 |
| [8] |
ELSHARKAWI F, ELSABAH M, SHABAYEK M, et al. Urine and serum exosomes as novel biomarkers in detection of bladder cancer[J]. Asian Pac J Cancer Prev, 2019, 20(7): 2219-2224. DOI:10.31557/APJCP.2019.20.7.2219 |
| [9] |
LI Q, WANG H, PENG H, et al. MicroRNAs: Key Players in Bladder Cancer[J]. Mol Diagn Ther, 2019, 23(5): 579-601. DOI:10.1007/s40291-019-00410-4 |
| [10] |
ORSO F, QUIRICO L, DETTORI D, et al. Role of miRNAs in tumor and endothelial cell interactions during tumor progression[J]. Semin Cancer Biol, 2019, pii: S1044-579X(19): 30169-5. DOI:10.1016/j.semcancer.2019.07.024 |
| [11] |
VOS P D, LEEDMAN P J, FILIPOVSKA A, et al. Modulation of miRNA function by natural and synthetic RNA-binding proteins in cancer[J]. Cell Mol Life Sci, 2019, 76(19): 3745-3752. DOI:10.1007/s00018-019-03163-9 |
| [12] |
ZHANG Y, ROTH JA, YU H, et al. A 5-MicroRNA signature identified from serum MicroRNA profiling predicts survival in patients with advanced stage non-small cell lung cancer[J]. Carcinogenesis, 2019, 40(5): 643-650. DOI:10.1093/carcin/bgy132 |
| [13] |
REN C, CHEN H, HAN C, et al. High expression of miR-16 and miR-451 predicating better prognosis in patients with gastric cancer[J]. J Cancer Res Clin Oncol, 2016, 142(12): 2489-2496. DOI:10.1007/s00432-016-2243-z |
| [14] |
ZHU C, REN C, HAN J, et al. A five-microRNA panel in plasma was identified as potential biomarker for early detection of gastric cancer[J]. Br J Cancer, 2014, 110(9): 2291-2299. DOI:10.1038/bjc.2014.119 |
| [15] |
MA J, WENG L, WANG Z, et al. MiR-124 induces autophagy-related cell death in cholangiocarcinoma cells through direct targeting of the EZH2-STAT3 signaling axis[J]. Exp Cell Res, 2018, 366(2): 103-113. DOI:10.1016/j.yexcr.2018.02.037 |
| [16] |
YU F, LIU J B, WU Z J, et al. Tumor suppressive microRNA-124a inhibits stemness and enhances gefitinib sensitivity of non-small cell lung cancer cells by targeting ubiquitin-specific protease 14[J]. Cancer Lett, 2018, 427: 74-84. DOI:10.1016/j.canlet.2018.04.022 |
| [17] |
LI X, YU Z, LI Y, et al. The tumor suppressor miR-124 inhibits cell proliferation by targeting STAT3 and functions as a prognostic marker for postoperative NSCLC patients[J]. Int J Oncol, 2015, 46(2): 798-808. DOI:10.3892/ijo.2014.2786 |
| [18] |
LU M L, ZHANG Y, LI J, et al. MicroRNA-124 inhibits colorectal cancer cell proliferation and suppresses tumor growth by interacting with PLCB1 and regulating Wnt/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2019, 23(1): 121-136. DOI:10.26355/eurrev_201901_16756 |
| [19] |
CAO Z, XU L, ZHAO S, et al. The functions of microRNA-124 on bladder cancer[J]. Onco Targets Ther, 2019, 12: 3429-3439. DOI:10.2147/OTT.S193661 |
| [20] |
LIM H J, CROWE P, YANG J L. Current clinical regulation of PI3K/PTEN/Akt/mTOR signalling in treatment of human cancer[J]. J Cancer Res Clin Oncol, 2015, 141(4): 671-689. DOI:10.1007/s00432-014-1803-3 |
| [21] |
HOUÉDÉ N, POURQUIER P. Targeting the genetic alterations of the PI3K-AKT-mTOR pathway: its potential use in the treatment of bladder cancers[J]. Pharmacol Ther, 2015, 145: 1-18. DOI:10.1016/j.pharmthera.2014.06.004 |



