2. 2400014 重庆市, 重庆医科大学附属儿童医院儿科研究所,儿科学重庆市重点实验室
2. Chongqing Key Laboratory of Pediatrics, Chongqing, 400014, China
支气管哮喘是一种严重危害人类健康的慢性气道炎症性疾病,在我患病率呈逐年上升趋势,且儿童患病率高于成人,已严重影响儿童身心健康[1]。哮喘患者的细胞浸润支气管黏膜会产生各种介质,包括活性氧。活性氧的产生增加,导致氧化力和抗氧化防御系统之间的不平衡,有利于氧化损伤,这与哮喘的发病机制有关[2]。Nrf2是细胞抗氧化应激体系的关键转录因子[3],新近研究发现,支气管上皮细胞可以吞噬有机粉尘(Organicdust,OD),其内源性氧化应激增加,在Nrf2免疫荧光染色后与对照组人支气管上皮细胞(BEAS-2B细胞)相比,OD处理明显增加Nrf2的核易位[4]。糖皮质激素是目前治疗哮喘的一线用药,能够有效控制气道炎症,缓解症状[5]。大量研究表明糖皮质激素与氧化应激有关[6-8],Alam MM等从小鼠肝脏中鉴定出糖皮质激素受体(Glucocorticoid receptor,GR)作为新的Nrf2结合配偶体[9],但地塞米松对哮喘氧化应激的调控作用尚不明确。因此,为进一步探究糖皮质激素在哮喘治疗过程中的更多机制。本文利用HDM建立哮喘小鼠模型探究地塞米松对哮喘小鼠肺部氧化应激反应的作用及其可能的机制,为哮喘的治疗提供更为广阔的思路和方向。
1 材料与方法 1.1 主要材料和试剂 1.1.1 实验动物30只6-8周C57BL/6雌性小鼠购于重庆医科大学实验动物中心,饲养于重庆医科大学附属儿童医院实验动物中心SPF级,温度在22~26 ℃,湿度约55%~60%,经受12 h/ 12 h的黑暗/光照循环。
1.1.2 试剂屋尘螨(华科生物公司),地塞米松(Enzo), 丙二醛(MDA)检测试剂盒(TBA微板法)(雷根生物技术),GSSG检测试剂盒(欣博盛生物技术),兔超敏二步法免疫组化检测试剂盒(中山金桥生物技术),Nrf2兔抗鼠抗体(武汉三鹰生物技术),Keap1抗体(成都正能生物技术),GAPDH兔抗鼠抗体(武汉三鹰生物技术),β-actin兔抗鼠抗体(武汉三鹰生物技术),Cy3-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(武汉三鹰生物技术),BCA法蛋白定量试剂盒(凯基生物技术),化学发光(ECL)试剂盒(Millipore),PCR引物由上海生工化工合成,高纯总RNA快速提取试剂盒(北京百泰克生物技术有限公司),RNA逆转录试剂盒(TaKaRa公司)。
1.2 实验方法 1.2.1 动物分组及处理用随机分组法将30只C57BL/6雌性小鼠(6-8周)分成对照组、哮喘组及地塞米松组。根据课题组研究基础,利用屋尘螨(House dust mites, HDM)进行哮喘建模。在第0, 14天,哮喘组小鼠接受20 μg/30 μL HDM工作液滴鼻致敏滴鼻致敏,第21、23、25、27、29天,给予30 μL HDM工作液激发。对照组在相同时间给予相同剂量的生理盐水进行致敏和激发。地塞米松治疗组小鼠致敏及激发同哮喘组,根据文献[10-12]在每次激发前30 min每只小鼠给予200 μL地塞米松溶液(5 mg/kg)腹腔注射。
1.2.2 苏木素-伊红(HE)染色取小鼠左肺于4%多聚甲醛固定,脱水,包埋,制成石蜡组织切片(4 μm),行HE染色,观察肺部炎症细胞浸润情况。
1.2.3 肺组织中MDA的测定根据丙二醛(MDA)检测试剂盒说明书,称取适量肺组织用PBS进行匀浆,样本准备完毕后用BCA蛋白浓度测定试剂盒测定蛋白浓度,以便后续计算组织中MDA含量,用酶标仪在535 nm处测定样本吸光度。
1.2.4 肺组织中GSSG的测定根据试剂盒说明书,称取适量肺组织用于检测,利用动态学测定法,计算得到肺组织中GSSG的含量。
1.2.5 Western Blot检测各种小鼠中Nrf2和keap1的表达称取各组小鼠适量肺组织,根据说明书配制蛋白裂解液,裂解肺组织后离心提取总蛋白,使BCA测定法测定蛋白质浓度。取蛋白质样品用10%SDS-PAGE分离并转移到PVDF膜,5%牛奶封闭1 h,加入一抗(兔抗小鼠Nrf2多克隆抗体1:1 000,兔抗小鼠β-actin 1:1 000)4 ℃孵育过夜。TBST漂洗3次后加入二抗(辣根过氧化物酶标记的山羊抗兔1:5 000稀释)室温孵育1 h。通过增强的化学发光(ECL)试剂盒显现免疫反应性。
1.2.6 免疫组化检测肺组织中Nrf2的表达左肺石蜡组织切片(4 μm),常规脱蜡至水,利用0.01 mol/L的枸橼酸钠进行抗原修复,滴加3%过氧化氢酶消除组织中的内源性过氧化物酶,5%BSA封闭60 min,滴加Nrf2一抗(1:100稀释)4 ℃孵育过夜。第二天室温复温30 min,洗去一抗,滴加二抗及辣根酶标记链霉卵白素工作液,DAB镜下显色,苏木素染核,脱水晾干封片,显微镜下观察Nrf2的表达, 采集成像。
1.2.7 免疫荧光检测肺组织中的Nrf2的表达左肺石蜡组织切片(4 μm),常规脱蜡至水,滴加兔抗小鼠Nrf2一抗(1:100稀释)4 ℃孵育过夜。第二天室温复温30 min,洗去一抗,滴加二抗(1:250)稀释并用于室温孵育60 min,洗去二抗,滴加DAPI,避光孵育30 min,清洗后封片,采集成像。
1.2.8 逆转录-聚合酶链反应(RT-PCR)检测肺中Nrf2及HO-1 mRNA的表达根据制造商的说明,使用Bioteke高纯总RNA快速提取试剂盒提取各组小鼠适量肺组织中的RNA,分别测定各组总RNA浓度,然后逆转录合成模cDNA,最后进行实时定量聚合酶链反应扩增(Q-RT-PCR)。引物序列见表 1。
| 基因 | 引物序列 |
| Nrf2 | 上游:5′-CAGCATAGAGCAGGACATGGAG-3′ |
| 下游:5′-GAACAGCGGTAGTATCAGCCAG-3′ | |
| HO-1 | 上游:5′-GAACAGCGGTAGTATCAGCCAG-3′ |
| 下游:5′-GTGTTCCTCTGTCAGCATCACC-3′ | |
| GAPDH | 上游:5′-CAGCGACACCCACTCCTCCACCTT-3′ |
| 下游:5′-CATGAGGTCCACCACCCTGTTGCT-3′ |
1.3 统计学方法
采用Graph Pad Prism 5.0软件进行统计分析,方差齐时,各组用单因素方差分析或Turkey检验;方差不齐,各组用Kruskal-Wallis检验。组间比较用多因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠致敏示意图及HE染色结果哮喘小鼠模型构建示意图如图 1A。HE染色观察到哮喘组小鼠气道周围炎症细胞浸润明显,地塞米松组小鼠气道周围炎症细胞较哮喘组明显减少(图 1B),成功构建哮喘小鼠模型,地塞米松能明显控制哮喘小鼠气道炎症。

|
| A:小鼠致敏激发示意图; B-D:各组小鼠肺组织HE染色(B:对照组,C:哮喘组;D:地塞米松组)(200×) 图 1 小鼠致敏示意图及HE染色结果 |
2.2 小鼠MDA测定结果
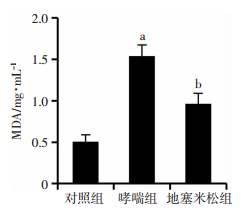
哮喘组与对照组相比,肺组织中MDA的含量显著升高(P < 0.01),地塞米松组与哮喘组相比,肺组织中MDA的含量降低(P < 0.05),差异均有统计学意义,见图 2。
|
| a: P < 0.01,与对照组比较;b: P < 0.05,与哮喘组比较 图 2 各组小鼠肺组织中MDA含量 |
2.3 各组小鼠肺组织中GSSG含量
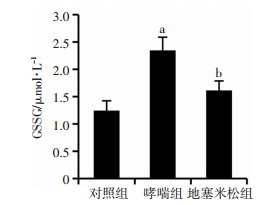
哮喘组与对照组相比,肺组织中GSSG的含量升高(P < 0.01);地塞米松组与哮喘组相比,肺组织中GSSG的含量降低(P < 0.05),差异均有统计学意义,见图 3。
|
| a: P < 0.01,与对照组比较, b: P < 0.05,与哮喘组比较 图 3 各组小鼠肺组织GSSG含量 |
2.4 各组小鼠中Nrf2和HO-1的转录水平
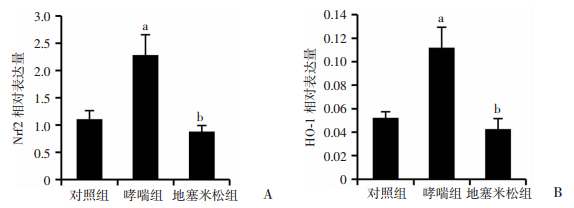
哮喘组较对照组小鼠肺组织中Nrf2和HO-1的转录水平升高(P < 0.05),地塞米松使用后的哮喘小鼠Nrf2和HO-1的转录水平下降(P < 0.05),见图 4。
|
| a: P < 0.05,与对照组比较,b: P < 0.05,与哮喘组比较 图 4 qPCR检测小鼠肺组织Nrf2及HO-1基因表达情况 |
2.5 小鼠肺组织中Nrf2免疫组化和免疫荧光染色结果
较对照组(8.65±0.72)相比,哮喘组(28.76±2.21)小鼠肺组织中Nrf2的量明显增加(P < 0.01),地塞米松组(9.90±0.53)较哮喘组降低(P < 0.01),见图 5。

|
| A:免疫组化检测小鼠肺组织中Nrf2表达情况;B:免疫荧光检测小鼠肺组织中Nrf2表达情况(200×) 图 5 小鼠肺组织中Nrf2免疫组化和免疫荧光染色结果 |
2.6 Western blot检测小鼠肺组织中Nrf2-Keap1蛋白的表达
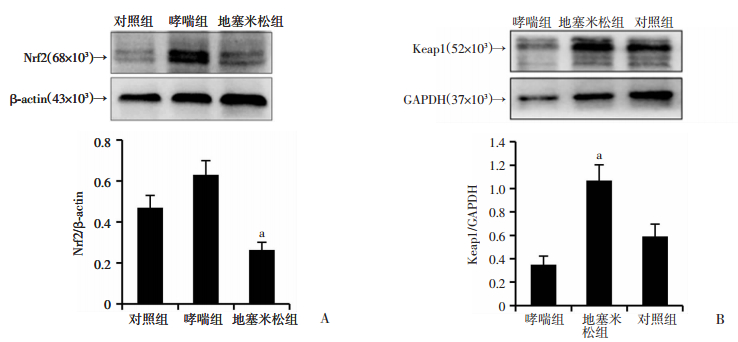
Nrf2-Keap1通路参与细胞的抗氧化过程, Nrf2、keap1是细胞内防御氧化和亲电性应激损伤的重要蛋白[3]。地塞米松组与哮喘组相比,肺组织中Nrf2的蛋白水平降低(P < 0.05),而Keap1的蛋白表达水平升高(P < 0.05),差异均有统计学意义。
|
| A: Nrf2; B: Keap1; a: P < 0.05,与哮喘组比较 图 6 Western blot检测小鼠肺组织中Nrf2、Keap1蛋白表达情况及半定量分析 |
3 讨论
哮喘是一种慢性的气道炎症性疾病,危害儿童的身心健康,给社会和家庭带来沉重的经济负担。人们对炎症细胞以及细胞因子参与哮喘已经有足够的认识,但不太了解哮喘也是一种氧化应激疾病[13]。氧化应激导致的氧化剂和抗氧化剂之间的不平衡,在哮喘的发病机制中起重要作用,特别是在哮喘恶化期间[14]。大量研究发现氧化应激在哮喘的发生和发展中发挥重要的作用,氧化应激的抑制能够有效缓解哮喘[13, 15]。
糖皮质激素有明显的抗炎和抑制气道重塑的作用,合理利用糖皮质激素能够有效改善哮喘患者肺功能状态及气流受限[16]。目前主要研究了地塞米松对于对哮喘气道炎症的抑制作用,而地塞米松在哮喘氧化应激中的作用了解较少。MDA是膜脂质过氧化的产物,可通过MDA了解生物体内抗氧化能力及氧化应激水平[17]。本实验发现使用地塞米松后,哮喘组MDA明显下降,说明地塞米松能够减少MDA的产生,抑制哮喘患者的氧化应激从而起到保护作用。哮喘患者支气管洗液和支气管肺泡灌洗液中谷胱甘肽的氧化含量高于对照组,表明气道存在氧化应激[18],本实验中GSSG的含量在哮喘组升高,而使用地塞米松后较哮喘组有下降,说明哮喘小鼠使用地塞米松后能降低其肺部氧化应激水平。
Nrf2是具有碱性亮氨酸拉链基序的转录因子,其在氧化还原调节中起关键作用。在应激情况下,Keap1与Nrf2结合并介导Nrf2快速泛素化和随后的降解[18]。Nrf2通路与氧化应激、凋亡和炎症反应等密切相关。当体内自由基增多或者受到外界刺激时,导致Nrf2与相互抑制的Keap1解离,活化的Nrf2可通过结合抗氧化应激元件,启动下游因子(如HO-1)的表达,同时可以调节还原型谷胱甘肽保护气道上皮细胞的炎症反应[19]。哮喘与Nrf2表达紊乱有关,导致过敏性哮喘小鼠模型中的气道炎症和高反应性,表明Nrf2通路在体内过敏和哮喘反应中具有重要的保护作用[21]。与患有轻度至中度哮喘的儿童相比,严重哮喘患儿的Nrf2蛋白表达较高,同时在PBMC和气道灌洗细胞中,严重哮喘患儿的Nrf2 mRNA表达较高[20]。也有文献报道,Nrf2缺陷小鼠对哮喘的易感性增加,包括氧化应激,炎症,黏液和气道高反应性升高[22]。本实验结果提示哮喘中Nrf2表达增加,而Keap1表达下降,使用地塞米松后Nrf2降低,而Keap1的表达升高,同时Nrf2的mRNA变化趋势与蛋白水平一致。经过OD处理后的BEAS-2B细胞中HO-1的表达水平较对照组升高,与本实验结果相同[4]。我们由此推测地塞米松通过调控Keap1-Nrf2通路来调节哮喘小鼠肺部氧化应激反应。此外研究报道也称,Nrf2对抗氧化反应的影响以及细胞抗氧化能力的降低导致了糖皮质激素的副作用[9],所以研究地塞米松与Nrf2之间的相互作用对于减少糖皮质激素治疗的副作用有现实意义。
综上所述,本部分研究发现地塞米松可以降低哮喘小鼠肺部的氧化应激水平,且肺组织中Keap1的表达升高而Nrf2的表达降低,提示地塞米松可能通过Keap1-Nrf2通路影响哮喘的氧化应激,为哮喘的治疗提供了新的思路和靶点。但是本研究不足之处是仅探讨了地塞米松使用后Nrf2及Keap1的转录水平及蛋白的变化,因此Nrf2与地塞米松之间具体的作用序列或靶点还需进一步探究。
| [1] |
CASTILLO J R, PETERS S P, BUSSE WW. Asthma exacerbations: pathogenesis, prevention, and treatment[J]. J Allergy Clin Immunol Pract, 2017, 5(4): 918-927. DOI:10.1016/j.jaip.2017.05.001 |
| [2] |
GABALLAH HH, GABER R A, SHARSHAR R S, et al. NOD2 expression, DNA damage and oxido-inflammatory status in atopic bronchial asthma: Exploring their Nexus to disease severity[J]. Gene, 2018, 660: 128-135. DOI:10.1016/j.gene.2018.03.061 |
| [3] |
WANG J C, LU Q Y, CAI J Y, et al. Nestin regulates cellular redox homeostasis in lung cancer through the Keap1-Nrf2 feedback loop[J]. Nat Commun, 2019, 10(1): 5043. DOI:10.1038/s41467-019-12925-9 |
| [4] |
MCGOVERN T, FARAHNAK S, CHEN M, et al. Organic dust, causing both oxidative stress and Nrf2 activation, is phagocytized by bronchial epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2019, 317(3): L305-L316. DOI:10.1152/ajplung.00377.2018 |
| [5] |
NHU Q M, ACEVES SS. Tissue remodeling in chronic eosinophilic esophageal inflammation: parallels in asthma and therapeutic perspectives[J]. Front Med (Lausanne), 2017, 4: 128. DOI:10.3389/fmed.2017.00128 |
| [6] |
李彬, 李茹, 谢小华, 等. 地塞米松对实验性自身免疫性脑脊髓炎小鼠的抗氧化损伤作用[J]. 细胞与分子免疫学杂志, 2013, 29(11): 1155-1158. LI B, LI R, XIE X H, et al. Anti-oxidative effects of dexamethasone on mice with experimental autoimmune encephalomyelitis[J]. Chin J Cell Mol Immunol, 2013, 29(11): 1155-1158. DOI:10.13423/j.cnki.cjcmi.006935 |
| [7] |
ZHU L J, YI X L, ZHAO J, et al. Betulinic acid attenuates dexamethasone-induced oxidative damage through the JNK-P38 MAPK signaling pathway in mice[J]. Biomed Pharmacother, 2018, 103: 499-508. DOI:10.1016/j.biopha.2018.04.073 |
| [8] |
SINGH A K, HALDAR C. Melatonin modulates glucocorticoid receptor mediated inhibition of antioxidant response and apoptosis in peripheral blood mononuclearcells[J]. Mol Cell Endocrinol, 2016, 436: 59-67. DOI:10.1016/j.mce.2016.07.024 |
| [9] |
ALAM MM, OKAZAKI K, NGUYEN L T T, et al. Glucocorticoid receptor signaling represses the antioxidant response by inhibiting histone acetylation mediated by the transcriptional activator NRF2[J]. J Biol Chem, 2017, 292(18): 7519-7530. DOI:10.1074/jbc.M116.773960 |
| [10] |
NIU C, LIU N, LIU J, et al. Vitamin A maintains the airway epithelium in a murine model of asthma by suppressing glucocorticoid-induced leucine zipper[J]. Clin Exp Allergy, 2016, 46(6): 848-860. DOI:10.1111/cea.12646 |
| [11] |
XIE J, LONG X R, GAO L Q, et al. Respiratory syncytial virus nonstructural protein 1 blocks glucocorticoid receptor nuclear translocation by targeting IPO13 and may account for glucocorticoid insensitivity[J]. J Infect Dis, 2017, 217(1): 35-46. DOI:10.1093/infdis/jix445 |
| [12] |
朱绮芬, 郑斌, 颜仁杰, 等. 玉屏风颗粒对地塞米松诱导的免疫抑制幼鼠的影响[J]. 世界临床药物, 2018, 39(5): 329-333. ZHU Q F, ZHENG B, YAN R J, et al. Effect of Yupingfeng granule on the immunosuppression induced by dexamethasone in immature mice[J]. World Clin Drugs, 2018, 39(5): 329-333. DOI:10.13683/j.wph.2018.05.009 |
| [13] |
ANDRIANJAFIMASY M, ZERIMECH F, AKIKI Z, et al. Oxidative stress biomarkers and asthma characteristics in adults of the Egea study[J]. Eur Respir J, 2017, 50(6): 1701193. DOI:10.1183/13993003.01193-2017 |
| [14] |
CORRADI M, FOLESANI G, ANDREOLI R, et al. Aldehydes and glutathione in exhaled breath condensate of children with asthma exacerbation[J]. Am J Respir Crit Care Med, 2003, 167(3): 395-399. DOI:10.1164/rccm.200206-507OC |
| [15] |
蓝楠.氧化应激在支气管哮喘中的作用机制研究[D].泸州: 泸州医学院, 2012. LAN N. Mechanism of oxidative stress in bronchial asthma[D]. Luzhou: Luzhou Medical College. |
| [16] |
PAPI A, BRIGHTLING C, PEDERSEN S E, et al. Asthma[J]. Lancet, 2018, 391(10122): 783-800. DOI:10.1016/s0140-6736(17)33311-1 |
| [17] |
GABALLAH HH, GABER R A, SHARSHAR R S, et al. NOD2 expression, DNA damage and oxido-inflammatory status in atopic bronchial asthma: Exploring their Nexus to disease severity[J]. Gene, 2018, 660: 128-135. DOI:10.1016/j.gene.2018.03.061 |
| [18] |
MISHRA V, BANGA J, SILVEYRA P. Oxidative stress and cellular pathways of asthma and inflammation: Therapeutic strategies and pharmacologicaltargets[J]. PharmacolTher, 2018, 181: 169-182. DOI:10.1016/j.pharmthera.2017.08.011 |
| [19] |
刘建秋, 马莹, 王雪慧. 淫羊藿苷对慢性哮喘大鼠氧化应激及肺组织Nrf2、HO-1表达的影响[J]. 中华中医药学刊, 2019, 37(12): 2823-2826. LIU J Q, MA Y, WANG X H. Effect of icariin on oxidative stress and Nrf2 and HO-1 expression in lung tissue of chronic asthma rats[J]. Chin Arch Tradit Chin Med, 2019, 37(12): 2823-2826. DOI:10.13193/j.issn.1673-7717.2019.12.001 |
| [20] |
FITZPATRICK A M, STEPHENSON S T, HADLEY G R, et al. Thiol redox disturbances in children with severe asthma are associated with posttranslational modification of the transcription factor nuclear factor (erythroid-derived 2)-like 2[J]. J Allergy Clin Immunol, 2011, 127(6): 1604-1611. DOI:10.1016/j.jaci.2011.03.031 |
| [21] |
DWORSKI R, HAN W, BLACKWELL T S, et al. Vitamin E prevents NRF2 suppression by allergens in asthmatic alveolar macrophages in vivo[J]. Free Radic Biol Med, 2011, 51(2): 516-521. DOI:10.1016/j.freeradbiomed.2011.04.040 |
| [22] |
SUSSAN T E, GAJGHATE S, CHATTERJEE S, et al. Nrf2 reduces allergic asthma in mice through enhanced airway epithelial cytoprotective function[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(1): L27-L36. DOI:10.1152/ajplung.00398.2014 |



