2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院病理科
2. Department of Pathology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
RanBP9,又名RanBPM(Ran-binding protein in microtubule organizing center),是一个新的Ran蛋白结合蛋白[1]。它广泛表达于不同组织和细胞系,在细胞内发挥支架蛋白的作用,是细胞内具有不同生物学功能的蛋白复合体的关键组成部分,可维持蛋白质稳定、调节基因转录活性。进一步研究发现RanBP9亦参与调节细胞周期、细胞黏附、凋亡、迁移等[2]。同时RanBP9与多种肿瘤的发生、发展密切相关,它在结肠癌、胃癌和肺癌中均发挥抑癌基因的作用,可以显著抑制肿瘤的转移并增加其对化疗药物的敏感性。但关于RanBP9在骨肉瘤发生、发展中的作用尚不清楚,本课题组前期研究发现,RanBP9在骨肉瘤细胞中低表达,且与骨肉瘤的增殖、凋亡和转移相关[3]。RanBP9是一个与凋亡相关的支架蛋白,在细胞内的分布情况随着细胞凋亡的进程可发生显著改变。近期研究表明RanBP9能以凋亡前体蛋白的形式在细胞凋亡中发挥重要的调节作用[3],但其在骨肉瘤凋亡过程中的作用及分子机制仍有待进一步研究。因此,本研究拟通过过表达RanBP9来进一步探讨其对骨肉瘤细胞凋亡的影响和分子机制。
1 材料与方法 1.1 细胞系和培养人成骨细胞hFOB(hFOB1.19)和骨肉瘤细胞系SaOS2、MG63、U2OS和HOS均购自美国典型培养物保藏中心,由本实验室传代保种。SaOS2、HOS、U2OS培养于含有10%胎牛血清的DMEM培养基中,MG63培养于含有10%胎牛血清的1640培养基中,置于37 ℃、5% CO2混合气体的无菌恒温培养箱中培养。hFOB1.19成骨细胞培养于添加G418(终浓度至0.3 mg/mL)、10%胎牛血清的无酚红DMEM/F12培养基中,置于34 ℃、5% CO2混合气体的无菌恒温培养箱中培养。
1.2 过表达RanBP9骨肉瘤细胞株的建立及鉴定带RFP荧光的过表达RanBP9慢病毒载体由上海英骏生物公司合成。将生长状态良好的骨肉瘤SaOS2细胞按1×105/孔接种到6孔板,待细胞融合率约30%时,PBS漂洗细胞3次,更换新鲜无双抗培养基,病毒稀释液中加入促转染试剂polybrene(聚凝胺),终浓度为5 μg/mL,按照细胞MOI值计算并加入相应量病毒。将培养基和病毒液充分混匀后置于CO2孵箱孵育24 h,换成新鲜的完全培养基。48 h后荧光显微镜下观察转染效率,将细胞进行常规传代培养,通过流式细胞仪筛选出稳定过表达RanBP9的细胞株,分为对照组(Control)和过表达组(over RanBP9)。
1.3 Real-time PCR(RT-PCR)检测提取细胞RNA,按1 :25比例用DEPC水稀释样品RNA 2 μL,用Smartspec 3000核酸蛋白定量仪测定RNA的浓度。按照TaKaRa公司的Prime Script RT reagent Kit说明书,将RNA反转录为cDNA。根据SYBER Premix Ex TaqTM Ⅱ说明书,配置10 μL反应体系:5 μL SYBER Premix Ex TaqTM Ⅱ、0.8 μL cDNA、上游及下游引物各0.5 μL、3.2 μL dH2O。根据基因BANK中提供的基因序列,用Primier premier 5.0软件设计特异引物,同时以GADPH作为内参。GAPDH上游引物:5′-CTTTGGTATCGTGGAAGGACTC-3′,下游引物:5′-GTA-GAGGCAGGGATGATGTTCT-3′;RanBP9上游引物:5′-CGCATCCAATACCAGCAGCC-3′,下游引物:5′- GGCACAGTACCCATGGTGGA-3′;Cytc上游引物:5′-TCGGAGCGGGAGTGTTCGTTG-3′,下游引物:5′-CCTCCCTTTTCAACGGTGTGGC-3′;Caspase-3上游引物:5′-CATGGAAGCGAATCAATGGACT-3′,下游引物:5′-CTGTACCAGACCGAGATGTCA-3′;Bax上游引物:5′-CCC-GAGAGGTCTTTTTCCGAG-3′,下游引物:5′-CCAGCCCATGATGGTTCTGAT-3′;Bcl-2上游引物:5′-GCGGAGTTCACAGCTCTATAC-3′,下游引物:5′-AAAAGGCCCCTACAGTTACCA-3′;Fas上游引物:5′-TATCACCACTATTGCTGGAGTCA-3′,下游引物:5′-GCTGTGTC-TTGGACATTGTCA-3′;Flip上游引物:5′-ACAACAAGGACCACGGGAGGAG-3′,下游引物:5′-TGGAGGCAA-AGAAACCGAAAGC-3′。将反应体系放入仪器Bio-Rad CFX96 Real-time System,根据扩增曲线和溶解曲线,制作标准曲线进行结果分析。
1.4 Western blot检测骨肉瘤细胞RanBP9蛋白表达提取细胞总蛋白,采用Pierce BCA Protein Assay Kit测定蛋白浓度。SDS-聚丙烯酰胺凝胶电泳,转膜,封闭:用脱脂奶粉浸泡PVDF膜,水平摇床缓慢摇晃,室温下封闭4 h;将膜放人稀释好的一抗:RanBP9兔抗人多克隆抗体(Abcam公司,美国,1 :1 000稀释)、Cytc小鼠抗人单克隆抗体(Cell Signal Techology公司,美国,1 :300稀释),Cleaved caspase-3兔抗人多克隆抗体(Abcam公司,美国,1 :500稀释)、Bax兔抗人单克隆抗体(Abcam公司,美国,1 :500稀释)、Fas小鼠抗人多克隆抗体(Abcam公司,美国,1 :300稀释)、Flip鼠抗人多克隆抗体(Cell Signal Techology公司,美国,1 :300稀释)、内参兔抗人GAPDH单克隆抗体(Cell Signal Techology公司,1 :2 000稀释),4 ℃孵育过夜。次日用PBST溶液洗膜10 min×3次。添加二抗(Cell Signal Techology公司,1 :5 000稀释),室温孵育1.5 h;用化学发光显色试剂盒(Pierce公司,美国)显色,Bio-Rad凝胶成像仪自动曝光成像。
1.5 CCK-8检测细胞增殖能力使用细胞增殖试剂WST-8(Roche Biochemicals,曼海姆,德国)测量细胞生长。将细胞以2 000/孔接种在96孔微量滴定板(Corning Costar,Corning,NY)中后,根据制造商的说明,在收获时将10 μL CCK-8添加到每个孔中。加入CCK-8后1 h,通过测量转化的染料在450 nm波长处的光密度值[D(450)]来测定细胞活力。
1.6 流式细胞仪检测过表达RanBP9对骨肉瘤细胞细胞凋亡的影响将处于对数生长期的overRanBP9和Control骨肉瘤细胞SaOS2置于超低黏附板,悬浮培养3 d,然后收集到离心管中,低温低速(4 ℃ 1 000 r/min)离心5 min,弃去上清液;PBS洗涤细胞沉淀,4 ℃ 1 000 r/min再次离心5 min;弃去PBS后用200 μL结合缓冲液重悬细胞,分别加入Annexin V- APC染色液3 μL和PI 3 μL,混合均匀,避光孵育15 min,每组设3个复孔;转移至流式上机管中,上机检测。
1.7 TUNEL检测细胞凋亡将细胞接种在含10%FBS的Dulbecco改良Eagle培养基中的盖玻片上24 h,用4%多聚甲醛固定20 min,在37 ℃用5%山羊血清封闭30 min,然后用0.3% Triton X-100处理,在室温下放置10 min。将酶溶液添加到标记溶液(1 :9稀释)中,以获得末端脱氧核苷酸转移酶介导的dUTP-生物素缺口末端标记(TUNEL)反应混合物(Roche),将50 μL加入每个样品中并孵育在黑暗中于37 ℃的潮湿环境中放置60 min。对于阴性对照,添加50 μL的标记溶液。通过激光共聚焦扫描显微镜采集图片。
1.8 线粒体膜电位分析(ΔΨm)使用线粒体膜电位测定试剂盒(海门市北洋生物技术研究所)和JC-1(亲脂性阳离子5, 5′,6, 6′-tetrachloro-1,1′,3,3′-四乙基苯并咪唑碳氰化碘)检测由RanBP9转染诱导的凋亡过程中发生的线粒体膜电位变化。简而言之,将Control细胞和overRanBP9细胞(5×105)接种到6孔板中。过夜生长后,将细胞与1 mL JC-1工作溶液在CO2孵化器中孵育20 min。除去染色溶液,并用JC-1染色缓冲液洗涤细胞2次,然后使用带通滤光片(荧光素和Cy3)通过荧光显微镜分析。
1.9 统计学分析采用SPSS 22.0统计软件进行分析, 数据以x±s表示,两组间均值比较采用独立样本t检验,检验水准α=0.05。
2 结果 2.1 成骨细胞和骨肉瘤细胞株中RanBP9的mRNA含量和蛋白表达水平RanBP9在成骨细胞hFOB1.19及在骨肉瘤细胞株HOS、SaSO2、MG63和U2OS中均呈阳性表达,且在骨肉瘤细胞中的表达明显低于成骨细胞(P < 0.01, 图 1A);同时RanBP9在恶性程度较低的骨肉瘤细胞株MG63和HOS中的表达要高于恶性程度较高的细胞株SaOS2和U2OS(图 1A)。Western blot结果与RT-PCR结果一致(图 1B)。
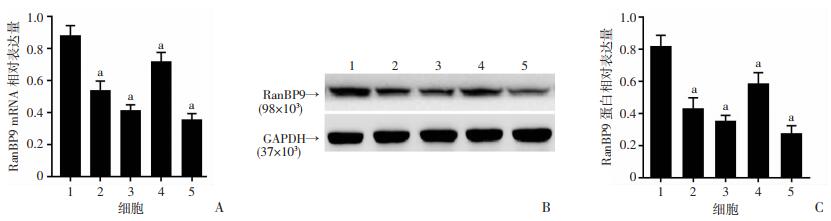
|
| 1:hFOB1.19; 2: HOS; 3: SaSO2; 4: MG63; 5: U2OS; A:RT-PCR检测结果;B:Western blot检测结果; C:半定量分析;a:P < 0.01,与hFOB1.19细胞比较 图 1 成骨细胞及骨肉瘤细胞株中RanBP9的mRNA及蛋白表达情况 |
2.2 过表达RanBP9的骨肉瘤细胞株的建立及鉴定
利用慢病毒载体转染SaOS2细胞,成功建立稳定过表达RanBP9的骨肉瘤细胞株,RT-PCR和Western blot检测结果均提示:与Control对照组比较,overRanBP9组RanBP9在核酸及蛋白水平均显著上调(P < 0.01,图 2A、B)。

|
| A:RT-PCR检测RanBP9表达;B:Western blot检测RanBP9表达;C:半定量分析 1:Control组;2:over RanBP9组;a:P < 0.01,与Control组比较 图 2 过表达RanBP9的骨肉瘤细胞株的建立及鉴定 |
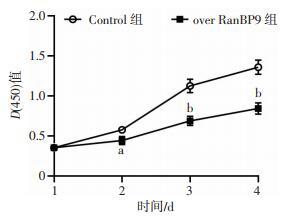
2.3 CCK-8法检测细胞增殖能力
CCK-8比色法显示:过表达RanBP9的细胞株在接种第2天起,增殖速率显著低于Control组, 差异有统计学意义(2 d:P=0.023;3 d:P=0.002;4 d:P=0.001,图 3)。表明过表达RanBP9显著降低了骨肉瘤细胞的增殖能力。
|
| a:P < 0.05,b:P < 0.01,与Control组比较 图 3 CCK-8检测两组SaOS2细胞增殖能力 |
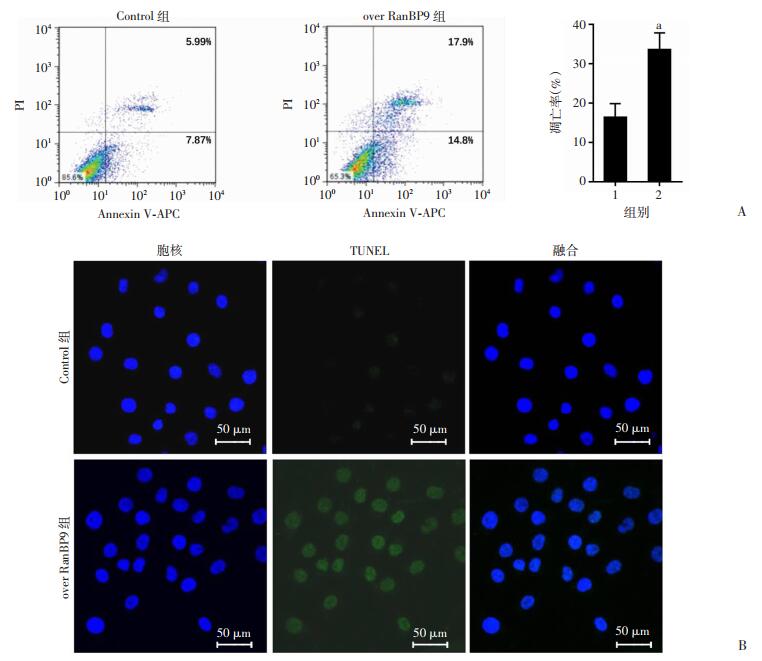
2.4 过表达RanBP9对骨肉瘤细胞凋亡率的影响
流式细胞仪检测结果显示:过表达RanBP9后,SaOS2细胞的总凋亡率由(16.37±3.48)%增加至(33.62±4.19)%,其中早期凋亡率由7.87%增至14.80%,晚期凋亡率由5.99%增至17.90%。说明过表达RanBP9可以显著增加骨肉瘤细胞的凋亡率,即RanBP9可促进骨肉瘤细胞发生凋亡(P < 0.05,图 4A)。TUNEL染色结果与流式细胞仪检测结果一致:SaOS2在过表达RanBP9后,其荧光强度显著高于对照组(图 4B)。
|
| A:流式双标法检测细胞凋亡 1:Control组;2:over RanBP9组;a:P < 0.01,与Control组比较;B:TUNEL染色检测细胞凋亡 图 4 过表达RanBP9对骨肉瘤细胞SaOS2凋亡率的影响 |
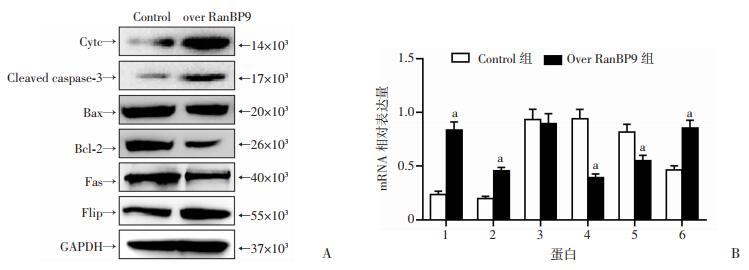
2.5 RanBP9对内外源性凋亡信号转导途径相关分子表达的影响
Western blot和RT-PCR检测结果均显示:对于线粒体途径,过表达RanBP9后,Cleaved caspase-3和Cytc表达水平均明显上调,且同时上调了Bax/Bcl-2的比率,差异有统计学意义;对于死亡受体通路而言,RanBP9的上调反而引起了Fas的下调, 同时导致死亡受体通路凋亡抑制因子Flip的表达上调,差异有统计学意义(P < 0.01, 图 5),但其变化程度较内源性线粒体途径较小。上述结果表明:RanBP9在骨肉瘤中通过显著激活内源性线粒体通路发挥诱导凋亡的作用,而外源性死亡受体途径在该过程中被一定程度的抑制。
|
| 1: Cytc; 2: Cleaved caspase-3; 3: Bax; 4: Bcl-2; 5: Fas; 6: Flip; a:P < 0.01,与Control组比较 图 5 Western blot(A)和RT-PCR(B)检测过表达RanBP9对内外源性凋亡信号转导途径相关分子表达的影响 |
2.6 过表达RanBP9后骨肉瘤细胞线粒体膜电位的改变
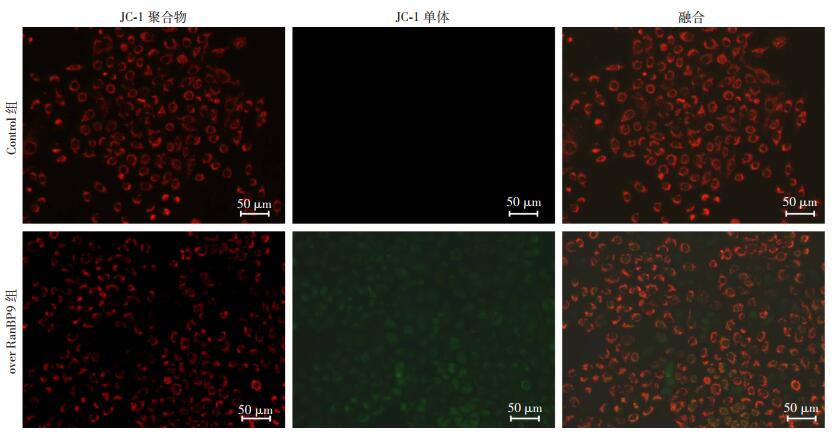
结果显示:SaOS2细胞展示出橘红色的荧光,代表正常细胞线粒体的JC-1聚合体,而在over RanBP9细胞中红色荧光转变为绿色荧光,更加接近于阳性对照,代表凋亡细胞线粒体的JC-1单体(图 6)。结果表明:RanBP9破坏了线粒体膜电位,诱导了内源性线粒体凋亡信号转导途径,进一步验证了RanBP9通过激活线粒体途径诱导骨肉瘤细胞凋亡。
|
| 图 6 JC-1检测过表达RanBP9后骨肉瘤细胞线粒体膜电位的改变 |
3 讨论
RanBP9,最初由YOKOYAMA等[4]在酵母双杂交实验中进行筛选和鉴定。RanBP9在各种生物体中存在,包括人类、恒河猴、小鼠和青蛙[5-6],主要分布在细胞核和细胞质中[6]。它在细胞内发挥支架蛋白的作用——参与组成不同功能的蛋白复合体,维持蛋白质的稳定和转录活性,同时亦可调节细胞周期、细胞黏附、迁移等。RanBP9参与中央微管的成核,影响细胞分裂和分化[7]。RanBP9不仅在正常细胞中发挥作用,对疾病的发生、发展亦有影响。WANG等[8-9]报道了RanBP9过表达可以在阿尔茨海默病小鼠模型中可减少树突和棘密度,从而引起棘突丧失导致的学习和记忆缺陷。QIN等[10]研究发现RanBP9在结肠癌中发挥抑癌作用;SHAO等[11]发现在具有远处转移的胃癌中,RanBP9表达降低;ZHAO等[12]则发现与正常组织相比,肺癌中RanBP9表达显著升高,但在肺癌细胞系中敲低RanBP9促进了肿瘤的转移,过表达RanBP9则抑制了肿瘤的发展并增加了肺癌对药物治疗的敏感性;WEI等[13]发现RanBP9和乳腺癌相关。以上研究均提示:RanBP9可作为一个抑癌基因发挥作用,但其在骨肉瘤中的作用仍有待进一步研究。本课题组之前研究发现,RanBP9在骨肉瘤中呈相对低表达,且可抑制肿瘤增殖及转移[3, 14],但其在骨肉瘤凋亡中的作用机制并不清楚。因此,本研究选择了RanBP9表达较低的骨肉瘤细胞SaOS2为研究对象,利用慢病毒载体建立了稳定过表达RanBP9的骨肉瘤细胞系,来探讨其在骨肉瘤凋亡中的作用及机制。
本研究发现,RanBP9在成骨细胞hFOB1.19及在骨肉瘤细胞株HOS、SaSO2、MG63和U2OS中均呈阳性表达,且在骨肉瘤细胞中的表达显著低于成骨细胞。利用慢病毒载体转染骨肉瘤细胞SaOS2,成功建立了稳定过表达RanBP9的骨肉瘤细胞株:Real-time PCR和Western blot检测结果均提示:与对照组比较,over RanBP9组RanBP9的表达显著上调。CCK-8结果提示过表达RanBP9显著降低了骨肉瘤细胞的增殖能力,而流式双标和TUNEL染色结果都显示过表达RanBP9显著增加了骨肉瘤细胞的凋亡率。以上结果均表明,RanBP9能抑制肿瘤增殖、促进凋亡,可作为一个抑癌基因在骨肉瘤细胞中发挥作用。
RanBP9在细胞内的分布随着凋亡的过程而改变,并能以凋亡前体蛋白的形式在细胞死亡途径中发挥调节作用,本研究亦发现RanBP9可促进骨肉瘤细胞的凋亡,但其具体的作用机制并不清楚。细胞凋亡,即细胞程序性死亡,是死亡信号触发或细胞内外环境变化导致的一种应答反应,是一个细胞主动死亡的过程。它能及时、有效地清除体内过量或具有有潜在危险的细胞,进而维持体内各种细胞的平衡[15]。这对于维持机体内环境的稳定具有重要意义。细胞凋亡的发生受到相关信号通路的精确调控。目前普遍认为主要有两条凋亡诱导途径:外部途径即死亡受体介导的凋亡途径、内部途径即线粒体凋亡途径[16-17]。本实验结果证明了RanBP9过表达在mRNA水平上调了Cytc、Caspase-3的表达以及Bax/Bcl-2的比率,在蛋白水平上调了Cleaved caspase-3和Cytc的表达。同时RanBP9降低了线粒体的膜电位,增加了骨肉瘤细胞中JC-1单体的比例,Cytc表达的增加以及线粒体膜电位的破坏,提示可能存在Cytc线粒体到胞质的释放,进一步证实RanBP9的过表达激活了线粒体通路,即RanBP9通过激活线粒体途径促进了骨肉瘤细胞的凋亡。而线粒体在内源性凋亡信号途径中处于中心位置,Cytc从线粒体释放是细胞凋亡的关键环节,Smac/DIABLO、AIF、Omi/HtrA2等其他凋亡相关分子的释放则不可逆地启动了下游的凋亡信号通路[18]。Cytc的释放是由线粒体膜通透性增加所导致的——呼吸链中的质子和电子的转移使得线粒体膜两侧产生了电位(ΔΨ),该电位促使了ATP的形成,膜电位不可逆的下降导致了膜通透性的增加。值得关注的是,RanBP9的上调反而引起了死亡受体途径关键因子Fas的下调, 并且导致了死亡受体通路凋亡抑制因子Flip的表达上调,即过表达RanBP9后,骨肉瘤细胞的外源性死亡受体途径被抑制,其抑制程度不如较线粒体途径的激活明显。Fas/FasL信号途径,作为死亡受体信号转导通路的关键通路之一,在诱导细胞凋亡中发挥重要作用。FAS作为跨膜蛋白,由其胞质的C末端区、跨膜区及胞膜外的N末端区三部分组成。其胞内区含有死亡结构域DD,在传递凋亡信号途径中发挥关键作用。Fas与其配体FasL结合后,后者由金属蛋白酶介导的水解,产生可溶性的FasL,只有三聚化的可溶性的FasL才具有功能:通过其胞质区的DD及下游相应的Caspase诱导凋亡的发生,内源性抑制剂Flip则可以通过与Caspase-8竞争性结合,抑制后者的活化,进而抑制死亡受体途径所介导的细胞凋亡。因此,本实验结果显示:RanBP9过表达诱导了骨肉瘤细胞的凋亡,该过程中线粒体通路被显著激活,而死亡受体途在一定程度上被抑制,前者变化程度较后者更为明显,其具体的分子机制仍有待进一步研究。
RanBP9亦可通过与调节凋亡过程的各种蛋白质相互作用,进而在凋亡激活的其他方面发挥作用。例如,RanBP9可以与肿瘤坏死因子TNF受体超家族的一部分p75神经营养因子受体(p75NTR)的细胞内死亡结构域相互作用[18],而后者可以与许多衔接蛋白结合并促进细胞凋亡[19]。RanBP9还可以与CDK11的胱天蛋白酶处理片段相互作用,而CDK11可参与细胞凋亡信号转导和诱导细胞凋亡[20]。然而,这些相互作用在RanBP9对促进骨肉瘤凋亡中的作用仍有待探索。最后,RanBP9被证明可以通过抑制泛素化和随后的降解来稳定促凋亡转录因子p73[21],且RanBP9过表达会上调p73 mRNA[22],表明其在转录和蛋白质水平上都能稳定p73。综上,RanBP9可能在凋亡级联激活的各个步骤参与调节细胞凋亡,其对骨肉瘤细胞的凋亡调控机制值得进一步探索。
| [1] |
MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271-289. DOI:10.3322/caac.21349 |
| [2] |
FEARON E R, VOGELSTEIN B. A genetic model for colorectal tumorigenesis[J]. Cell, 1990, 61(5): 759-767. DOI:10.1016/0092-8674(90)90186-I |
| [3] |
张樨, 吕杨帆, 戴欢子, 等. RanBP9的表达对骨肉瘤细胞增殖、凋亡及转移的影响[J]. 第三军医大学学报, 2014, 36(8): 745-749. ZHANGX, LYU Y F, DAI H Z, et al. Effect of RanBP9 expression on proliferation, apoptosis and metastasis in human osteosarcoma cells[J]. J Third Mil Med Univ, 2014, 36(8): 745-749. |
| [4] |
YOKOYAMA N, HAYASHI N, SEKI T, et al. A giant nucleopore protein that binds Ran/TC4[J]. Nature, 1995, 376(6536): 184-188. DOI:10.1038/376184a0 |
| [5] |
MURRIN L C, TALBOT J N. RanBPM, a scaffolding protein in the immune and nervous systems[J]. J Neuroimmune Pharmacol, 2007, 2(3): 290-295. DOI:10.1007/s11481-007-9079-x |
| [6] |
SALEMI L M, LOUREIRO S O, SCHILD-POULTER C. Characterization of RanBPM molecular determinants that control its subcellular localization[J]. PLoS ONE, 2015, 10(2): e0117655. DOI:10.1371/journal.pone.0117655 |
| [7] |
DAS S, SURESH B, KIM H, et al. RanBPM: A potential therapeutic target for modulating diverse physiological disorders[J]. Drug Discovery Today, 2017, 22(12). DOI:10.1016/j.drudis.2017.08.005 |
| [8] |
WANG R, WANG H, CARRERA I, et al. COPS5 protein overexpression increases amyloid plaque burden, decreases spinophilin-immunoreactive puncta, and exacerbates learning and memory deficits in the mouse brain[J]. J Biol Chem, 2015, 290(14): 9299-9309. DOI:10.1074/jbc.M114.595926 |
| [9] |
WANG R, PALAVICINI J P, WANG H, et al. RanBP9 overexpression accelerates loss of dendritic spines in a mouse model of Alzheimer's disease[J]. Neurobiol Dis, 2014, 69: 169-179. DOI:10.1016/j.nbd.2014.05.029 |
| [10] |
QIN C, ZHANG Q, WU G. RANBP9 suppresses tumor proliferation in colorectal cancer[J]. Oncol Lett, 2019, 17(5): 4409-4416. DOI:10.3892/ol.2019.10134 |
| [11] |
SHAO S, SUN P H, SATHERLEY L K, et al. Reduced RanBPM expression is associated with distant metastasis in gastric cancer and chemoresistance[J]. Anticancer Res, 2016, 36(3): 1295-1303. |
| [12] |
ZHAO Z, CHENG S, ZABKIEWICZ C, et al. Reduced expression of RanBPM is associated with poorer survival from lung cancer and increased proliferation and invasion of lung cancer cells in vitro[J]. Anticancer Res, 2017, 37(8): 4389-4397. DOI:10.21873/anticanres.11833 |
| [13] |
WEI J D, JANG J H, KIM J H, et al. RanBPM inhibits BLT2-mediated IL-8 production and invasiveness in aggressive breast cancer cells[J]. Biochem Biophys Res Commun, 2017, 483(1): 305-311. DOI:10.1016/j.bbrc.2016.12.147 |
| [14] |
DAI H, LV Y F, YAN G N, et al. RanBP9/TSSC3 complex cooperates to suppress anoikis resistance and metastasis via inhibiting Src-mediated Akt signaling in osteosarcoma[J]. Cell Death Dis, 2016, 7(12): e2572. DOI:10.1038/cddis.2016.436 |
| [15] |
LIN H Y, CHIN Y T, YANG Y C, et al. Thyroid hormone, cancer, and apoptosis[J]. Compre Physiol, 2016, 6(3): 1221-1237. DOI:10.1002/cphy.c150035 |
| [16] |
BLANDER J M. The many ways tissue phagocytes respond to dying cells[J]. Immunol Rev, 2017, 277(1): 158-173. DOI:10.1111/imr.12537 |
| [17] |
SIDDIQUI W A, AHAD A, AHSAN H. The mystery of BCL2 family: Bcl-2 proteins and apoptosis: an update[J]. Arch Toxicol, 2015, 89(3): 289-317. DOI:10.1007/s00204-014-1448-7 |
| [18] |
GERMAIN M, MATHAI J P, MCBRIDE H M, et al. Endoplasmic reticulum BIK initiates DRP1-regulated remodelling of mitochondrial cristae during apoptosis[J]. Embo J, 2005, 24(8): 1546-1556. DOI:10.1038/sj.emboj.7600592 |
| [19] |
ZHANG J, MA W, TIAN S, et al. RanBPM interacts with TβRI, TRAF6 and curbs TGF induced nuclear accumulation of TβRI[J]. Cell Signal, 2014, 26(1): 162-172. DOI:10.1016/j.cellsig.2013.09.019 |
| [20] |
MIKOLAJCZYK M, SHI J, VAILLANCOURT R R, et al. The cyclin-dependent kinase 11p46 isoform interacts with RanBPM[J]. Biochem Biophys Res Commun, 2003, 310(1): 14-18. DOI:10.1016/j.bbrc.2003.08.116 |
| [21] |
KRAMER S, OZAKI T, MIYAZAKI K, et al. Protein stability and function of p73 are modulated by a physical interaction with RanBPM in mammalian cultured cells[J]. Oncogene, 2005, 24(5): 938-944. DOI:10.1038/sj.onc.1208257 |
| [22] |
LIU T, ROH S E, WOO J A, et al. Cooperative role of RanBP9 and P73 in mitochondria-mediated apoptosis[J]. Cell Death Dis, 2013, 4(1): e476.. DOI:10.1038/cddis.2012.203 |



