2. 400016 重庆,重庆医科大学附属第一医院:眼科学重庆市重点试验室, 老年病科
2. Department of Geriatrics, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
阿尔茨海默病(Alzheimer's disease,AD)是一种以认知和神经精神症状为特征的神经系统退行性疾病,其起病隐匿,发展缓慢,临床上以记忆丧失、行为改变、定向障碍、视觉障碍和睡眠障碍等表现为特征。到目前为止,AD治疗的主要目的是延缓疾病的发展,提高生活质量,但是没有治愈的方法。AD患者的认知衰退指示着神经系统的退化,在临床前期就可以通过脑成像技术和蛋白生物标志物捕捉到相关的病理变化。有证据表明,AD在其出现临床症状前20年就出现了相关神经退行性变的病理改变[1],这提示如果能早期发现、早期干预疾病可有效延缓AD的进展[2]。虽然一些探索性的生物标志物已经被提出用于AD的早期诊断,例如tau蛋白的过度磷酸化和脑脊液中β-淀粉样蛋白(Aβ)水平以及成像研究(如碳11-匹兹堡复合物B正电子发射断层扫描)[3],但由于其入侵式检查方式以及成本昂贵、缺乏足够的医疗设施而在临床应用中受限。因此,重要的是找到容易实施和具有成本效益的方式来提供关于疾病的线索,以便于及时干预疾病和提高患者的生活质量。
视网膜细胞与大脑有着相同的胚胎起源,并且视网膜是中央视网膜神经系统中唯一可以直接观察到的部分。视网膜神经纤维层(retinal nerve fiber layer,RNFL)是视网膜最内层,由视网膜神经节细胞轴突组成,它将视网膜神经与外侧膝状体背侧核相连接,突触连接到视觉皮层,所以可以认为视网膜是中枢神经系统的投射。此外,它们在血管系统、神经胶质细胞、神经递质系统和与视觉皮质的连接性方面也是相似的。AD患者的大脑中含有神经原纤维缠结(nerve fiber tangle,NFT),这些缠结由Tau蛋白形成,并与不溶性Aβ沉积配对形成斑块。这个过程最终导致神经元和突触[4]的丢失。AD患者的视觉相关区域[5]和皮层下视觉中心[6]存在Aβ的沉积和神经原纤维缠结,引起了多种视觉和临床症状[7]。所以有理由认为通过眼睛的一些变化可以直接反映大脑的变化,使用眼睛相关的非侵袭性生物标志物可能为AD的发病和进展提供新的见解。
近年来,神经电生理检查和光学成像技术的发展使得检测眼部神经退行性疾病成为可能。视觉诱发电位(VEP)测试常用于评估视网膜和视神经的生物电功能。有研究发现AD患者在PVEP检查中发现P100波的潜伏期增加[8],P100波振幅降低[9]。同时,OCT是一种快速、无创的成像工具,可以生成视网膜的三维横断面图像,并可精确测量视网膜厚度等信息。有研究表明,与年龄匹配的健康对照组相比,AD患者的RNFL更薄[10]。利用眼睛作为大脑的延伸,对患者进行直接、无创的眼部检查来实现AD病理的非侵入性可视化,尽管存在特异性不高的局限性,但也是对AD诊断监测的一个重要进展。
迄今为止,鲜见联合使用PVEP和OCT将视网膜功能和结构相结合来对AD患者的视网膜进行评估的相关研究。本研究将AD患者和健康对照组的PVEP与OCT测试相结合,旨在通过多个眼部指标来区分AD患者和正常人,并提高区分能力的特异性和敏感度,评估眼部指标是否有望成为AD诊断的生物标志物。
1 资料与方法 1.1 研究对象 1.1.1 AD组共31例, 为重庆医科大学附属第一医院老年科2018年8月至2019年11月期间的门诊患者。入组标准为:①符合美国国立神经病及语言障碍疾病和脑卒中研究所、阿尔茨海默病及相关疾病协会标准(NINCDS-ADRDA)“可能阿尔茨海默病”诊断标准;②Hachinski缺血指数 < 4分;③无其他精神疾病史;④CT或MRI排除血管性病变等脑部病变。⑤眼部入选标准:最佳矫正视力(best corrected visual acuity,BCVA)>0.5 (Snellen视力表)、眼压正常、眼球运动正常。排除青光眼、视网膜脱离、视网膜血管病变、老年性黄斑变性、高度近视等眼底病变,以及白内障严重影响眼部检查的患者。
1.1.2 正常对照组(healthy control, HC组)共36例, 为在社区中招募的健康志愿者。入组标准为:①年龄63~90岁;②认知功能正常:MMSE不低于27分;③无精神疾病史;④无严重躯体疾病;⑤CT或MRI无器质性疾病的证据;⑥眼部入选标准同AD组。
该计划得到了重庆医科大学附属第一医院伦理委员会的批准,批号:2019年科研伦理(2019-127)号,并获得了患者或其家属的书面知情同意。
1.2 方法 1.2.1 图形视觉诱发电位(pattern visual evoked potential,PVEP)本研究使用GT-2008V-Ⅰ视觉电生理仪(重庆国特医疗设备有限公司)对受试者进行PVEP检查。检查前准备:受试者瞳孔保持自然状态,并且要矫正屈光状态。嘱咐受检查者全身肌肉放松, 精神集中。①电极:用EEG盘电极。记录电极放在0z位(枕骨粗隆上方2.5 cm处),参考电极放在Fz位(鼻根上12 cm处), 地电极放在耳垂处。检查前需做皮肤准备,用酒精棉片擦净皮脂和污垢,0z位皮肤还特别需剪去安放电极处的数根头发,并涂抹导电膏后再安放电极;②刺激方式:使用瞬态翻转图形VEP,即使用电视屏幕上棋盘变换做刺激;③记录条件:患者端坐于距刺激屏前约1 m处,图形视野为全视野1 cpd,黑+白棋盘格,对比度96%,亮度140 cd/m2;分析时间250 ms,采样频率2.4 Hz。对受试者两只眼各重复3次检查,并录入中间值进行统计分析。
1.2.2 光学相干断层扫描(optical coherence tomography,OCT)用复方托吡卡胺眼液将双眼扩瞳后,使用OCT(德国海德堡光学相干断层扫描仪)测量视乳头周围RNFL厚度。对于图像采集,在受试者坐下并正确定位后,使用虹膜和眼底视点将图像与扫描中心的视神经乳头(ONH)对焦,然后手动采集6 mm×6 mm的图像数据,随后系统可以自动分析获得上(鼻上、颞上)、下(鼻下、颞下)、鼻、颞侧pRNFL厚度参数。每一位受试者都检查了双眼,然而我们的分析仅包括每个受试者右眼的数据,以避免由于每个受试者双眼之间存在关联而造成的偏倚。
1.3 统计学方法使用SPSS 25.0统计学软件,以P < 0.05代表有统计学意义。通过以下方式比较AD组和HC组的PVEP和OCT的参数:①对于正态分布的数据,应用x±s表示,并使用独立样本t检验;②对于非正态分布的数据,使用中位数(1/4分位数、3/4分位数)表示,并使用Mann-WhitneyU检验进行分析。然后将组间存在差异的指标纳入二元logistic回归分析,并用单个指标以及多个指标的组合做ROC曲线,分析曲线下面积(AUC)。PVEP的数据分析包括P100波的潜伏期和幅值,OCT的数据分析包括各个象限的pRNFL厚度。
2 结果 2.1 一般资料的比较两组的年龄、性别、最佳矫正视力(best corrected visual acuity,BCVA)和眼压均差异无统计学意义(表 1)。AD组年龄为63~90(73.69±7.344)岁,对照组年龄为63~85(72.93±7.860)岁。
| 组别 | n | 年龄/岁 | 男性/女性 (例) |
最佳矫 正视力 |
眼压/mmHg |
| Ad组 | 31 72 | (66, 79) | 13/18 | 0.8(0.7,1.0) | 15.48±1.546 |
| HC组 | 36 70 | (67, 79) | 12/24 | 0.8(0.7, 1.0) | 15.44±1.681 |
| P值 | 0.890a | 0.613b | 0.550a | 0.921c |
2.2 AD组P100波幅值降低
AD组在P100波的潜伏期与HC组差异无统计学意义(P>0.05),P100波的幅值明显降低(P < 0.05,表 2)。
| 组别 | n | 潜伏期/ms | 幅值/μV |
| Ad组 | 31 | 111.37±13.86 | 5.60(4.00, 6.20) |
| HC组 | 36 | 106.81±10.90 | 8.95(6.38, 11.83) |
| P值 | 0.136 | < 0.001 |
2.3 AD组pRNFL厚度变薄
与健康对照组相比,AD组的鼻侧、鼻上、颞上、颞下象限的pRNFL厚度均显著变薄(P < 0.05),颞侧及鼻下象限厚度在两组间差异无统计学意义(P>0.05,表 3)。图 1为AD患者在OCT检查中的典型表现,图 2为同一患者脑部MRI表现(海马体萎缩Ⅱ级)。
| 组别 | n | 颞侧象限 | 鼻侧象限 | 鼻上象限 | 颞上象限 | 鼻下象限 | 颞下象限 |
| Ad组 | 31 | 72(64, 85) | 67.77±16.14 | 91.87±22.76 | 120(96, 133) | 101(88, 135) | 123.55±20, 87 |
| HC组 | 36 | 72(66, 87) | 75.53±10.10 | 114.89±20.15 | 143(128, 152) | 111(96, 116) | 142.22±23, 20 |
| P值 | 0.835 | 0.025 | < 0.001 | < 0.001 | 0.711 | 0.001 |
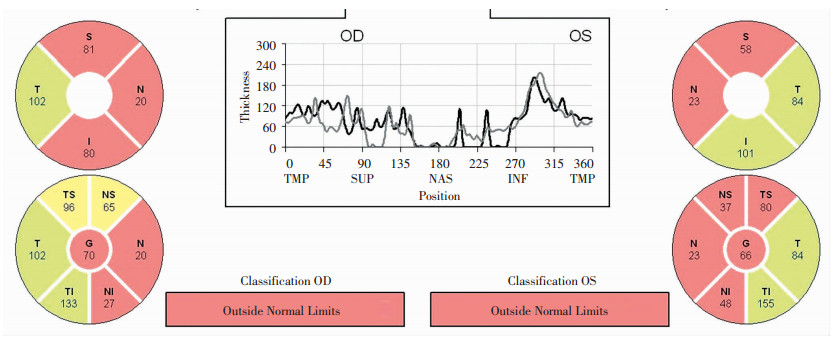
|
| 主要表现出鼻侧和上方的pRNFL厚度显著变薄 图 1 AD患者的典型OCT检查结果 |
2.4 多因素回归分析
将PVEP和OCT的检查结果进行单因素分析后,得到P100幅值和鼻侧、鼻上、颞上、颞下象限pRNFL厚度差异具有统计学意义,将以上指标纳入二元logistic回归分析(表 4)。
| 因素 | Model 1 | Model2 | Model3 | Model4 | |||||||||||
| OR | 95 % Cl | P | OR | 95 % Cl | P | OR | 95 % Cl | P | OR | 95 % Cl | P | ||||
| N | - | - | 0.778 | - | - | 0.340 | - | - | 0.47 | - | - | 0.297 | |||
| NS | 1.048 | 1.010-1.088 | 0.014 | - | - | - | 1.057 | 1.021-1.094 | 0.002 | 1045 | 1.015 -1.075 | - | |||
| TS | 1.036 | 0.999-1.073 | 0.054 | 1.054 | 1.016-1.094 | - | - | - | - | - | - | 0.160 | |||
| TI | - | - | 0.956 | - | - | 0.649 | - | - | 0.267 | 1.033 | 1.004-1.064 | - | |||
| 幅值 | 1.746 | 1.274-2. 391 | 0.001 | 1.76 | 1.304-2. 337 | - | 1.770 | 1.286-2.438 | < 0.001 | - | - | - | |||
| Model1:纳入所有因素;Model2:纳入除NS外所有因素;Model3:纳入除TS外所有因素;Model4:纳入除幅值外所有因素;OR:比值比;CI:置信区间;pRNFL:视乳头周围视网膜神经纤维层;N:鼻侧象限pRNFL厚度;NS:鼻上象限pRNFL厚度;TS:颞上象限pRNFL厚度;TI:颞下象限pRNFL厚度 | |||||||||||||||
2.5 ROC曲线分析 2.5.1 单个参数的ROC曲线
如图 3所示,鼻侧象限pRNFL的AUC为0.655;鼻上象限pRNFL的AUC为0.770;颞上象限pRNFL的AUC为0.767;颞下方pRNFL的AUC为0.763;P100幅值AUC为0.836,发现鼻侧、鼻上、颞上象限pRNFL厚度相应的AUC在0.655~0.770之间,对区分AD患者和正常人群的预测效果较差,P100波幅值相应的AUC为0.836,预测效果一般。
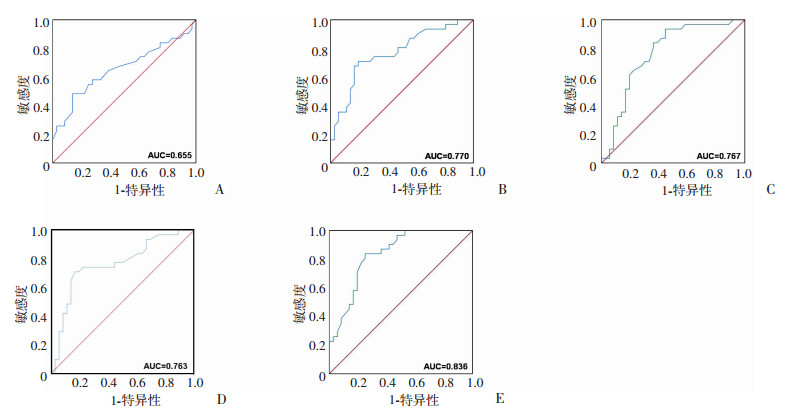
|
| 主要表现出鼻侧和上方的pRNFL厚度显著变薄 图 3 AD患者的典型OCT检查结果 |
2.5.2 各参数组合的ROC曲线
如图 4所示,结合鼻上象限、颞上象限pRNFL厚度以及P100幅值3个指标的AUC为0.929;结合颞上象限pRNFL厚度和P100幅值2个指标的AUC为0.901;结合鼻上象限pRNFL厚度和P100幅值2个指标的AUC为0.907;结合鼻上象限和颞下象限pRNFL厚度两个指标的AUC为0.831。发现结合pRNFL厚度和P100波幅值所对应的AUC在0.901~0.929,对区分AD患者和正常人群的预测效果很好,具有较高的诊断效能。
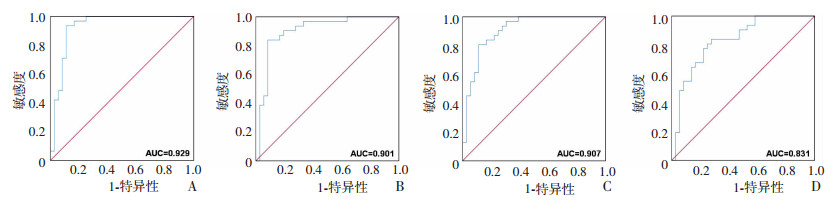
|
| AUC:曲线下面积;pRNFL:视乳头周围视网膜神经纤维层;A:鼻侧pRNFL对应的AUC面积;B:鼻上方pRNFL对应的AUC面积;C:颞上方pRNFL对应的AUC面积;D:颞下方pRNFL对应的AUC面积;E:P100波幅值对应的AUC面积 图 4 视网膜功能或结构单一参数的ROC曲线 |
3 讨论
本研究中纳入的AD患者的年龄、性别、最佳矫正视力和眼压与正常对照组之间差异均无统计学意义,然而却发现AD患者的pRNFL较对照组显著变薄。因为RNFL是由来自视网膜神经节的轴突组成,这些轴突汇聚到视盘上,所以可以把pRNFL厚度作为评估轴突丢失程度和神经元变性的依据。此前也有很多使用OCT的研究已经证明了AD患者的pRNFL细胞有丢失现象,并且这种变化在疾病的相对早期最明显[11]。至今在阿尔茨海默病中已经报道了几种类型的pRNFL丢失,包括上方pRNFL[11],上方、鼻侧pRNFL[12],或者上方、下方pRNFL[13]的丢失,但这种表现是非特异性的,在其他与认知能力下降相关的神经退行性疾病如帕金森病[14]和路易体痴呆[15]的研究中也有类似的发现。值得注意的是,在我们的研究中发现上方pRNFL变薄最为显著,这可能是由于上方视网膜轴突所投射的楔形回在AD的皮质损伤中也最为明显的体现[16]。此外我们还发现在PVEP检查中AD患者的P100波幅值较正常人降低。由于PVEP的潜伏期和幅值可能会受到白内障混浊程度的影响,所以本研究纳入的受试者最佳矫正视力均不低于0.5。因为有研究表明白内障患者的最佳矫正视力大于0.3时,其具有正常的PVEP结果,且与正常对照组的PVEP的幅值无明显差异[17],同时我们还保证了两组的平均最佳矫正视力无明显差异(BCVA均为0.8),这就在很大程度上减少了晶体混浊程度对两组间PVEP的幅值造成差异的影响。PVEP检查的P100波反映的是视神经的生物电功能[18],P100波幅值的降低则可能是视神经功能障碍的亚临床特征。虽然现已有报道发现AD患者P100波的潜伏期增加[19],振幅降低[9],但也有研究报道AD患者PVEP结果相较正常人无显著差异[20]。
以前的研究均使用单一标志物来评估AD患者的视网膜变化,在诊断AD时可能存在特异性低的缺点,本研究发现,使用单个pRNFL厚度做得的ROC曲线AUC在0.655~0.770之间,预测效果较低;使用P100幅值做得的ROC曲线AUC为0.836,预测效果一般,所以直接使用这些眼部的指标作为AD诊断的生物标志物可能是不可靠的。本研究则结合了结构(pRNFL厚度)和功能(PVEP测试)来联合评估AD的视网膜变化,我们认为通过整合测试参数可以找到更多临床诊断价值。进一步分析多参数ROC曲线后发现鼻上、颞上pRNFL厚度和P100波幅值相结合的ROC曲线AUC为0.929,预测效果很好,具有最高的诊断效能。此外,使用颞上pRNFL厚度和P100波幅值相结合以及鼻上pRNFL厚度和P100波幅值两两参数相结合的ROC曲线AUC分别为0.901和0.907,仍然有较高的诊断效能,但是由于颞上和鼻上pRNFL厚度参数都能由OCT检查同时得到,所以在临床上可以同时使用颞上、鼻上RNFL厚度和P100波幅值3个参数来评估患者患AD的风险,以及辅助AD的诊断。总之,本研究结果表明PVEP和OCT的组合为AD的诊断提供了良好的临床生物标记,与单个参数相比,结合视网膜结构和功能的ROC曲线可以更好地区分AD患者和健康对照组。
本研究的不足之处在于这并不能最终说明联合OCT和PVEP检查对阿尔茨海默病有诊断作用,只证明了AD患者的视网膜结构和功能较正常人均有显著差异,并且联合OCT和PVEP的测试参数可以提高区分能力的特异性和灵敏度,但要达到“早期诊断”的效果还远远不够。早期诊断是AD领域的热点之一,目前仍以PET-CT或脑脊液生物标志物为主,但临床实施困难、费用昂贵,眼部检查成为无创、易实施的策略之一,值得研究。本研究旨在说明眼部变化与AD的关系,寻找到可能成为AD诊断生物标志物的眼部指标。我们有计划纳入临床前期的患者,但需要大量社区筛查工作,这将在进一步的研究中进行。
如本文所述,OCT、PVEP是比较易得且无创的检查方式,不仅费用较低、检查所需时间短,并且患者也较容易配合。所以未来的研究可以采用多中心临床试验,对有记忆减退、判断力下降、日常生活能力下降等症状的老年人进行OCT和PVEP检查,把鼻上、颞上pRNFL厚度变薄,P100幅值降低作为危险因素,评估其发展为AD的可能性,并长时间跟踪随访,进一步评价视网膜结构及功能的损害在阿尔茨海默病诊断中的意义。
| [1] |
BATEMANR J, XION G C, BENZINGER T L, et al. Dominantly inherited Alzheimer network. Clinical and biomarker changes in dominantly inherited Alzheimer's disease.[J]. N Engl J Med, 2012, 367(9): 795-804. DOI:10.1056/NEJMoa1202753 |
| [2] |
WORTMANN M. Dementia: a global health priority-highlights from an ADI and World Health Organizationreport[J]. Alz Res Therapy, 2012, 4(5): 40. DOI:10.1186/alzrt143 |
| [3] |
CERQUERA-JARAMILLO M A, NAVA-MESA M O, GONZÁLEZ-REYES R E, et al. Visual features in Alzheimer's disease: from basic mechanisms to clinical overview[J]. Neural Plast, 2018, 2018: 1-21. DOI:10.1155/2018/2941783 |
| [4] |
GAO L Y, LIU Y, LI X H, et al. Abnormal retinal nerve fiber layer thickness and macula lutea in patients with mild cognitive impairment and Alzheimer's disease[J]. Arch Gerontol Geriatr, 2015, 60(1): 162-167. DOI:10.1016/j.archger.2014.10.011 |
| [5] |
NEDDENS J, TEMMEL M, FLUNKERT S, et al. Phosphorylation of different tau sites during progression of Alzheimer's disease[J]. Acta Neuropathol Commun, 2018, 6(1): 52. DOI:10.1186/s40478-018-0557-6 |
| [6] |
ERSKINE D, TAYLOR J P, FIRBANK M J, et al. Changes to the lateral geniculate nucleus in Alzheimer's disease but not dementia with Lewy bodies[J]. Neuropathol Appl Neurobiol, 2016, 42(4): 366-376. DOI:10.1111/nan.12249 |
| [7] |
LENOIR H, SIÒROFFÒ. Visual perceptual disorders in Alzheimer's disease[J]. Geriatr Psychol Neuropsychiatr Vieil, 2019, 17(3): 307-316. DOI:10.1684/pnv.2019.0815 |
| [8] |
NG OO, Q. Z., WAN HITAM, W. H., AB RAZAK, A ., et al. Evaluation of retinal nerve fiber layer thickness, electroretinogram and visual evoked potential in patients with alzheimer's disease[J]. J Ophthalmol, 2019, 1-7. DOI:10.1155/2019/6248185 |
| [9] |
VAN WIJNGAARDEN P, HADOUX X, ALWAN M, et al. Emerging ocular biomarkers of Alzheimer disease[J]. Clin Exp Ophthalmol, 2017, 45(1): 54-61. DOI:10.1111/ceo.12872 |
| [10] |
TREBBASTONI A, D'ANTONIO F, BRUSCOLINI A, et al. Retinal nervefibre layer thickness changes in Alzheimer's disease: Results from a 12-month prospective case series[J]. Neurosci Lett, 2016, 629: 165-170. DOI:10.1016/j.neulet.2016.07.006 |
| [11] |
LA MORGIA C, ROSS-CISNEROS F N, KORONYO Y, et al. Melanopsin retinal ganglion cell loss in Alzheimerdisease[J]. Ann Neurol, 2016, 79(1): 90-109. DOI:10.1002/ana.24548 |
| [12] |
KROMER R, SERBECIC N, HAUSNER L, et al. Detection of retinal nerve fiber layer defects in Alzheimer's disease using SD-OCT[J]. Front Psychiatry, 2014, 5: 22. DOI:10.3389/fpsyt.2014.00022 |
| [13] |
NGOLAB J, HONMA P, RISSMAN R A, et al. Reflections on the Utility of the Retina as a Biomarker for Alzheimer's disease: A literature review[J]. Neurol Ther, 2019, 8(Suppl 2): 57-72. DOI:10.1007/s40120-019-00173-4 |
| [14] |
WEIL R S, SCHRAG A E, Warren J D, et al. Visual dysfunction in Parkinson's disease[J]. Brain, 2016, 139(11): 2827-2843. DOI:10.1093/brain/aww175 |
| [15] |
MORENO-RAMOST, JULIÁN BENITO-LEÓN, VILLAREJO-GALENDE A, et al. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease[J]. J Alzheimer Dis: JAD, 2012, 34(3): 659-664. DOI:10.3233/JAD-121975 |
| [16] |
FROHMAN EM, FUJIMOTO JG, FROHMAN TC, et al. Optical coherence tomography: a window into the mechanisms of multiple sclerosis[J]. Nat Clin Pract Neurol, 2008, 4: 664-675. DOI:10.1038/ncpneuro0950 |
| [17] |
JINGA, LEI Z, YUSHENG W, et al. The success of cataract surgery and the preoperative measurement of retinal function by electrophysiological techniques[J]. J Ophthalmol, 2015, 2015: 1-10. DOI:10.1155/2015/401281 |
| [18] |
BEARSE, MARCUSA. Principles and Practice of Clinical Electrophysiology of Vision[M]. Massachusetts: MIT Press, 2007. DOI:10.1097/opx.0b013e318155a94e
|
| [19] |
KRASODOMSKAK, WOJCIECH LUBIN'SKI, POTEMKOWSKI A, et al. Electrophysiological changes in patients with early stages of Alzheimer's disease[J]. Ann Acad Med Stetin, 2007, 53 Suppl 1: 49-57. |
| [20] |
ISERI P K, ALTINAS O, TOKAY T, et al. Relationship between cognitive impairment and retinal morphological and visual functional abnormalities in alzheimer disease[J]. J Neurophthalmol, 2006, 26(1): 18-24. DOI:10.1097/01.wno.0000204645.56873.26 |




