2. 362801 福建 泉州,福建省泉州市泉港区医院病理科;
3. 350005 福州,福建医科大学附属第一医院病理科
2. Department of Pathology, Quangang District Hospital, Quanzhou, Fujian Province, 362801;
3. Department of Pathology, First Affiliated Hospital of Fujian Medical University, Fuzhou, Fujian Province, 350005, China
乳腺癌是女性最常见的恶性肿瘤,占女性肿瘤性死亡病因的首位[1]。根据激素受体及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)状态,乳腺癌分为4个亚型[2],即Luminal A、Luminal B、HER2过表达及三阴性。而孕激素受体(progesterone receptor,PR)在Luminal A和Luminal B分型中起关键作用。2013年,PRAT等[3]对Luminal A型乳腺癌进行免疫组化(immunohistochemistry,IHC)检测,证明PR>20%的患者无病生存期更长。该结论被Gallen国际专家联盟采用,通过强调PR的阈值把Luminal A型乳腺癌定义为雌激素受体(estrogen receptor,ER)+、PR>20%、HER2-、Ki67 < 14%,预示患者有复发风险;Luminal B型(HER2-)乳腺癌定义为ER+、HER2-,并满足以下任一条件:Ki67≥20%,PR-或 < 20%,该类型乳腺癌具有高复发风险[4]。因此,PR对乳腺癌分型及预后有重要意义[3]。
乳腺癌在接受辅助或新辅助治疗前必须明确激素受体状态[5],激素受体ER和PR免疫组化结果判读为阴性或阳性,按ER和PR状态分为4组,分别为ER+/PR+、ER+/PR-、ER-/PR+和ER-/PR-[6]。PR阳性(ER+/PR+及ER-/PR+)患者优先使用他莫昔芬[7],而PR阴性(ER+/PR-)患者常对他莫昔芬产生耐药,可优先使用芳香酶类药物治疗[8]。
由于PR状态对乳腺癌的分型、治疗及预后均意义重大,选择合适PR抗体是精确判读至关重要的前提。已有大量对PR不同克隆号抗体进行的研究,如PgR636[9]、16[9]、1E2[10]、SP2[10]等,克隆号不同存在对组织前处理的反应效果不同、IHC的敏感性及染色阳性率不一致以及非特异性着色等现象[9-10]。众多PR抗体中,1E2使用最广泛。TROXELL等[9]对1 200个试验室的PR抗体进行总结发现1E2的使用率达到61%。我科IHC检测PR(1E2)结果中ER-/PR+组乳腺癌病例数量偏多,即使经过重复检测结果依然如此。我们提出2个问题:1E2是否值得继续使用?它与目前国内其他试验室所用PR抗体有无区别?因此,本研究选用4个PR抗体(SP2、1E2、16及EP2),对石蜡包埋非特殊型浸润性乳腺癌(non-specific invasive breast cancers, NSIBCs)组织芯片进行IHC检测,比较4种抗体的表达情况,筛选出敏感性较好抗体,为临床病理PR判读及NSIBCs患者内分泌治疗、预后判断提供依据。
1 资料与方法 1.1 标本来源收集福建医科大学附属第一医院2010年1月1日至2012年1月1日NSIBCs手术标本195例,均为女性患者,年龄24~86(50.23±10.71)岁。病例按照WHO(2012)乳腺肿瘤的标准诊断[11],且由2位高年资主治以上医师对HE诊断结果进行审核。纳入标准:①初次及再次审核均诊断为非特殊型浸润性癌;②女性患者。排除标准:①新辅助化疗后的非特殊型浸润性癌;②复审存在争议的病例。
1.2 方法标本离体后0.5 h内10%中性缓冲福尔马林固定(>6 h,< 72 h),石蜡包埋;制备5×6(5列6排)空白蜡块,采用手动组织芯片制作枪(购自广州秀威科技有限公司)按直径2 mm的大小进行目标蜡块取样,依次植入空白蜡块;按3 μm厚度切片,行HE及免疫组化染色;4种PR免疫组化抗体均为工作液[EP2(兔单克隆抗体,北京中杉金桥生物技术有限公司)、SP2(兔单克隆抗体,福州迈新生物技术开发有限公司)、1E2(兔单克隆抗体,Roche公司)和16(鼠单克隆抗体,北京中杉金桥生物技术有限公司)],ER(工作液,克隆号SP1,Roche公司);均采用Ventana全自动免疫组化仪检测。
1.3 评判标准ER、PR免疫组化结果由2位高年资主治以上医师对切片的染色强度及阳性细胞百分率进行分级评分,采用半定量的Allred score评分系统,具体如下:①阳性细胞比例按照0、< 1%、1%~10%、>10%~33%、>33%~66%、>66%分成6个等级,对应的阳性细胞比例评分为0~5分;②染色强度分成无、弱、中及强阳性4个等级,染色强度评分分别为0~3分;③阳性细胞比例评分与染色强度评分相加,其中≥3分为染色阳性。
1.4 统计学分析应用SPSS 23.0统计学软件进行分析。4个PR抗体与ER构成比(ER±/PR±)比较采用χ2检验。各抗体表达的一致性采用Kappa(κ)系数检验。4个PR抗体的染色模式采用Wilcoxon相关样本检验。各抗体之间的染色模式比较采用Frideman组间比较。双侧检验,检验水准α=0.05。
2 结果 2.1 4种PR的免疫组化定位及染色强度情况几乎所有NSIBCs病例4种PR抗体均定位于细胞核,但染色强度及着色细胞数等存在差异。极个别病例的个别抗体染色定位异常(图 1)。
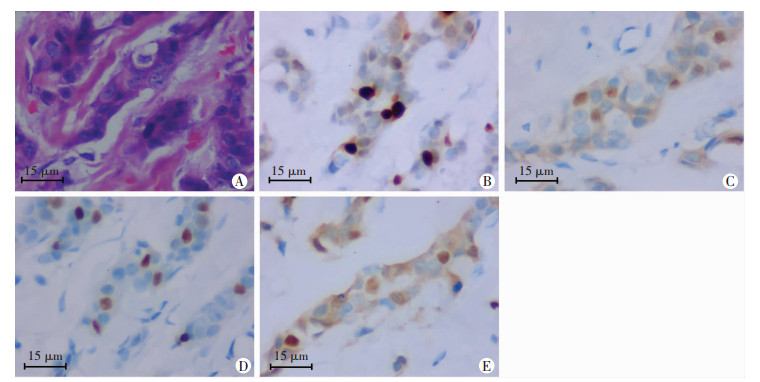
|
| A:HE染色下组化染色定位异常病例的光镜图像;B:1E2强阳性及细胞核定位;C:EP2中等阳性及细胞核伴少量细胞质定位;D:SP2中-强阳性及细胞核定位;E:16弱-中等阳性及细胞核伴明显细胞质阳性 图 1 NSIBCs组织芯片中4种PR抗体的定位及染色强度 |
2.2 4种PR与ER阳性及阴性病例构成比(ER±/PR±)比较
195例NSIBCs的4种PR与ER判读结果分4组,即ER+/PR+、ER+/PR-、ER-/PR-、ER-/PR+,统计结果显示各组间差异无统计学意义(P=0.236,表 1),仅PR(1E2)抗体ER±/PR+病例数较其他PR抗体多。不考虑ER表达情况,对4种PR抗体同时阴性或阳性病例数及一致性检测,显示1E2与EP2、16、SP2同时评判为阴性或阳性(PR+/-)比例分别为86.67%(169/195)、83.07%(162/195)、81.54%(159/195),一致性较好(κ值分别为0.694、0.645、0.634),而EP2与16、SP2相同表达(PR+/-)的比例分别为90.77%(177/195)、87.18%(170/195),一致性很好(κ值分别为0.804、0.753),16与SP2同时阴性或阳性(PR+/-)为87.69%(171/195),一致性也很好(κ=0.783)。
| 组别 | 1E2 | EP2 | SP2 | 16 |
| ER+/PR+ | 97(49.7) | 88(45.1) | 86(44.1) | 84(43.1) |
| ER+/PR- | 34(17.4) | 43(22.1) | 45(23.1) | 47(24.1) |
| ER-/PR- | 53(27.2) | 60(30.8) | 60(30.8) | 61(31.3) |
| ER-/PR+ | 11(5.6) | 4(2.1) | 4(2.1) | 3(1.5) |
2.3 4种PR抗体阳性病例着色情况、染色强度及A-score评分
与EP2、SP2、16阳性表达率(均 < 50%)比较,1E2阳性率最高(108/195,占55.8%), 同时阳性细胞百分比 < 25%的比例最少(35.2%),>75%的比例最多(38.9%), 且A-Score评分 < 3分的比例最少(11.1%),具体见表 2。
| 指标 | 1E2 | EP2 | SP2 | 16 |
| 阴性 | 87(44.2) | 103(52.8) | 104(53.3) | 108(55.4) |
| 阳性 | 108(55.8) | 92(47.2) | 91(46.7) | 87(44.6) |
| 着色细胞比例 | ||||
| 1%~25% | 38(35.2) | 50(54.3) | 49(53.3) | 54(62.1) |
| > 25%~50% | 21(19.4) | 16(17.4) | 9(10.0) | 12(13.8) |
| > 50%~75% | 7(6.5) | 9(9.8) | 11(12.3) | 5(5.7) |
| > 75% | 42(38.9) | 17(18.5) | 22(24.4) | 16(18.4) |
| 染色强度 | ||||
| 弱 | 26(24.1) | 47(51.1) | 44(48.4) | 43(49.4) |
| 中 | 19(17.6) | 22(23.9) | 24(26.4) | 20(23.0) |
| 强 | 63(58.3) | 23(25.0) | 23(25.3) | 24(27.6) |
| A-Score | ||||
| 3 | 12(11.1) | 23(25.0) | 26(29.2) | 27(31.0) |
| 4 | 14(13.0) | 18(19.6) | 11(12.4) | 15(17.2) |
| 5 | 8(7.4) | 15(16.3) | 15(16.9) | 13(13.8) |
| 6 | 19(17.6) | 11(12.0) | 14(15.7) | 14(16.1) |
| 7 | 15(13.9) | 14(15.2) | 9(10.1) | 7(8.0) |
| 8 | 40(37.0) | 11(12.0) | 14(15.7) | 12(13.8) |
2.4 4种PR抗体的平均着色情况、染色强度及A-score评分比较
结果显示,1E2的平均着色细胞数、平均阳性细胞百分比评分、平均染色强度及平均A-score评分均明显高于EP2、SP2、16(P < 0.01),而EP2、SP2、16之间差异无统计学意义(P>0.05,表 3)。
| 抗体 | 阳性例数 | 平均着色细胞数(%) | 平均百分比评分 | 平均染色强度 | 平均A-score |
| 1E2 | 108 | 51.34 | 3.87 | 2.34 | 6.21 |
| EP2 | 92 | 34.17a | 3.35a | 1.72a | 5.09a |
| SP2 | 91 | 37.80a | 3.40a | 1.77a | 5.12a |
| 16 | 87 | 30.37a | 3.16a | 1.78a | 4.94a |
| a:P < 0.01,与1E2比较 | |||||
3 讨论
通过对195例NSIBCs组织芯片进行4种PR抗体(1E2、EP2、SP2、16)IHC染色及比较,显示兔单克隆抗体1E2平均着色细胞数、平均百分比评分、平均染色强度、平均A-score明显高于其他3个抗体,是较理想的PR抗体。
兔单克隆PR抗体1E2阳性率高、受固定延时等因素影响小[9-10]。尽管兔单克隆与鼠单克隆抗体均是临床病理试验室及科研常用免疫组化选择,但有研究认为兔单克隆PR抗体具有更高的敏感性及可靠性[12]。本研究195例NSIBCs染色PR的整体阳性率约50%,其中兔单克隆抗体EP2为47.2%(92/195)、SP2为46.7%(91/195)、1E2为55.8%(108/195),鼠单克隆抗体16为44.6%(87/195),与文献报道的PR阳性率(54.7%~75.5%)基本类似[13]。不仅抗体的不同克隆号会导致IHC结果有差别,其他因素也对组化结果产生不同影响,如标本预处理过程(固定液类型、标本固定时间)、分析因素(稀释、对照样本)等影响[13]。延长福尔马林固定时间会使ER/PR表达评分下降,但1E2受固定影响最小[9]。本试验所用NSIBCs手术标本取材后均经中性福尔马林固定过夜(24~48 h),但4种PR阳性率有差别且1E2阳性率最高,说明1E2受固定时长影响最小。
1E2与其他3个抗体的一致性及A-score评分不同,敏感性更高。本研究结果表明1E2与EP2、SP2、16等3个抗体一致性中等(κ值分别为0.694、0.645、0.634),而EP2与16、SP2(κ值为0.804、0.753)、16与SP2(κ值为0.783)一致性较好。关于κ值意义的解释目前并无统一标准,常用分段解释如下:κ < 0.2,差;0.21~0.4,弱;0.41~0.60,中;0.61~0.8,好;0.81~1.00,非常好[13]。所用4个抗体间的κ值中等(0.61~ 0.8),且4个PR抗体与ER表达的阴性及阳性病例构成比差异无统计学意义(P=0.236),说明4个PR抗体对NSIBCs组织的着色整体是一致的。此外,4个PR抗体对NSIBCs组织染色(+/-)构成比无明显统计学意义(P>0.05),然而肿瘤细胞平均着色细胞数、平均百分比评分、平均染色强度、平均A-score等4个因素分层比较中1E2各项评分最高,且进一步组间分析显示1E2与其他3个抗体(EP2、SP2、16)比较均有统计学意义(P < 0.05),但后三者之间无统计学意义(P>0.05)。综上,1E2比其他3个抗体(EP2、SP2、16)对NSIBCs组织有更高的敏感性和可靠性。
本试验还发现3个问题:①1E2、EP2、SP2、16等4个抗体均存在少量的ER-/PR+病例,其中EP2、SP2、16分别为2.1%、2.1%和1.5%,1E2达到5.6%(11/195)。ER-/PR+病例组客观存在的。HWANG等[6]对810 587例乳腺癌患者行激素受体免疫组化研究的结果中ER-/PR+型乳腺癌占16.7%(135 441/810 587),且该型患者预后比ER+/PR±组患者差。HUANG等[14]对1 362例乳腺癌HER2状态研究中ER-/PR+病例占5.3%。PR存在多个亚型,但PR抗体常结合PRA和PRB亚型。CALHOUN等[15]认为1E2可结合PRA、PRB、PRC等3个亚型,16仅结合PRA、PRB等2个亚型,这可能是1E2敏感性高的原因之一。本试验11例1E2(ER-/PR+)中,PR染色强度为1%~97%不等,仅1例阳性率为97%,其他均≤35%,11个病例平均染色强度30.1%。1E2(ER-/PR+)病例与其他激素状态组(ER+/PR-、ER+/PR+、ER-/PR-)在临床病理及分子机制方面的差别需收集更多病例进一步分析。②本研究结果显示PR(1E2、EP2、SP2、16)等4个抗体一致性,与CALHOUN等[15]验证4个PR抗体(1E2、1A6、16、636),以及TROXELL等[9]分析的4个PR抗体(1E2, 16, PgR-636, PgR-1294)一致性的结论一致,即PR的多个克隆号抗体一致性好,但1E2对乳腺癌有更高的亲和力, 且使用最广泛。③有1例NSIBC组织显示PR抗体(16、EP2)的IHC结果细胞核及细胞质阳性,该现象并未在其他文献中提及,仅IBRAHIM等[10]报道SP2出现细胞质假阳性和非特异性染色。
最后,虽然国内乳腺病理专家并未对PR抗体进行推荐[16],本试验也提示4个PR抗体(1E2、EP2、SP2、16)IHC表达一致性较好,均可用于乳腺癌临床病理诊断,但兔单克隆抗体1E2比其他3个抗体(EP2、SP2、16)敏感性及染色强度等方面更好、无非特异性染色,具有更好的临床病理使用价值。
| [1] |
Global Burden of Disease Cancer Collaboration. FITZMAURICE C, AKINYEMIJU T F, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2016: A systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2018, 4(11): 1553-1568. DOI: 10.1001/jamaoncol.2018.2706.
|
| [2] |
HWANG K T, KIM J, JUNG J, et al. Impact of breast cancer subtypes on prognosis of women with operable invasive breast cancer: A population-based study using SEER database[J]. Clin Cancer Res, 2019, 25(6): 1970-1979. DOI:10.1158/1078-0432.CCR-18-2782 |
| [3] |
PRAT A, CHEANG M C, MARTÍN M, et al. Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically defined luminal A breast cancer[J]. J Clin Oncol, 2013, 31(2): 203-209. DOI:10.1200/JCO.2012.43.4134 |
| [4] |
PRAT A, PINEDA E, ADAMO B, et al. Clinical implications of the intrinsic molecular subtypes of breast cancer[J]. Breast, 2015, 24(suppl 2): S26-S35. DOI:10.1016/j.breast.2015.07.008 |
| [5] |
BURSTEIN H J, LACCHETTI C, ANDERSON H, et al. Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: ASCO clinical practice guideline focused update[J]. J Clin Oncol, 2019, 37(5): 423-438. DOI:10.1200/JCO.18.01160 |
| [6] |
HWANG K T, KIM J, JUNG J, et al. Long-term prognostic effect of hormone receptor subtype on breast cancer[J]. Breast Cancer Res Treat, 2020, 179(1): 139-151. DOI:10.1007/s10549-019-05456-w |
| [7] |
NORDENSKJÖLD A, FOHLIN H, FORNANDER T, et al. Progesterone receptor positivity is a predictor of long-term benefit from adjuvant tamoxifen treatment of estrogen receptor positive breast cancer[J]. Breast Cancer Res Treat, 2016, 160(2): 313-322. DOI:10.1007/s10549-016-4007-5 |
| [8] |
LUMACHI F, SANTEUFEMIA D A, BASSO S M, et al. Current medical treatment of estrogen receptor-positive breast cancer[J]. World J Biol Chem, 2015, 6(3): 231-239. DOI:10.4331/wjbc.v6.i3.231 |
| [9] |
TROXELL M L, LONG T, HORNICK J L, et al. Comparison of estrogen and progesterone receptor antibody reagents using proficiency testing data[J]. Arch Pathol Lab Med, 2017, 141(10): 1402-1412. DOI:10.5858/arpa.2016-0497-OA |
| [10] |
IBRAHIM M, DODSON A, BARNETT S, et al. Potential for false-positive staining with a rabbit monoclonal antibody to progesterone receptor (SP2): findings of the UK National External Quality Assessment Scheme for Immunocytochemistry and FISH highlight the need for correct validation of antibodies on introduction to the laboratory[J]. Am J Clin Pathol, 2008, 129(3): 398-409. DOI:10.1309/2YXRLEQVPPNRWHGA |
| [11] |
LAKHANI S R, ELLIS I O, SCHNITT S J, et al. WHO Classification of Tumours of the Breast. 4th ed[M]. International Agency for Research on Cancer. Lyon: IARC press, 2012.
|
| [12] |
RHODES A, SARSON J, ASSAM E E, et al. The reliability of rabbit monoclonal antibodies in the immunohistochemical assessment of estrogen receptors, progesterone receptors, and HER2 in human breast carcinomas[J]. Am J Clin Pathol, 2010, 134(2): 621-632. DOI:10.1309/AJCPOG3O3KTPZQNK |
| [13] |
BAE Y K, GONG G, KANG J, et al. Hormone receptor expression in invasive breast cancer among Korean women and comparison of 3 antiestrogen receptor antibodies: a multi-institutional retrospective study using tissue microarrays[J]. Am J Surg Pathol, 2012, 36(12): 1817-1825. DOI:10.1097/PAS.0b013e318267b012 |
| [14] |
HUANG H J, NEVEN P, DRIJKONINGEN M, et al. Association between tumour characteristics and HER-2/neu by immunohistochemistry in 1362 women with primary operable breast cancer[J]. J Clin Pathol, 2005, 58(6): 611-616. DOI:10.1136/jcp.2004.022772。 |
| [15] |
CALHOUN B C, MOSTELLER B, WARREN D, et al. Analytical and clinical performance of progesterone receptor antibodies in breast cancer[J]. Ann Diagn Pathol, 2018, 35: 21-26. DOI:10.1016/j.anndiagpath.2018.02.007 |
| [16] |
水若鸿, 杨文涛. 乳腺癌雌、孕激素受体免疫组织化学检测中的常用抗体[J]. 中华病理学杂志, 2015, 44(4): 229-231. SHUI R H, YANG W T. Frequently used antibodies of estrogen and progesterone receptors in breast cancers by immunohistochemistry[J]. Chin J Pathol, 2015, 44(4): 229-231. DOI:10.3760/cma.j.issn.0529-5807.2015.04.003 |



