2. 401121 重庆,超声医疗国家工程研究中心
2. National Engineering Research Center of UItrasound Medicine, Chongging, 401121, China
外泌体是一种细胞主动分泌的纳米级囊泡,直径为50~200 nm,具有脂质双层膜结构,可以从不同的细胞类型(包括免疫细胞,间充质细胞和癌细胞)中释放,内含完整具功能的mRNA、microRNA、蛋白质等分子[1]。由于肿瘤外泌体可以转运这些分子,因此被认为是致癌信息的细胞间通信介质[2-3]。外泌体是人类生命所必需的,不仅参与维持发育、生长、分化和衰老等关键生理过程,还参与疾病的发展,例如肝脏疾病,神经退行性疾病和癌症[4]。
肿瘤细胞来源的外泌体在肿瘤进程中具有多种生物学功能,肿瘤外泌体不仅可以通过其携带的TGF-β1或CD39促使肿瘤发生免疫逃逸[5-7],还可以促进内皮细胞形成血管[8]。同时越来越多的证据表明,肿瘤来源的外泌体可以通过引发上皮间质转化(EMT)促进肿瘤的侵袭和扩散[9-10]。
成纤维细胞是结缔组织中最丰富的细胞类型,它们通过分泌细胞外基质(ECM)成分形成结构框架[11]。成纤维细胞在肿瘤进展中的作用是多方面的,在肿瘤发展早期阶段,成纤维细胞对肿瘤产生接触抑制作用抑制其发展[12-13],而在后期,它协同肿瘤细胞通过基质重塑、细胞增殖和血管生成与EMT来促进肿瘤发展[14-15]。
肿瘤相关成纤维细胞在肿瘤的局部侵袭和转移中起主要作用,同时黑色素瘤细胞分泌的外泌体能以形成转移灶的方式远距离操纵微环境,从而为肿瘤细胞的远处定植提供“土壤”[16]。由此我们提出科学假设:黑色素瘤细胞分泌的外泌体可能作为重要信息传递使者调控成纤维细胞(mouse embryonic fibroblast,MEF)的功能,促进其侵袭。因此,本研究分离并鉴定黑色素瘤细胞分泌的外泌体,胰酶消化法提取成纤维细胞。采用超速离心分离外泌体,使用透射电镜、Western blot、粒度分析鉴定外泌体标志蛋白以及形态和粒径分布,使用共聚焦观察和流式检测观察外泌体摄取过程,使用Transwell、Western blot、免疫细胞化学、RT-qPCR检测MEF侵袭能力与MMP2、MMP9的基因与蛋白表达,以期为揭示外泌体介导的黑色素瘤微环境调控成纤维细胞功能提供了有力的实验证据。
1 材料与方法 1.1 动物、主要材料与设备C57BL/6小鼠从重庆医科大学实验动物中心购买,饲养至8~10周龄,体质量约25 g,选择位于发情期的雌性小鼠与雄鼠1:1合笼,次日检栓,有阴栓者计为孕1 d。小鼠黑色素瘤B16-F10细胞购自中国科学院上海细胞库;RPMI1640培养基、DMEM培养基购自Hyclone公司;胎牛血清(FBS)购自四季青公司;Tyrp2、TSG101、MMP2、MMP9抗体购自Abcam公司;免疫组化二步法试剂盒、DAB显色试剂盒、羊抗兔二抗购自北京中杉金桥生物技术有限公司;蛋白酶抑制剂混合片购自德国罗氏公司;RIPA裂解液、BCA试剂盒、ECL显影试剂盒购自碧云天生物技术有限公司;TC2323型二氧化碳孵箱购自Shel-Lab公司;CFX96型PCR仪购自BIO-RAD公司;LX70、FSX100、BX51型倒置显微镜购自Olympus公司;粒度仪Zeta SIZER 3000HS购自英国马尔文公司;流式细胞仪BD Influx购自英美国BD公司;激光扫描共聚焦显微镜购自德国Leica公司。
1.2 细胞培养 1.2.1 MEF分离培养取孕期13.5d的孕鼠,处死后取出胚胎并去除头、尾、四肢和内脏,将组织剪碎后37 ℃消化5 min后立即加入等体积完全培养基(DMEM,10%FBS)终止反应,将上清转移至细胞筛过滤,所得过滤液经1 000 r/min离心5 min后弃上清并用完全培养基重悬,37 ℃静置4~8 h后换液去除杂细胞;随后按照常规细胞培养操作进行培养,待细胞汇合度达80%以上进行传代。
1.2.2 B16F10培养B16F10细胞培养于完全培养基(RPMI1640,10%FBS)中,在37℃、5%CO2条件下常规培养至细胞汇合度达80%以上时更换为无血清1640培养基,继续培养48 h后收集培养上清。
1.3 外泌体的分离与鉴定 1.3.1 外泌体的分离使用差速离心和超速离心方法分离外泌体,将收集的B16F10培养上清液以4 ℃、400×g离心5 min,去除沉淀;4 ℃、2 000×g离心10 min;去除沉淀;4 ℃、10 000×g离心30 min,去除沉淀,4 ℃、100 000×g离心70 min,PBS重悬沉淀;4 ℃、100 000×g离心70 min,PBS重悬沉淀即外泌体悬液。用于外泌体的鉴定和处理细胞。
1.3.2 透射电镜鉴定外泌体形态取外泌体悬液10μL,使用1×PBS进行50倍稀释后吸取15 μL滴加至铜网上,室温过夜干燥,醋酸双氧铀复染,随后透射电镜观察并拍照保存
1.3.3 纳米粒子跟踪分析外泌体粒径取外泌体悬液100 μL,使用1×PBS进行10倍稀释,转移至比色皿中,放入粒度仪上样口,测量外泌体粒径分布
1.3.4 Western blot测定外泌体标志物将100 μL外泌体悬液加入含罗氏蛋白酶抑制剂的RIPA裂解液,置于冰上,超声裂解10 min后4 ℃、12 000×g离心10 min,取上清。BCA法测定浓度,上样15 μg总蛋白于10%胶分离蛋白组分。湿转后3%BSA室温封闭1 h,一抗TSG101(1:1 000),TYRP2(1:1 000)于4 ℃孵育过夜。二抗(1:3 000)室温孵育1 h,ECL显影后保存图像。
1.4 外泌体摄取实验 1.4.1 激光共聚焦观察外泌体摄取情况PKH26荧光染料与外泌体悬液以1:250的比例混匀,置于室温中避光静置5 min,加入10 mL含BSA的无菌PBS终止反应,100 000×g,70 min离心后重悬沉淀即为标记外泌体。随后将PKH26标记的外泌体与MEF细胞爬片共培养,在共培养时间达到0~48 h时,于激光共聚焦荧光显微镜下观察MEF细胞摄取外泌体情况。
1.4.2 流式检测外泌体摄取率外泌体染色方法同前,将PKH26染色的外泌体与MEF共培养0~48 h后,胰酶消化为单细胞悬液,流式检测MEF在各时间点对外泌体的摄取阳性率。
1.5 细胞侵袭实验采用Transwell小室,按照每孔50 μL在上室底部滤膜预先铺设1:8稀释的Matrigel胶。MEF细胞消化并重悬后调整悬液浓度,以5×104个/孔接种于Transwell小室的上室,下室600 μL含20%FBS的DMEM培养基,外泌体实验组额外加入20 μL重悬均匀的外泌体悬液,对照组添加等量PBS。培养24 h后取出小室,棉签擦去未穿透的上室细胞,4%多聚甲醛固定20 min,1%结晶紫染色15 min。每张膜随机选取5个视野并计算穿过滤膜的细胞数。
1.6 侵袭相关蛋白MMP2、MMP9表达检测 1.6.1 Western blot法检测收集处理过的细胞,用含罗氏蛋白酶抑制剂的RIPA提取细胞总蛋白,进行SDS-聚丙烯酰胺凝胶电泳(10%),湿转1~2 h,使用3%BSA室温封闭1 h,一抗MMP2(1:1 000),MMP9(1:1 000), 4 ℃孵育过夜,次日TBST漂洗后二抗(1:3 000)室温孵育1 h,ECL孵育后曝光显影并保存图像进行结果分析。
1.6.2 免疫细胞化学染色MEF细胞接种至爬片上,经外泌体处理48 h后,PBS冲洗,4%多聚甲醛室温固定20 min,随后按照二步法免疫组化试剂盒对爬片进行室温封闭20 min,一抗孵育1 h,反应增强20 min,二抗孵育20 min,DAB显色后拍照并封片保存
1.7 qRT-PCR相对定量分析将MEF细胞以1×106/mL接种至6孔板上,细胞分为PBS对照组与exo实验组,外泌体处理48 h后,使用TRIzol法从细胞中提取总RNA,并用分光光度计检测RNA纯度与浓度,按照TaKaRa反转录试剂盒说明书将RNA反转录成cDNA,再使用SYBR Green法以GAPDH为进行实时荧光定量PCR,每个样品均设3复孔,得到的数据采用2-ΔΔC计算细胞中MMP2、MMP9 mRNA的相对表达量。引物序列如下:GAPDH上游5′-CCCAGACAGTGGATGATGC-3′,下游5′-TTGTCCTTCCTCCCAGGTC-3′;MMP2上游5′-CCCAGACAGTGGATGATGC-3′,下游5′-TTGTCCTTCCTCCCAGGTC-3′;MMP9上游5′-CCCAGACAGTGGATGATGC-3′,下游5′-TTGTCCTTCCTCCCAGGTC-3′。
1.8 统计学分析实验数据用GraphPad Prism 5统计软件处理,每次至少观察3个样本,结果以x±s表示。两组均数比较采用t检验,检验水准α=0.05。
2 结果 2.1 MEF形态学观察与B16F10外泌体鉴定显微镜下观察可见,MEF细胞贴壁生长。细胞成梭形、多边形或条带状,胞质丰富,朝外伸出纤维状伪足,随着细胞的增殖逐渐连接成片。
B16F10来源的外泌体采用超速离心法提取,透射电子显微镜下可以清晰地观察到B16F10来源外泌体呈现其典型的形貌特征,具有脂质双层分子膜包绕形成的球体结构,外部为双层脂质分子膜的深染区,内部为不均质浅染区,可见部分为蛋白质密度物质(图 1A)。Western blot检测到其标志蛋白TSG101和TYRP2均为阳性(图 1B)。粒度分析检测发现100 000×g离心提取的外泌体粒径主要分布在50~200 nm,见图 1C。
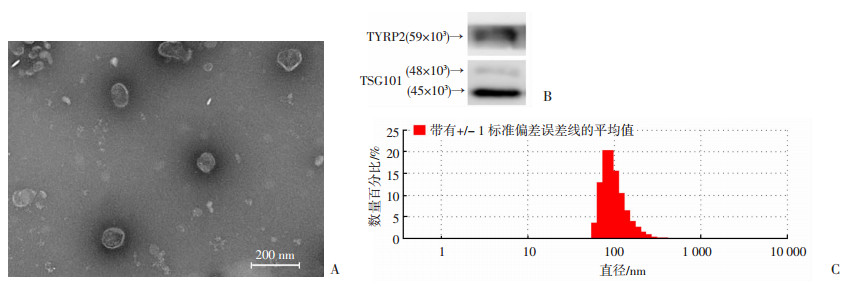
|
| A:透射电镜观察B16F10细胞的外泌体;B:Western blot检测B16F10细胞来源的外泌体表达TSG101和TYRP2;C:B16F10细胞来源外泌体的粒径大小分布 图 1 外泌体的特征鉴定 |
2.2 MEF细胞摄取外泌体
为观察B16F10外泌体能否进入MEF细胞以便发挥其功能,将PKH26预染色的外泌体与MEF爬片共培养,处理0、12、24、48h后共聚焦显微镜下观察并拍摄。荧光标记的外泌体与MEF细胞共培12h后,外泌体已经能被MEF细胞成功摄取至胞质中,24 h后开始在细胞核周围聚集,48 h时细胞核周围可见明显红色荧光(图 2A)。流式检测结果也显示随着时间增加MEF中的外泌体阳性率逐渐增加,与共聚焦结果一致(图 2B)。
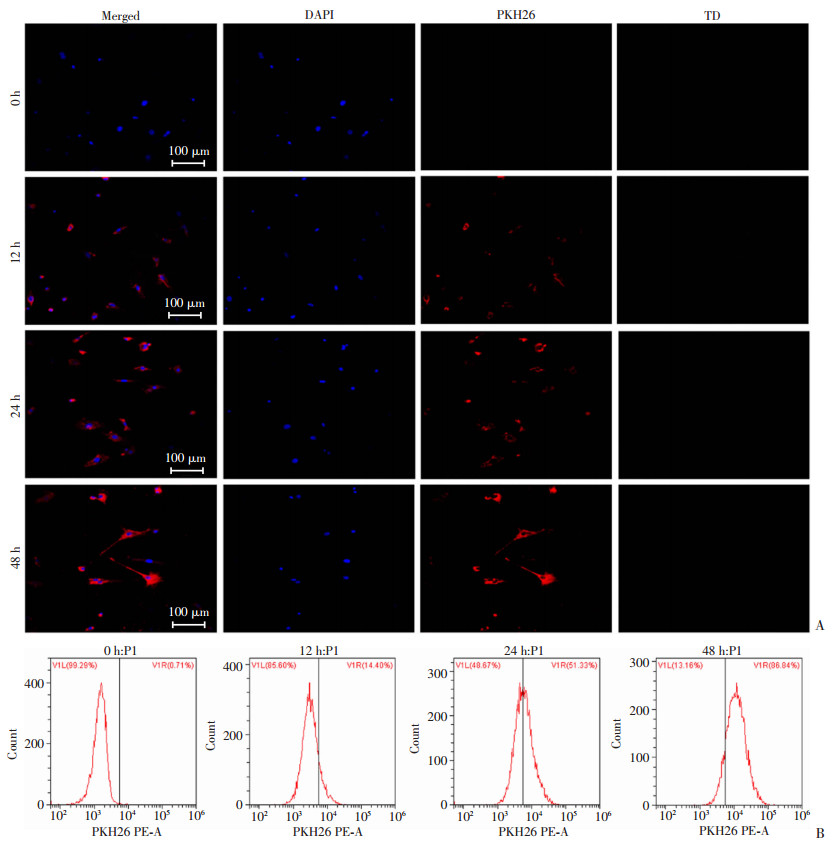
|
| A:共聚焦观察外泌体处理0、12、24、48 h后MEF对其摄取情况; TD为共聚焦显微镜下拍下的非激发光图片, 即无荧光细胞图片; B:流式检测外泌体处理0、12、24、48 h后MEF细胞摄取阳性率 图 2 MEF细胞摄取荧光标记的外泌体 |
2.3 B16F10外泌体促进MEF细胞侵袭
Transwell观察使用B16F10外泌体处理MEF细胞48 h后各组穿膜细胞数。外泌体组的侵袭细胞数为(104.7±3.8),显著多于MEF+PBS对照组[(69.4±1.3),P < 0.01],提示B16F10外泌体能显著促进MEF细胞侵袭(图 3)。
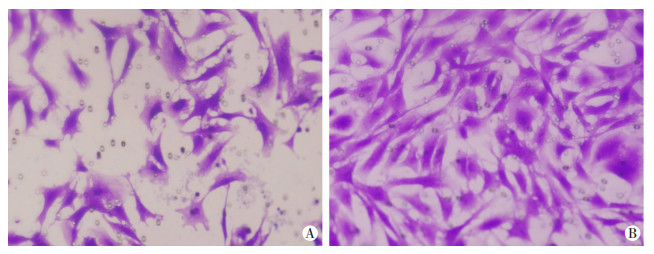
|
| A:对照组,B:外泌体组 图 3 结晶紫染色检测外泌体处理前后MEF侵袭能力(×200 |
2.4 B16F10外泌体促进MEF表达MMP2、MMP9 2.4.1 B16F10外泌体促进MEF中MMP2、MMP9蛋白表达
Western blot检测结果显示,经0.31、0.62、1.25、2.50、5.00 μg/mL浓度外泌体处理MEF细胞48 h后,在相对较低外泌体浓度条件下(0.31、0.62 μg/mL),MMP2表达量显著增加,随后表达逐渐下调。而MMP9表达量则随着外泌体浓度增加而逐渐上调直到外泌体浓度达到2.50 μg/mL,随后表达降低(图 4)。0.62 μg/mL外泌体处理MEF细胞0、12、24、36、48 h的结果显示,外泌体处理48 h后MEF细胞对MMP2和MMP9的表达量出现显著差异(图 4)。结果提示,外泌体在一定范围内能显著促进MEF表达MMP2、MMP9蛋白,此结果也得到了免疫细胞化学的方法验证(图 5)。
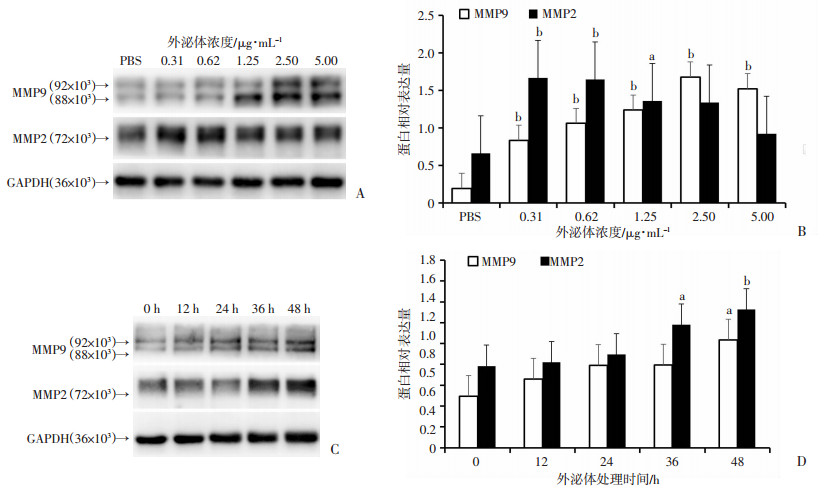
|
|
a:P < 0.05,b:P < 0.01,与PBS组比较 A、B:不同浓度黑色素瘤外泌体处理后MMP2、MMP9蛋白的表达及半定量分析;C、D黑色素瘤外泌体处理不同时间后MMP2、MMP9蛋白的表达及半定量分析 图 4 黑色素瘤外泌体对MEF表达MMP2、MMP9的影响 |
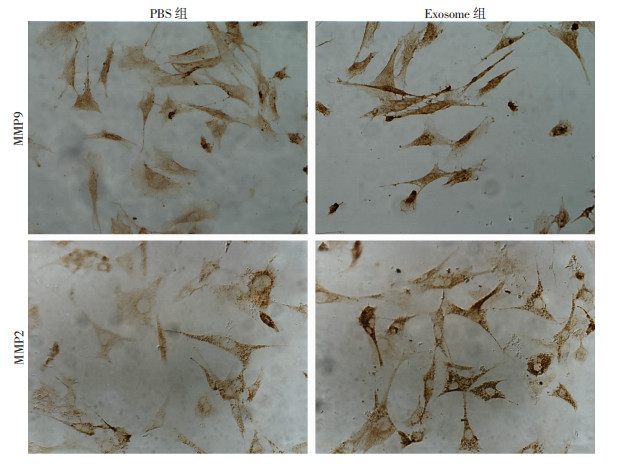
|
| 图 5 免疫细胞化学检测黑色素瘤外泌体处理后MEF细胞中MMP2、MMP9表达量变化(×200) |
2.4.2 B16F10外泌体促进MEF中MMP2、MMP9基因的表达
qRT-PCR检测结果显示,0.62 μg/mL外泌体作用于MEF细胞48 h后,MMP9的mRNA表达量为对照组的(1.44±0.14)倍(P < 0.05),MMP2的mRNA表达量为对照组的(1.32±0.10)倍(P < 0.05)。
3 讨论肿瘤的转移是一个复杂的过程,其主要过程为肿瘤细胞发生上皮间质转化,突破基底膜屏障并向邻近组织迁移,侵入血管和淋巴管系统,或通过影响间质细胞来构造适宜肿瘤转移的微环境从而促进继发性肿瘤的产生[17]。越来越多的研究证明,肿瘤来源的外泌体可以通过促进成纤维细胞和间质细胞向肌成纤维细胞分化、促进血管生成或通过在新的位置形成转移灶等方式来参与肿瘤的转移进程[18]。
本研究通过共聚焦与流式检测发现MEF对黑色素瘤细胞外泌体的摄取呈时间依赖性,同时Transwell实验说明成纤维细胞对外泌体的摄取显著促进了其在体外的侵袭能力。癌症的进展早已不再被认为是独立事件,癌组织周围基质细胞所分泌的多种因子与肿瘤细胞间相互的作用在肿瘤的发生和转移中起着重要作用[19]。MEF可以为肿瘤提供独特的微环境来促进肿瘤的生长与侵袭[20],已有报道MEF不仅可以通过降解ECM和基底膜为后续肿瘤生长提供空间,还可以重塑ECM,从而为癌细胞创造转移路径,进而促进癌细胞的转移[21-22],细胞体外侵袭能力的改变与其MMPs的表达直接相关[23-24],MMPs的表达和活性在肿瘤中及其周围均升高,并与肿瘤的恶性程度相关。肿瘤细胞的侵袭和转移取决于基底膜和ECM的降解,MMP2、MMP9被认为是主要的ECM降解蛋白酶[25]。成纤维细胞表达的MMP2、MMP9可以促进乳腺癌、肺腺癌的侵袭[26-27],且肿瘤相关的成纤维细胞可以通过MMP来实现基质重塑[28]。本课题通过Western blot与免疫细胞化学检测发现肿瘤外泌体处理后的MEF细胞中MMP2、MMP9的蛋白表达显著增加,说明MEF细胞穿透基质胶的能力增强是由于外泌体促进其MMP2、MMP9的表达,从而导致穿透基质胶的细胞量显著增加。qRT-PCR结果也从基因层面验证了MEF中MMP2、MMP9表达能力的变化。因此,我们推测黑色素瘤外泌体通过促进MEF细胞MMP2、MMP9表达从而导致其侵袭能力增强。
综上所述,本研究在体外水平独立分析了黑色素瘤外泌体在成纤维细胞侵袭过程中的重要作用,验证了存在黑色素瘤细胞向正常细胞传递侵袭性的外泌体通讯方式[29-31],黑色素瘤细胞外泌体与MEF的侵袭进展密切相关。证实了黑色素瘤外泌体对MEF具有促侵袭和MMP2、MMP9表达的效应,为寻求控制肿瘤侵袭转移的方法提供一定的研究基础。
| [1] |
JAVEED N, MUKHOPADHYAY D. Exosomes and their role in the micro-/macro-environment: a comprehensive review[J]. J Biomed Res, 2017, 31(5): 386-394. DOI:10.7555/JBR.30.20150162 |
| [2] |
KOSAKA N, YOSHIOKA Y, TOMINAGA N, et al. Dark side of the exosome: the role of the exosome in cancer metastasis and targeting the exosome as a strategy for cancer therapy[J]. Future Oncol, 2014, 10(4): 671-681. DOI:10.2217/fon.13.222 |
| [3] |
COLOMBO M, RAPOSO G, THÉRY C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol, 2014, 30: 255-289. DOI:10.1146/annurev-cellbio-101512-122326 |
| [4] |
MILANE L, SINGH A, MATTHEOLABAKIS G, et al. Exosome mediated communication within the tumor microenvironment[J]. J Control Release, 2015, 219: 278-294. DOI:10.1016/j.jconrel.2015.06.029 |
| [5] |
SUN Y, LIU J. Potential of cancer cell-derived exosomes in clinical application: a review of recent research advances[J]. Clin Ther, 2014, 36(6): 863-872. DOI:10.1016/j.clinthera.2014.04.018 |
| [6] |
CLAYTON A, AL-TAEI S, WEBBER J, et al. Cancer exosomes express CD39 and CD73, which suppress T cells through adenosine production[J]. J Immunol, 2011, 187(2): 676-683. DOI:10.4049/jimmunol.1003884 |
| [7] |
SYN N, WANG L Z, SETHI G, et al. Exosome-mediated metastasis: from epithelial-mesenchymal transition to escape from immunosurveillance[J]. Trends Pharmacol Sci, 2016, 37(7): 606-617. DOI:10.1016/j.tips.2016.04.006 |
| [8] |
KUCHARZEWSKA P, CHRISTIANSON H C, WELCH J E, et al. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development[J]. Proc Natl Acad Sci USA, 2013, 110(18): 7312-7317. DOI:10.1073/pnas.1220998110 |
| [9] |
WHITESIDE T L. The role of tumor-derived exosomes in epithelial mesenchymal transition (EMT)[J]. Transl Cancer Res, 2017, 6(Suppl 1): S90-S92. DOI:10.21037/tcr.2017.02.13 |
| [10] |
全景羽, 卢子滨, 余林中. 外泌体对上皮-间质转化调控作用的研究进展[J]. 南方医科大学学报, 2019, 39(3): 127-130. QUANJ Y, LU Z B, YU L Z, et al. Research progress of exosomes in epithelial-mesenchymal transition[J]. J Southern Med Univ, 2019, 39(3): 377-380. DOI:10.12122/j.issn.1673-4254.2019.03.19 |
| [11] |
KALLURI R. The biology and function of fibroblasts in cancer[J]. Nat Rev Cancer, 2016, 16(9): 582-598. DOI:10.1038/nrc.2016.73 |
| [12] |
HINZ B, PHAN S H, THANNICKAL V J, et al. The myofibroblast: one function, multiple origins[J]. Am J Pathol, 2007, 170(6): 1807-1816. DOI:10.2353/ajpath.2007.070112 |
| [13] |
MCANULTY R J. Fibroblasts and myofibroblasts: their source, function and role in disease[J]. Int J Biochem Cell Biol, 2007, 39(4): 666-671. DOI:10.1016/j.biocel.2006.11.005 |
| [14] |
GIENIEC K A, BUTLER L M, WORTHLEY D L, et al. Cancer-associated fibroblasts-heroes or villains?[J]. Br J Cancer, 2019, 121(4): 293-302. DOI:10.1038/s41416-019-0509-3 |
| [15] |
LEBLEU V S, KALLURI R. A peek into cancer-associated fibroblasts: origins, functions and translational impact[J]. Dis Model Mech, 2018, 11(4). DOI:10.1242/dmm.029447 |
| [16] |
HOOD J L, SAN R S, WICKLINE S A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis[J]. Cancer Res, 2011, 71(11): 3792-3801. DOI:10.1158/0008-5472.CAN-10-4455 |
| [17] |
HEERBOTH S, HOUSMAN G, LEARY M, et al. EMT and tumor metastasis[J]. Clin Trans Med, 2015, 4(1): 6. DOI:10.1186/s40169-015-0048-3 |
| [18] |
RAMTEKE A, TING H, AGARWAL C, et al. Exosomes secreted under hypoxia enhance invasiveness and stemness of prostate cancer cells by targeting adherens junction molecules[J]. Mol Carcinog, 2015, 54(7): 554-565. DOI:10.1002/mc.22124 |
| [19] |
XING F, SAIDOU J, WATABE K. Cancer associated fibroblasts (CAFs) in tumor microenvironment[J]. Front Biosci (Landmark Ed), 2010, 15: 166-179. DOI:10.2741/3613 |
| [20] |
TAO L L, HUANG G C, SONG H Z, et al. Cancer associated fibroblasts: an essential role in the tumor microenvironment[J]. Oncol Lett, 2017, 14(3): 2611-2620. DOI:10.3892/ol.2017.6497 |
| [21] |
GASCARD P, TLSTY T D. Carcinoma-associated fibroblasts: orchestrating the composition of malignancy[J]. Genes Dev, 2016, 30(9): 1002-1019. DOI:10.1101/gad.279737.116 |
| [22] |
GAGGIOLI C, HOOPER S, HIDALGO-CARCEDO C, et al. Fibroblast-led collective invasion of carcinoma cells with differing roles for RhoGTPases in leading and following cells[J]. Nat Cell Biol, 2007, 9(12): 1392-1400. DOI:10.1038/ncb1658 |
| [23] |
BROWN G T, MURRAY G I. Current mechanistic insights into the roles of matrix metalloproteinases in tumour invasion and metastasis[J]. J Pathol, 2015, 237(3): 273-281. DOI:10.1002/path.4586 |
| [24] |
沙永强, 吕永钢. 力生长因子E肽对前交叉韧带成纤维细胞活力、迁移与侵袭的影响[J]. 医用生物力学, 2016, 31(3): 227-234. SHA Y Q, LYU Y G. Effects of MGF E peptide on cell viability, migration and invasion of ACL fibroblasts[J]. J Med Biomech, 2016, 31(3): 227-234. DOI:10.3871/j.1004-7220.2016.03.227 |
| [25] |
CONLON G A, MURRAY G I. Recent advances in understanding the roles of matrix metalloproteinases in tumour invasion and metastasis[J]. J Pathol, 2019, 247(5): 629-640. DOI:10.1002/path.5225 |
| [26] |
AYE M M, MA C L, LIN H, et al. Ethanol-induced in vitro invasion of breast cancer cells: the contribution of MMP-2 by fibroblasts[J]. Int J Cancer, 2004, 112(5): 738-746. DOI:10.1002/ijc.20497 |
| [27] |
IIJIMA T, MINAMI Y, NAKAMURA N, et al. MMP-2 activation and stepwise progression of pulmonary adenocarcinoma: analysis of MMP-2 and MMP-9 with gelatin zymography[J]. Pathol Int, 2004, 54(5): 295-301. DOI:10.1111/j.1440-1827.2004.01623.x |
| [28] |
ERDOGAN B, WEBB D J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis[J]. Biochem Soc Trans, 2017, 45(1): 229-236. DOI:10.1042/bst20160387 |
| [29] |
XIAO D Y, BARRY S, KMETZ D, et al. Melanoma cell-derived exosomes promote epithelial-mesenchymal transition in primary melanocytes through paracrine/autocrine signaling in the tumor microenvironment[J]. Cancer Lett, 2016, 376(2): 318-327. DOI:10.1016/j.canlet.2016.03.050 |
| [30] |
HU T R, HU J C. Melanoma-derived exosomes induce reprogramming fibroblasts into cancer-associated fibroblasts via Gm26809 delivery[J]. Cell Cycle, 2019, 18(22): 3085-3094. DOI:10.1080/15384101.2019.1669380 |
| [31] |
GYUKITY-SEBESTYÉN E, HARMATI M, DOBRA G, et al. Melanoma-derived exosomes induce PD-1 overexpression and tumor progressionvia mesenchymal stem cell oncogenic reprogramming[J]. Front Immunol, 2019, 10: 2459. DOI:10.3389/fimmu.2019.02459 |



