2. 400016 重庆,重庆医科大学超声影像学研究所,超声分子影像重庆市重点实验室
2. Chongqing Key Laboratory of Ultrasound Molecular Imaging, Institute of Ultrasound Imaging, Chongqing Medical University, Chongqing, 400016, China
乳腺癌已成为全世界女性健康问题中的亟待解决的重要威胁[1]。在过去的几十年中,治疗方法有所扩展,但传统手术依然起着主导作用,辅以放射疗法,化学疗法,内分泌治疗,免疫治疗[2]。然而传统手术对治疗后生活质量的影响已经引起广泛重视[3]。“精准医学”概念近年来反复被提及,它强调“可视化”,“诊疗一体化”和“低剂量和低毒副作用”。分子影像的崛起为精准医学提供了一种可能[4],多种影像学技术相结合旨在找到可以早期诊断和精准治疗的良方。酞菁铁(FePc)在材料化学领域多用于光催化剂[5],具有与卟啉相似的结构,但其相较血卟啉衍生物有更宽的可见光吸收谱带(600~800 nm)[6],这个光吸收谱带落在光声成像仪的激光使用范围(680~970 nm),可用于光声成像。液态氟碳中的全氟戊烷(PFP)支持通过液-气相变进行超声成像,沸点相对较低(29 ℃)[7-8]。光声成像技术作为医学领域的新型技术,联合光学成像和声学成像,前者利用不同生物介质专属的光谱特性来显示生物组织分布情况,后者利用声波折射、反射等物理特性对显像病变组织[9-10]。
近年来的崛起的新型核苷酸配体分子,其相对比分子量巨大的抗体蛋白等,不仅分子量小且低免疫原性,而且具备较强的特异性和较高的亲和力,因此适配体被大量用于实验作为载体工具靶向到肿瘤,用做成像和治疗的研究。AS1411是G4序列核酸适配子(含有26个碱基),对在持续增值的肿瘤细胞中高度表达的核仁蛋白具备高特异性的识别能力[11-12]。
本实验以乳腺癌为模型,利用FDA认证的PLGA纳米材料搭载光敏剂酞菁铁,内核包裹可液-气相变的全氟戊烷(PFP),外接AS1411作为靶向探针。旨在初步探究该纳米粒光声/超声造影多模态成像效果,以及酞菁铁的光热转化和光致相变能力,为进一步开发靶向分子探针提供新的可能性。
1 材料与方法 1.1 主要试剂和仪器主要试剂:羧基端乳酸-羟基乙酸共聚物(PLGA-COOH,济南岱罡);酞菁铁(FePc,TCI公司);AS1411-NH2/标记FAM的AS1411 (委托上海生工合成);全氟戊烷(PFP,Strem Chemicals公司);三氯甲烷(成都市科龙化工);异丙醇(重庆东川化工);琼脂糖(Life Technologies);聚乙烯醇PVA、EDC、NHS、MES (Sigma公司);CCK-8试剂(MCE公司);Dil(碧云天生物公司);TE缓冲液、DAPI(博士德生物公司);人乳腺癌MCF-7细胞(重庆医科大学超声影像学研究所);RPMll640培养基(Gibco公司)。
主要仪器:Sonic声振仪(Sonic),光学显微镜(Olympus IX71),透射电镜(HITACHI),粒径测量仪(Malvern公司),流式细胞仪(Beckmancoulter公司),激光共聚焦显微镜(Nikon公司),多功能酶标仪(Thermo Fisher公司),近红外激光仪(Stone-laser公司,660 nm),热成像仪(Fotric公司),小动物光声成像仪(Vevo@LAZR 2100)。
1.2 实验方法 1.2.1 AS1411-PLGA@FePc@PFP的制备及理化特性超声双步乳化法制备纳米粒,将50 mg PLGA和8 mg FePc充分混合,溶解于2 mL三氯甲烷,再加入200 μL的PFP溶液,用声震仪(2.5 min,100 W)乳化后得到蓝色乳浊液;向其中加入10 mL 4% PVA溶液,再次声震仪乳化(4 min,100 W), 加入10 mL 2%的异丙醇;将混合乳液经过磁力搅拌达6 h挥发三氯甲烷。以上所有步骤均避光和冰浴。随后采用双蒸水反复洗涤,经低温离心获取非靶向纳米粒PLGA@FePc@PFP。采用碳二亚胺法连接适配体AS1411与PLGA@FePc@PFP,具体步骤如下:取一定量PLGA@FePc@PFP(5.0 mg/mL),加入适量MES缓冲液(0.1 mol/L,pH=5.0),再加入适量NHS和EDC,4 ℃下振荡孵育3 h,低温离心洗涤去除多余的NHS/EDC。加入适量MES缓冲液(0.1 mol/L,pH=8.0),然后加入3 OD适配体AS1411(1 OD≈33.3 μg),适配体已提前溶解于TE缓冲液(pH=8.0)中。在4 ℃下孵育3 h,低温离心洗涤,获得靶向纳米粒AS1411-PLGA@FePc@PFP。使用透射电镜、马尔文粒径仪、紫外分光光度计等设备检测各个性质。绘制FePc的标准曲线,然后通过公式计算包封率:FePc包封率=M1/M2×100%;M1表示包载于PLGA纳米粒中的FePc含量,M2表示FePc的投入总量。
1.2.2 非靶向纳米粒与AS1411连接检测用DiI染色纳米粒,适配体AS1411的3'端用FAM标记。利用激光共聚焦显微镜观察PLGA@FePc@PFP与AS1411的连接情况,流式细胞仪检测上述二者连接率。
1.2.3 细胞培养及细胞毒性实验在5% CO2、37 ℃培养箱中用RMPI1640培养基培养MCF-7细胞。实验均采用对数期生长细胞。待细胞状态良好,将MCF-7细胞铺入96孔板放回敷箱继续孵育。随后将AS1411-PLGA@FePc@PFP稀释成不同浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)后加入96孔板,并设置复孔。不同浓度AS1411-PLGA@FePc@PFP和细胞共同孵育24 h取出,加入CCK-8试剂1 h后,用多功能酶标仪检测并计算出细胞存活率。
1.2.4 体外靶向实验将处于对数期的MCF-7细胞接种于共聚焦培养皿中培养、贴壁。实验分为2组:非靶向组(DiI-PLGA@FePc@PFP)和靶向组(DiI-AS1411-PLGA@FePc@PFP)。以上纳米粒均在制备时候伴随PLGA-COOH添加了DiI染料,并灭菌。在两组中分别加入适量靶向/非靶向纳米粒后放回细胞培养箱继续培养2 h,多次洗涤细胞以清除未靶向到细胞的纳米粒,随后用多聚甲醛固定细胞,用DAPI为细胞核染色。于激光共聚焦显微镜下观察两组细胞周围的靶向情况。
1.2.5 体外光热效应及光致相变将浓度为5.0 mg/mL的AS1411-PLGA@PFP纳米粒和浓度为1.0 mg/mL,2.5 mg/mL和5.0 mg/mL的AS1411-PLGA@FePc@PFP分别加入4组96孔板中,运用660 nm激光辐照300 s,用热成像仪监测纳米粒悬液的随时间和浓度增加的温度变化。辐照前后分别于光镜下观察两种纳米粒(AS1411-PLGA@FePc@PFP和AS1411-PLGA@PFP均为5.0 mg/mL)的相变情况。
1.2.6 体外光声成像浓度分别为(0.5、1.0、2.5、5.0 mg/mL)的AS1411-PLGA@FePc@PFP纳米粒和浓度为5.0 mg/mL的AS1411-PLGA @PFP纳米粒悬液,依次被加入琼脂凝胶模型,选取适当位置,光声成像系统选用波长为680 nm(基于FePc的吸收波峰在仪器中的全波长扫描后得到的激发波长)来激发和扫描成像。用系统内置软件测量出光声信号强度,绘制相关曲线。
1.2.7 体外超声/造影成像同上,浓度为(0.5、1.0、2.5、5.0 mg/mL)的AS1411-PLGA@FePc@PFP纳米粒和浓度为5.0 mg/mL的AS1411-PLGA @PFP纳米粒悬液,被激光分别辐照后转入3%凝胶模型中,利用超声模式观察其增强显像的效果,然后用重庆医科大学超声影像学研究所自主发明的超声图像灰度值分析软件(DFY软件)测量纳米粒信号灰度值,绘制相关曲线。
1.2.8 动物模型的建立和分组选取4~6周龄的雌性BALB/c裸鼠(质量为16~20 g)18只,将人乳腺癌细MCF-7单细胞悬液(1×106/mL)注射于裸鼠脊柱旁右大腿内侧皮下(0.1 mL/只)建立荷瘤模型,待体积长至约150 mm3后随机分组用于光声成像,超声成像和体内升温实验。
1.2.9 体内光声成像将6只荷瘤鼠分为2组(n=3),经尾静脉注射200 μL 5.0 mg/mL的AS1411-PLGA@FePc@PFP或PLGA@FePc@PFP,使用光声成像仪采集注射前、注射后6 h的光声图像,定量分析光声信号强度。
1.2.10 体内超声/造影成像将6只荷瘤鼠随机分为2组(n=3),每组经尾静脉注射200 μL 5.0 mg/mL的AS1411-PLGA@FePc@PFP或PLGA@FePc@PFP,于注射后6 h使用660 nm激光辐照肿瘤部位10 min,用光声成像仪的超声模式采集辐照前、辐照后的超声/造影图像,并利用DFY灰度软件定量分析信号强度。
1.2.11 体内光热效应将6只荷瘤鼠随机分为2组(n=3),每组经尾静脉注射200 μL的5.0 mg/mL的AS1411-PLGA@FePc@PFP或PLGA@FePc@PFP,于注射后6 h使用660 nm激光辐照肿瘤部位,用热成像仪的采集辐照前和辐照10 min时的热成像图。
1.3 统计方法采用SPSS 22.0软件进行统计学分析,计量资料以x±s表示,两变量之间则采用线性相关分析,多样本均数的比较采用的单因素方差分析,两组间的进一步比较采用LSD-t检验,检验水准:α=0.05。
2 结果 2.1 AS1411-PLGA@FePc@PFP的基本理化性质成功制备出AS1411-PLGA@FePc@PFP,结构示意图见1A,透射电镜可见该纳米粒的粒径均匀,并且与粒径测量结果基本一致(图 1B)。纳米粒粒径为(208.03±8.96) nm(图 1C),分散性良好(PdI:0.111),电位为(-10.8±1.14) mV(图 1D),紫外吸收光谱可见AS1411-PLGA@FePc@PFP在635 nm处出现最大吸收峰,吸收光谱可见AS1411-PLGA@FePc@PFP与游离FePc的吸收峰相近,并且AS1411-PLGA@ PFP位于600~700 nm间则没有明显吸收波峰(图 1E)。通过紫外分光光度计绘制FePc的标准吸收曲线回归方程为:Y=1.910×X+0.089 07,R2=0.997 6。由此计算出FePc的包封率为(83.96±1.61)%。综合以上结果表明FePc和PFP已成功地被包载于PLGA上,并且FePc具备较高包载率。

|
| A:靶向纳米粒AS1411-PLGA@FePc@PFP的组成结构示意图; B:透射电子显微镜下的AS1411-PLGA@FePc@PFP;C:靶向纳米粒粒径分布;D:靶向纳米粒电位分布;E:不同纳米粒/材料的紫外吸收光谱分析 图 1 靶向纳米粒AS1411-PLGA@FePc@PFP基本理化性质结果 |
2.2 非靶向纳米粒与AS1411连接率
激光共聚焦显微镜显示,Dil染色的纳米粒为红色荧光(图 2A),绿色荧光是FAM标记的AS1411(图 2B),两者在融合通道内的显示黄色荧光(图 2C),表明AS1411已与PLGA@FePc@PFP成功连接。流式细胞仪反馈连接率为(93.31±2.58)% (图 2D),证明该靶向纳米粒连接率尚好。
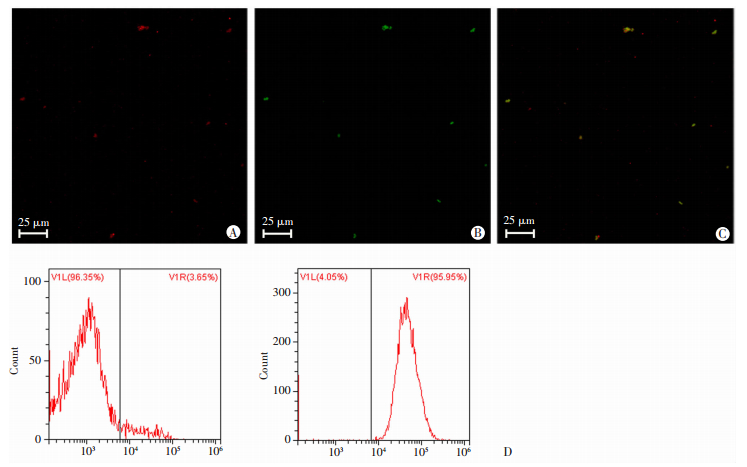
|
| A: Dil染色的纳米粒; B:FAM标记的AS1411;C:二者融合通道;D:流式仪测试非靶向组(左)和靶向组(右)的纳米粒的荧光比例 图 2 激光共聚焦显微镜和流式细胞仪观察非靶向纳米粒PLGA@FePc@PFP与适配体AS1411的连接情况 |
2.3 细胞毒性实验
MCF-7细胞在被加入不同浓度的AS1411-PLGA@FePc@PFP (0.2、0.4、0.6、0.8、1.0 mg/mL)后继续孵育24 h,利用CCK-8检测MCF-7细胞的存活率分别为(95.73±1.06)%、(96.13±2.07)%、(94.93±3.72)%、(94.73±2.28)%、(95.76±1.85)%,各组间差异无统计学意义,说明AS1411-PLGA@FePc@PFP没有明显的细胞毒性,可用于进一步的实验。
2.4 体外靶向实验激光共聚焦显微镜观察(图 3),在靶向组的细胞核周围和细胞膜内出现大量DiI标记的红色纳米粒,而在非靶向组中,仅可见少量纳米粒随机存在。这表明该靶向纳米粒的体外寻靶效果明显。由于AS1411作用于核仁蛋白,而该蛋白广泛存在于细胞核,部分存在于胞质和胞膜。故本实验中纳米粒也存在相近区域分布。

|
| 激光共聚焦显微镜下观察,红色荧光为Dil标记的纳米粒,蓝色荧光为DAPI染色的细胞核,Merged为融合图像 图 3 激光共聚焦显微镜评价非靶向纳米粒PLGA@FePc@PFP/靶向纳米粒AS1411-PLGA@FePc@PFP与MCF-7细胞结合情况 |
2.5 体外光热效应和光致相变
经过660 nm激光辐照,并随着辐照时间的增加,AS1411-PLGA@FePc@PFP纳米粒悬液温度随着辐照时间增加而逐渐升高,而对照组AS1411-PLGA@PFP纳米粒悬液的温度没有明显的变化;并且不同浓度的AS1411-PLGA@FePc@PFP经过激光辐照后,呈现不同程度的温度增加(图 4B),从热成像仪拍摄的图片同样可以看出趋势(图 4A)。此外,光镜下可以观察到AS1411-PLGA@FePc@PFP纳米粒辐照后发生了液-气相变,而AS1411-PLGA @PFP纳米粒无明显相变(图 4C)。这是因为FePc具有较强的光热转化能力,在近红外波长段强烈地吸收光能后转化为热能,使悬液升温,进而促使PLGA核心的PFP发生液-气相变。以上结果说明该纳米粒具有良好的光热效应。

|
| A: 4组纳米粒经激光辐照后的近红外相机拍摄的升温图;B:4组纳米粒经激光辐照后的近红外升温温度曲线图; C:激光辐照前后2种纳米粒的光镜下相变结果 图 4 纳米粒AS1411-PLGA@FePc@PFP与AS1411-PLGA@PFP经激光辐照后体外光热效应和光致相变结果 |
2.6 体外光声成像
在680 nm波长激发下,随着AS1411-PLGA@FePc@PFP浓度增加,光声信号(PA)强度逐渐增强(图 5A),表明该纳米粒具备良好的光声成像能力,并且随着浓度增强呈线性相关(图 5B)。对照组AS1411-PLGA @PFP由于不带有光敏剂FePc,而未见明显光声信号。说明搭载FePc的AS1411-PLGA@FePc@PFP是一个效果明确的光声造影剂。
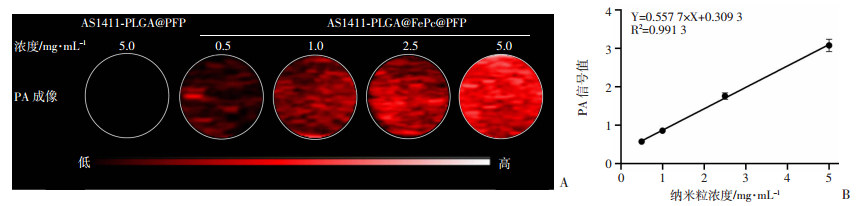
|
| A:不同浓度纳米粒体外光声成像;B:不同浓度纳米粒体外光声成像定量分析相关性 图 5 纳米粒AS1411-PLGA@FePc@PFP与AS1411-PLGA@PFP体外光声成像及定量分析 |
2.7 体外超声/造影成像
如图 6所示,激光辐照后不同浓度的AS1411-PLGA@FePc@PFP呈现出明显的图像信号。而对照组AS1411-PLGA@PFP被激光辐照后的超声(B-mode)/造影(CEUS)图像仅能看见很少的信号(图 6A)。由于前期的光热效应实验表明AS1411-PLGA@FePc@PFP纳米粒具备良好的光热能力,激光辐照导致内核液态氟碳发生液-气相变,进一步增强了超声/造影的信号。而对照组纳米粒中不含有光敏剂FePc,不能实现光热转化后的升温,所以没有观察到经过激光辐照后的AS1411-PLGA@PFP纳米粒存在增强超声信号。DFY组织灰度定征软件可以测出信号平均灰度值(图 6B、C):提示在同样的激光辐照下,随着纳米粒浓度的增高,超声/造影的信号越强,呈现出正相关。结果不仅说明FePc的光热能力和PFP的液-气相变能够增强超声显像,表明该纳米粒同时还是一个良好的超声显像剂。
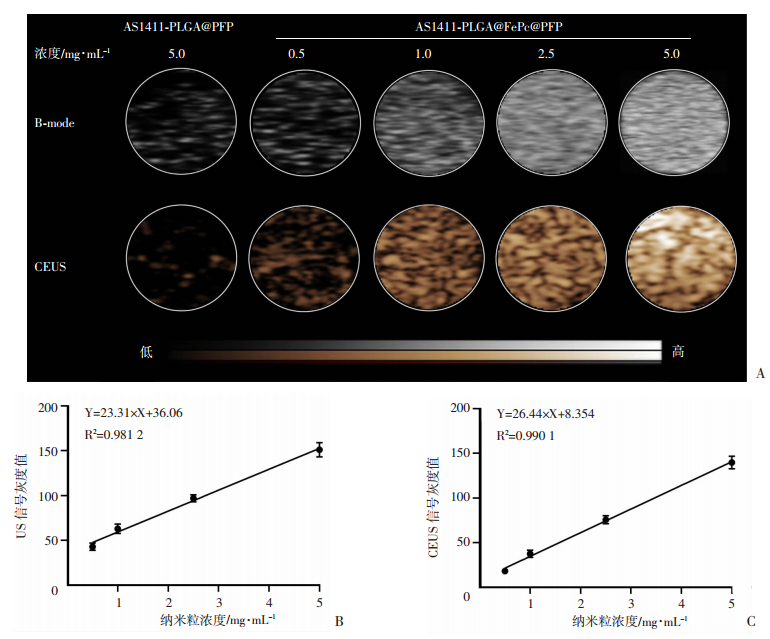
|
| A:不同浓度纳米粒体外超声/造影成像;B、C:体外超声/造影成像定量分析相关性 图 6 纳米粒AS1411-PLGA@FePc@PFP与AS1411-PLGA@PFP体外超声/造影增强成像及定量分析 |
2.8 体内光声成像
如图 7A所示,尾静脉注射纳米粒前,两组荷瘤鼠肿瘤部位均无明显光声信号,于注射后6 h探测到靶向组瘤内可见光声信号,注射前、后光声值分别为(0.26±0.02)和(1.26±0.06),差异具有统计学意义(P < 0.05)。与此同时,非靶向组瘤内在PLGA@FePc@PFP注射后6 h未见明显光声信号,其注射前、后光声值为(0.25±0.01)和(0.30±0.01),差异不具有统计学意义(P>0.05)。体内光声成像的两组结果提示:靶向组与非靶向组注射后6 h瘤内光声信号值差异具有统计学意义(P < 0.05,图 7B)。证明在相同条件下,靶向纳米粒在体内肿瘤部位具有更好的富集效果,且荷瘤鼠体内的光声信号说明负载FePc的纳米粒在体内也可有良好光声成像能力。
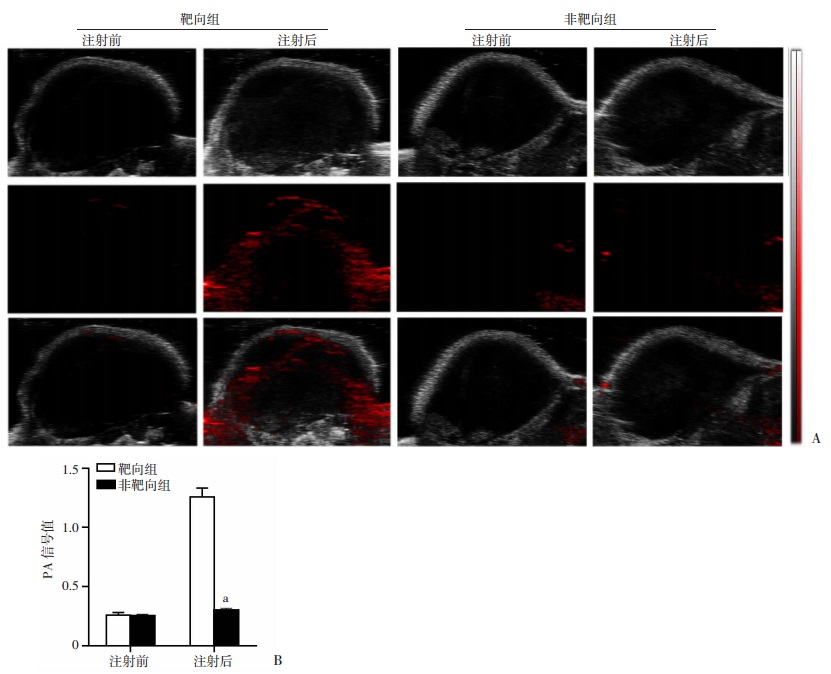
|
| a:P < 0.05, 与靶向组比较 图 7 靶向组与非靶向组纳米粒注射前和注射6h后的体内光声成像图(A)和定量分析(B) |
2.9 体内超声/造影成像
如图 8A所示,辐照前两组的超声(B-mode)/造影(CEUS)图像在荷瘤鼠体内肿瘤部位均表现为无明显回声。激光辐照后,靶向组肿瘤部位内超声/造影图像均呈现回声信号的增多,而非靶向组肿瘤部位内超声/造影图像未观察到明显的回声信号增多,靶向组与非靶向组经过激光辐照后的信号值差异具有统计学意义(P < 0.05,图 8B、C)。表明AS1411-PLGA@FePc@PFP较非靶向纳米粒的超声/造影效果更佳。

|
| A:超声造影成像图;B:B-mode信号定量分析;C:CEUS信号定量分析a: P < 0.05, 与靶向组比较 图 8 靶向组与非靶向组纳米粒注射前和注射6 h后辐照前后的体内超声/造影成像图和定量分析 |
2.10 体内光热效应
如图 9A所示,辐照后的荷瘤鼠肿瘤部位局部升温,其中靶向组达(50.53±0.56)℃,非靶向组达(40.63±0.78)℃(图 9B),二者差异具有统计学意义(P < 0.05)。表明纳米粒基于酞菁铁在体内具有光热转化能力,且靶向组具有更好的升温效果。
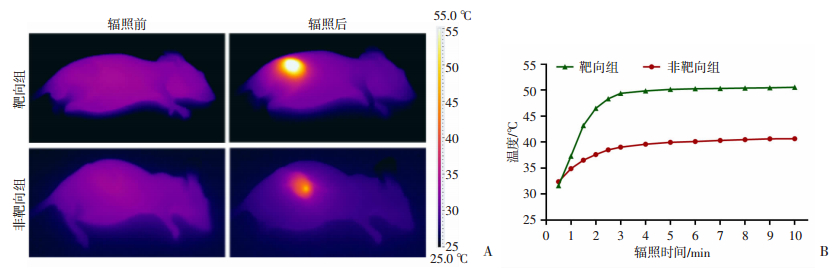
|
| A:热成像图;B:不同辐照时间的温度变化 图 9 靶向组与非靶向组纳米粒注射6 h后激光辐照前和辐照10 min时的热成像表现 |
3 讨论
适配体作为90年代新崛起的靶向探针,受到了广泛的使用和推广。基于其具有很多大分子抗体承担的靶向探针不具备的优势。其属于碱基单链,分子量较小,不会产生抗原-抗体的免疫反应,并且由于其两端修饰有COOH或者NH2,易于连接多种基团。比如连接表面富集COOH的PLGA材料,用于搭载显像剂[13];可以耦联DOTA基团的COOH以便于螯合各种核素比如177Lu、68Ga、64Cu,用于核素的治疗和显像;也可以耦联化疗药物和试剂直接靶向递送至肿瘤内部。本研究采用的适配子AS1411由三维DNA样结构组成,靶向核仁蛋白,该蛋白在乳腺癌等实体肿瘤广泛表达,存在于细胞核、膜、胞质中。其良好的靶向效果已被大量的实验探索和论证[14]。
本研究应用生物相容性好的PLGA高分子材料作为载体,通过超声乳化法搭载光敏剂FePc,采用碳二亚胺法外接AS1411与纳米粒,成功制备了具备靶向能力并且良好成像效果的多功能纳米粒。通过对纳米粒进行理化性质检测,其透射电镜下呈球形,大小较为均一且分散性良好,粒径为(208.03±8.96) nm。据文献记载,肿瘤新生血管内皮间隙为380~780 nm,理论上该实验制备的纳米粒可穿越大部分肿瘤新生血管内皮间隙到达靶区, 而实际上由于肝脾血管网的摄取,被动靶向效果并不理想[15]。激光共聚焦显微镜和流式仪提示PLGA@FePc@PFP和AS1411的连接率可高达(93.31±2.58)%。体外寻靶实验中可以观察到靶向组中MCF-7细胞周围的纳米粒明显多于非靶向组。同时,体内外光声/超声造影成像实验进一步证明该纳米粒具良好的靶向效果和成像能力。光声成像作为新型成像模式,有助于弥补单纯超声成像分辨率较差的缺陷,将光的高分辨率和声的高穿透性整合。在超声造影成像的实验中,靶向纳米粒富集入肿瘤部位后经激光辐照,利用FePc的光热转化效应使液态氟碳(PFP)发生液-气相变,起到了显著的超声造影增强作用,因此该靶向纳米粒可实现影像的引导作用,作为潜在的乳腺癌临床诊断造影剂。且文献记载,当瘤体温度高于46 ℃时可对肿瘤细胞实现一定的抑制效果[16]。本研究中肿瘤部位可升温至(50.53±0.56)℃,具有实现诊疗一体化效果的潜在可能。对于进一步的生物应用和临床转化,仍需我们继续努力。
综上,本研究选择灵敏度高、无抗原抗体反应的适配体与效果优良的光敏剂酞菁铁相结合,基于纳米医学平台,成功构建一种多功能纳米粒,并证明其良好的体内外靶向、成像能力及光热转化效果。为建立一种高效且安全的分子显像与靶向治疗方式提供新的可能。
| [1] |
DESANTIS C E, MA J M, GAUDET M M, et al. Breast cancer statistics, 2019[J]. CA A Cancer J Clin, 2019, 69(6): 438-451. DOI:10.3322/caac.21583 |
| [2] |
TURNER N C, NEVEN P, LOIBL S, et al. Advances in the treatment of advanced oestrogen-receptor-positive breast cancer[J]. Lancet, 2017, 389(10087): 2403-2414. DOI:10.1016/S0140-6736(16)32419-9 |
| [3] |
SOLANKI M, VISSCHER D. Pathology of breast Cancer in the last half century[J]. Hum Pathol, 2019, S0046-S8177(19): 30172-8. DOI:10.1016/j.humpath.2019.09.007 |
| [4] |
王志刚. 多功能超声分子探针显像与增效高强度聚焦超声治疗[J]. 临床超声医学杂志, 2017, 19(9): 577-579. WANG Z G. Multifuctional ultrasound molecular probes for imaging and synergistic high-intensity focused ultrasound therapy[J]. J Clin Ultrasound Med, 2017, 19(9): 577-579. DOI:10.16245/j.cnki.issn1008-6978.2017.09.001 |
| [5] |
VALLURU K S, WILLMANN J K. Clinical photoacoustic imaging of cancer[J]. Ultrasonography, 2016, 35(4): 267-280. DOI:10.14366/usg.16035 |
| [6] |
VALLURU K S, WILSON K E, WILLMANN J K. Photoacoustic imaging in oncology: translational preclinical and early clinical experience[J]. Radiology, 2016, 280(2): 332-349. DOI:10.1148/radiol.16151414 |
| [7] |
SINGH S, AGGARWAL A, BHUPATHIRAJU N V, et al. Glycosylated porphyrins, phthalocyanines, and other porphyrinoids for diagnostics and therapeutics[J]. Chem Rev, 2015, 115(18): 10261-10306. DOI:10.1021/acs.chemrev.5b00244 |
| [8] |
HAN Z B, HAN X, ZHAO X M, et al. Iron phthalocyanine supported on amidoximated Pan fiber as effective catalyst for controllable hydrogen peroxide activation in oxidizing organic dyes[J]. J Hazard Mater, 2016, 320: 27-35. DOI:10.1016/j.jhazmat.2016.08.004 |
| [9] |
LIU J X, SHANG T T, WANG F J, et al. Low-intensity focused ultrasound (LIFU)-induced acoustic droplet vaporization in phase-transition perfluoropentane nanodroplets modified by folate for ultrasound molecular imaging[J]. Int J Nanomedicine, 2017, 12: 911-923. DOI:10.2147/IJN.S122667 |
| [10] |
周頔, 孙阳, 王志刚. 包裹液态氟碳的多功能纳米粒研究进展[J]. 中国医学影像技术, 2016, 32(1): 138-141. ZHOU D, SUN Y, WANG Z G. Research progresses of multi-functional liquid perfluorocarbons nanoparticles[J]. Chin J Med Imaging Technol, 2016, 32(1): 138-141. DOI:10.13929/j.1003-3289.2016.01.036 |
| [11] |
SHARMA V R, THOMAS S D, MILLER D M, et al. Nucleolin overexpression confers increased sensitivity to the anti-nucleolin aptamer, AS1411[J]. Cancer Invest, 2018, 36(9/10): 475-491. DOI:10.1080/07357907.2018.1527930 |
| [12] |
LIU G, GAO N S, ZHOU Y, et al. Polydopamine-based "four-in-one" versatile nanoplatforms for targeted dual chemo and photothermal synergistic cancer therapy[J]. Pharmaceutics, 2019, 11(10): E507. DOI:10.3390/pharmaceutics11100507 |
| [13] |
王征, 丁劲松, 罗声娟, 等. 携带适配体AS1411的液态内核纳米超声造影剂的制备和评估[J]. 中南大学学报(医学版), 2018, 43(6): 610-618. WANG Z, DING J S, LUO S J, et al. Development and evaluation of ultrasound contrast agents with AS1411-conjugated nanoparticles with liquid core[J]. J Central South Univ Med Sci, 2018, 43(6): 610-618. DOI:10.11817/j.issn.1672-7347.2018.06.006 |
| [14] |
戴碧纯, 潘碧垚, 张珊珊, 等. 核酸适配体技术在胰腺癌诊断和治疗中的应用[J]. 肝胆胰外科杂志, 2019, 31(6): 325-328. DAI B C, PAN B Y, ZHANG S S, et al. Applicationof nucleic acid aptamer technology in the diagnosis and treatment of pancreatic cancer[J]. J Hepatopancreatobil Surg, 2019, 31(6): 325-328. DOI:10.11952/j.issn.1007-1954.2019.06.002 |
| [15] |
MAEDA H, NAKAMURA H, FANG J. The EPR effect for macromolecular drug delivery to solid tumors: Improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo[J]. Adv Drug Deliv Rev, 2013, 65(1): 71-79. DOI:10.1016/j.addr.2012.10.002 |
| [16] |
GHAFFARI H, BEIK J, TALEBI A, et al. New physical approaches to treat cancer stem cells: a review[J]. Clin Transl Oncol, 2018, 20(12): 1502-1521. DOI:10.1007/s12094-018-1896-2 |





