2. 430070 武汉,中国人民解放军中部战区总医院心血管内科
2. Department of Cardiology, General Hospital of Central Theater Command, Wuhan, Hubei Province, 430070, China
冠状动脉微血管疾病(coronary microvascular disease, CMD)是动脉内径<400 μm的微血管结构和功能异常所导致的冠状动脉疾病。在具有明显心肌缺血症状的冠脉非阻塞性病变患者中,CMD的发生率为45%~60%[1]。糖尿病、高脂血症、高血压、心肌缺血再灌注损伤、吸烟和慢性炎症等因素均可导致CMD。微血管内皮细胞功能紊乱和结构改变是导致CMD发生的重要原因[2]。研究表明,心血管疾病的许多危险因素均可能引起微血管内皮细胞中一氧化氮(nitric oxide, NO)/内皮素-1(endothelin-1, ET-1)、血栓素A2(thromboxane A2, TXA2)/前列腺素I2(prostaglandin I2, PGI2)的比值失衡,出现微血管内皮功能紊乱和通透性增加,同时增加粒细胞在局部的浸润,可最终导致微血管闭塞,从而引发心肌缺血和心血管不良事件。因此,进一步探讨微血管内皮细胞功能障碍发生的机制对CMD的防治具有重要意义。
血小板和内皮细胞之间的相互作用所导致的局部炎症反应是内皮功能障碍的重要原因之一[3]。当血管内皮细胞被激活或损伤时,血小板可快速黏附、聚集于该部位,释放多种炎症介质和趋化因子,粒细胞通过与激活的血小板和内皮细胞之间的相互作用,迅速聚集在受损血管部位,进一步加重炎症反应和损伤。此外,被激活的血小板可释放出大量的血小板微囊泡(platelet microvesicles,PMVs),发挥更广泛的促炎症和促血栓形成作用[4]。PMVs是直径为0.1~1 μm的膜性微囊泡,由脂质双分子层、血小板膜蛋白和内容物所组成,含有线粒体、microRNAs和细胞因子等多种生物活性物质。PMVs与细胞接触后可通过内饮和膜融合等方式将生物活性物质递送给靶细胞,实现对细胞功能的调控[5]。亦有研究表明,在急性冠脉综合征患者血浆中,PMVs水平较稳定型冠心病患者显著升高,且与心血管风险和不良临床预后呈正相关。
本课题组前期研究发现,PMVs具有促进动脉粥样硬化斑块形成和血管新生的作用[6-7],但PMVs对微血管功能的影响尚不清楚。本研究采用二磷酸腺苷(adenosine diphosphate,ADP)激活血小板后产生的PMVs作用于人微血管内皮细胞(human microvascular endothelial cells,HMECs),检测和分析TXB2/6-keto-PGF1α(实际反映TXA2/PGI2的比值)和NO/ET-1比值的变化、内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)的磷酸化水平,以了解微血管内皮细胞功能改变;通过检测HMECs培养上清中细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)和E-选择素(E-selectin)的水平,以及内皮微囊泡(endothelial microvesicles,EMVs)的含量,进一步评价PMVs对HMECs是否具有损伤作用。
1 材料与方法 1.1 试剂材料通过静脉采集健康志愿者的全血,以1:10体积的柠檬酸钠溶液抗凝。血栓素A2(TXA2)和前列腺素I2(PGI2)的稳定代谢产物TXB2和6-keto-PGF1α的ELISA检测试剂盒购自Cayman Chemical公司(USA);磷酸化eNOS的抗体购自Abcam公司(USA);内皮素-1(ET-1)抗体购自Santa Cruz公司(USA);ICAM-1、VCAM-1的ELISA试剂盒购自上海信裕公司;DAF-FMDA(NO荧光探针)、E-selectin ELISA购自索莱宝生物公司;HMECs购自ATCC(USA)。
1.2 细胞培养HMECs采用DMEM高糖培养基(含10%胎牛血清和1%青/链霉素),在37 ℃,5% CO2的孵育箱中培养。采用第3~10代的HMECs用于实验。
1.3 人血小板分离及PMVs的制备取柠檬酸钠抗凝的健康人全血,110×g离心15 min获得富含血小板血浆(platelet-rich plasma, PRP),取PRP以710×g离心15 min获得血小板沉淀,以CGS缓冲液洗涤血小板3次,台式液重悬血小板至3×108/mL;血小板悬液中加入终浓度20 μmol/L的ADP,37 ℃孵育10 min以激活血小板。710×g离心15 min去除活化的血小板(沉淀部分),上清部分于4 ℃以20 000×g离心60 min,得到的沉淀即为PMVs,同时保留此上清作为对照(Sup组),以台式液作为空白对照(control, Con组)。采用BCA试剂盒测定PMVs的蛋白浓度[7]。
1.4 ELISA检测50 μg/mL PMVs与HMECs孵育6、12、24 h,或采用不同浓度(10、20、50 μg/mL)的PMVs与HMECs孵育24 h,收集细胞培养上清,按照ELISA试剂盒说明书检测TXB2、6-Keto-PGF1α、ICAM-1、VCAM-1和E-selectin的水平。
1.5 NO含量测定HMECs以2×104个/孔接种至96孔板中。采用不同浓度(10、20、50 μg/mL)的PMVs与HMECs孵育24 h后,弃去细胞培养基,加入NO荧光探针(3 μmol/L DAF-FM-Da)继续孵育30 min,荧光显微镜(激发波长为515 nm)下观察并拍照。每个视野中统计25个细胞的荧光强度并采用Image J软件进行定量分析。
1.6 Western blot检测采用不同浓度(10、20、50 μg/mL)的PMVs孵育HMECs 24 h。RIPA裂解液(含蛋白酶和磷酸酶抑制剂)裂解细胞,收集细胞上清后采用BCA法检测蛋白浓度。各组取等量蛋白进行凝胶电泳,转膜(PVDF膜),并用5%的牛奶室温封闭。PVDF膜加入抗ET-1、磷酸化eNOS(p-eNOS)和GAPDH的一抗,置于摇床上4 ℃孵育过夜后,加二抗于室温下孵育1 h后洗涤。采用化学发光仪曝光条带,扫描后分析相关数据。
1.7 流式细胞仪检测EMVs含量采用不同浓度的PMVs(10、20、50 μg/mL)孵育HMECs 24 h后收集细胞培养上清。取100 μL HMECs培养上清,分别加入CD31-PE抗体和Annexin V-FITC抗体各5 μL,室温避光孵育20 min。以0.2 ~1 μm的微珠作为参考,采用流式细胞仪(Verse,BD公司)检测HMECs培养上清中EMVs(CD31+/Annexin V+)的含量。
1.8 统计学分析实验均重复3次,数据以x±s表示,采用GraphPad Prism 6软件进行统计分析,两组间比较采用t检验,多样本采用单因素方差分析,检验水准:α= 0.05。
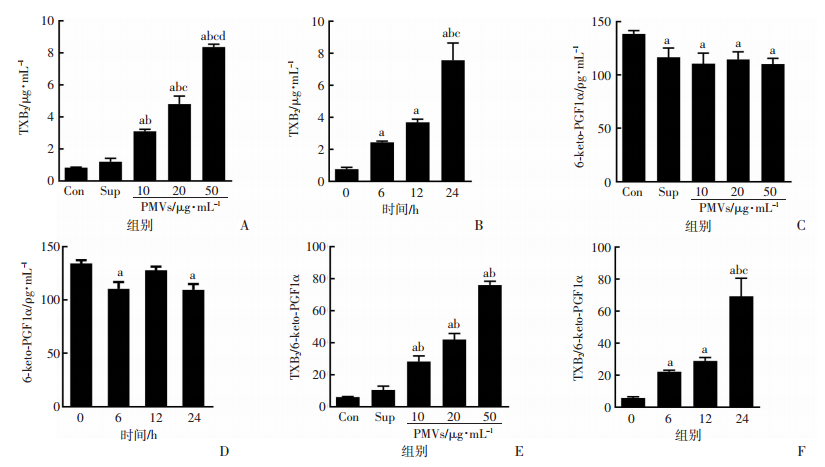
2 结果 2.1 PMVs可使内皮细胞TXB2/6-keto-PGF1α比值升高ELISA检测TXA2和PGI2的稳定代谢产物TXB2和6-keto-PGF1α。结果显示,PMVs可使HMECs分泌的TXB2的水平增加,并呈剂量和时间依赖性(图 1A、B),而6-keto-PGF1α的水平则明显降低(图 1C、D),导致TXB2/6-keto-PGF1α的比值显著升高(图 1E、F);其中50 μg/mL PMVs组TXB2/6-keto-PGF1α的比值较对照组升高约12倍(P < 0.05),表明PMVs可导致TXA2/PGI2比例的明显上升。
|
| A、C、E:各组作用于HMECs细胞24 h a:P < 0.05,与Con组比较;b:P < 0.05,与Sup组比较;c:P < 0.05,与10 μg/mL PMVs组比较;d:P < 0.05,与20 μg/mL PMVs组比较;B、D、F: 50 μg/mL PMVs作用于HMECs不同时间a:P < 0.05,与0 h比较;b:P < 0.05,与6 h比较;c:P < 0.05,与12 h比较 图 1 PMVs对HMECs培养上清中TXB2和6-keto-PGF1α水平的影响(n=3, x±s) |
2.2 PMVs可降低HMECs中NO含量和eNOS的磷酸化水平,促进ET-1表达
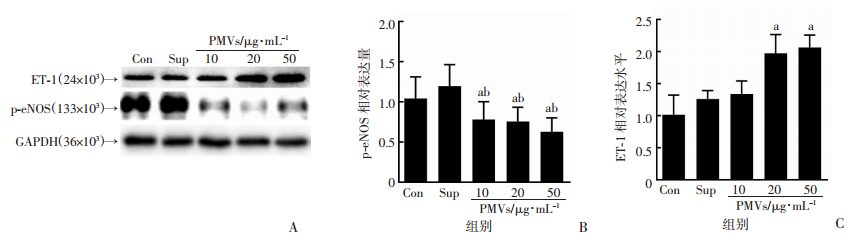
荧光探针检测结果显示,50 μg/mL PMVs可显著降低HMECs中NO的含量(图 2)。eNOS是诱导内皮细胞NO合成的限速酶。eNOS蛋白Ser1177位点的磷酸化水平降低可导致eNOS酶活性降低、NO生成减少。同时,Western blot检测结果显示,PMVs可显著抑制eNOS蛋白的磷酸化水平(图 3)。这说明PMVs能降低eNOS的磷酸化活性,进而减少NO的释放量。

|
| A~E:荧光显微镜下观察各组HMECs中NO含量的变化;F:各组作用24 h后HMECs中NO含量的变化a:P < 0.05,与Con组比较;b:P < 0.05,与Sup组比较 图 2 PMVs对HMECs中NO水平的影响(n=3, x±s) |
|
| A:Western blot检测p-eNOS和ET-1的蛋白含量;B-C:半定量分析结果;a:P < 0.05,与Con组比较;b:P < 0.05,与Sup组比较 图 3 Western blot检测PMVs对HMECs中ET-1和p-eNOS表达的影响(n=3, x±s) |
ET-1是由血管内皮细胞分泌的一种强烈的血管收缩调节因子,在维持基础血管张力和内皮功能稳态中具有重要作用。Western blot检测结果显示,与对照组比较,PMVs能够显著增加HMECs中ET-1蛋白的表达(图 3)。
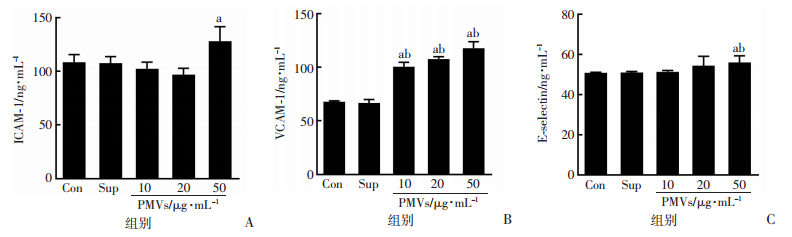
2.3 PMVs可促进HMECs培养上清中ICAM-1、VCAM-1和E-selectin表达10、20、50 μg/mL PMVs刺激HMECs 24 h后,ELISA检测细胞培养上清中的ICAM-1、VCAM-1和E-selectin(图 4)。结果显示,与对照组比较,50 μg/mL PMVs可促进HMECs分泌ICAM-1、E-selectin,差异具有统计学意义(P < 0.05)。10、20、50 μg/mL PMVs均可促进HMECs分泌VCAM-1,差异具有统计学意义(P < 0.05)。
|
| A-C: PMVs孵育24 h后检测细胞培养上清中ICAM-1、VCAM-1和E-selectin的分泌a:P < 0.05,与对照组(Con)比较;b:P < 0.05,与PMVs上清(Sup)组比较 图 4 PMVs对HMECs培养上清中ICAM-1、VCAM-1和E-selectin水平的影响(n=3, x±s) |
2.4 PMVs可促进HMECs产生EMVs
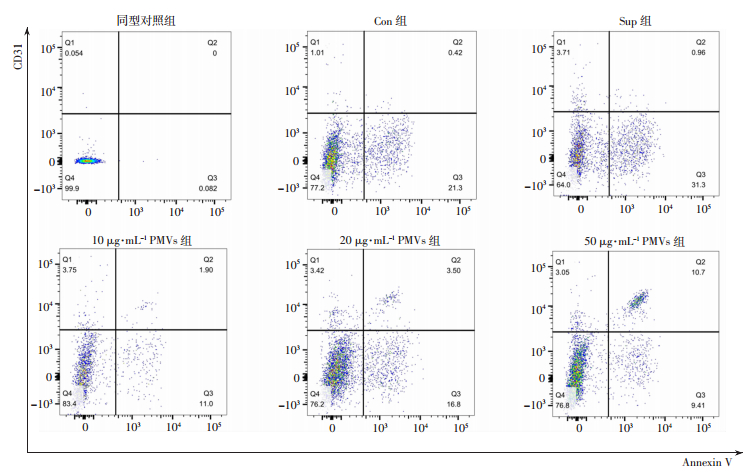
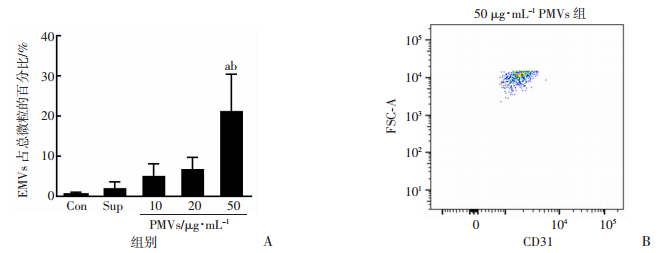
流式细胞术定量检测结果显示,20、50 μg/mL PMVs刺激HMECs 24 h后,EMVs的释放较Con组和Sup组明显增加(P < 0.05,图 5、6)。
|
| 图 5 流式细胞术检测各组HMECs培养上清中的EMVs(CD3+/Annexin V+) (n=3, x±s) |
|
| A:各组流式细胞术检测结果a:P < 0.05,与Con组比较;b:P < 0.05,与Sup组比较;B:EMVs的FSC-A散点图 图 6 PMVs对各组HMECs培养上清中EMVs含量的影响(n=3, x±s) |
3 讨论
微血管内皮细胞是血液和微血管壁之间的一层高度选择性屏障,通过调节微血管的通透性和完整性,参与血液和组织间的物质能量代谢。此外,微血管内皮细胞也是一种具有分泌功能的细胞,可通过合成和释放多种细胞因子和血管活性物质,如TXA2、PGI2、NO、ET-1、ICAM-1、VCAM-1及E-selectin等调节血管收缩和舒张,从而维持血管稳态和血管功能。微血管内皮功能障碍是微血管内皮细胞在多种病理因素刺激下出现的功能异常,表现为微血管张力调节障碍和黏附分子表达异常,是众多疾病发生的始动环节。例如,在心血管疾病高危因素如高血压、糖尿病、炎症、吸烟、血脂异常等的参与下,冠脉内皮细胞受损,导致了CMD的发生[8]。此外,心肌缺血再灌注所导致的微血管内皮损伤被认为是PCI术后“无复流”现象发生的重要原因之一[9]。血小板是血管壁炎症反应的重要参与成分。血小板募集到血管损伤部位后,迅速被激活,黏附、聚集于微血管内皮,导致微血栓形成和微血管阻塞[10]。活化的血小板及其激活后产生的PMVs还可释放大量细胞因子和趋化因子,招募白细胞黏附至受损血管壁局部,加剧局部炎症反应,导致内皮细胞通透性增加,微血管渗漏增多,微血管功能障碍[11]。
TXA2/PGI2的动态平衡在调控内皮细胞通透性、维持微血管功能方面具有重要作用。PGI2主要由血管内皮细胞产生,PGI2可通过激活腺苷酸环化酶,上调血小板cAMP水平,拮抗TXA2的促血管收缩和血小板聚集作用。病理情况下,二者间平衡被打破,导致内皮损伤和功能障碍。TXA2和PGI2的半衰期较短且不稳定,因此在研究中主要通过检测TXA2和PGI2的稳定代谢产物TXB2和6-keto-PGF1α以反映其水平[12]。本研究发现,PMVs可明显增加HMECs培养上清中TXB2水平,同时降低6-keto-PGF1α水平,导致HMECs培养上清中TXB2/6-keto-PGF1α的比值显著升高。表明PMVs能干扰内皮细胞TXA2/PGI2的平衡状态,导致内皮依赖性血管舒缩功能受损。
NO和ET-1是由血管内皮细胞合成和分泌的一对血管舒缩因子,两者保持一定的平衡是维持正常血管功能状态的重要因素。NO是L-精氨酸在eNOS的催化作用下合成的一种促血管舒张物质。此外,NO还具有抑制白细胞与内皮细胞黏附、抑制血小板黏附和聚集等作用。而ET-1是一种内皮源性的强效血管收缩肽,在调节血管张力中发挥着重要的作用。本研究发现,PMVs可通过下调HMECs中eNOS蛋白磷酸化水平(Ser1177位点)而降低eNOS的活性,导致NO的生成和释放缺陷,同时促进ET-1蛋白的表达,从而破坏NO/ET-1平衡,使得血管内皮细胞表现为收缩功能优势而舒张功能障碍的状态,导致内皮细胞功能紊乱的发生。正常情况下,血管内皮细胞中ICAM-1、VCAM-1及E-selectin的表达量很低,当内皮细胞炎症或损伤时,能在多种细胞因子的触发下迅速升高。本研究发现血小板活化后产生的PMVs能上调内皮细胞中ICAM-1、VCAM-1及E-selectin的表达水平,表明血小板可通过释放PMVs参与白细胞和血管内皮细胞之间的黏附级联反应从而加重炎症反应。
细胞外囊泡(extracellular vesicles,EVs)是细胞分泌的一类超微膜性囊泡,包括外泌体(exosomes)、微囊泡(microvesicles, MVs)和凋亡小体(apoptotic bodies)[13-14]。外泌体是由多囊泡体与细胞膜融合形成的直径为30~150 nm的EVs,微囊泡则是由细胞膜出芽形成的直径为100~1000 nm的EVs[15]。EMVs是内皮细胞激活或凋亡时释放的微囊泡。临床研究发现,糖尿病、血管钙化等心血管疾病发生时,病人血浆中EMVs的分泌增加,加重了血管局部炎症反应[16]。循环血中EMVs在所有微粒组分中所占比例的升高可作为内皮细胞损伤和功能紊乱的标志。本研究发现,PMVs可显著促进HMECs释放EMVs,提示PMVs对HMECs具有损伤作用。
本研究发现,PMVs可使HMECs中TXA2/PGI2的比值升高,而NO/ET-1的比值下降,从而导致内皮细胞功能障碍;同时上调HMECs中ICAM-1、VCAM-1、E-selectin的水平,以及促进EMVs的分泌,提示PMVs可能通过上述影响导致内皮细胞损伤和内皮通透性增加。本研究进一步阐明了血小板与微血管功能障碍之间的关系,可望为微血管功能障碍和冠状动脉微血管疾病的防治提供新的思路。
| [1] |
张运, 陈韵岱, 傅向华, 等. 冠状动脉微血管疾病诊断和治疗的中国专家共识[J]. 中国循环杂志, 2017, 32(5): 421-430. ZHANG Y, CHEN Y D, FU X H, et al. Chinese expert consensus on the diagnosis and treatment of coronary microvascular disease[J]. Chin Circ J, 2017, 32(5): 421-430. DOI:10.3969/j.issn.1000-3614.2017.05.003 |
| [2] |
TAQUETI V R, DI CARLI M F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2018, 72(21): 2625-2641. DOI:10.1016/j.jacc.2018.09.042 |
| [3] |
HAMILOS M, PETOUSIS S, PARTHENAKIS F. Interaction between platelets and endothelium: from pathophysiology to new therapeutic options[J]. Cardiovasc Diagn Ther, 2018, 8(5): 568-580. DOI:10.21037/cdt.2018.07.01 |
| [4] |
ZALDIVIA M T K, MCFADYEN J D, LIM B, et al. Platelet-derived microvesicles in cardiovascular diseases[J]. Front Cardiovasc Med, 2017, 4: 74. DOI:10.3389/fcvm.2017.00074 |
| [5] |
BEI J J, LIU C, PENG S, et al. Staphylococcal SSL5-induced platelet microparticles provoke proinflammatory responses via the CD40/TRAF6/NFκB signalling pathway in monocytes[J]. Thromb Haemost, 2016, 115(3): 632-645. DOI:10.1160/TH15-04-0322 |
| [6] |
汪泽扬, 潘丽娜, 陈丽媛, 等. 血小板微粒对ApoE-/-小鼠动脉粥样硬化斑块形成及稳定性的影响[J]. 第三军医大学学报, 2019, 41(6): 514-520. WANG Z Y, PAN L N, CHEN L Y, et al. Effects of platelet microparticles on atherosclerotic plaque formation and stability in ApoE-/-mice[J]. J Third Mil Med Univ, 2019, 41(6): 514-520. DOI:10.16016/j.1000-5404.201811130 |
| [7] |
SUN C, FENG S B, CAO Z W, et al. Up-regulated expression of matrix metalloproteinases in endothelial cells mediates platelet microvesicle-induced angiogenesis[J]. Cell Physiol Biochem, 2017, 41(6): 2319-2332. DOI:10.1159/000475651 |
| [8] |
XU J, LO S, JUERGENS C P, et al. Assessing coronary microvascular dysfunction in ischaemic heart disease: little things can make a big difference[J]. Heart Lung Circ, 2020, 29(1): 118-127. DOI:10.1016/j.hlc.2019.05.187 |
| [9] |
GAO X M, SU Y D, MOORE S, et al. Relaxin mitigates microvascular damage and inflammation following cardiac ischemia-reperfusion[J]. Basic Res Cardiol, 2019, 114(4): 30. DOI:10.1007/s00395-019-0739-9 |
| [10] |
SCHANZE N, BODE C, DUERSCHMIED D. Platelet contributions to myocardial ischemia/reperfusion injury[J]. Front Immunol, 2019, 10: 1260. DOI:10.3389/fimmu.2019.01260 |
| [11] |
BURBANO C, VILLAR-VESGA J, OREJUELA J, et al. Potential involvement of platelet-derived microparticles and microparticles forming immune complexes during monocyte activation in patients with systemic lupus erythematosus[J]. Front Immunol, 2018, 9: 322. DOI:10.3389/fimmu.2018.00322 |
| [12] |
PÉREZ-CREMADES D, BUENO-BETÍC, GARCÍA-GIMÉNEZ J L, et al. Extracellular histones disarrange vasoactive mediators release through a COX-NOS interaction in human endothelial cells[J]. J Cell Mol Med, 2017, 21(8): 1584-1592. DOI:10.1111/jcmm.13088 |
| [13] |
STAHL P D, RAPOSO G. Extracellular vesicles: exosomes and microvesicles, integrators of homeostasis[J]. Physiology (Bethesda), 2019, 34(3): 169-177. DOI:10.1152/physiol.00045.2018 |
| [14] |
BOULANGER C M, LOYER X, RAUTOU P E, et al. Extracellular vesicles in coronary artery disease[J]. Nat Rev Cardiol, 2017, 14(5): 259-272. DOI:10.1038/nrcardio.2017.7 |
| [15] |
SHAO H L, IM H, CASTRO C M, et al. New technologies for analysis of extracellular vesicles[J]. Chem Rev, 2018, 118(4): 1917-1950. DOI:10.1021/acs.chemrev.7b00534 |
| [16] |
HIJMANS J G, BAMMERT T D, STOCKELMAN K A, et al. High glucose-induced endothelial microparticles increase adhesion molecule expression on endothelial cells[J]. Diabetol Int, 2019, 10(2): 143-147. DOI:10.1007/s13340-018-0375-x |



