2. 400010 重庆,重庆医科大学附属第二医院:病理科
2. Department of Pathology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
胃癌在亚洲国家发病率相对较高,而我国的早期胃癌诊断率远远低于日韩两国,大多数为进展期胃癌[1],导致了胃癌发病率及死亡率已经成为我国仅次于肺癌的第二大癌症[2]。因此,进一步认识胃癌的发病机制,早期诊断,寻找更加有效的胃癌治疗方法,仍是目前亟待解决的问题。
胃癌是来源于胃黏膜上皮的恶性肿瘤,胃上皮细胞的异常分化是促进胃癌发生发展的重要机制[3]。胃上皮细胞的正常分化过程被干扰后,可表现为异常的肠化生,随着细胞的持续性增殖,逐渐出现恶性表型[4-5]。早期胃癌主要由胃型细胞组成,而在胃癌进展中,胃型细胞则向肠型细胞转化[6]。神经元素3(neurogenin3,NEUROG3)基因最早于1996年发现[7],主要作用为调控神经元的分化。后来逐渐发现NEUROG3可影响胰腺内分泌细胞的分化。而最近在转基因小鼠中的研究显示,NEUROG3的表达对于维持正常胃黏膜上皮细胞分化必不可少,敲除NEUROG3基因后,小鼠胃黏膜上皮出现了肠化生[8]。
以上研究提示,NEUROG3可能参与了人胃上皮细胞的分化,影响胃癌的发生与进展。本实验将检测不同分化程度的胃癌组织和细胞系中NEUROG3的表达,并探讨其对胃癌细胞恶性表型的影响。
1 材料与方法 1.1 材料共302个胃癌及胃黏膜组织来自重庆医科大学第二附属医院。人胃癌细胞系MKN-28,SGC-7901,MKN-45,BGC-823和人胃黏膜上皮细胞系GES-1来自于重庆医科大学附属第一医院分子肿瘤学和表观遗传学实验室,HEK293细胞来源于南开大学医学国际协同创新中心实验室。免疫组化Envision试剂盒购自北京ZSGB-BIO公司;小鼠抗NEUROG3单克隆抗体(TA500090)和小鼠β-actin单克隆抗体(TA811000)均购自北京OriGene Technologies公司;RPMI 1640培养基、胎牛血清、青/链霉素均购于美国BI公司;非必需氨基酸、谷氨酰胺、丙酮酸钠和DMEM培养基均购自美国Gibco公司;嘌呤霉素购自美国Sigma公司;pLV-H1-EF1α-puro载体单寡核苷酸基因沉默RNAi试剂盒购自美国Biosettia公司;TRIzol、Lipofectamine 2000购于美国Invitrogen公司;ECL化学发光kit、BCA试剂盒均购自美国EMD Millipore公司;cDNA反转录和Real-time PCR SuperMix试剂盒购自北京TransGen Biotech公司;EdU Apollo®488细胞增殖试剂盒购自广州RiboBio公司;Transwell小室购自美国Corning公司;Matrigel购自美国BD公司。
1.2 HE染色及IHC分析HE染色:将石蜡包埋切片经脱蜡、HE染色后,脱水、封片。IHC按Envision试剂盒说明书进行。切片脱蜡后在抗原修复液中煮沸以暴露抗原,小鼠抗NEUROG3单克隆抗体(稀释为1 :150)孵育一抗,接着孵育生物素标记的二抗,HRP-生物素偶联的三抗孵育后,DAB显色、苏木精复染、脱水、封片。免疫组化分析由2名病理科医生独立评估。评分按染色强度及范围分为4等,无:0分,弱:1分,中:2分,强:3分。2~3分判断为阳性,0~1分判断为阴性。
1.3 细胞培养胃癌细胞和GES-1细胞用含10%胎牛血清和青链霉素双抗的RPMI 1640培养基,HEK293T细胞用含10%胎牛血清和非必需氨基酸、谷氨酰胺和丙酮酸钠的DMEM培养基,于37 ℃,5%CO2细胞培养箱中培养,2~3 d换液1次。待细胞生长至对数生长期时进行收集处理。
1.4 质粒构建与慢病毒转染首先在Biosettia网站(http://biosettia.com/support/shrna-designer)上设计合成三个shRNA-NEUROG3序列[9]: shRNA-1:5′-AGCGCAATCGAATGCACAACC-3′,shRNA-2:5′-GCAATCGAATGCACAACC-3′,shRNA-3:5′-GCGCAATCGAATGCACAACC-3′。按RNAi试剂盒说明书克隆到pLV-H1-EF1α-puro载体上,生成pLV-shRNA载体。按说明书使用Lipofectamine 2000转染慢病毒载体至HEK293T细胞,通过磷酸钙转染包装质粒而产生慢病毒并收集。胃癌细胞密度达到20%~30%时,用慢病毒感染细胞。嘌呤霉素筛选稳定转染细胞shNEUROG3/MKN-28和Ctrl/MKN-28。
1.5 RNA提取和Real-time PCR实验采用TRIzol法提取样本总RNA(1.0 μg),按试剂盒说明书合成cDNA,采用Real-time PCR方法对基因的表达水平进行验证。GAPDH作为内参,靶基因的相对表达量采用2-ΔΔCt比较法计算[10]。GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′;NEUROG3上游引物:5′-CTAAGAGCGAGTTGGCACTGA-3′,下游引物5′-GAGGTTGTGCATTCGATTGCG-3′。
1.6 Western blot检测收集对数生长期的胃癌细胞和GES-1细胞,加入细胞裂解液,冰上裂解30 min;4 ℃,12 000 rpm× 15 min,取上清,BCA试剂盒测定蛋白样品浓度;取40 μg蛋白样品进行SDS-PAGE电泳后,电转至PVDF膜上,5 %胎牛血清TBST液室温封闭1 h;加入小鼠抗NEUROG3单克隆抗体(1 :1 000),4 ℃孵育过夜,辣根过氧化物酶(horse radish peroxidase,HRP)标记的二抗(1 :5 000)室温孵育1 h,ECL曝光显影,实验重复3次。
1.7 克隆形成实验将shNEUROG3/MKN-28和Ctrl/MKN-28细胞(6× 102细胞/孔)接种于6孔板中,培养7 d。细胞用20%甲醇固定,0.5%结晶紫染色,光学显微镜下拍照计数。
1.8 EdU细胞增殖实验将培养在24孔板中的shNEUROG3/MKN-28和Ctrl/MKN-28细胞培养48 h,设3个复孔。然后使用EdU试剂盒按说明书操作进行检测。荧光显微镜下拍照计数,每个视野至少200个细胞。EdU阳性细胞计数为(EdU染色细胞/Hoechst染色细胞)×100%。
1.9 细胞划痕实验shNEUROG3/MKN-28和Ctrl/MKN-28细胞在6孔板中生长至90%融合,然后用移液管尖划痕,设3个复孔。在光学显微镜下分别记录24 h和48 h后细胞迁移距离,计算迁移距离百分比。
1.10 Transwell实验在Transwell 24孔小室底部铺50 μL matrigel基质胶,37 ℃固定1 h后,将4.0×104个shNEUROG3/MKN-28和Ctrl/MKN-28细胞分别加入小室,设3个复孔。常规培养48 h,用棉签刮去未迁移的细胞,用20%甲醇固定细胞,0.5%结晶紫染色。光学显微镜下拍照计数。
1.11 统计学分析采用SPSS 20.0软件进行统计学分析,Image J软件进行图像分析,数据以 x±s表示,两组间比较采用t检验,比较多组间差异采用单因素方差ANOVA分析,采用Spearman’s秩相关检验分析相关性。
2 结果 2.1 NEUROG3在胃组织中的表达与其分化程度呈正相关,和胃癌临床分期呈负相关根据HE染色分组和IHC染色结果(图 1A)表明,在低分化的胃癌中,NEUROG3表达评分较低,而在分化程度较高的胃癌组织、癌旁组织和肠化生胃黏膜中表达评分相对较高(P < 0.001,表 1)。中高分化腺癌患者(高分化腺癌标本数较少,仅3例,故与中分化腺癌一同分组分析),NEUROG3的表达阳性数明显高于低分化腺癌患者(P < 0.001,表 1)。相关性分析提示NEUROG3的表达强度与细胞分化程度呈正相关(r=0.412,表 2)。胃癌临床病理特点的关系分析显示,NEUROG3的表达差异与患者性别、年龄和肿瘤大小无统计学意义(P>0.05,表 2),而与是否存在淋巴结转移(P < 0.05,r=-0.180,表 2)和TNM分期(P < 0.001,r=-0.431,表 2)呈明显负相关。

|
| 图 1 观察NEUROG3在胃组织中的表达 |
| 胃组织分类 | n | 阴性 | 阳性 | |||
| 0分 | 1分 | 2分 | 3分 | |||
| 癌旁组织a | 121 | 11(9.1) | 13(10.7) | 43(35.5) | 54(44.6) | |
| 肠化生b | 60 | 10(16.7) | 5(8.3) | 20(33.3) | 25(41.6) | |
| 中高分化腺癌c | 49 | 11(22.4) | 8(16.3) | 22(44.9) | 8(16.3) | |
| 低分化腺癌 | 72 | 41(56.9) | 16(22.2) | 10(13.9) | 5(6.9) | |
| a:χ2=26.427, P=0.000; b: χ2=22.546, P=0.000; c: χ2=20.362, P=0.000, 与低分化腺癌组NEUROG3表达阳性率比较 | ||||||
| 患者临床特点 | NEUROG3(例) | 合计 | P | χ2 | r | |
| 阴性 | 阳性 | |||||
| 年龄(岁) | ||||||
| < 60 | 27 | 17 | 44 | 0.803 | 0.062 | -0.023 |
| ≥60 | 49 | 28 | 77 | |||
| 性别 | ||||||
| 男 | 42 | 25 | 67 | 0.975 | 0.001 | -0.003 |
| 女 | 34 | 20 | 54 | |||
| 肿瘤大小 | ||||||
| < 5 cm | 59 | 38 | 97 | 0.364 | 0.825 | -0.083 |
| ≥5cm | 17 | 7 | 24 | |||
| 淋巴结转移 | ||||||
| 阴性 | 25 | 23 | 48 | 0.048 | 3.919 | -0.180 |
| 阳性 | 51 | 22 | 73 | |||
| 肿瘤细胞分化程度 | ||||||
| 中高分化 | 19 | 30 | 49 | 0.000 | 20.362 | 0.412 |
| 低分化 | 57 | 15 | 72 | |||
| 肿瘤TNM分期 | ||||||
| Ⅰ | 8 | 23 | 31 | 0.000 | 26.380 | -0.431 |
| Ⅱ | 30 | 13 | 43 | |||
| Ⅲ | 33 | 9 | 42 | |||
| Ⅳ | 4 | 1 | 5 | |||
2.2 沉默NEUROG3基因表达导致胃癌细胞去分化
Real-time PCR和Western blot的检测结果提示,在mRNA和蛋白水平上,高分化胃癌细胞系MKN-28和胃黏膜上皮细胞系GES-1中,NEUROG3的基因转录水平明显高于中低分化胃癌细胞系SGC-7901、MKN-45和BGC-823,并且蛋白表达呈强阳性(图 2A、B)。这与临床标本的检测结果是一致的。慢病毒转染沉默NEUROG3基因表达后(P < 0.01,图 2C、D),与Ctrl/MKN-28细胞相比,shNEUROG3/MKN-28细胞变小,核质比增大(图 2E)。此外,细胞分化抑制因子Id-1的表达也明显增加(P < 0.001,图 2F)。
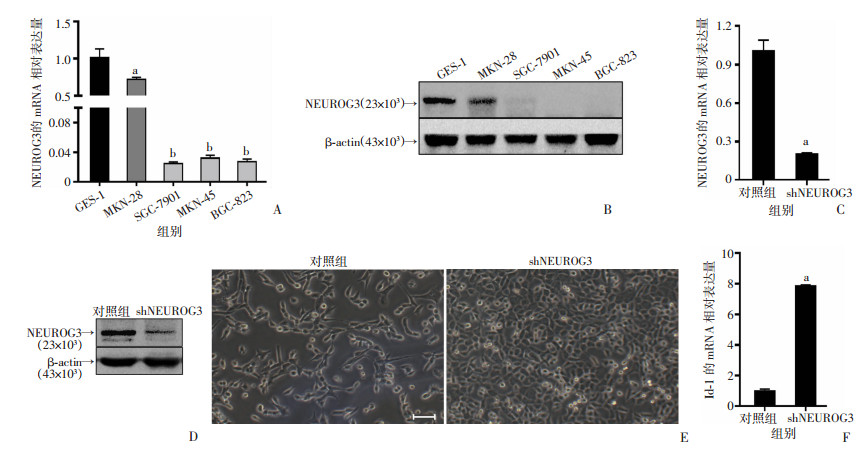
|
| A:Real-time PCR检测胃癌细胞中NEUROG3 mRNA的表达a:P < 0.01,b:P < 0.001,与GES-1组比较;B:Western blot检测胃癌细胞中NEUROG3蛋白的表达;C:Real-time PCR检测胃癌细胞shNEUROG3/MKN-28中NEUROG3 mRNA的表达a:P < 0.01,与对照组比较;D:Western blot检测胃癌细胞shNEUROG3/MKN-28中NEUROG3蛋白的表达;E:MKN-28细胞NEUROG3敲低后细胞形态学变化;F:Real-time PCR检测MKN-28细胞NEUROG3敲低后Id-1 mRNA的表达a:P < 0.001,与对照组比较 图 2 沉默NEUROG3基因表达导致胃癌细胞去分化 |
2.3 沉默NEUROG3基因表达可促进MKN-28细胞的增殖和迁移
克隆形成实验和EdU细胞增殖实验提示,沉默NEUROG3基因表达,shNEUROG3/MKN-28细胞克隆形成明显增多,细胞增殖率显著增加(P < 0.05,图 3A~D)。划痕实验和Transwell侵袭实验表明,shNEUROG3/MKN-28细胞的迁移侵袭能力较对照组细胞提高了约1.5倍(P < 0.05,图 3E~H)。
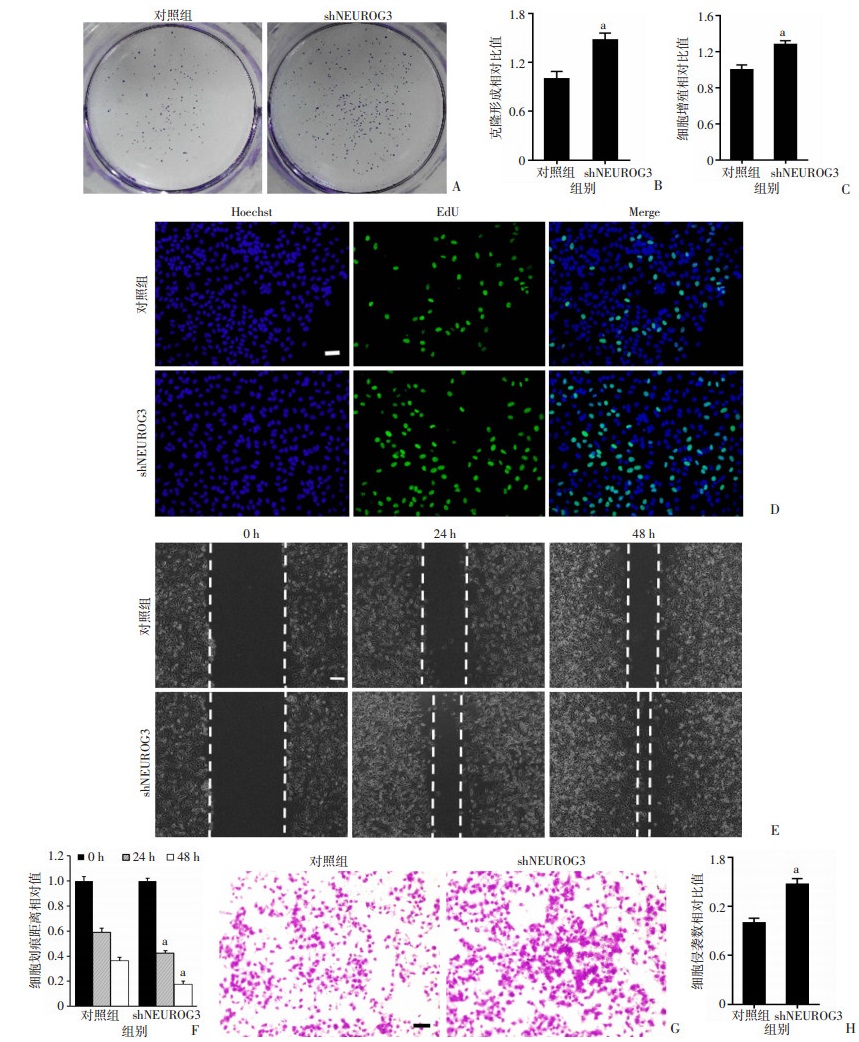
|
| A:克隆形成实验检测胃癌细胞增殖情况;B:胃癌细胞克隆数相对比值统计a:P < 0.05,与对照组比较;C:胃癌细胞增殖相对比值统计a:P < 0.05,与对照组比较; D:EdU细胞增殖实验检测胃癌细胞增殖情况;E:划痕实验检测胃癌细胞迁移情况;F:胃癌细胞迁移距离相对比值统计a:P < 0.05,与对照组比较;G:Transwell实验检测胃癌细胞侵袭情况;H:胃癌细胞侵袭数相对比值统计a:P < 0.01,与对照组比较 图 3 沉默NEUROG3基因表达促进胃癌细胞增殖和迁移 |
3 讨论
NEUROG3是与褪黑激素相关的bHLH转录因子的成员,也被称为Math4B、Atoh5、NGN-3、bHLHa7等。其基因位于10q22.1,包含0.6 kb的编码基因[10-11]。目前,大多数的研究均围绕NEUROG3在调节胰腺内分泌细胞分化方面的作用进行[11-12]。而由于陆续在胰腺癌[13]和乳腺癌[9]组织中发现其低表达,并且在转基因小鼠[8]中的研究发现NEUROG3可调节胃黏膜细胞分化。以上发现均提示NEUROG3可能与肿瘤的发生发展相关。而NEUROG3与胃癌的关系,目前并无相关报道,我们的研究首次揭示了其在胃癌发生发展过程中的作用,为胃癌的早期诊断和治疗提供了新的靶点。
胃黏膜上皮的异常分化可表现为异常的肠化生,随着细胞的持续性增殖和异常分化加重,逐渐癌变,而随着胃癌的进展,胃型细胞向肠型细胞转化加重,分化程度降低[4-6]。本研究中,NEUROG3在胃癌组织、癌旁组织和肠化生胃黏膜组织中的表达是随着细胞分化程度的升高而增高的。并且,低分化程度的胃癌组织NEUROG3表达阳性率明显低于中高分化胃癌组织。进一步的分析表明,NEUROG3的表达与胃癌的淋巴结转移和肿瘤分期呈负相关。以上结果提示NEUROG3可能参与了胃癌细胞分化。而我们需要在胃癌细胞系中进一步验证。在不同分化程度的胃细胞系中,我们检测了NEUROG3的表达。结果提示,高分化的胃上皮细胞系和高分化胃癌细胞系中,NEUROG3的表达明显高于中低分化胃癌细胞系。同样提示其表达程度与胃癌细胞分化程度密切相关,这与临床组织样本的检测结果是一致的。大量研究显示,细胞异常分化和持续增殖是恶性肿瘤发生发展的早期事件,分化程度高的肿瘤侵袭性弱,预后好,而细胞分化程度低或无分化的肿瘤总体生存率明显降低[14-15]。以上结果提示NEUROG3的表达高低与胃癌的预后密切相关。
那么干扰NEUROG3的表达是否影响胃癌细胞的分化呢?既往的转基因小鼠中研究显示,敲除NEUROG3基因后,其胃腺上皮层内分泌细胞明显减少甚至缺失,并且胃黏膜上皮出现了异常分化及明显的肠化生[8]。在我们的细胞实验中,将强阳性表达NEUROG3的高分化胃癌细胞MKN-28沉默NEUROG3表达后,胃癌细胞出现形态明显缩小,核质比增大的去分化改变,并且代表细胞分化抑制的因子Id-1的表达也明显升高。这些结果均提示,抑制NEUROG3表达,可促进胃癌细胞的去分化。
既往报道,肿瘤细胞的增殖和转移与细胞分化程度同样密切相关,分化程度低的癌细胞,往往增殖和迁移侵袭能力较强[15]。因此,我们需要抑制胃癌细胞NEUROG3的表达,促进胃癌细胞去分化,探讨其对胃癌细胞增殖和迁移侵袭能力的影响。通过NEUROG3特异性shRNA抑制胃癌MKN-28细胞中NEUROG3的表达后,我们利用细胞增殖和迁移侵袭实验进行了验证。结果表明,NEUROG3的下调可不同程度的促进胃癌细胞的增殖、迁移和侵袭。
综上所述,本研究证实了NEUROG3在胃癌中低表达,在影响胃癌细胞分化和恶性表型中发挥重要作用。下一步我们将研究NEUROG3基因在胃癌中表达降低的机制,在体内实验中进一步探讨其在胃癌发生发展中的作用,使其有望成为胃癌早期诊断、判断预后和治疗靶点的新标志物。
| [1] |
RAHMAN R, ASOMBANG A W, IBDAH J A. Characteristics of gastric cancer in Asia[J]. World J Gastroenterol, 2014, 20(16): 4483-4490. DOI:10.3748/wjg.v20.i16.4483 |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
CARCAS L. Gastric cancer review[J]. J Carcinog, 2014, 13(1): 14. DOI:10.4103/1477-3163.146506 |
| [4] |
MILLS J C, ANDERSSON N, HONG C V, et al. Molecular characterization of mouse gastric epithelial progenitor cells[J]. Proc Natl Acad Sci USA, 2002, 99(23): 14819-14824. DOI:10.1073/pnas.192574799 |
| [5] |
LI W, GE Z, LIU C, et al. CIP2A is overexpressed in gastric cancer and its depletion leads to impaired clonogenicity, senescence, or differentiation of tumor cells[J]. Clin Cancer Res, 2008, 14(12): 3722-3728. DOI:10.1158/1078-0432.ccr-07-4137 |
| [6] |
TATEMATSU M, TSUKAMOTO T, INADA K. Stem cells and gastric cancer: role of gastric and intestinal mixed intestinal Metaplasia[J]. Cancer Sci, 2003, 94(2): 135-141. DOI:10.1111/j.1349-7006.2003.tb01409.x |
| [7] |
SOMMER L, MA Q, ANDERSON D J. Neurogenins, a novel family of atonal-related bHLH transcription factors, are putative mammalian neuronal determination genes that reveal progenitor cell heterogeneity in the developing CNS and PNS[J]. Mol Cell Neurosci, 1996, 8(4): 221-241. DOI:10.1006/mcne.1996.0060 |
| [8] |
LEE C S, PERREAULT N, BRESTELLI J E, et al. Neurogenin 3 is essential for the proper specification of gastric enteroendocrine cells and the maintenance of gastric epithelial cell identity[J]. Genes Dev, 2002, 16(12): 1488-1497. DOI:10.1101/gad.985002 |
| [9] |
ZHOU C, JIANG H M, ZHANG Z, et al. ZEB1 confers stem cell-like properties in breast cancer by targeting neurogenin-3[J]. Oncotarget, 2017, 8(33): 54388-54401. DOI:10.18632/oncotarget.17077 |
| [10] |
ZHANG J B, ZHANG H L, CHEN Y K, et al. Platelet-derived growth factor D promotes the angiogenic capacity of endothelial progenitor cells[J]. Mol Med Rep, 2019, 19(1): 125-132. DOI:10.3892/mmr.2018.9692 |
| [11] |
QU X L, AFELIK S, JENSEN J N, et al. Notch-mediated post-translational control of Ngn3 protein stability regulates pancreatic patterning and cell fate commitment[J]. Dev Biol, 2013, 376(1): 1-12. DOI:10.1016/j.ydbio.2013.01.021 |
| [12] |
MAGENHEIM J, KLEIN A M, STANGER B Z, et al. Ngn3(+) endocrine progenitor cells control the fate and morphogenesis of pancreatic ductal epithelium[J]. Dev Biol, 2011, 359(1): 26-36. DOI:10.1016/j.ydbio.2011.08.006 |
| [13] |
NAGARAJA P, PARASHIVAMURTHY K, SIDNAL N, et al. Analysis of gene expression on ngn3 gene signaling pathway in endocrine pancreatic cancer[J]. Bioinformation, 2013, 9(14): 739-747. DOI:10.6026/97320630009739 |
| [14] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the nextgeneration[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [15] |
SU S S, HONG F, LIANG Y L, et al. Lgr5 methylation in cancer stem cell differentiation and prognosis-prediction in colorectal cancer[J]. PLoS ONE, 2015, 10(11): e0143513. DOI:10.1371/journal.pone.0143513 |



