2. 400016 重庆,重庆医科大学附属第二医院三腺外科
2. Department of Thyroid, Pancreatic and Breast Surgery, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
乳腺癌是全球高发的疾病,HER2阳性是乳腺癌预后不良的独立指标。针对HER2的靶向治疗给HER2阳性的乳腺癌患者预后带来明显改善。目前针对HER2的靶向药物主要包括两大类:①针对胞外结构域的单克隆抗体类,如曲妥珠单抗、帕妥珠单抗及抗体-药物结合体T-DM1;②针对胞内酪氨酸激酶结构域的酪氨酸激酶抑制剂,如拉帕替尼、诺拉替尼及阿法替尼等。其中曲妥珠单抗作为最早的抗HER2抗体,在HER2靶向治疗中应用最为广泛和成熟[1]。尽管针对HER2的靶向治疗给患者的预后带来了极大改善,但治疗后的继发性耐药或部分患者原发性的耐药仍然是患者获益的瓶颈。拉帕替尼是2007年3月美国FDA批准上市的小分子酪氨酸激酶抑制剂,作为HER1/HER2双靶点抑制剂,单药作为一线治疗,有效率可达到28%。与卡培他滨联合治疗晚期或转移性乳腺癌,可明显延长疾病进展时间和无疾病进展时间。尤其是当其在曲妥珠单抗治疗失败后作为二线药物治疗时,仍具有8%的有效率。尽管治疗的效果是令人振奋的,但大部分患者依然会对拉帕替尼的治疗产生耐药[2]。耐药性的产生依然是拉帕替尼治疗失败的主要原因。因此,研究拉帕替尼耐药的机制,为临床治疗和预测提供新的靶向,成为当前急需解决的问题。
YAP是Hippo信号通路中的关键因子。该信号通路通过调节细胞的生长、增殖和凋亡,主要参与调控器官大小和组织再生,在胚胎发育和组织器官形成等过程中具有重要作用。YAP的表达异常与多种肿瘤的发生、发展及耐药相关。GUJRAL等[3]研究发现,Hippo信号通路与吉西他滨等细胞毒性药物的耐药有关;上调YAP可引起乳腺癌和卵巢癌细胞对化疗药物紫杉醇和顺铂的耐药性[4-5]。其机制可能与促进EGFR的过表达有关[6]。在非小细胞肺癌中,YAP可促进酪氨酸激酶抑制剂厄洛替尼(erlotinib)耐药的产生,以干扰RNA抑制非小细胞肺癌中YAP的表达,有利于逆转厄洛替尼的耐药[7]。但在乳腺癌中,靶向HER2的酪氨酸激酶抑制剂拉帕替尼耐药中有无YAP的异常尚不清楚。因此,本研究采用逐步增加剂量法与高浓度反复间歇诱导的方法诱导乳腺癌细胞株Skbr3对拉帕替尼耐药,并利用该耐药细胞株探讨Hippo信号通路的关键因子YAP在耐药中的作用及机制,为临床对拉帕替尼耐药的治疗提供新的靶点和思路。
1 材料与方法 1.1 材料拉帕替尼(lapatinib)购自德诺和生物公司,维替泊芬(vertepovfin)购自美国Selleck公司,CCK-8试剂(CK04)购自日本同仁公司,二甲基亚砜(dimethyl sulfoxide,DMSO;C2H6SO)购自碧云天生物技术研究所,SYBR荧光定量PCR试剂盒、逆转录试剂盒均购自TaKaRa公司,BCA蛋白定量试剂盒(00121506)购自康为世纪公司,SDS-PAGE凝胶速配试剂盒(L00670-50T)购自金斯瑞生物科技公司,抗体均购自Abways Technology公司,超敏ECL化学发光检测试剂盒(EL0511005)购自爱必信(上海)生物科技有限公司。
1.2 细胞培养人乳腺癌细胞株Skbr3购自美国ATCC公司。用含有10%胎牛血清的DMEM培养,置于37 ℃、5% CO2的细胞培养箱中培养。0.25%胰蛋白酶消化传代,每3天传代1次,倒置显微镜下观察细胞形态。
1.3 耐药细胞模型的建立通过药物浓度递增与高浓度反复间歇诱导的方法建立乳腺癌拉帕替尼耐药模型。将Skbr3细胞接种于10%胎牛血清的DMEM培养基中培养,24 h后待细胞贴壁生长状态良好时加入拉帕替尼药物,作用48 h后更换为不含拉帕替尼药物的培养基培养,待细胞生长融合度约为80%时进行传代处理,再次重复以上加药培养过程。拉帕替尼作用浓度依次为:0.25、0.5、0.75、1.0、2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0、22.5、25.0 μmol/L。期间间歇使用高浓度冲击(20 μmol/L)。历时7个月,Skbr3细胞基本可以在含拉帕替尼药物浓度为25.0 μmol/L的培养基中稳定生长和传代。即耐药模型建立成功,将此耐药细胞命名为Skbr3-LR。
1.4 CCK-8分析细胞药物敏感性改变分别将处于对数生长期的Skbr3亲本细胞(Skbr3)和耐药细胞(Skbr3-LR)按8×103/孔接种于96孔板,100 μL培养液,设置3个复孔。待细胞完全贴壁后,按倍比稀释依次加入不同浓度的拉帕替尼。加药期间观察细胞形态,48 h后行CCK-8检测。每孔加入CCK-8溶液10 μL,37 ℃孵育2~3 h,酶标仪测定波长450 nm处光密度值[D(450)]。3次独立读取后取平均值,绘制细胞增殖曲线,GraphPad Prism 5.0软件计算各组IC50。
将处于对数生长期的Skbr3耐药细胞接种于96孔板,待细胞完全贴壁后,将细胞分为2组,一组按倍比稀释依次加入不同浓度的拉帕替尼(Skbr3-LR组)。另一组同时加入维替泊芬10 μmol/L(Skbr3-LR+V组),48 h后行CCK-8检测。方法同上。
1.5 结晶紫染色实验分别将处于对数生长期的Skbr3亲本细胞和耐药细胞接种于6孔板,密度约30%。待细胞贴壁后,分别加入终浓度为40、80 μmol/L的拉帕替尼和空白DMSO组。培养3~5 d后,小心吸弃培养孔中的液体,PBS洗2遍,加入结晶紫溶液常温染色。
将处于对数生长期的Skbr3耐药细胞接种于6孔板,密度约30%。待细胞贴壁后,将细胞分为2组,一组加入终浓度为40、80 μmol/L的拉帕替尼和空白DMSO组。另一组同时加入维替泊芬10 μmol/L,培养3~5 d后,结晶紫溶液常温染色。方法同上。
1.6 平板克隆形成实验同上,将处于对数生长期的Skbr3亲本细胞和耐药细胞接种于6孔板,密度约10%。待细胞贴壁后,加入相应药物,每隔3 d换液1次,并持续维持药物浓度。培养2周后,结晶紫染色并进行细胞克隆计数。
1.7 定量PCR分析分别提取对数生长期的Skbr3亲本细胞和耐药细胞总RNA,逆转录获cDNA。检测两组细胞上皮-间质化指标的改变,YAP/TAZ及Cyr61的表达。
1.8 Western blot检测分别提取Skbr3亲本细胞、耐药细胞及耐药细胞加维替泊芬处理组总蛋白,BCA法测定蛋白浓度,按照30 ng上样量进行SDS-PAGE凝胶电泳。电泳结束后湿转至PVDF膜上,用5%脱脂牛奶TBST进行封闭,封闭时间2 h。封闭结束后加入一抗(YAP、p-YAP)孵育过夜。TBST漂洗3遍后,加入二抗,常温孵育2 h后用凝胶成像仪曝光分析条带。
1.9 统计学分析采用GraphPad Prism 5.0和SPSS 20.0进行统计分析。试验均重复3次,数据以x±s表示。多组均数比较采取单因素方差分析,两组均数比较采取t检验。检验水准α=0.05。
2 结果 2.1 对拉帕替尼耐药的乳腺癌细胞株模型鉴定通过药物浓度递增与高浓度反复间歇诱导的方法,建立了较稳定的乳腺癌拉帕替尼耐药模型(图 1A),命名为Skbr3-LR,结晶紫染色及克隆形成实验结果显示,与亲本细胞比较,在致死浓度拉帕替尼的处理下,耐药模型中存活的细胞数明显增加(图 1C、D)。CCK-8检测结果显示,随着拉帕替尼浓度的升高,细胞存活的比例逐渐降低;与亲本细胞比较,耐药模型下降的速度较慢,对拉帕替尼的敏感性降低(图 1B)。经GraphPad Prim 5.0计算,Skbr3的拉帕替尼IC50为3.61 μmol/L,Skbr3-LR的IC50为29.26 μmol/L,耐药倍数约为8倍。
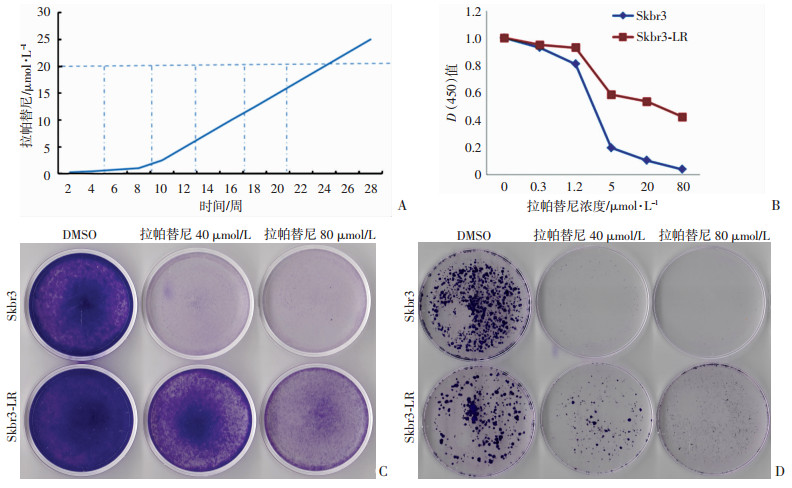
|
| A:以药物浓度递增与高浓度反复间歇诱导的方法建立乳腺癌拉帕替尼耐药模型;B:不同浓度拉帕替尼处理48 h后Skbr3和Skbr3-LR细胞活性;C、D:结晶紫染色及克隆形成实验检测致死浓度拉帕替尼处理Skbr3和Skbr3-LR细胞后存活情况 图 1 耐药细胞株Skbr3-LR的鉴定 |
2.2 定量PCR检测耐药细胞株中上皮-间质转化相关指标的改变
挑取上皮-间质转化常用指标E-cadherin、Twist、Vinemtin和N-cadherin用定量PCR做初步检测。结果可见,与亲本细胞Skbr3比较,耐药细胞株的上皮标志物E-cadherin表达显著降低,而间质标志物Twist、Vinemtin和N-cadherin表达显著上升(P < 0.05,图 2)。提示耐药株有上皮间质转化。

|
| a:P < 0.05,与Skbr3比较 图 2 定量PCR检测EMT标志物的表达 |
2.3 耐药模型Hippo信号通路中关键效应因子的检测
PCR结果显示,与亲本细胞比较,耐药细胞中YAP和TAZ的表达显著上升,YAP的下游基因CYR61表达也显著升高(P < 0.05,图 3A)。Western blot结果可见,耐药细胞株中总YAP及磷酸化YAP蛋白的表达均显著上升(P < 0.05,图 3B、C)。

|
| A:定量PCR检测亲本和耐药细胞株中YAP/TAZ/CYR61的表达;B、C:Western blot检测亲本和耐药细胞株中YAP和磷酸化YAP的表达及半定量分析 a:P < 0.05,与Skbr3比较 图 3 定量PCR和Western blot检测YAP的表达 |
2.4 维替泊芬处理后,耐药细胞株对拉帕替尼敏感性的改变
将耐药细胞株分为2组:拉帕替尼处理(Skbr3-LR)组和维替泊芬+拉帕替尼处理(Skbr3-LR+V)组。CCK-8结果显示,以维替泊芬处理后,耐药株对拉帕替尼的敏感性重新升高,其IC50值从11.25 μmol/L逆转到2.98 μmol/L (图 4A)。结晶紫染色结果可见,以维替泊芬处理后,在高浓度拉帕替尼培养基中存活的细胞数量明显降低(图 4B)。定量PCR和Western blot结果显示,YAP表达显著降低(P < 0.05,图 4C、D)。
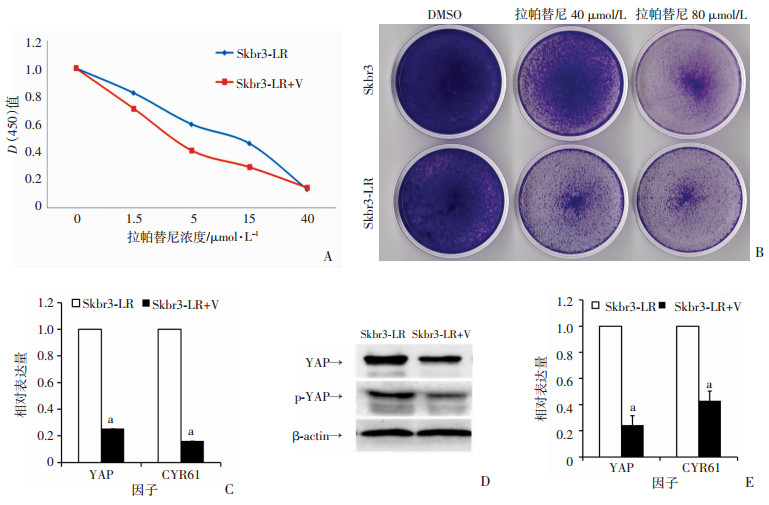
|
| A:CCK-8测定48 h后两组细胞活性;B:结晶紫染色检测两组存活细胞;C:定量PCR检测细胞中YAP/CYR61的表达;D、E:Western blot检测细胞中YAP和磷酸化YAP的表达及半定量分析 a:P < 0.05,与Skbr3-LR比较 图 4 维替泊芬对耐药细胞Skbr3-LR耐药性的影响 |
3 讨论
YAP作为高度保守的Hippo信号通路关键效应因子,因其与多种恶性肿瘤的发生、发展密切相关,近年来引起了人们广泛的关注,成为研究的热点。哺乳动物Hippo信号通路主要由4部分组成:①多重上游信号输入因子,包括Fat4、Dchs1/2、FRMD6、NF2和KIBRA;②核心激酶级联反应链,包括MST1/2、hSAV1、LATS1/2和MOB1[8];③下游转录共激活因子,包括YAP/TAZ和TEAD[9];④下游调节因子,包括RASSFs、ASPP1/2和Ajuba。在上游信号输入因子的作用下, MST1/2被活化,然后依次磷酸化hSAV1、LATS1/2与MOB1,并相互结合形成聚合物,促进YAP/TAZ磷酸化并停留在细胞质中。一方面,磷酸化的YAP/TAZ与细胞质中的14-3-3蛋白结合,抑制YAP/TAZ的促增殖和抗凋亡活性,从而促进细胞凋亡;另一方面,磷酸化的YAP/TAZ可能被泛素化降解[10]。如果MST1/2-YAP/TAZ信号通路被阻断或失活,YAP/TAZ不能被磷酸化,未被磷酸化的YAP/TAZ迁移进入细胞核,并与TEAD等转录因子结合,促进下游Cyclin E、AXL、CTGF和Cyr61等靶基因的表达,从而启动YAP/TAZ的促增殖和抗凋亡活性,促进细胞增殖。
在多种肿瘤的发生中,可以观察到YAP表达的异常。YAP在非小细胞肺癌标本中高表达,并且与肿瘤分期和淋巴结转移显著相关[11-12],YAP对肺癌细胞的调控可能与线粒体应激有关[13]。胃癌中,升高的SOX9可促进YAP的表达,并增加胃癌细胞的上皮-间质转化[14]。基因敲除YAP/TAZ的表达可降低癌细胞的迁移及裸鼠体内肿瘤的形成[15]。乳腺癌的发生与Hippo信号通路密切相关。Hippo通路中Lats表达下调可导致乳腺癌侵袭性因素增多,如:肿瘤体积增大,淋巴结转移增多,雌、孕激素受体阴性表达[16]。Lats1/2的低表达甚至缺失会强化乳腺癌细胞的增殖能力,提高管腔型乳腺癌侵袭性,可能是乳腺恶性肿瘤发生、发展的关键要素之一,有望成为乳腺癌治疗的新靶点[17]。但Hippo信号通路关键效应因子YAP和TAZ在乳腺癌中的表达却充满争议。WANG等[18]通过免疫组化检测乳腺癌标本,显示乳腺癌中YAP表达升高,认为YAP是原癌基因。但更多的研究显示,乳腺癌中YAP表达较癌旁组织降低,YAP在乳腺癌中作为抑癌基因存在。我们总结了近年来关于乳腺癌标本中YAP或TAZ表达的文献,发现多检测总的YAP表达,并没有检测YAP在胞质和胞核的分布比率。而YAP蛋白在胞质和胞核中具有不同的功能,这也是我们下一步要研究的方向。
YAP蛋白不仅与肿瘤发生相关,也与肿瘤耐药有关。研究发现,不仅在吉西他滨、紫杉醇和顺铂等化疗药物的耐药中YAP表达异常,在非小细胞肺癌酪氨酸激酶抑制剂厄洛替尼的耐药中,也可观察到YAP上调,以干扰RNA抑制非小细胞肺癌中YAP的表达,有利于逆转厄洛替尼的耐药[7]。在ALK基因重排的肺癌细胞中,靶向YAP可逆转ALK抑制剂的获得性耐药[19]。同时,YAP可促进PD1/PD-L1的表达,导致肿瘤细胞在免疫治疗中逃逸,也是导致靶向治疗耐药的重要原因[20];在BRAFi耐药的黑色素瘤中也观察到类似的结果[21]。但乳腺癌拉帕替尼耐药的机制中有无YAP的参与尚不清楚。本研究采用逐步增加剂量与高浓度反复间歇诱导的方法构建了拉帕尼替耐药细胞株,结晶紫染色和克隆形成实验均可见在高浓度的拉帕替尼作用下,耐药株对拉帕替尼的敏感性明显降低;细胞增殖实验显示,随着拉帕替尼浓度的增加,细胞增殖速度明显降低,但与亲本细胞相比,拉帕替尼对耐药株的抑制率降低。证明Skbr3耐药株构建成功。本研究结果显示,代表间质化的指标Twist、Vinemtin和N-cadherin在耐药株中表达上升,而上皮标志物E-cadherin在耐药株中表达下降,提示耐药细胞发生了上皮-间质化转变;与亲本细胞相比,耐药株中YAP的表达上升明显;进一步Western blot检测YAP结果与PCR结果一致,但和我们预期不同的是不仅总的YAP蛋白表达上升,磷酸化YAP表达也上升。既往研究显示,磷酸化YAP不稳定,不能进入细胞核诱导细胞的增殖,相反,磷酸化的YAP很容易在胞质中被泛素化降解。也有研究提示,磷酸化的YAP在胞质中有抗凋亡的作用。下一步我们将探讨其原因。维替泊芬可阻断YAP蛋白与下游TEAD的结合,从而阻止下游通路的激活。研究发现,Cyr61是YAP的下游基因,沉默YAP的表达可抑制Cyr61的表达水平,从而导致肝细胞的增殖障碍[22]。以维替泊芬处理耐药细胞株后,可以观察到YAP表达的下调及下游靶基因Cyr61表达的下调,说明维替泊芬可以有效阻断该通路的激活。CCK-8结果显示,维替泊芬处理后耐药细胞株对拉帕替尼的敏感性重新增加,进一步证实在乳腺癌拉帕替尼耐药的过程中有YAP的参与。本研究为临床拉帕替尼耐药的治疗提供了新的靶点和思路。
| [1] |
CAMERON D, PICCART-GEBHART M J, GELBER R D, et al. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial[J]. Lancet, 2017, 389(10075): 1195-1205. DOI:10.1016/S0140-6736(16)32616-2 |
| [2] |
PARONI G, FRATELLI M, GARDINI G, et al. Synergistic antitumor activity of lapatinib and retinoids on a novel subtype of breast cancer with coamplification of ERBB2 and RARA[J]. Oncogene, 2012, 31(29): 3431-3443. DOI:10.1038/onc.2011.506 |
| [3] |
GUJRAL T S, KIRSCHNER M W. Hippo pathway mediates resistance to cytotoxic drugs[J]. Proc Natl Acad Sci USA, 2017, 114(18): E3729-E3738. DOI:10.1073/pnas.1703096114 |
| [4] |
SONG Q H, MAO B B, CHENG J B, et al. YAP enhances autophagic flux to promote breast cancer cell survival in response to nutrient deprivation[J]. PLoS ONE, 2015, 10(3): e0120790. DOI:10.1371/journal.pone.0120790 |
| [5] |
JEONG W, KIM S B, SOHN B H, et al. Activation of YAP1 is associated with poor prognosis and response to taxanes in ovarian cancer[J]. Anticancer Res, 2014, 34(2): 811-817. |
| [6] |
SONG S M, HONJO S, JIN J K, et al. The hippo coactivator YAP1 mediates EGFR overexpression and confers chemoresistance in esophageal cancer[J]. Clin Cancer Res, 2015, 21(11): 2580-2590. DOI:10.1158/1078-0432.CCR-14-2191 |
| [7] |
HSU P C, YOU B, YANG Y L, et al. YAP promotes erlotinib resistance in human non-small cell lung cancer cells[J]. Oncotarget, 2016, 7(32): 51922-51933. DOI:10.18632/oncotarget.10458 |
| [8] |
LIU H R, DU S Y, LEI T T, et al. Multifaceted regulation and functions of YAP/TAZ in tumors (Review)[J]. Oncol Rep, 2018, 40(1): 16-28. DOI:10.3892/or.2018.6423 |
| [9] |
HONG W J, GUAN K L. The YAP and TAZ transcription co-activators: key downstream effectors of the mammalian Hippo pathway[J]. Semin Cell Dev Biol, 2012, 23(7): 785-793. DOI:10.1016/j.semcdb.2012.05.004 |
| [10] |
HANSEN C G, NG Y L, LAM W L, et al. The Hippo pathway effectors YAP and TAZ promote cell growth by modulating amino acid signaling to mTORC1[J]. Cell Res, 2015, 25(12): 1299-1313. DOI:10.1038/cr.2015.140 |
| [11] |
XIE M, ZHANG L, HE C S, et al. Prognostic significance of TAZ expression in resected non-small cell lung cancer[J]. J Thorac Oncol, 2012, 7(5): 799-807. DOI:10.1097/JTO.0b013e318248240b |
| [12] |
WANG Y, DONG Q Z, ZHANG Q F, et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer[J]. Cancer Sci, 2010, 101(5): 1279-1285. DOI:10.1111/j.1349-7006.2010.01511.x |
| [13] |
ZHOU J Y, ZHANG S Z, LI Z J, et al. Yap-Hippo promotes A549 lung cancer cell death via modulating MIEF1-related mitochondrial stress and activating JNK pathway[J]. Biomedecine Pharmacother, 2019, 113: 108754. DOI:10.1016/j.biopha.2019.108754 |
| [14] |
ZHOU H L, LI G Q, HUANG S, et al. SOX9 promotes epithelial-mesenchymal transition via the Hippo-YAP signaling pathway in gastric carcinoma cells[J]. Oncol Lett, 2019, 18(1): 599-608. DOI:10.3892/ol.2019.10387 |
| [15] |
KARPOWICZ P, PEREZ J, PERRIMON N. The Hippo tumor suppressor pathway regulates intestinal stem cell regeneration[J]. Development, 2010, 137(24): 4135-4145. DOI:10.1242/dev.060483 |
| [16] |
VISSER S, YANG X L. LATS tumor suppressor: A new governor of cellular homeostasis[J]. Cell Cycle, 2010, 9(19): 3892-3903. DOI:10.4161/cc.9.19.13386 |
| [17] |
COOPER J, GIANCOTTI F G. Cancer: a new role for non-canonical Hippo signaling[J]. Cell Res, 2017, 27(4): 459-460. DOI:10.1038/cr.2017.27 |
| [18] |
WANG X D, SU L L, OU Q S. Yes-associated protein promotes tumour development in luminal epithelial derived breast cancer[J]. Eur J Cancer, 2012, 48(8): 1227-1234. DOI:10.1016/j.ejca.2011.10.001 |
| [19] |
YUN M R, CHOI H M, LEE Y W, et al. Targeting YAP to overcome acquired resistance to ALK inhibitors in ALK-rearranged lung cancer[J]. EMBO Mol Med, 2019, 11(12): e10581. DOI:10.15252/emmm.201910581 |
| [20] |
LEE B S, PARK D I, LEE D H, et al. Hippo effector YAP directly regulates the expression of PD-L1 transcripts in EGFR-TKI-resistant lung adenocarcinoma[J]. Biochem Biophys Res Commun, 2017, 491(2): 493-499. DOI:10.1016/j.bbrc.2017.07.007 |
| [21] |
KIM M H, KIM C G, KIM S K, et al. YAP-induced PD-L1 expression drives immune evasion in BRAFi-resistant melanoma[J]. Cancer Immunol Res, 2018, 6(3): 255-266. DOI:10.1158/2326-6066.CIR-17-0320 |
| [22] |
MOORING M, FOWL B H, LUM S Z C, et al. Hepatocyte stress increases expression of YAP and TAZ in hepatocytes to promote parenchymal inflammation and fibrosis[J]. Hepatology, 2019. DOI:10.1002/hep.30928 |



