2. 400016 重庆, 重庆医科大学:公共卫生与管理学院营养与食品卫生学教研室;
3. 400016 重庆, 重庆医科大学:附属第一医院重大代谢性疾病转化医学重点实验室
2. Department of Nutrition and Food Hygiene, School of Public Health and Management, Chongqing Medical University, Chongqing, 400016, China;
3. Key Laboratory of Translational Medicine in Major Metabolic Diseases, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
肺癌是全球高发的恶性肿瘤,且位于癌症死因首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌发病总数约85% [1]。在2014年,我国约有78.2万人被诊断为肺癌,而因肺癌死亡的则高达62.6万人[2]。NSCLC患者约有65%在确诊时已是晚期肺癌或伴随癌细胞转移,而转移正是造成患者死亡的重要原因之一[3]。目前临床常用的治疗肺癌的方法仍是手术与化疗,但效果并不理想,患者的5年生存率小于16%[4-5]。因此研究肺癌的相关转移机制,对肺癌患者的预后具有重要的现实意义。
目前能量代谢的改变已成为肿瘤发病的新标志,肥胖、脂肪因子与肿瘤的相关性也得到进一步验证[6]。瘦素是由白色脂肪细胞合成分泌的蛋白质,在肥胖个体中高表达,已被证实参与肿瘤细胞增殖、侵袭及迁移的关键步骤,调节肿瘤微环境,被认为是肥胖相关癌症(如乳腺癌、结肠癌等)的中间体[7-8]。已有报道瘦素可促进肺癌细胞增殖[9],但瘦素在肺癌细胞迁移中的作用及其相关机制尚未得到深入研究。葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)又称热休克蛋白家族A成员5(heat shock protein family a member 5, HSPA5),位于所有真核生物的内质网膜上,在蛋白折叠和成熟中起着至关重要的作用[10]。研究表明GRP78参与肿瘤发生、发展、迁移、侵袭并与耐药相关[11-12]。临床证据表明,GRP78在非小细胞肺癌患者中表达,并在晚期肺癌中高度富集,可能是肺癌中独立的不良预后因素[13-14]。研究表明瘦素在神经细胞中可以促进GRP78表达[15]。因此,本研究拟探讨瘦素是否通过PI3K/mTOR/STAT3信号通路调节肺癌细胞内GRP78的表达进而影响细胞迁移,为肺癌防治提供新思路。
1 材料与方法 1.1 细胞系与试剂人肺腺癌细胞株A549购自美国菌种保藏库(American Type Culture Collection, ATCC),人大细胞肺癌细胞株NCI-H460购自中国科学院上海生命科学研究院细胞库,均由北京阅微基因技术有限公司鉴定成功。细胞培养所用RPMI1640(SH30809.01),青霉素-链霉素双抗溶液(SV30010)购自HyClone公司,胎牛血清(04-001-1A)购自BI公司, 重组人类瘦素(398-LP)购自RD systems公司,GRP78靶向抑制剂HA15(HY-100437)购自MCE公司,PI3K靶向抑制剂Ly294002(S1737)购自碧云天公司,mTOR靶向抑制剂雷帕霉素(A606203)购自生工生物工程公司,PMSF蛋白酶抑制剂(ST506)购自碧云天公司,Western blot与免疫荧光所用Ⅰ抗β-actin(TA-09)购自中杉金桥公司,mTOR(2972S)购自CST公司,STAT3(BM4170)购自博士德公司,GRP78由重庆医科大学感染性疾病分子生物学教育部重点实验室汪德强教授惠赠。Western blot所用Ⅱ抗均购自中杉金桥公司,免疫荧光Ⅱ抗山羊抗小鼠IgG/FITC标记(ZF-0312)购自中杉金桥公司,细胞核染液DAPI(C1006)购自碧云天公司。
1.2 肺癌患者生存曲线分析登陆GEPIA(http://gepia.cancer-pku.cn/)网站,输入基因名HSPA5、LEP(Leptin, 瘦素),癌症类型选择肺腺癌与肺鳞癌,点击生存曲线分析,即可得到HSPA5即GRP78高表达与低表达肺癌患者与瘦素高表达与低表达肺癌患者的生存曲线分析结果。
1.3 细胞培养A549与H460细胞系均培养于含10%胎牛血清、1%青霉素-链霉素双抗溶液的RPMI1640培养液,放置于37 ℃,5% CO2,相对湿度95%的培养箱中培养,细胞贴壁生长,每2~3天传代,实验均采用对数生长期的细胞。
1.4 细胞划痕实验将肺癌细胞A549与H460以2×105/mL(每孔1 mL)分别接种至6孔板内,待细胞贴壁生长后用无血清培养液RPMI1640饥饿12 h,作划痕处理。对照组采用无血清RPMI1640培养,瘦素组采用100 ng/mL瘦素培养,HA15组采用10 μmol/L HA15培养,瘦素+HA15组采用100 ng/mL瘦素与10 μmol/L HA15共同培养,用无血清培养液RPMI进行稀释。在划痕后0、48 h分别拍照,使用图像分析软件Image J分析划痕弥合率。
1.5 细胞荧光将爬片置于底部划线的6孔板内,细胞以2×105/mL(每孔1 mL)铺板,待细胞贴壁后饥饿12 h,对照组采用无血清RPMI1640培养,瘦素组用含100 ng/mL瘦素的RPMI1640培养,48 h后取出6孔板去除培养液,4%多聚甲醛室温固定20 min,随后用100%甲醇于-20 ℃透化10 min,山羊血清室温封闭1 h,GRP78抗体4 ℃孵育过夜。第2日将爬片取出复温,选择对应种属的FITC-Ⅱ抗37 ℃避光孵育1 h,DAPI染核5 min,抗荧光淬灭剂封片后在荧光显微镜下观察。
1.6 Western blot检测将肺癌细胞A549以2×105/mL(每孔1 mL)分别接种至6孔板内,待细胞贴壁生长后用无血清培养液RPMI1640饥饿12 h,对照组采用无血清RPMI1640培养,Ly294002组采用20 mmol/L Ly294002培养,雷帕霉素组采用100 ng/mL雷帕霉素培养,瘦素组采用100 ng/mL瘦素培养,瘦素+Ly294002组采用20 mmol/L Ly294002与100 ng/mL瘦素共同培养,瘦素+雷帕霉素组采用100 ng/mL雷帕霉素与100 ng/mL瘦素共同培养,用无血清培养液RPMI进行稀释。48 h后用RIPA裂解缓冲液与PMSF蛋白酶抑制剂提取细胞全蛋白,BCA法测定蛋白质浓度。采用10%或12%的分离胶,样品上样量30~40 μg,采用0.45 μm PVDF膜湿转,5%脱脂奶粉37 ℃摇床封闭1 h。用相应的Ⅰ抗与Ⅱ抗孵育该膜,TBST洗涤后用化学发光液孵育条带,在Fusion Fx5化学发光检测仪(Vilber)中进行显色,条带以ImageJ软件进行定量分析。
1.7 统计学分析数据以x±s表示,采用SPSS 17.0统计学软件,两组间差异采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准:α=0.05, 实验均独立重复至少3次。
2 结果 2.1 Leptin与GRP78高表达预示不良预后利用GEPIA网站(http://gepia.cancer-pku.cn/),分析来自于TCGA数据库的肺癌患者相关数据,结果发现瘦素(图 1A)与GRP78(图 1B)高表达患者的总生存率与低表达患者相比显著下降(P < 0.05),说明Leptin与GRP78高表达预示肺癌预后不良。
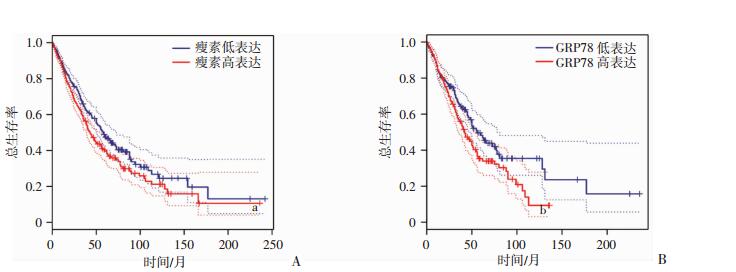
|
| A:瘦素高表达和低表达肺癌患者的生存曲线分析a:P < 0.05,与瘦素低表达组比较;B:GRP78高表达和低表达肺癌患者的生存曲线分析b:P < 0.05,与GRP78低表达组比较 图 1 瘦素(A)与GRP78(B)表达水平与肺癌患者总生存率 |
2.2 瘦素促进肺癌细胞迁移
划痕实验结果显示,当用100 ng/mL Leptin分别处理肺癌细胞A549与H460 48 h后,与对照组相比,A549细胞瘦素处理组划痕弥合率平均升高27%(图 2A),H460细胞瘦素处理组划痕弥合率平均升高22%(图 2B),说明Leptin可显著促进肺癌细胞A549(P < 0.01)与H460(P < 0.05)迁移。
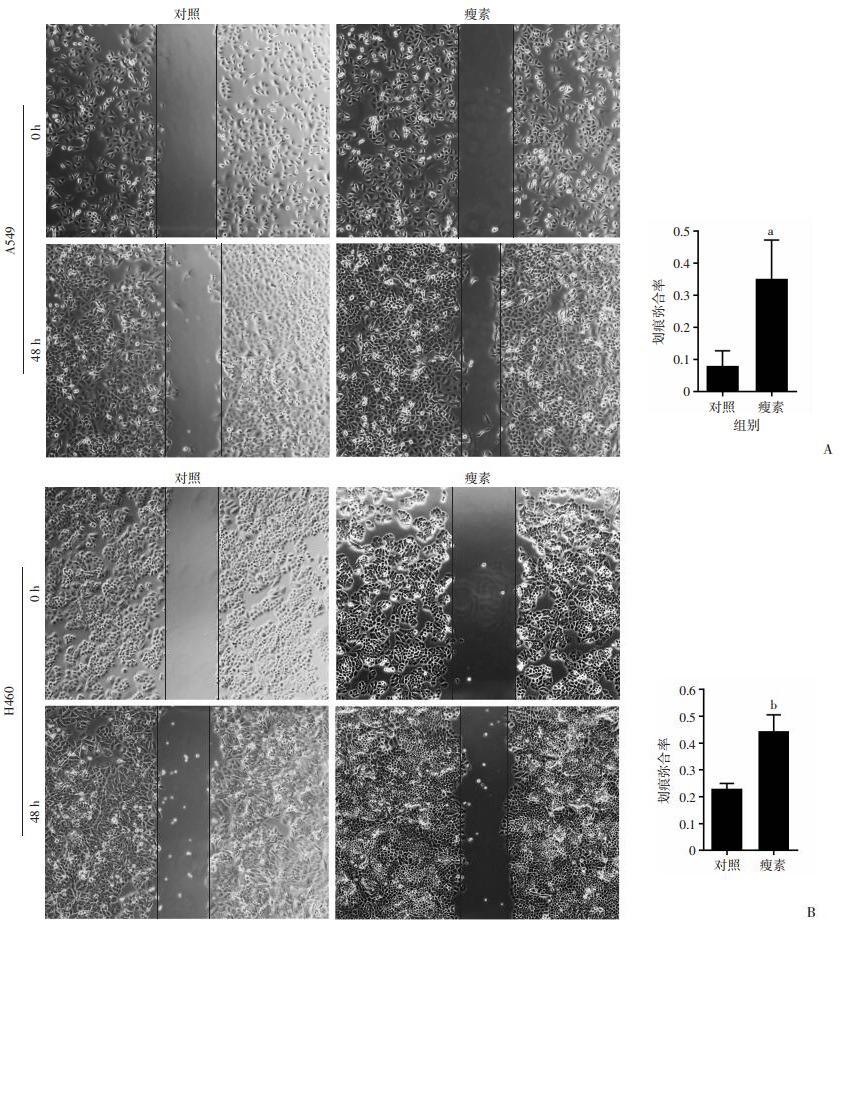
|
| a:P < 0.01,b:P < 0.05,与对照组比较 图 2 瘦素促进肺癌细胞A549(A ×100)与H460(B)迁移 |
2.3 瘦素促进肺癌细胞GRP78的表达
当100 ng/mL Leptin处理肺癌细胞A549与H460 48 h后,细胞荧光检测GRP78的表达,结果显示与对照组相比,瘦素处理48 h后A549(图 3A)与H460(图 3B)细胞GRP78荧光(绿色)均显著增强,并高于对照组(P < 0.01)。
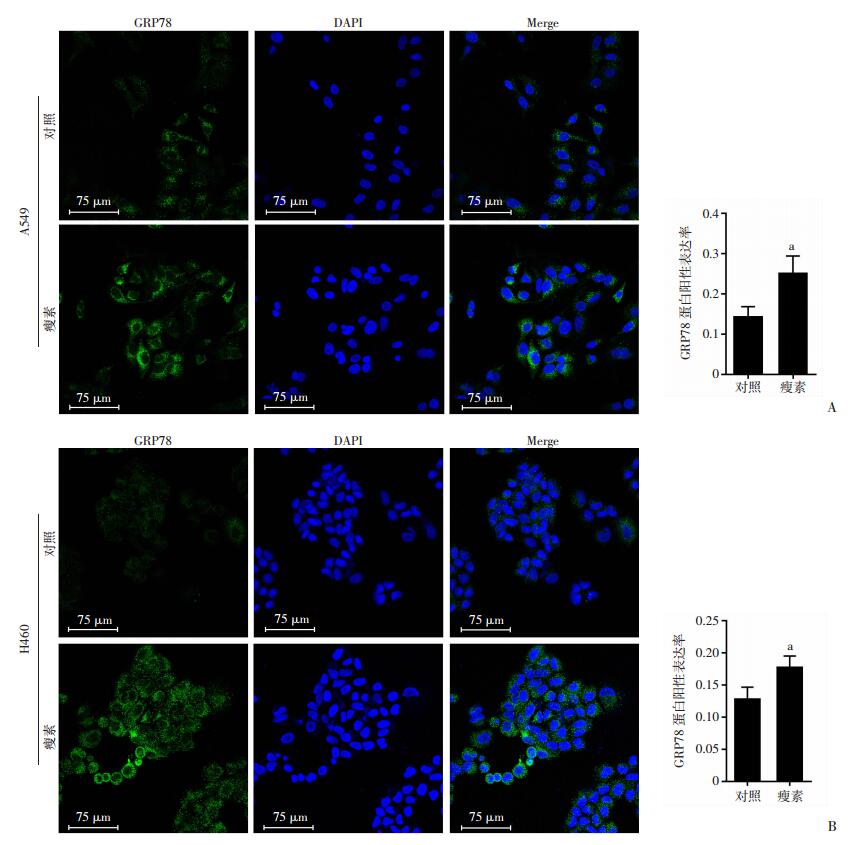
|
| A:A549细胞GRP78表达及半定量分析;B:H460细胞GRP78表达及半定量分析a:P < 0.05,与对照组比较 图 3 细胞荧光检测瘦素对肺癌细胞A549与H460中GRP78表达的影响 |
2.4 瘦素通过PI3K/Akt/mTOR通路调节GRP78的表达
为进一步探究Leptin促进GRP78表达的机制,采用PI3K靶向抑制剂Ly294002(20 mmol/L)单独处理或与100 ng/mL Leptin联合处理肺癌细胞A549 48 h,结果显示Ly294002单独处理后,mTOR、STAT3、GRP78的表达量较对照组均被显著抑制,而Ly294002与Leptin联合处理后,mTOR、STAT3、GRP78的表达量相对于Leptin单独处理组也显著下降(图 4A)。当用mTOR靶向抑制剂雷帕霉素(100 ng/mL)单独处理或联合Leptin(100 ng/mL)处理48 h后,结果显示当雷帕霉素单独处理时,STAT3、GRP78的表达量显著均低于对照组,而当雷帕霉素联合Leptin处理时,STAT3、GRP78的表达量显著低于Leptin单独处理组(图 4B)。该结果说明Leptin可能是通过PI3K/mTOR/STAT3通路促进A549细胞GRP78的表达。
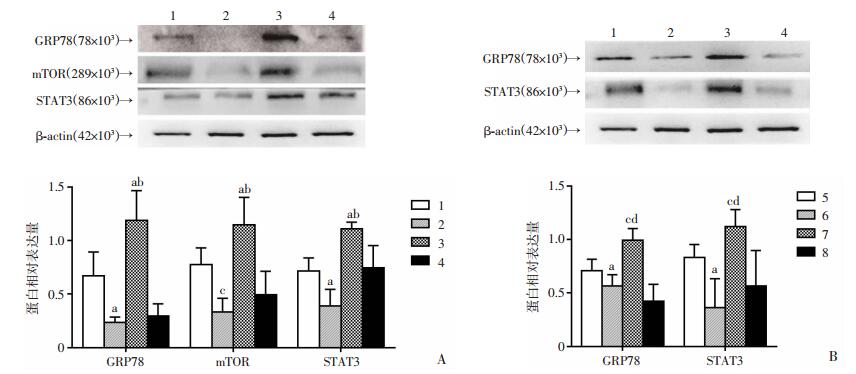
|
|
1、5:对照组;2:Ly294002组;3、7:瘦素组;4:瘦素+Ly294002组;6:雷帕霉素组;8:瘦素+雷帕霉素组;a:P < 0.05,与对照组比较,b:P < 0.05,与瘦素+Ly294002组比较,c:P < 0.01,与对照组比较,d:P < 0.05,与瘦素+雷帕霉素组比较 A:瘦素与PI3K对GRP78、mTOR、STAT3表达的影响及半定量分析;B:瘦素与mTOR对GRP78、STAT3表达的影响及半定量分析 图 4 Western blot检测瘦素通过PI3K/mTOR/STAT3通路上调A549中GRP78表达 |
2.5 GRP78参与Leptin促进肺癌细胞迁移
为探究GRP78在瘦素促进肺癌细胞迁移中的作用,将GRP78的靶向抑制剂HA15单独处理或与Leptin联合处理肺癌细胞A549(图 5),实验结果显示,HA15单独处理组划痕弥合率在A549细胞中显著低于对照组,而Leptin与HA15联合处理组的划痕弥合率显著低于Leptin单独处理组,说明靶向抑制GRP78影响Leptin对肺癌细胞A549迁移的促进作用,GRP78参与Leptin促进肺癌细胞迁移。
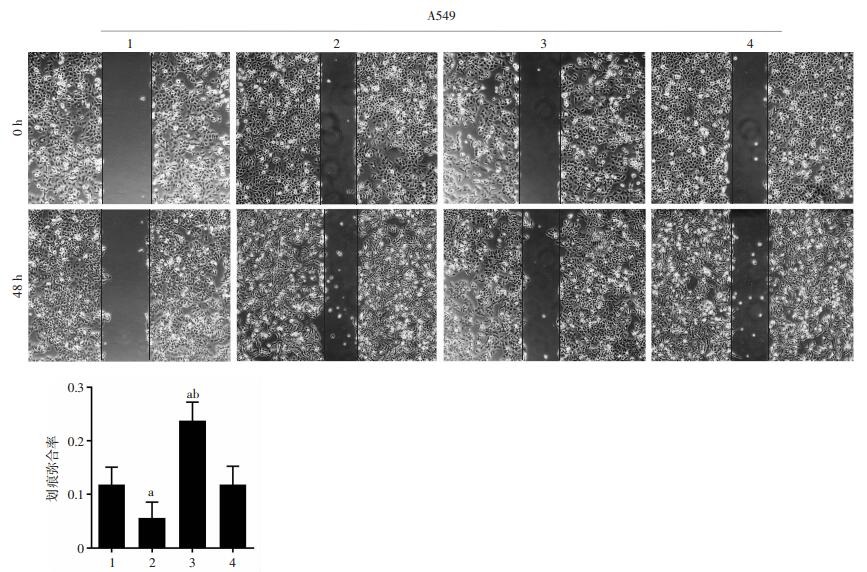
|
| 1:对照组;2:HA15组;3:瘦素组;4:瘦素+HA15组;a:P < 0.01,与对照组比较;b:P < 0.01,与瘦素+HA15组比较 图 5 靶向抑制GRP78减弱瘦素对肺癌细胞A549的促迁移作用(×100) |
3 讨论
肺癌作为全国乃至全球范围内发病率与死亡率最高的恶性肿瘤,近年来虽有靶向药物(如表皮生长因子受体-酪氨酸激酶抑制剂EGFR-TKI)面世,但NSCLC患者预后仍不理想。因此,探明NSCLC发生、发展机制对临床药物研发及临床治疗有积极意义。
瘦素作为较早发现的脂肪因子之一,已被证实与多种疾病相关,包括如乳腺癌、结肠癌等[16-17]。研究表明肺组织中的瘦素与肺癌进展之间存在显著相关性,可能与肺癌的发生和肿瘤的转移有关[18]。细胞和动物模型研究表明,瘦素可以增强多种恶性肿瘤(乳腺癌、结直肠癌、前列腺癌、胰腺癌和卵巢癌等)的生长与迁移[19]。但在人群研究中,血清瘦素与肺癌的关系却不一致[20-22]。本研究发现瘦素高表达与肺癌患者不良预后相关,并且瘦素可显著增强肺癌细胞A549与H460迁移。这提示瘦素可能会成为肺癌的一个不良预后指标。
GRP78是内质网中主要的分子伴侣蛋白,被视为是内质网应激的标志物,与多种疾病发生、发展相关,包括癌症、生殖系统、神经退行性病变等[23-24]。近期研究表明,GRP78高表达对多种癌症发生、发展有一定的促进作用,可促进癌细胞耐药性,而抑制GRP78可改善多种化疗药物疗效[25-27]。临床研究也表明,GRP78在非小细胞肺癌患者中表达,并在晚期肺癌中高度富集。这可能在NSCLC的癌变过程中发挥重要作用,并与不良预后相关[13]。本研究分析也证实GRP78高表达的肺癌患者总生存率显著低于低表达者。而用100 ng/mL瘦素处理肺癌细胞A549与H460 48 h后,GRP78表达量显著上升,且GRP78参与瘦素促进肺癌细胞迁移,小分子化合物抑制GRP78后瘦素的促迁移能力减弱。这提示瘦素可能通过调节GRP78的表达来促进肺癌细胞的迁移。
雷帕霉素(mTOR)是一种丝氨酸/苏氨酸激酶,位于PI3K/Akt通路的下游,在细胞的生长、增殖、调控细胞周期等多个方面发挥重要作用[28],PI3K/Akt/mTOR通路的失调与NSCLC的发展有关[29]。信号转导子和转录激活3(STAT3)因其在肿瘤细胞增殖、存活、侵袭和免疫抑制中的作用而闻名。STAT3的较高水平与肝癌、胃癌、神经胶质瘤和前列腺癌患者的整体生存密切相关[30]。近年来,研究表明STAT3的激活与肺癌的发生和发展密切相关[31-32]。PI3K / Akt / mTOR途径和STAT3途径均由肥胖相关因素(包括瘦素、脂联素和炎性细胞因子)介导,并且在许多与肥胖相关的癌症类型的发展中起重要作用,包括乳腺癌、前列腺癌、结肠癌等[33-34]。本研究发现,瘦素通过激活PI3K/mTOR/STAT3途径参与肺癌细胞A549中内质网分子伴侣蛋白GRP78的表达。当用100 ng/mL瘦素处理后,PI3K、mTOR和STAT3在A549细胞中均被上调,GRP78的表达量也显著上升。当LY294002和雷帕霉素分别抑制PI3K和mTOR时,STAT3和GRP78蛋白的表达也相应降低。
综上,瘦素可通过激活PI3K/mTOR/STAT3通路调节GRP78的表达来促进肺癌细胞的迁移。这提示瘦素在脂质代谢影响肺癌发展中发挥了作用,并会对预后产生不良影响,有望为临床治疗或药物开发提供新的思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
CHEN W, SUN K, ZHENG R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] |
OZRETIC' L, HEUKAMP L C, ODENTHAL M, et al. The role of molecular diagnostics in cancer diagnosis and treatment[J]. Onkologie, 2012, 35(s1): 8-12. DOI:10.1159/000334823 |
| [4] |
SCHABATH M B, NGUYEN A, WILSON P, et al. Temporal trends from 1986 to 2008 in overall survival of small cell lung cancer patients[J]. Lung Cancer, 2014, 86(1): 14-21. DOI:10.1016/j.lungcan.2014.07.014 |
| [5] |
URAMOTO H, TANAKA F. Recurrence after surgery in patients with NSCLC[J]. Transl Lung Cancer Res, 2014, 3(4): 242-249. DOI:10.3978/j.issn.2218-6751.2013.12.05 |
| [6] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [7] |
RAY A, CLEARY M P. The potential role of leptin in tumor invasion and metastasis[J]. Cytokine Growth Factor Rev, 2017, 38: 80-97. DOI:10.1016/j.cytogfr.2017.11.002 |
| [8] |
VANSAUN M N. Molecular pathways: adiponectin and leptin signaling in cancer[J]. Clin Cancer Res, 2013, 19(8): 1926-1932. DOI:10.1158/1078-0432.CCR-12-0930 |
| [9] |
ZHENG X J, YANG Z X, DONG Y J, et al. Downregulation of leptin inhibits growth and induces apoptosis of lung cancer cellsvia the Notch and JAK/STAT3 signaling pathways[J]. Biol Open, 2016, 5(6): 794-800. DOI:10.1242/bio.017798 |
| [10] |
BROCCHIERI L, CONWAY DE MACARIO E, MACARIO A J. Hsp70 genes in the human genome: Conservation and differentiation patterns predict a wide array of overlapping and specialized functions[J]. BMC Evol Biol, 2008, 8: 19. DOI:10.1186/1471-2148-8-19 |
| [11] |
SUN Q, HUA J, WANG Q, et al. Expressions of GRP78 and Bax associate with differentiation, metastasis, and apoptosis in non-small cell lung cancer[J]. Mol Biol Rep, 2012, 39(6): 6753-6761. DOI:10.1007/s11033-012-1500-8 |
| [12] |
LEE A S. GRP78 induction in cancer: therapeutic and prognostic implications[J]. Cancer Res, 2007, 67(8): 3496-3499. DOI:10.1158/0008-5472.CAN-07-0325 |
| [13] |
MA X, GUO W, YANG S, et al. Serum GRP78 as a tumor marker and its prognostic significance in non-small cell lung cancers: a retrospective study[J]. Dis Markers, 2015, 2015: 814670. DOI:10.1155/2015/814670 |
| [14] |
KWON D, KOH J, KIM S, et al. Overexpression of endoplasmic reticulum stress-related proteins, XBP1s and GRP78, predicts poor prognosis in pulmonary adenocarcinoma[J]. Lung Cancer, 2018, 122: 131-137. DOI:10.1016/j.lungcan.2018.06.005 |
| [15] |
THON M, HOSOI T, YOSHII M, et al. Leptin induced GRP78 expression through the PI3K-mTOR pathway in neuronal cells[J]. Sci Rep, 2014, 4: 7096. DOI:10.1038/srep07096 |
| [16] |
HUANG Y X, JIN Q N, SU M, et al. Leptin promotes the migration and invasion of breast cancer cells by upregulating ACAT2[J]. Cell Oncol (Dordr), 2017, 40(6): 537-547. DOI:10.1007/s13402-017-0342-8 |
| [17] |
AL-SHIBLI S M, HARUN N, ASHOUR A E, et al. Expression of leptin and leptin receptors in colorectal cancer-an immunohistochemical study[J]. Peer J, 2019, 7: e7624. DOI:10.7717/peerj.7624 |
| [18] |
TONG X, MA Y, ZHOU Q L, et al. Serum and tissue leptin in lung cancer: a meta-analysis[J]. Oncotarget, 2017, 8(12): 19699-19711. DOI:10.18632/oncotarget.14963 |
| [19] |
HOUSA D, HOUSOVA J, VERNEROVA Z, et al. Adipocytokines and cancer[J]. Physiol Res, 2006, 55(3): 233-244. DOI:10.1016/j.bioeng.2004.09.001 |
| [20] |
AMBROSINI G, NATH A K, SIERRA-HONIGMANN M R, et al. Transcriptional activation of the human leptin gene in response to hypoxia. Involvement of hypoxia-inducible factor 1[J]. J Biol Chem, 2002, 277(37): 34601-34609. DOI:10.1074/jbc.M205172200 |
| [21] |
SONG C H, LIAO J, DENG Z H, et al. Is leptin a predictive factor in patients with lung cancer?[J]. Clin Biochem, 2014, 47(3): 230-232. DOI:10.1016/j.clinbiochem.2013.12.003 |
| [22] |
ANAR C, DENIZ D, EROL S, et al. Are serum leptin levels a prognostic factor in advanced lung cancer?[J]. Bratisl Lek Listy, 2017, 118(1): 13-16. DOI:10.4149/BLL_2017_003 |
| [23] |
HEBERT-SCHUSTER M, ROTTA B E, KIRKPATRICK B, et al. The interplay between glucose-regulated protein 78 (GRP78) and steroids in the reproductive system[J]. Int J Mol Sci, 2018, 19(7): E1842. DOI:10.3390/ijms19071842 |
| [24] |
CASAS C. GRP78 at the centre of the stage in cancer and neuroprotection[J]. Front Neurosci, 2017, 11: 177. DOI:10.3389/fnins.2017.00177 |
| [25] |
HUANG Y Y, PU L J, SONG L L, et al. Knockdown of GRP78 enhances cell death by cisplatin and radiotherapy in nasopharyngeal cells[J]. Anticancer Drugs, 2016, 27(8): 726-733. DOI:10.1097/CAD.0000000000000377 |
| [26] |
DAUER P, SHARMA N S, GUPTA V K, et al. GRP78-mediated antioxidant response and ABC transporter activity confers chemoresistance to pancreatic cancer cells[J]. Mol Oncol, 2018, 12(9): 1498-1512. DOI:10.1002/1878-0261.12322 |
| [27] |
COOK K L, CLARKE R. Role of GRP78 in promoting therapeutic-resistant breast cancer[J]. Future Med Chem, 2015, 7(12): 1529-1534. DOI:10.4155/FMC.15.80 |
| [28] |
ISHIKAWA D, TAKEUCHI S, NAKAGAWA T, et al. mTOR inhibitors control the growth of EGFR mutant lung cancer even after acquiring resistance by HGF[J]. PLoS ONE, 2013, 8(5): e62104. DOI:10.1371/journal.pone.0062104 |
| [29] |
FUMAROLA C, BONELLI M A, PETRONINI P G, et al. Targeting PI3K/AKT/mTOR pathway in non small cell lung cancer[J]. Biochem Pharmacol, 2014, 90(3): 197-207. DOI:10.1016/j.bcp.2014.05.011 |
| [30] |
YU H, LEE H, HERRMANN A, et al. Revisiting STAT3 signalling in cancer: new and unexpected biological functions[J]. Nat Rev Cancer, 2014, 14(11): 736-746. DOI:10.1038/nrc3818 |
| [31] |
GRABNER B, SCHRAMEK D, MUELLER K M, et al. Disruption of STAT3 signalling promotes KRAS-induced lung tumorigenesis[J]. Nat Commun, 2015, 6: 6285. DOI:10.1038/ncomms7285 |
| [32] |
ZHOU J J, QU Z X, YAN S P, et al. Differential roles of STAT3 in the initiation and growth of lung cancer[J]. Oncogene, 2015, 34(29): 3804-3814. DOI:10.1038/onc.2014.318 |
| [33] |
CHEN J. Multiple signal pathways in obesity-associated cancer[J]. Obes Rev, 2011, 12(12): 1063-1070. DOI:10.1111/j.1467-789X.2011.00917.x |
| [34] |
JAFFE T, SCHWARTZ B. Leptin promotes motility and invasiveness in human colon cancer cells by activating multiple signal-transduction pathways[J]. Int J Cancer, 2008, 123(11): 2543-2556. DOI:10.1002/ijc.23821 |



