2. 400038 重庆,陆军军医大学(第三军医大学):高原军事医学系高原生理学与病理学教研室,全军高原医学重点实验室,特殊环境医学教育部重点实验室;
3. 第一附属医院全军病理学研究所;
4. 400016 重庆,重庆医科大学:实验教学管理中心
2. Department of High Altitude Physiology and High Altitude Biology, Key Laboratory of High Altitude Medicine of PLA, Key Laboratory of Extreme Environmental Medicine of Ministry Education, Faculty of High Altitude Military Medicine;
3. Institute of Pathology, First Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400038, China;
4. Experimental Teaching Management Center, Chongqing Medical University, Chongqing, 400016
缺氧是多种疾病发生发展的病理基础,因缺氧导致的组织器官损伤会直接威胁人的生命安全。临床上虽然已有借助氧气瓶、呼吸机等改善组织氧供应的措施,但是这些措施需要相应的设备,不便于携带或常规配置。对外界氧含量降低(如高空作业和高原缺氧)或有外呼吸功能障碍(如肺源性心脏病和慢性阻塞性肺疾病等)的情况下,这些措施并不高效实用。在人体中,红细胞中的血红蛋白(hemoglobin,Hb)是维持血液和组织中足够O2水平的关键蛋白质。Hb独特的分子变构效应使其具有高效装卸O2的功能特性[1]。调节Hb与O2结合(Hb-O2)亲和力和波尔效应这两种特性可直接且快速地提高肺部从外界摄取O2、在组织卸载O2的能力,改善组织缺氧损伤[2]。因此,基于Hb提高血液携氧能力、增强组织氧供是较为经济、方便、快速、有效的抗缺氧措施。一种新型的血红蛋白变构剂——GTB440,能与Hb的α链N端缬氨酸共价可逆地结合,增加Hb的氧亲和力,稳定氧合Hb状态,目前主要用于镰刀型贫血病的治疗研究,并取得显著性成就[3-4]。然而,利用GBT440上调Hb-O2亲和力是否能改善缺氧性疾病有待探索。本研究探讨GBT440对血液携氧特性的影响及其抗缺氧效果。
1 材料与方法 1.1 实验材料和仪器主要仪器:常压常氧和常压缺氧装置(实验室制),气体浓度检测仪(深圳普利通科技有限公司),智能控氧仪ZKY2(浙江建德通达电子控制设备厂),HEMOX-ANALYZER血氧分析仪(美国TCS Scientific公司),血气分析仪及血气分析试剂盒(美国IRMA公司), pH值测量仪(德国Satorius公司),GBT440(C19H19N3O3, 美国全球血液公司),缺氧探针(美国Hypoxyprobe公司)。
实验动物:30只8~10周龄C57雄性小鼠,体质量(20±2)g;24只6~7周龄SD雄性大鼠,体质量(200±10)g,均由陆军军医大学实验动物中心提供。
1.2 氧解离曲线绘制及波尔效应检测新鲜健康成年C57雄性小鼠全血,乙二胺四乙酸(EDTA)抗凝,用不同浓度的GBT440(0、50、100、200、300 μmol/L,溶于二甲基亚砜且终浓度 < 2%),在37 ℃恒温箱孵育1 h,配制氧解离曲线(oxygen dissociation curves, ODCs)检测样本(3 mL PBS,30 μL孵育后的血样本,12 μL 22%胎牛血清,20 μL 10%聚二甲基硅氧烷,轻荡混匀),用Hemox-Analyzer血氧分析仪分析ODCs检测样本,按照操作说明调试仪器,通入纯N2,在37 ℃绘制ODCs,计算P50(血氧饱和度为50%时的氧分压)。重复上述步骤,在pH仪的监测下分别用1 mmol/L HCl和1 mmol/L NaOH调定ODCs检测样本的pH值(7.10、7.40、7.70),得到不同pH值影响下的ODCs及相应P50,计算酸碱敏感值(sensitive index, SI),SI=(P507.10-P507.70)/P507.40×100%(P507.10、P507.40、P507.70分别代表ODC检测样本pH=7.10、7.40、7.70时相应的P50),即波尔效应强弱指标[5]。
1.3 血气检测实验室自制常压常氧、常压缺氧装置, 控氧仪监测并控制装置内O2浓度,密闭的缺氧装置通入纯氮气(N2), 使装置内O2浓度降低到10%,常压装置内O2浓度为21%。将24只SD雄性大鼠, 按随机数表法分为常氧对照组(NC,0 mg/kg GBT440), 常氧用药组(NG, 100 mg/kg GBT440), 缺氧对照组(HC,0 mg/kg GBT440), 缺氧用药组(HG, 100 mg/kg GBT440)(n=6)。实验前1 d下午6点后所有大鼠禁食,实验当天用药组通过灌胃的方式给予GBT440,对照组灌以相应溶剂。1 h后常氧组和缺氧组大鼠分别放置在已提前调好O2浓度的常氧装置和缺氧装置内。6 h后在装置内取材,大鼠麻醉完全后,剖腹并分离腹主动脉,用已排尽空气、肝素钠湿润过的注射器抽取0.5 mL动脉血,针头用橡皮隔绝空气,快速注入血气分析试剂盒中,插入血气分析仪检测,仪器检测相应指标,同时保留部分抗凝动脉血进行ODCs检测,ODCs的检测是用GBT440给动物灌胃后,再取动物新鲜全血,按照上述方法配制ODCs检测样本,用血氧分析仪同上述方法绘制ODCs。ODCs检测均重复3次,P50取平均值。
1.4 免疫组织化学检测缺氧探针16只雄性C57小鼠, 按随机数字表法分为NC、NG、HC、HG 4个组(n=4),同方法1.3给药和常氧缺氧处理。取材前1.5 h, 所有小鼠腹腔注入60 mg/kg缺氧探针派诺硝唑(pimonidazole hydrochloride,一种新型乏氧细胞标记物,其原理是利用还原硝基有选择性结合乏氧细胞的能力而形成的一种从细胞水平测定缺氧程度技术)。麻醉小鼠后剖开胸腔和腹腔,暴露心脏、肝脏和肾脏,剪开右心房放出血液,用灌注泵从心尖处先后给小鼠全身缓慢地灌注生理盐水和4%多聚甲醛,直到全身板直僵硬,皮肤和肝肾脏苍白,取出小鼠大脑,肝脏左叶和完整左肾,放入4%多聚甲醛固定24 h后修整组织,取脑组织和肾组织冠状面中部厚5 mm的切块,肝组织呈1 cm×1 cm×0.5 cm切块, 石蜡包埋切片后做免疫组织化学检测,一抗以FITC-抗派诺硝唑探针小鼠IgG单克隆抗体孵育,二抗以HRP-兔抗FITC IgG多克隆抗体孵育。在显微镜下,40倍镜下观察肝实质细胞和肾皮质细胞,运用Image Pro Plus 6.0软件拍照分析,在全镜扫描仪下,20倍镜下观察脑冠状面,用OLYMPIS VS-ASW 2.9软件进行分析。
1.5 统计学处理采用SPSS19.0统计软件, 实验数据以x±s表示,P50及SI采用单因素方差分析,体内实验结果均采用双因素方差分析,且用最小显著差异法LSD进行均数之间差异显著性检验, 发生率用χ 2检验。检验水准α=0.05。
2 结果 2.1 GBT440对Hb-O2亲和力的影响为了明确GBT440对Hb与O2亲和力的影响,用不同浓度GBT440孵育小鼠全血后得到的ODCs,结果发现:随着药物浓度的增加(0、50、100、200、300 μmol/L),ODCs逐渐左移,P50降低(P < 0.05, 图 1),分别为(40.20± 0.31)、(38.16±1.42)、(27.42±2.40)、(8.72±1.16)、(7.02±1.19)mmHg。与未用药组(0 μmol/L组)对比,50 μmol/L组无统计学差异(P>0.05),100、200、300 μmol/L组有统计学差异(P < 0.05)。
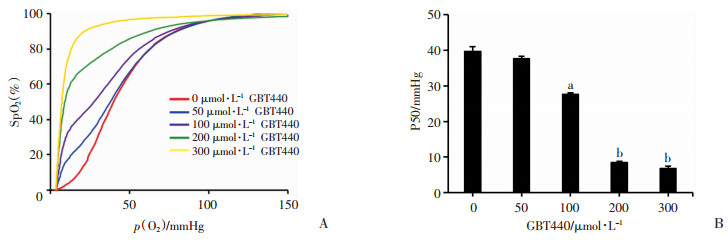
|
| A:不同浓度GBT440孵育全血后的氧离曲线;B:不同浓度GBT440孵育全血后P50统计 a: P < 0.01, 与0 μmol/L比较;b: P < 0.01, 与100 μmol/L比较 图 1 GBT440对体外小鼠血液氧离曲线及P50的影响 |
2.2 GBT440对波尔效应的影响
为了探讨GBT440是否会影响Hb对O2的释放,检测酸碱条件下ODCs的变化,结果见图 2。不同浓度GBT440孵育后的血样本,在酸性条件下(pH=7.10),ODCs均右移,在碱性条件下(pH=7.70),ODCs均左移,即均存在波尔效应。但是不同GBT440浓度条件下ODCs移动的幅度不同,酸碱敏感指数SI随着药物浓度的增加逐渐降低(P < 0.01)。
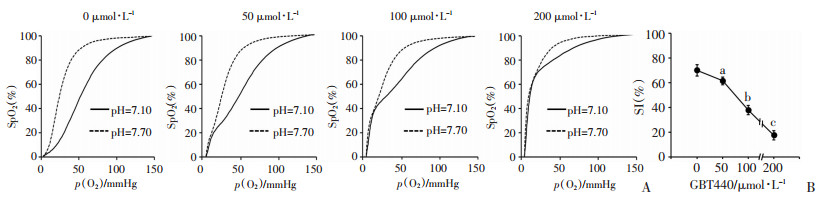
|
|
A:在酸碱条件下不同浓度GBT440孵育全血后的氧离曲线;B:不同浓度GBT440孵育全血后的酸碱敏感值(SI) a: P < 0.01, 与0 μmol/L比较;b: P < 0.01, 与50 μmol/L比较;c: P < 0.01, 与100 μmol/L比较 图 2 不同浓度GBT440对小鼠红细胞波尔效应的影响 |
2.3 GBT440对血液携氧能力的影响
对比NC和HC组,NG和HG组血液ODCs明显左移,P50值显著性下降(P < 0.05)。对比NG组,HG组血液的ODCs左移的幅度变小,但P50值无统计学差异(P> 0.05,图 3A)。
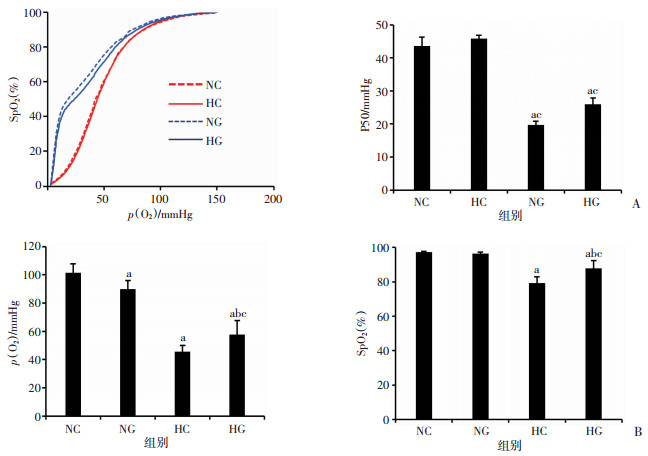
|
|
A: GBT440对常氧和缺氧大鼠氧离曲线及P50的影响;B:GBT440对血氧参数p(O2)、SpO2的影响 a: P < 0.01, 与NC组比较;b: P < 0.01, 与NG组比较;c: P < 0.01, 与HC组比较 图 3 GBT440对血液携氧能力的影响 |
为了明确GBT440是否能改善血液携氧特性,检测常氧和缺氧条件下的动脉血氧参数,结果见图 3B,以NC组的各项指标为基准值作对比,HC组和HG组的氧分压[p(O2)],血氧饱和度(SpO2)显著下降(P < 0.05),HG组p(O2)、SpO2相对HC组显著提高(P < 0.05,图 3B)。双因素方差分析发现缺氧和用药两个因素存在显著的交互作用(P < 0.01)。
2.4 GBT440对酸碱平衡的影响为了探讨GBT440是否能够改善缺氧的严重程度,分析HC和HG组每个样本发生代偿之外的代谢性酸中毒,该酸中毒程度反映了组织的缺氧严重程度。对比NC组,HC组和HG组的二氧化碳分压[p(CO2)],碱剩余(BE), 碳酸氢根离子(HCO3-)显著降低(P < 0.01,表 1),初步判定HC组和HG组存在呼吸性碱中毒。根据预计代偿公式[6]:Δ[HCO3-]=0.2×ΔPCO2±2.5(“Δ”表示改变值),进一步计算大鼠代偿之外的代谢性酸中毒,对比HC组,HG组中6只大鼠此部分的代谢性酸中毒发生率显著降低(P < 0.01),分别为66.67%、16.67%。
| 组别 | pH | p(CO2)/mmHg | BE/mmol·L-1 | HCO3-/mmol·L-1 |
| NC | 7.38±0.04 | 33.58±3.05 | -4.72±2.12 | 19.50±1.72 |
| NG | 7.35±0.04 | 35.42±3.88 | -5.40±1.79 | 19.47±1.78 |
| HC | 7.37±0.03 | 26.35±1.20a | -8.62±2.05a | 15.03±1.70a |
| HG | 7.37±0.05 | 22.63±4.20ab | -10.07 ±2.07ab | 16.22±1.00ab |
| a: P < 0.05,与NC组比较;b: P < 0.01,与NG组比较 | ||||
2.5 GBT440对缺氧小鼠脑、肝、肾组织缺氧程度的影响
为了明确GBT440是否能改善重要组织的缺氧程度,我们利用缺氧探针派诺硝唑,通过免疫组织化学的方法来检测肝、肾、脑组织的缺氧程度,结果发现(图 4):对比NC组,HC组脑组织、肝实质细胞和肾皮质细胞的染色程度加深。在使用GBT440后,上述变化明显减轻:和HC组相比,HG组脑组织(尤其是大脑前额叶)、肝实质细胞和肾皮质细胞的染色程度降低,但是和NG组相比,着色仍然较深。
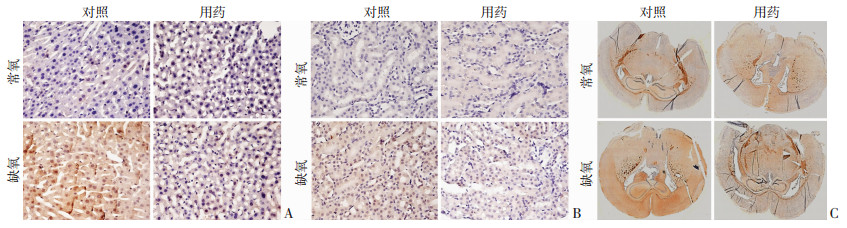
|
| A:肝实质细胞(×40);B:肾皮质细胞(×40);C:大脑矢状面(×20) 图 4 免疫组织化学显示GBT440对缺氧小鼠肝、肾、脑组织缺氧程度的影响 |
3 讨论
GBT440是一种新型的Hb变构剂,其吡唑取代基能与Hb分子中一个α链的N端缬氨酸残基结合,稳定了Hb分子的R态,导致Hb-O2亲和力增加。GBT440还与Hb的第2个α链的131位丝氨酸形成氢键,阻止了Hb四聚体与其它GBT440分子结合。因此,一个Hb四聚体只能同一个GBT440分子结合(以1 :1的化学计量与Hb结合),相比5-HMF、Tucarasol、BW12C这3种Hb变构剂(以2 :1的化学计量与Hb结合),GBT440能更加有效地提高Hb-O2的亲和力[3, 7]。而我们的体外实验结果显示随着GBT440浓度的增加,ODCs逐渐左移,P50降低,表明GBT440能有效使Hb-O2亲和力增加。
在外界环境O2分压降低时,O2分子从肺泡弥散到红细胞的驱动力降低,引起血氧含量降低。此时,增加Hb-O2亲和力有利于Hb在肺泡毛细血管处结合更多的O2。在常氧条件下,GBT440提高Hb-O2亲和力后,在动脉血中释放的O2减少。p(O2)指物理溶解在血液中的氧所产生的张力,因此p(O2)降低,但是此时的Hb携O2量已经高饱和(SpO2>97%),仍处于氧离曲线的平坦部分,以至于GBT440作用常氧大鼠后不会引起SpO2的明显改变;但是在缺氧条件下,利用GBT440提高Hb-O2亲和力后,动脉血液中的p(O2)和SpO2均显著提高,组织毛细血管和周围组织液的氧分压梯度(动静脉氧分压差)增加,促使O2分子向组织细胞的扩散。
Hb-O2亲和力增高使得Hb结合的O2不易释放给组织细胞使用,但是,O2释放还会受到波尔效应(pH/CO2对Hb-O2亲和力的影响)的影响[8]。因此,我们模拟体内的酸碱环境,波尔效应检测发现在酸性条件下GBT440作用后的ODCs依然会明显右移。在缺氧时,组织细胞的无氧酵解增强,产生大量的乳酸等酸性代谢产物,降低血液pH值。代谢终产物CO2也可以降低血液的pH值,还可以直接与Hb分子结合降低Hb-O2亲和力,使ODCs右移。另外,在机体缺氧时红细胞内2, 3-二磷酸甘油酸(2, 3-diphosphoglyceric acid,2, 3-DPG)、磷酸盐等增多,也促使ODCs右移。因此,在组织细胞中存在多种因素使ODCs右移,降低Hb-O2亲和力,从而避免因GBT440引起的Hb-O2亲和力增高而造成的O2释放障碍。另外,缺氧时GBT440增加动脉SpO2的同时,也增加了动脉p(O2),说明结合在高亲和力Hb的O2释放到血浆中的量也增加,这一结果也证明了结合了GBT440的Hb依然会释放氧到血浆中。
组织缺氧程度越重,代谢性酸中毒的可能性越大,因此代谢性酸中毒发生率可以反映缺氧严重程度。缺氧组血液中p(CO2)降低,说明存在呼吸性碱中毒。因为在急性缺氧条件下,机体吸入低浓度的O2,动脉血p(O2)、SpO2降低,直接刺激颈动脉体,促使呼吸加深加快,CO2呼出增多,导致p(CO2)降低,血浆中H2CO3降低, 机体代偿性HCO3-减少。另一方面,机体缺氧导致组织细胞无氧酵解增强,乳酸等酸性产物增多,引起代谢性酸中毒。代谢性酸中毒时H+增多,也可以中和一部分HCO3-,导致HCO3-进一步降低[6, 9-10]。因此,我们通过呼吸性碱中毒预计代偿公式来计算缺氧时代谢性酸中毒的发生率,实验结果表明GBT440显著降低了缺氧时代谢性酸中毒的发生率,说明GBT440能降低缺氧的严重程度。另外,缺氧探针的结果更加直接表明GBT440能显著减轻肝、肾、脑组织的缺氧程度。
GBT440能显著改善组织的缺氧程度,除了与其增强红细胞在肺部抓取更多的氧有关外,也从侧面说明结合了GBT440的Hb能顺利释放氧。在比较严重的缺氧环境下, 怎么从外环境获取更多的O2是首要解决的问题,GBT440提高Hb-O2亲和力后有助于Hb在肺部从外界环境获取更多的O2, 维持较高的p(O2)。而且,在脑、肌肉组织中酸性代谢产物、2, 3-DPG等增多,使Hb-O2亲和力降低,可以减轻因GBT440引起Hb-O2亲和力增高而造成的O2释放困难。从鱼类到鸟类和哺乳动物,存在耐缺氧物种的Hb-O2亲和力高于不耐缺氧物种的现象。如飞越喜马拉雅山、耐缺氧能力极强的斑头雁,通过基因突变使其具有很高的Hb-O2亲和力[11]。YALCIN等[12]通过5-HMF控制大鼠的Hb-O2亲和力,发现在急性重度缺氧条件下,P50的减少是有益的。我国研究者发现[13]对比平原汉族人,世代居住在高原低氧环境的藏族人群和已对高原习服的汉族人群有较强的耐缺氧能力,其P50值均显著降低。因此提高Hb-O2亲和力有助于提高机体的耐缺氧能力。
在ODCs的上段,p(O2)的变化并不能引起SpO2明显的变化。在轻度缺氧时p(O2)仍然维持在较高的水平,因此氧亲和力的变化对SpO2的影响并不明显,所以GBT440对轻度缺氧并无明显的效果。相反,降低Hb-O2亲和力的变构剂可能有较好的效果,因为此类变构剂有助于O2的释放[2]。但是在重度缺氧时,p(O2)的变化较明显,SpO2的变化在ODCs的陡段,因此GBT440增加Hb-O2亲和力有助于形成较高的SpO2,而组织中的酸性环境可以促使O2的释放。在高海拔地区,Hb-O2亲和力高的鹿鼠在严重缺氧条件下具有更高的耐缺氧能力,而在低海拔地区,Hb-O2亲和力较低的鹿鼠具有更好的表现[14]。因此对于较严重缺氧的情况,例如高原、高空作业、剧烈运动,GBT440有望成为一种提高作业能力,预防低氧损伤的有效药物。
| [1] |
GELL D A. Structure and function of haemoglobins[J]. Blood Cells Mol Dis, 2018, 70: 13-42. DOI:10.1016/j.bcmd.2017.10.006 |
| [2] |
SRINIVASAN A J, MORKANE C, MARTIN D S, et al. Should modulation of p50 be a therapeutic target in the critically ill?[J]. Expert Rev Hematol, 2017, 10(5): 449-458. DOI:10.1080/17474086.2017.1313699 |
| [3] |
FERRONE F A. GBT440 increases haemoglobin oxygen affinity, reduces sickling and prolongs RBC half-life in a murine model of sickle cell disease[J]. Br J Haematol, 2016, 174(4): 499-500. DOI:10.1111/bjh.14212 |
| [4] |
DUFU K, LEHERE-GRAIWER J, RAMOS E, et al. GBT440 inhibits sickling of sickle cell trait blood under in vitro conditions mimicking strenuous exercise[J]. Hematol Rep, 2016, 8(3): 6637. DOI:10.4081/hr.2016.6637 |
| [5] |
YUAN Y, TAM M F, SIMPLACEANU V, et al. New look at hemoglobin allostery[J]. Chem Rev, 2015, 115(4): 1702-1724. DOI:10.1021/cr500495x |
| [6] |
SEIFETR J L, CHANG H Y. Disorders of acid-base balance: new perspectives[J]. Kidney Dis(Basel), 2017, 2(4): 170-186. DOI:10.1159/000453028 |
| [7] |
HUTCHALEELAHA A, PATEL M, WASHINGTON C, et al. Pharmacokinetics and pharmacodynamics of voxelotor(GBT440) in healthy adults and patients with sickle cell disease[J]. Br J Clin Pharmacol, 2019, 85(6): 1290-1302. DOI:10.1111/bcp.13896 |
| [8] |
ZHENG G, SCHAEFER M, KARPLUS M. Hemoglobin Bohr effects: atomic origin of the histidine residue contributions[J]. Biochemistry, 2013, 52(47): 8539-8555. DOI:10.1021/bi401126z |
| [9] |
HOCHRAINER M, FUNK G C. Interpretation of acid-base disorders[J]. Med Klin Intensivmed Notfmed, 2019, 114(8): 765-776. DOI:10.1007/s00063-019-00621-x |
| [10] |
SPITAL A. Physiological approach to assessment of acid-base disturbances[J]. N Engl J Med, 2015, 372(2): 193. DOI:10.1056/NEJMc1413880 |
| [11] |
JENDROS A, MALTE H, OVERGAARD C B, et al. Allosteric mechanisms underlying the adaptive increase in hemoglobin-oxygen affinity of the bar-headed goose[J]. J Exp Biol, 2018, 221(Pt 18): jeb185470. DOI:10.1242/jeb.185470 |
| [12] |
YALCIN O, CABRALES P. Increased hemoglobin O2 affinity protects during acute hypoxia[J]. Am J Physiol Heart Circ Physiol, 2012, 303(3): H271-H281. DOI:10.1152/ajpheart.00078.2012 |
| [13] |
LI C, LI X, LIU J, et al. Investigation of the differences between the Tibetan and Han populations in the hemoglobin- oxygen affinity of red blood cells and in the adaptation to high-altitude environments[J]. Hematology(Amsterdam, Netherlands), 2018, 23(5): 309-313. DOI:10.1080/10245332.2017.1396046 |
| [14] |
STORZ J F. Hemoglobin-oxygen affinity in high-altitudevertebrates: is there evidence for an adaptive trend?[J]. J Exp Biol, 2016, 219(20): 3190-3203. DOI:10.1242/jeb.127134 |



