2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院细胞生物学教研室
2. Department of Cell Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
慢性肾病引起的心血管并发症一直是临床上亟待解决的问题。慢性肾病患者体内高表达的转化生长因子(transformation growth factor β1, TGFβ1)促进内皮间质化,导致内皮细胞功能失调,是引起血管新生内膜增生及血管狭窄的主要因素之一[1-2]。有报道表明TGFβ家族成员在诱导内皮间质化的同时还促进了内皮细胞自噬[3]。自噬是细胞维持自身稳态的有效机制,当血管受到急性损伤时,促进平滑肌细胞自噬可以降低炎症反应,减少细胞外基质的沉积,减轻血管狭窄程度[4]。CHANG等[5]研究则发现阻止内皮细胞自噬可减少内皮细胞损伤。表明自噬在血管损伤修复过程中发挥重要作用,阻止内皮细胞自噬很有可能对血管起到保护作用。
二甲双胍(Metformin)是临床上常用降糖药。研究表明二甲双胍可促进平滑肌细胞自噬来抑制新生内膜增生,从而起到血管保护作用[6]。另有报道二甲双胍可抑制肾小管上皮细胞自噬从而保护细胞免受蛋白尿引起的氧化应激损伤[7]。但是二甲双胍对内皮细胞自噬的影响及其调控机制目前并不清楚。
YAP(yes-associated protein)是新近发现在细胞增殖、分化等调控上具有重要功能的Hippo信号通路的转录因子[8],YAP的异常调节可引起血管新生内膜增生及血管狭窄[9]。本研究观察TGFβ1和二甲双胍对内皮细胞自噬的影响,并进一步探讨YAP信号在其中的作用,以期为临床用药调控血管损伤修复提供实验参考。
1 材料与方法 1.1 材料与试剂RPMI 1640(C11875500BT)购自美国Gibco公司,胎牛血清(SV30087.03)购自美国HyClone公司,二甲双胍(D150959)购自美国Sigma公司,TGFβ1(100-21)购自美国Peprotech公司,XMU-MP-1(S8334)购自美国selleck公司,维替泊芬(Verteporfin,HY-B0146)购自美国MedChemExpress公司,CCK-8(CK04)购自日本DOJINDO公司,ECL化学发光显影试剂盒(P0018S)购自中国碧云天公司;一抗(均为兔源):LC3Ⅰ/Ⅱ(1271S)购自美国Cell Signaling Technology公司,Beclin-1(AP0768)、YAP(BS9920M)、pYAP(BS94007)、CTGF(BS7445)和GAPDH(AP0063)均购自美国Bioworld公司;二抗:辣根过氧化物酶标记山羊抗兔IgG(A0208)和Cy3标记山羊抗兔IgG(A0516)购自中国碧云天公司。
1.2 细胞培养和处理HUVEC细胞株为本室保存,用含10%胎牛血清的RPMI1640培养基在37 ℃、5%CO2培养箱中传代培养,选择处于对数期的细胞进行研究。HUVEC接种并生长到70%~80%后按不同分组加入5 mmol/L二甲双胍、10 ng/mL TGFβ1、2 μmol/L XMU-MP-1、0.25 μmol/L维替泊芬(Verteporfin)[10]进行处理。在检测TGFβ1和二甲双胍对自噬的影响实验中,细胞分为4组:对照组(ctl)、二甲双胍处理组(Met)、TGFβ1处理组(TGF)、二甲双胍和TGFβ1共处理组(M+T);在对YAP激活情况与自噬关系的研究中,除上述4组外,增加XMU-MP-1处理组(XMU)、二甲双胍+XMU-MP-1共处理组(M+X)、Verteporfin处理组(Ver)、Verteporfin+TGFβ1共处理组(V+T)、Verteporfin+XMU-MP-1共处理组(V+X),共9组。其中共处理组二甲双胍或Verteporfin均先加1 h后再加入TGFβ1或XMU-MP-1,24 h后收取细胞总蛋白质或进行后续实验。
1.3 CCK-8(Cell Counting Kit-8)检测细胞以2 000个/孔的密度接种于96孔板,分别予以不同浓度(0、2.5、5、10、20、40 mmol/L)二甲双胍处理24 h,又以5 mmol/L浓度的二甲双胍分别处理HUVEC 24、48、72 h,每组设3个复孔,同时设空白对照组。按试剂盒说明书加入10 μL CCK-8试剂孵育3 h后,在酶标仪450 nm波长下测定各孔吸光度。计算细胞存活率=(实验组-空白对照组)/(对照组-空白对照组)×100%。
1.4 透射电镜检测待测各组细胞经药物处理后,以胰酶消化并离心,取细胞数约8×105个用PBS重悬再离心,吸去PBS后沿管壁滴入500 μL戊二醛进行固定,制样后于扫描电镜下观察。
1.5 细胞免疫荧光细胞接种于盖玻片上,经相应处理后以PBS漂洗2次,室温下4%多聚甲醛固定20 min,0.3% TritonX-100处理15 min,封闭20 min,加入兔源LC3Ⅰ/Ⅱ抗体(1:100)于4 ℃孵育过夜,PBS漂洗3次后,Cy3标记山羊抗兔IgG(1:1 000)室温孵育1.5 h后,PBS漂洗3次,滴加DAPI室温孵育5 min,PBS漂洗3次后,封片,在荧光显微镜下观察拍照。
1.6 Western blot检测8×105个细胞经含有蛋白酶抑制剂的RIPA裂解液冰上裂解5 min,刮取细胞裂解液于EP管中,8 000×g离心10 min,吸取上清,BCA法测定蛋白浓度,以5×SDS上样缓冲液于105 ℃煮沸5 min。20 μg蛋白样品经10% SDS-PAGE凝胶电泳,以250 mA恒流1.5 h转移到硝酸纤维素膜上,室温封闭1 h。4 ℃下将硝酸纤维素膜分别浸入LC3Ⅰ/Ⅱ(1:500)、Beclin-1(1:1 000)、YAP(1:1 000)、pYAP(1:1 000)、CTGF(1:1 000)、GAPDH(1:3 000)一抗中孵育过夜,TBST(Tris-Buffered Saline Tween-20)洗膜5 min×3次,浸入辣根过氧化物酶标记山羊抗兔IgG(1:1 000),室温孵1 h后用TBST洗膜5 min×3次,滴加ECL化学发光试剂盒显影,图像使用Adobe Photoshop 2020软件进行灰度值定量分析。
1.7 统计学分析实验均重复至少3次,计量数据以x±s表示。采用GraphPad Prism 8进行统计分析并制图,采用t检验进行两组间比较,单因素方差分析Dunnett-t检验进行多组间比较。P < 0.05表示差异有统计学意义。
2 结果 2.1 二甲双胍对HUVEC存活率的影响以0、2.5、5、10、20、40 mmol/L的二甲双胍处理HUVEC 24 h,随后进行CCK-8检测。单因素方差分析结果显示,二甲双胍浓度对HUVEC存活率有显著影响(F=22.21,P < 0.01),随着二甲双胍浓度的升高,细胞存活率逐渐下降。二甲双胍浓度在10、20、40 mmol/L时,细胞存活率与0 mmol/L相比显著降低(P < 0.01,图 1A)。在此基础上,进一步检测5 mmol/L二甲双胍处理24、48、72 h时细胞存活率。结果表明,单因素方差分析提示二甲双胍处理时间对HUVEC存活率同样存在显著影响(F=7.542,P < 0.01),与0 h处理组相比,48、72 h处理均显著抑制了HUVEC存活率(P < 0.05,图 1B)。因此,后续实验选择5 mmol/L二甲双胍处理24 h。

|
|
A:不同浓度二甲双胍处理24 h后HUVEC的存活率a: P < 0.01,与0 mmol/L组比较 B:5 mmol/L的二甲双胍处理不同时间后HUVEC的存活率b: P < 0.01,与0 h组比较 图 1 二甲双胍处理HUVEC后细胞存活率 |
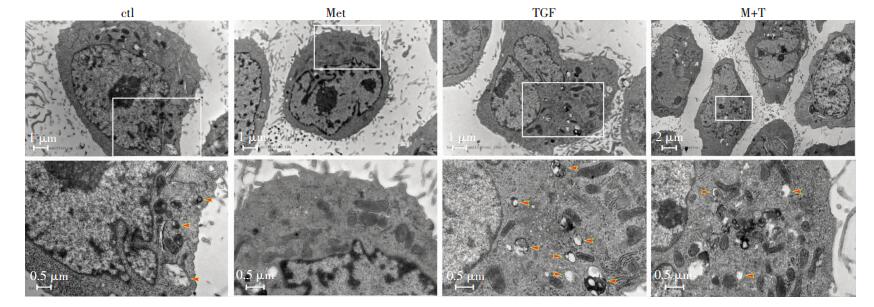
2.2 二甲双胍抑制TGFβ1诱导的内皮细胞内自噬体形成
电镜观察可见,与对照组比较,TGFβ1处理后细胞中有较多自噬体出现。经二甲双胍处理后,细胞内自噬体明显减少(图 2)。
|
| ctl:对照组;Met:5 mmol/L二甲双胍处理组;TGF:10 ng/mL TGFβ1处理组;M+T:二甲双胍和TGFβ1共处理组;下图为对应上图方框放大;箭头示自噬体 图 2 透射电镜观察HUVEC内自噬体 |
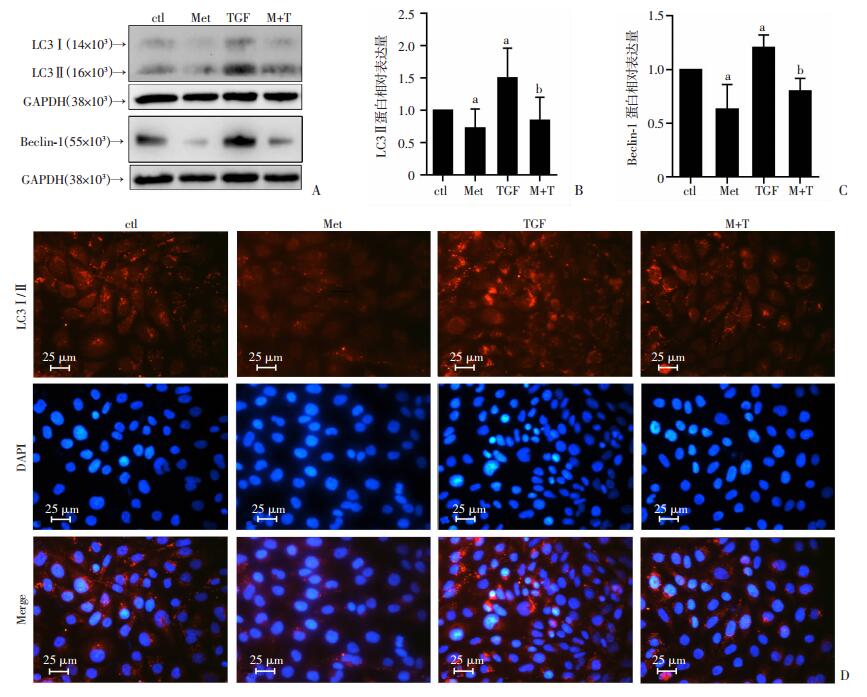
2.3 二甲双胍下调TGFβ1诱导的自噬相关分子表达
LC3Ⅱ和Beclin-1是细胞自噬标志分子,进一步检测HUVEC中这两种分子的表达水平。Western blot结果显示,TGFβ1促进了LC3Ⅱ和Beclin-1的表达(图 3A、B),二甲双胍处理逆转了TGFβ1对这两种分子表达的诱导效应。免疫荧光实验与Western Blot结果一致(图 3C)。结果表明二甲双胍明显抑制了TGFβ1诱导的细胞自噬。
|
| ctl:对照组;Met:5 mmol/L二甲双胍处理组;TGF:10 ng/mL TGFβ1处理组;M+T:二甲双胍和TGFβ1共处理组。A: Western Blot检测LC3Ⅰ/Ⅱ、Beclin-1表达;B: LC3Ⅰ/Ⅱ表达的量化分析;C:Beclin-1表达的量化分析;(a:P < 0.05,与ctl组比较;b:P < 0.05,与TGF组比较);D:免疫荧光观察HUVEC经处理后LC3Ⅰ/Ⅱ的表达情况(400×) 图 3 HUVEC经二甲双胍、TGFβ1处理后自噬标志分子的表达检测(n=3) |
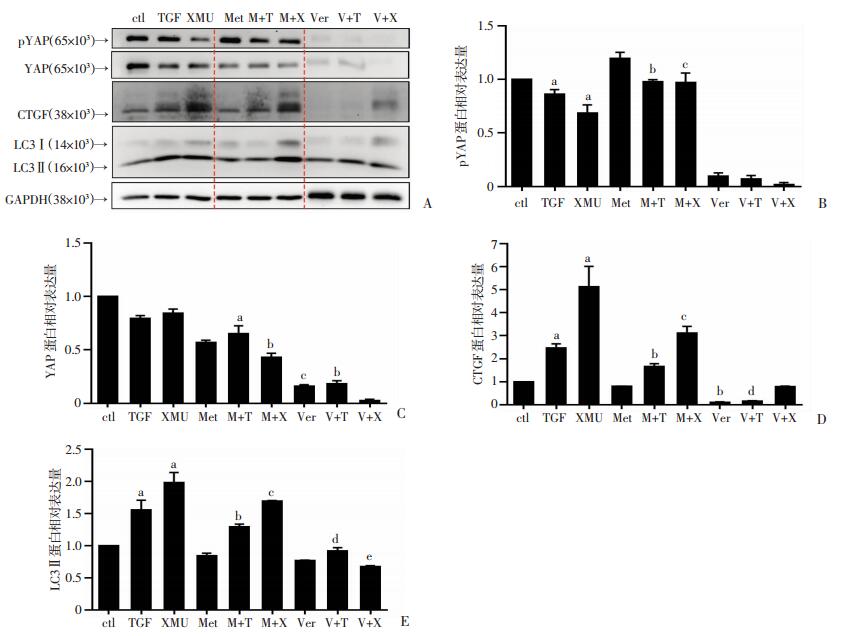
2.4 二甲双胍阻遏TGFβ1诱导的YAP激活
为了了解二甲双胍抑制TGFβ1诱导的自噬是否与YAP激活相关,采用YAP上游激酶MST1/2(mammalian Ste20-like kinases 1/2)的特异性抑制剂XMU-MP-1和YAP特异性抑制剂Verteporfin分别处理HUVEC,Western blot检测内皮细胞中LC3Ⅱ表达、YAP磷酸化水平及其下游靶蛋白结缔组织生长因子(connective tissue growth factor,CTGF)的表达情况。如图 4所示,TGFβ1处理后内皮细胞YAP磷酸化水平下降(P < 0.01,图 4A、B),总蛋白水平也有所降低(图 4AC),CTGF表达升高(P < 0.01,图 4A、D),与YAP上游激酶抑制剂XMU-MP-1处理内皮细胞后YAP及CTGF表达变化一致(P < 0.01,图 4A、B、C、D),表明TGFβ1阻止了YAP的失活。TGFβ1和XMU-MP-1处理均促进了LC3Ⅱ表达(P < 0.01,图 4A、E),提示我们TGFβ1很有可能通过保持YAP活化来促进自噬。经YAP特异性抑制剂Verteporfin处理后,TGFβ1和XMU-MP-1引起的CTGF表达被降低(P < 0.01,图A、D),二者所诱导的LC3Ⅱ的表达也受到抑制(P < 0.01,图 4A、E),这些结果表明YAP的活化状态与自噬水平呈正相关。经二甲双胍处理后,细胞中YAP表达均出现降低趋势(图 4A、B),且与TGFβ1和XMU-MP-1单处理组分别比较可见,联用二甲双胍明显促进了YAP磷酸化(P < 0.05,图 4A、B),CTGF表达被显著降低(分别P < 0.01,P < 0.05,图 4A、D)。此外,二甲双胍也减弱了TGFβ1和XMU-MP-1诱导的LC3Ⅱ的表达(P < 0.05,图 4A、E)。由图 4可见,二甲双胍对LC3Ⅱ和CTGF的表达变化趋势与Verteporfin影响一致。这些结果提示,二甲双胍很可能通过抑制YAP的表达并促进YAP失活介导了对HUVEC自噬的抑制作用。
|
|
ctl:对照组;TGF:10 ng/mL TGFβ1处理组;XMU:2 μmol/L XMU-MP-1处理组;Met:5 mmol/L二甲双胍处理组;M+T:二甲双胍和TGFβ1共处理组;M+X:二甲双胍和XMU-MP-1共处理组;Ver:0.25 μmol/L维替泊芬处理组;V+T:维替泊芬和TGFβ1共处理组;V+X:维替泊芬和XMU-MP-1共处理组 A:Western blot检测YAP相关分子及LC3Ⅰ/Ⅱ表达;B:pYAP蛋白表达的量化分析;a:P < 0.01,与ctl组比较;b:P < 0.05,与TGF组比较;c:P < 0.05,与XMU组比较;C:YAP蛋白表达的量化分析;a:P < 0.05,与TGF组比较;b:P < 0.01,与XMU组比较;c:P < 0.01,与TGF组比较;D:CTGF蛋白表达的量化分析;a:P < 0.01,与ctl组比较;b:P < 0.01,与TGF组比较;c:P < 0.05,与XMU组比较;d:P < 0.01,与XMU组比较;E:LC3 Ⅱ蛋白表达的量化分析;a:P < 0.01,与ctl组比较;b:P < 0.05,与TGF组比较;c:P < 0.05,与XMU组比较;d:P < 0.01,与TGF组比较;e:P < 0.01,与XMU组比较 图 4 HUVEC的YAP激活情况和LC3Ⅱ表达检测(n=3) |
3 讨论
慢性肾病患者心血管疾病发病率和死亡率均高于正常人,探索对慢性肾病患者心血管并发症的有效治疗方法一直是临床的重要课题。TGFβ1是慢性肾病患者体内高表达的细胞因子之一,我们以往也报道了TGFβ1会加重损伤血管的新生内膜增生,造成血管狭窄[11]。WANG等[3]报道了TGFβ2在引起内皮间质化的同时促进细胞自噬。提示我们TGFβ1很有可能也会引起内皮细胞自噬。自噬在血管损伤修复过程中有着重要作用,阻止内皮细胞自噬很有可能对血管起到保护作用。本研究显示,二甲双胍可通过阻止Hippo信号通路下游转录因子YAP的激活抑制TGFβ1诱导的内皮细胞自噬。
除了降低血糖的功能外,二甲双胍在抗衰老、抗肿瘤方面的新功能逐渐被认识[12]。二甲双胍对心血管是否具有保护作用也得到了越来越多的关注。LU等[6]研究报道二甲双胍可促进球囊损伤颈动脉处平滑肌细胞自噬,抑制新生内膜增生,阻止血管狭窄,从而起到血管保护作用。CHANG等[5]关于静脉移植模型的研究发现,利用3-甲基腺嘌呤阻止内皮细胞自噬,可减轻血管新生内膜增生和血管狭窄程度。本研究发现二甲双胍可抑制TGFβ1诱导的HUVEC自噬,提示二甲双胍很有可能通过阻止内皮细胞自噬来发挥血管保护功能。
内皮细胞内Hippo信号通路转录因子YAP激活引起自噬[13],因此我们推测二甲双胍、TGFβ1对自噬的调控可能与YAP激活相关。Hippo信号通路参与了心血管系统的发育和生理功能的调节[14]。当Hippo通路被激活时,上游的MST1/2等激酶磷酸化,继而磷酸化YAP使其失活。未磷酸化的YAP可由胞质转位入核,发挥转录因子作用,调节基因表达[15]。CTGF是YAP激活后的靶基因之一[16],其表达水平可反映YAP激活并入核发挥作用的程度。本研究利用两种对YAP特异性调控的药物XMU-MP-1和Verteporfin分别处理细胞,检测TGFβ1引起的自噬是否与YAP信号相关。XMU-MP-1可选择性地抑制MST1/2激酶,阻止YAP磷酸化,从而促进YAP转位入核发挥作用[17]。Verteporfin特异性阻断YAP-TEAD相互作用,起到抑制YAP的作用[18]。从图 4可见,TGFβ1抑制YAP磷酸化,可阻止YAP失活并促进细胞自噬,与XMU-MP-1的作用一致;而二甲双胍单独处理或与TGFβ1联用的情况下,与相应对照组或TGFβ1处理组相比,均可促进YAP磷酸化、阻遏YAP的作用并抑制LC3Ⅱ表达,与Verteporfin的作用趋势一致。这些结果表明二甲双胍对HUVEC自噬的抑制很有可能是通过阻止YAP激活实现的。
综上所述,本研究发现了二甲双胍可通过阻止YAP的激活抑制TGFβ1诱导的内皮细胞自噬。二甲双胍是否能够通过调控内皮细胞自噬,抑制损伤血管新生内膜增生,进而对血管起到保护作用还需要进一步在体实验验证。
| [1] |
BRAHMBHATT A, REMUZZI A, FRANZONI M, et al. The molecular mechanisms of hemodialysis vascular access failure[J]. Kidney Int, 2016, 89(2): 303-316. DOI:10.1016/j.kint.2015.12.019 |
| [2] |
TIAN D Y, JIN X R, ZENG X, et al. Notch signaling in endothelial cells:is it the therapeutic target for vascular neointimal hyperplasia?[J]. Int J Mol Sci, 2017, 18(8): 1615. DOI:10.3390/ijms18081615 |
| [3] |
WANG J, FENG Y, WANG Y, et al. Autophagy regulates Endothelial-Mesenchymal transition by decreasing the phosphorylation level of Smad3[J]. Biochem Biophys Res Commun, 2017, 487(3): 740-747. DOI:10.1016/j.bbrc.2017.04.130 |
| [4] |
LUO X, YANG D, WU W, et al. Critical role of histone demethylase Jumonji domain-containing protein 3 in the regulation of neointima formation following vascular injury[J]. Cardiovasc Res, 2018, 114(14): 1894-1906. DOI:10.1093/cvr/cvy176 |
| [5] |
CHANG Y J, HUANG H C, HSUEH Y Y, et al. Role of excessive autophagy induced by mechanical overload in vein graft neointima formation:prediction and prevention[J]. Sci Rep, 2016, 6: 22147. DOI:10.1038/srep22147 |
| [6] |
LU J, JI J, MENG H, et al. The protective effect and underlying mechanism of metformin on neointima formation in fructose-induced insulin resistant rats[J]. Cardiovasc Diabetol, 2013, 12: 58. DOI:10.1186/1475-2840-12-58 |
| [7] |
ALLOUCH S, MUNUSAMY S. Metformin attenuates albumin-induced alterations in renal tubular cells in vitro[J]. J Cell Physiol, 2017, 232(12): 3652-3663. DOI:10.1002/jcp.25838 |
| [8] |
MENG Z, MOROISHI T, GUAN K L. Mechanisms of Hippo pathway regulation[J]. Genes Develop, 2016, 30(1): 1-17. DOI:10.1101/gad.274027.115 |
| [9] |
YU Q, LI W, JIN R, et al. PI3Kγ (phosphoinositide 3-kinase γ) regulates vascular smooth muscle cell phenotypic modulation and neointimal formation through CREB (cyclic AMP-response element binding protein)/YAP (yes-associated protein) signaling[J]. Arterioscl, Throm Vasc Biol, 2019, 39(3): e91-e105. DOI:10.1161/ATVBAHA.118.312212 |
| [10] |
MORISHITA T, HAYAKAWA F, SUGIMOTO K, et al. The photosensitizer verteporfin has light-independent anti-leukemic activity for Ph-positive acute lymphoblastic leukemia and synergistically works with dasatinib[J]. Oncotarget, 2016, 7(35): 56241-56252. DOI:10.18632/oncotarget.11025 |
| [11] |
WANG Y, LIANG A, LUO J, et al. Blocking Notch in endothelial cells prevents arteriovenous fistula failure despite CKD[J]. J Am Soc Nephrol, 2014, 25(4): 773-783. DOI:10.1681/ASN.2013050490 |
| [12] |
PODHORECKA M, IBANEZ B, DMOSZYN'SKA A. Metformin—its potential anti-cancer and anti-aging effects[J]. Postepy Hig Med Dosw, 2017, 71: 170-175. DOI:10.5604/01.3001.0010.3801 |
| [13] |
YAO L, HE J, LI B, et al. Regulation of YAP by mammalian target of rapamycin complex 1 in endothelial cells controls blood pressure through COX-2/mPGES-1/PGE cascade[J]. Hypertension, 2019, 74(4): 936-946. DOI:10.1161/hypertensionaha.119.12834 |
| [14] |
ZHOU W, ZHAO M. How Hippo signaling pathway modulates cardiovascular development and diseases[J]. J Immunol Res, 2018, 2018: 3696914-3696914. DOI:10.1155/2018/3696914 |
| [15] |
BASU-ROY U, BAYIN N S, RATTANAKORN K, et al. Sox2 antagonizes the Hippo pathway to maintain stemness in cancer cells[J]. Nat Commun, 2015, 6: 6411. DOI:10.1038/ncomms7411 |
| [16] |
MA R, REN J M, LI P, et al. Activated YAP causes renal damage of type 2 diabetic nephropathy[J]. Eur Rev Med Pharmacol Sci, 2019, 23(2): 755-763. DOI:10.26355/eurrev_201901_16890 |
| [17] |
FAN F, HE Z, KONG LL, et al. Pharmacological targeting of kinases MST1 and MST2 augments tissue repair and regeneration[J]. Sci Transl Med, 2016, 8(352): 352ra108. DOI:10.1126/scitranslmed.aaf2304 |
| [18] |
ZHANG L, HE X, LIU X, et al. Single-cell transcriptomics in medulloblastoma reveals tumor-initiating progenitors and oncogenic cascades during tumorigenesis and relapse[J]. Cancer Cell, 2019, 36(3): 302-318. DOI:10.1016/j.ccell.2019.07.009 |



