2. 400038 重庆,陆军军医大学(第三军医大学):高原医学系病理生理学教研室
2. Department of Pathophysiology, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
胰腺癌是恶性程度极高的消化道肿瘤,是预后最差的恶性肿瘤之一,其在各种恶性肿瘤中的死亡率排名已经由第9位升高至第7位[1]。根治性切除术被认为是治疗胰腺癌的核心手段,但仅有15%至20%的患者能在疾病早期诊断并行根治性切除术[2]。胰腺癌难以在早期诊断、治疗可能是由于胰腺癌细胞生长、迁移中特殊的分子生物学过程[3]。因此,研究胰腺癌细胞增殖、侵袭及转移中的细胞和分子机制有助于阐明胰腺癌发生发展的过程,利于肿瘤的早期诊断和治疗。
copine是一种在草履虫中发现的Ca2+依赖的细胞膜结合蛋白,其特征是在N端有2个C2-domain,C端有一个A-domain[4]。copine家族与肿瘤的增殖、侵袭和转移关系密切。研究发现,copine 1与调节信号转导和细胞膜转运有关,其在骨肉瘤组织和细胞系中高表达,copine 1低表达会显著抑制Saos-2和HOS细胞增殖、克隆形成、侵袭和转移能力,并下调肿瘤相关蛋白的表达,如Ras,MEK-1/2,WNT1,beta-catenin,cyclin A1等[5]。同时,copine 1在甲状腺乳头状癌和甲状腺滤泡癌中差异表达,并与甲状腺癌细胞的生长、增殖和p53信号通路相关[6]。copine 7在乳腺癌中是抑癌基因,而在结直肠癌中是癌基因[7-8],其在移行细胞癌中会发生错义突变[9]。copine 3是促进非小细胞肺癌转移的重要基因[10],也是其独立的预后指标和潜在的治疗靶点[11]。Jab 1与copine 3相互作用并调节ErbB2信号通路;在乳腺癌细胞Skbr3中,Jab 1的过表达使copine 3与ErbB2结合增加,Jab 1与copine 3的过表达增强了Skbr3细胞的迁移能力[12-13]。可以推断,copine家族在肿瘤的发生发展中可能起重要作用,而copine 8与肿瘤的相关研究较少,copine 8被证实能与Runx1结合并在急性髓系白血病中起作用[14],但其在胰腺癌发生发展过程中的作用完全为空白。
因此,本文将研究copine 8在胰腺癌增殖、侵袭转移和凋亡过程中的作用,有助于阐明胰腺癌发生发展过程中的分子生物学机制,并且有利于肿瘤的早期诊断,能为寻找胰腺癌的潜在治疗靶点提供帮助。
1 材料与方法 1.1 材料胰腺癌细胞系CFPAC-1、AsPC-1、BxPC-3、PANC-1和正常胰腺细胞系HPDE购于美国模式菌种收集中心(ATCC);DMEM高糖培养基、胎牛血清、胰蛋白酶(Gibco),青霉素-链霉素溶液(碧云天);Lipofectamine 2000转染试剂(Invitrogen);蛋白酶抑制剂PMSF、RIPA裂解液(碧云天),上样缓冲液(Bio-Rad),8%预制胶(金开瑞),PVDF膜(Millipore),显色剂(Millipore),TBS干粉(博士德),兔抗人copine 8多克隆抗体(PA5-25255,Invitrogen),兔抗人GAPDH多克隆抗体(bs-10900R,博奥森),HRP标记羊抗兔抗体(SA00001-2,武汉三鹰);免疫组织化学检测试剂盒(SP-9001,中杉金桥);CCK8检测试剂盒(日本同仁),transwell小室(Millipore),细胞凋亡检测试剂盒(碧云天);靶向特异性敲降copine 8的siRNA(si-#1、si-#2和si-#3)、阴性对照(si-NC)由上海生物工程有限公司设计并化学合成;Olympus荧光显微镜,流式细胞仪,酶标仪、电泳仪、半干转仪(Bio-Rad)。
1.2 细胞培养与转染胰腺癌细胞系CFPAC-1、AsPC-1、BxPC-3、PANC-1和正常胰腺细胞系HPDE均在DMEM完全培养基中培养,该完全培养基在DMEM基础上补充有10%灭活的胎牛血清(FBS)和1%青霉素-链霉素溶液。细胞系在37 ℃,含有5% CO2的细胞培养箱中培养。取生长状态良好的细胞,按照Lipofectamine 2000说明书转染靶向特异性敲降copine 8的siRNA(si-#1,si-#2和si-#3)和si-NC,转染时间为72 h。
1.3 细胞总蛋白提取和Western blot检测取生长状态良好的细胞,利用胰蛋白酶消化至离心管后,用预冷的PBS洗3次,加入新配的含1%PMSF的RIPA裂解液,裂解30 min,并在中途旋涡混匀3次,14 000 rpm/min离心15 min,加入上样缓冲液后,沸水浴5 min,-20 ℃保存。Western blot检测时,取一定体积的蛋白样品,加入预制胶上样槽中,140 V电泳40 min,半干转条件为1.2 A 7 min,5%BSA封闭2 h,一抗4 ℃孵育过夜后,TBST洗5 min×3次,二抗孵育1 h,TBST洗5 min×3次,加入新配显色剂,曝光,拍照。
1.4 免疫组织化学和免疫荧光检测石蜡切片经65 ℃烤片、脱蜡、水化、抗原修复后,按照中杉金桥免疫组化试剂盒说明书,分别加入内源性过氧化物酶阻断剂(PBS洗3次)、封闭用正常山羊血清工作液,各孵育10 min后,一抗4 ℃孵育过夜,PBS洗3次。滴加生物素标记山羊抗兔IgG聚合物,室温孵育10 min,PBS洗3次;滴加辣根酶标记链霉卵白素工作液,室温孵育10 min,PBS洗3次;加入DAB显色液显色,苏木素复染,分化、冲洗返蓝;最后脱水、透明、封片和阅片。免疫荧光检测采用荧光标记的二抗避光37 ℃孵育1 h,PBS洗3次,DAPI染10 min,PBS洗3次后,使用荧光显微镜拍照。本文共使用胰腺癌组织和配对的癌旁组织各30例,均经病理诊断为胰腺导管腺癌,并做手术切除。
1.5 CCK8细胞增殖实验利用CCK8实验检测细胞的增殖活力。将转染48 h后的细胞利用胰酶消化、计数后,铺于96孔板中,细胞密度为3 000个/孔,然后将细胞继续培养24、48、72和96 h。在不同时间点将CCK8试剂(10 μL)加入孔板中并在37 ℃下孵育4 h,使用Bio-Rad酶标仪测量450 nm处的吸光度。每组设置3个平行孔。
1.6 集落形成实验将转染后24 h的细胞接种于6孔板中,并使其生长直至形成肉眼可见的集落。14 d后,将集落用甲醇固定,使用结晶紫染色并计数。
1.7 Transwell实验细胞迁移和侵袭能力采用Transwell实验检测。将转染24 h的细胞在无血清培养基中饥饿24 h,消化后用无血清培养基重悬,调整细胞密度至5×105个/mL,取100 uL细胞悬液加入Transwell小室上室,下室加入含20%胎牛血清的培养基600 μL,培养24 h后利用结晶紫染色,观察发生迁移的细胞并计数。侵袭能力检测是在细胞迁移检测的基础上,在Transwell小室上室中预先加入Matrigel。
1.8 细胞凋亡检测转染后细胞凋亡检测采用流式细胞术。使用AnnexinV-FITC/PI凋亡检测试剂盒按照制造商的说明书通过流式细胞术测定凋亡细胞比例。
1.9 生物信息学处理生存分析在GPIEA网站进行(http://gepia. cancer-pku.cn/)。利用The Cancer Genome Atlas (TCGA)胰腺癌患者组织RNA测序数据和GEO (Gene Expression Omnibus)数据库分析copine 8的表达差异。将胰腺癌患者分为copine 8低表达组和copine 8高表达组,分析两组的差异基因(P < 0.05,fold change>1.5),并对差异基因进行GO和KEGG通路富集分析。利用GSEA软件(4.0.1)分析copine 8低表达组和copine 8高表达组各通路富集情况,得到copine 8对各通路的影响。利用STRING数据库(https://string-db.org/cgi/input.pl)构建copine 8蛋白互作网络。
1.10 统计学分析使用GraphPad Prism 8软件进行统计学分析和图像处理,组间差异比较采用t检验。
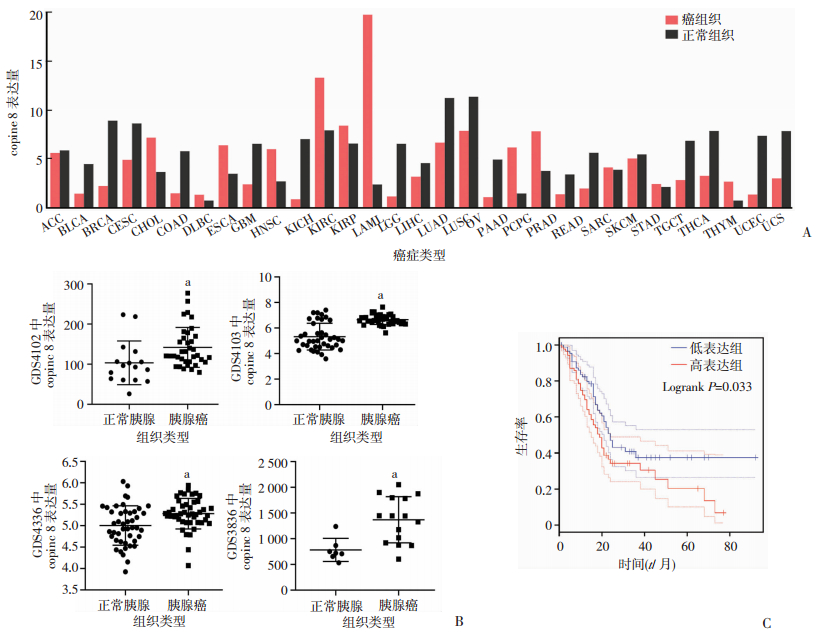
2 结果 2.1 人胰腺癌组织中copine 8表达水平上调且与生存相关分析TCGA癌组织和GTEx正常组织转录组水平测序数据,发现copine 8在各种类型的癌组织和正常组织中表达均不同,说明copine 8可能影响恶性肿瘤的发展(图 1A)。GEO数据库中选取胰腺癌组织和癌旁正常组织中的转录组数据集,包括GDS4102,GDS4103,GDS4336和GDS3836。通过进一步比较四个数据集中copine 8在胰腺癌和正常胰腺组织的表达情况,发现copine 8在胰腺癌组织中表达显著增高,说明该分子可能影响胰腺癌的进展(图 1B)。利用TCGA胰腺癌组织转录组数据,将患者分为copine 8高表达组(n=89)和copine 8低表达组(n=89),通过生存分析发现,copine 8的表达差异能影响胰腺癌患者的总体生存时间(P=0.033,图 1C)。
|
| A: TCGA数据库和GTEx数据库中各种癌组织和正常组织copine 8的表达情况ACC:肾上腺皮质癌;BLCA:膀胱尿路上皮癌;BRCA:乳腺浸润癌;CESC:宫颈癌;CHOL:胆管癌;COAD:结肠癌;DLBC:弥漫性大B细胞淋巴瘤;ESCA:食管癌;GBM:胶质瘤;HNSC:头颈鳞状细胞癌;KICH:肾嫌色细胞癌;KIRC:肾透明细胞癌;KIRP:肾乳头状细胞癌;LAML:急性髓细胞白血病;LGG:脑低级别胶质瘤;LIHC:肝细胞癌;LUAD:肺腺癌;LUSC:肺鳞癌;OV:卵鳞癌;PAAD:胰腺癌;PCPG:嗜铬细胞瘤;PRAD:前列腺癌;READ:直肠腺癌;SARC:肉瘤;SKCM:黑色素瘤;STAD:胃癌;TGCT:睾丸癌;THCA:甲状腺癌;THYM:胸腺癌;UCEC:子宫内膜癌;UCS:子宫肉瘤;B: copine 8在4个数据集(GDS4102、GDS4103、GDS4336和GDS3836)胰腺癌和正常胰腺组织中的表达情况a:P < 0.05,与正常胰腺组比较;C:将TCGA胰腺癌患者分为copine 8高、低表达组(n=89),分析copine 8表达对胰腺癌患者总体生存时间的影响 图 1 copine 8在胰腺癌中的表达情况 |
2.2 copine 8在胰腺癌中的作用机制探讨
通过将TCGA数据库中胰腺癌患者分为高表达copine 8和低表达copine 8两组,得到了两组患者的基因表达模式(图 2A)。分析两组的差异基因(P < 0.05,fold change>1.5),发现部分通路得到较好的富集,包括Hippo、mTOR和ERBB信号通路等,说明copine 8在胰腺癌中会影响这些通路的表达(图 2B)。通过进一步GSEA分析发现copine 8高表达组富集于WNT信号通路和Hippo通路(图 2C)。相关性分析得到Hippo通路中关键分子如YAP1、STK3、STK4和SGMS1等与copine 8有较好的相关性,说明copine 8能通过影响Hippo通路中关键分子的表达,从而影响胰腺癌的发展(图 2D)。通过构建蛋白互作网络,发现copine 8与其他蛋白有较为复杂的作用关系,可能共同影响胰腺癌的进展(图 2E)。

|
| A:热图分析高表达copine 8和低表达copine 8的胰腺癌患者基因表达情况;B:差异基因的GO和KEGG富集分析;C:高低表达copine 8患者的GSEA分析;D : copine 8与Hippo通路关键分子的相关性;E: copine 8相关分子的蛋白互作网络 图 2 copine 8在胰腺癌中的作用机制探讨 |
2.3 人胰腺癌组织中copine 8蛋白水平表达上调且定位于细胞质
通过比较配对胰腺癌和癌旁组织中copine 8蛋白表达量的差异,证实了转录组水平的结果,copine 8蛋白在胰腺癌组织中的表达高于癌旁组织(图 3A)。免疫荧光证实copine 8主要表达于胰腺癌细胞胞质中(图 3B)。

|
| A:免疫组化显示copine 8蛋白在胰腺癌组织和癌旁组织中的表达和分布情况;B:免疫荧光显示copine 8蛋白主要表达在胰腺癌细胞中的细胞质 图 3 人胰腺癌组织中copine 8蛋白水平表达情况 |
2.4 胰腺癌细胞系中copine 8的表达和敲除效率
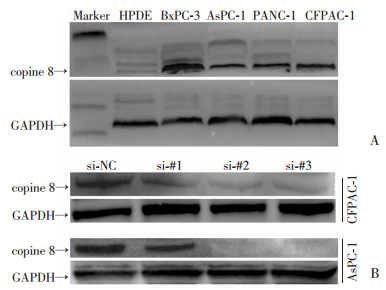
各胰腺癌细胞系包括CFPAC-1、AsPC-1、BxPC-3、PANC-1中copine 8蛋白表达均高于正常胰腺细胞系HPDE(图 4A)。利用siRNA敲除CFPAC-1和AsPC-1细胞系中的copine 8后,发现si-#2和si-#3敲除效率较高,因此将si-#3用于后续胰腺癌细胞功能实验探究(图 4B)。
|
| A:胰腺癌细胞系和正常胰腺细胞系中copine 8蛋白表达情况;B: copine 8敲除效率 图 4 Western blot检测copine 8蛋白表达情况 |
2.5 敲低copine 8对胰腺癌细胞增殖功能的影响
利用CCK8实验和集落形成实验(图 5)检测敲低copine 8后对胰腺癌细胞增殖功能的影响。CCK8实验发现在增殖到第4天时,转染si-copine 8的CFPAC-1和AsPC-1细胞的数量比转染si-NC的数量低(P < 0.05);且转染si-copine 8的CFPAC-1和AsPC-1细胞的集落形成能力明显较弱(P < 0.05)。这些结果说明干扰copine 8表达对胰腺癌细胞的增殖功能有显著影响。

|
| A: CFPAC-1的CCK8实验;B:AsPC-1的CCK8实验;C:集落形成实验检测敲低copine 8后对胰腺癌细胞增殖功能的影响;D:CFPAC-1细胞克隆形成数比较(x±s, n=3); E: AsPC-1细胞克隆形成数比较(x±s, n=3) a: P < 0.05, 与si-NC组比较 图 5 copine 8对胰腺癌细胞增殖功能的影响 |
2.6 敲低copine 8对胰腺癌细胞迁移和侵袭能力的影响
图 6展示了敲低copine 8后对胰腺癌细胞迁移和侵袭能力的影响。干扰胰腺癌细胞系CFPAC-1和AsPC-1中copine 8的表达后,两株细胞的迁移能力和侵袭能力都明显下降(P < 0.05),说明copine 8可能影响胰腺癌的侵袭转移能力。

|
| A:Transwell实验结果;B:CFPAC-1迁移细胞数比较(x±s, n=3);C:CFPAC-1侵袭细胞数比较(x±s,n=3);D:AsPC-1迁移细胞数比较(x±s,n=3);E:AsPC-1侵袭细胞数比较(x±s,n=3);a:P < 0.05, 与si-NC组比较 图 6 敲低copine 8后对胰腺癌细胞迁移和侵袭能力的影响 |
2.7 敲低copine 8对胰腺癌细胞凋亡的影响
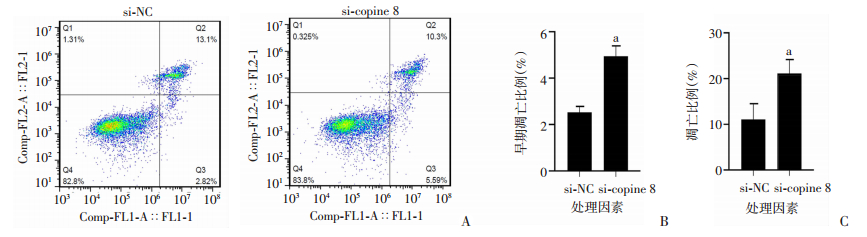
图 7显示敲低copine 8后对胰腺癌细胞凋亡的影响。由图中可以发现,干扰CFPAC-1细胞copine 8的表达后,早期凋亡的胰腺癌细胞比例和早期+晚期凋亡的细胞比例均明显增加(P < 0.05),说明copine 8可能影响胰腺癌细胞的凋亡。
|
| A:流式细胞术检测结果;B:CFPAC-1早期凋亡分析(x±s,n=3);C:CFPAC-1早期和晚期凋亡分析(x±s,n=3) a:P < 0.05,与si-NC组比较 图 7 敲低copine 8对胰腺癌细胞CFPAC-1凋亡的影响 |
3 讨论
胰腺癌作为一种高度恶性和高死亡率的消化系统肿瘤,其发生和进展的具体生物学机制还未被完全阐明[15-16]。本文通过研究copine 8在胰腺癌和癌旁组织中的表达情况和copine 8表达对胰腺癌患者生存预后的影响,结合干扰copine 8表达后胰腺癌细胞增殖、侵袭转移和凋亡等细胞功能的变化,并探究该分子对重要通路的影响,初步阐明了copine 8在胰腺癌中的重要生物学功能。
肿瘤细胞的增殖能力可能与多种因素有关,如miRNA表达[17]、信号通路活性[18]、转录因子功能[19]等。近期研究显示,同源域相互作用蛋白激酶2能通过ERK/cMyc轴抑制胰腺癌的增殖能力[20]。miR-9-5p能通过调节GOT1的表达,从而抑制胰腺癌细胞的增长[21]。本文通过细胞功能学实验,利用CCK8实验和集落形成实验在两种胰腺癌细胞系CFPAC-1和AsPC-1中均证明了干扰copine 8的表达能抑制胰腺癌细胞的增殖能力。这些结果说明了copine 8对胰腺癌细胞可能有促进生长的作用,设计并制造copine 8的靶向抑制剂可能对胰腺癌细胞的增殖有抑制作用,可以减缓胰腺癌的进展速度。
胰腺癌细胞具有较高的侵袭和转移能力,可能是该病难以治疗和死亡率较高的重要原因。MTA1被证实能通过HIF-α/VEGF信号通路促进胰腺癌细胞的侵袭和转移能力,可能是胰腺癌侵袭转移的重要机制之一[22]。KLF9不但能影响胰腺癌细胞的迁移和侵袭功能,还能通过调节MMP-9、MMP-2、Bcl-2、N-cadherin和cyclin B等分子的表达,对癌细胞的细胞周期、凋亡和上皮间质转化过程造成影响[23]。可以推断,胰腺癌的发展、转移和侵袭等过程是非常复杂的,涉及多种分子、多种通路的变化。本研究发现敲低copine 8会对胰腺癌细胞的侵袭转移能力具有较强的抑制作用,说明该分子在癌细胞侵袭转移过程中可能扮演重要的角色。copine 8可能是应对胰腺癌高侵袭转移率的潜在的治疗靶点,copine 8的靶向抑制物可能对该病的侵袭转移有重要抑制作用。
Hippo通路能促进胰腺癌的进展,其关键分子能调节胰腺星状细胞的功能和肿瘤相关巨噬细胞的募集,也与胰腺癌耐药和预后有关[24-25]。Hippo通路表达改变所导致的胰腺癌耐药性变化可能是通过调节miR-181c实现的[26]。同时,LncRNA UCA1也被证实能通过调节Hippo通路的表达,促进胰腺癌的侵袭和转移[27]。抑制Hippo通路中关键分子YAP的表达可以明显减弱胰腺癌细胞的增殖和侵袭能力,可能是胰腺癌治疗的潜在生物学靶点[28]。可以推断,Hippo通路在胰腺癌的发生和发展中起着重要作用。本研究发现,copine 8表达与Hippo通路中关键分子如YAP1、STK3、STK4、SGMS1等的表达相关,证实copine 8表达的变化可能影响Hippo通路的活性,导致胰腺癌增殖、侵袭和转移等功能的变化。因此,Hippo通路可能是copine 8影响胰腺癌细胞功能的重要机制。
本研究的不足之处在于,没有对利用TCGA数据库预测得到的通路富集结果进行验证,如WNT、Hippo、mTOR和ERBB信号通路等,仅停留于数据库分析阶段;也没有检测增殖、侵袭转移和凋亡相关基因表达,如Ki67、E-cadherin、N-cadherin、Vimentin、Bcl-2和Caspase3等。copine 8具体影响胞内重要信号通路的方式和具体过程,copine 8影响胰腺癌细胞增殖、侵袭转移和凋亡功能的具体机制,copine 8对裸鼠皮下成瘤过程的影响等将在后续实验中进行深入研究。
| [1] |
Global Burden Of Disease Cancer Collaboration, FITZMAURICE C, ABATE D, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2017: a systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2019, 5(12): 1749-1768. DOI:10.1001/jamaoncol.2019.2996 |
| [2] |
KAMISAWA T, WOOD L D, ITOI T, et al. Pancreatic cancer[J]. Lancet, 2016, 388(10039): 73-85. DOI:10.1016/s0140-6736(16)00141-0 |
| [3] |
TSAI S, EVANS D B. Therapeutic advances in localized pancreatic cancer[J]. JAMA Surg, 2016, 151(9): 862-868. DOI:10.1001/jamasurg.2016.1113 |
| [4] |
CREUTZ C E, TOMSIG J L, SNYDER S L, et al. Thecopines, a novel class of C2 domain-containing, calcium-dependent, phospholipid-binding proteins conserved from Paramecium to humans[J]. J Biol Chem, 1998, 273(3): 1393-1402. DOI:10.1074/jbc.273.3.1393 |
| [5] |
JIANG Z H, JIANG J N, ZHAO B Z, et al. CPNE1 silencing inhibits the proliferation, invasion and migration of human osteosarcoma cells[J]. Oncol Rep, 2018, 39(2): 643-650. DOI:10.3892/or.2017.6128 |
| [6] |
PARICHARTTANAKUL N M, SAHARAT K, CHOKCHAIC-HAMNANKIT D, et al. Unveiling a novel biomarker panel for diagnosis and classification of well-differentiated thyroid carcinomas[J]. Oncol Rep, 2016, 35(4): 2286-2296. DOI:10.3892/or.2016.4567 |
| [7] |
BAEK M, AHN T, KANG D, et al. CPNE7 as prognostic factor and therapeutic target in colorectal cancer[J]. Ann Surg Oncol, 2018, 25(1): S154. DOI:10.1245/s10434-018-6349-1 |
| [8] |
JEONG D, BAN S, KIM H, et al. Abstract 4455: Identification of novel oncogene, copine-7 (CPNE7), in colorectal cancer[J]. Cancer Res, 2017, 77(13): 4455. DOI:10.1158/1538-7445.am2017-4455 |
| [9] |
PAN H X, XU X J, WU D Y, et al. Novel somatic mutations identified by whole-exome sequencing in muscle-invasive transitional cell carcinoma of the bladder[J]. Oncol Lett, 2016, 11(2): 1486-1492. DOI:10.3892/ol.2016.4094 |
| [10] |
LIN H C, ZHANG F L, GENG Q, et al. Quantitative proteomic analysis identifies CPNE3 as a novel metastasis-promoting gene in NSCLC[J]. J Proteome Res, 2013, 12(7): 3423-3433. DOI:10.1021/pr400273z |
| [11] |
SAKTHIVEL K M, PRABHU VV. Copine 3 as a novel potential drug target for non-small-cell lung carcinoma[J]. J Environ Pathol Toxicol Oncol, 2017, 36(2): 107-112. DOI:10.1615/JEnvironPatholToxicolOncol.2017019540 |
| [12] |
CHOI H Y, PARK N, NA J B, et al. Direct binding of Copine3 with Jab1 activates downstream ErbB2 signaling and motility in SKBr3 breast cancer cells[J]. Oncol Rep, 2016, 35(2): 1147-1152. DOI:10.3892/or.2015.4472 |
| [13] |
HEINRICH C, KELLER C, BOULAY A, et al. Copine-Ⅲ interacts with ErbB2 and promotes tumor cell migration[J]. Oncogene, 2010, 29(11): 1598-1610. DOI:10.1038/onc.2009.456 |
| [14] |
RAMSEY H, ZHANG D E, RICHKIND K, et al. Fusion of AML1/Runx1 tocopine Ⅷ, a novel member of the copine family, in an aggressive acute myelogenous leukemia with t(12;21) translocation[J]. Leukemia, 2003, 17(8): 1665-1666. DOI:10.1038/sj.leu.2403048 |
| [15] |
MCGUIGAN A, KELLY P, TURKINGTON R C, et al. Pancreatic cancer: a review of clinical diagnosis, epidemiology, treatment and outcomes[J]. World J Gastroenterol, 2018, 24(43): 4846-4861. DOI:10.3748/wjg.v24.i43.4846 |
| [16] |
DRAPER A. Updates in pancreatic cancer: Modest gains andhopeful targets[J]. J Oncol Pharm Pract, 2019, 25(1): 101-109. DOI:10.1177/1078155218763035 |
| [17] |
CAO X M. Role of miR-337-3p and its target Rap1A inmodulating proliferation, invasion, migration and apoptosis of cervical cancer cells[J]. Cancer Biomark, 2019, 24(3): 257-267. DOI:10.3233/CBM-181225 |
| [18] |
SONG Q, CHEN Q, WANG Q M, et al. ATF-3/miR-590/GOLPH3 signaling pathwayregulates proliferation of breast cancer[J]. BMC Cancer, 2018, 18(1): 255. DOI:10.1186/s12885-018-4031-4 |
| [19] |
LU G H, SHI W L, ZHENG H Y. Inhibition of STAT6/anoctamin-1 activation suppresses proliferation and invasion of gastric cancer cells[J]. Cancer Biother Radiopharm, 2018, 33(1): 3-7. DOI:10.1089/cbr.2017.2287 |
| [20] |
QIN Y, HU Q S, JI S R, et al. Homeodomain-interacting protein kinase 2 suppresses proliferation and aerobic glycolysis via ERK/cMyc Axis in pancreatic cancer[J]. Cell Prolif, 2019, 52(3): e12603. DOI:10.1111/cpr.12603 |
| [21] |
WANG J, WANG B, REN H Q, et al. MiR-9-5p inhibits pancreatic cancer cell proliferation, invasion and glutamine metabolism by targeting GOT1[J]. Biochem Biophys Res Commun, 2019, 509(1): 241-248. DOI:10.1016/j.bbrc.2018.12.114 |
| [22] |
SUN X C, ZHANG Y, LI B S, et al. MTA1 promotes the invasion and migration of pancreatic cancer cells potentially through the HIF-α/VEGF pathway[J]. J Recept Signal Transduct Res, 2018, 38(4): 352-358. DOI:10.1080/10799893.2018.1531887 |
| [23] |
ZHONG Z W, ZHOU F, WANG D, et al. Expression of KLF9 in pancreatic cancer and its effects on the invasion, migration, apoptosis, cell cycle distribution, and proliferation of pancreatic cancer cell lines[J]. Oncol Rep, 2018, 40(6): 3852-3860. DOI:10.3892/or.2018.6760 |
| [24] |
ANSARI D, OHLSSON H, ALTHINI C, et al. The hippo signaling pathway in pancreatic cancer[J]. Anticancer Res, 2019, 39(7): 3317-3321. DOI:10.21873/anticanres.13474 |
| [25] |
EIBL G, ROZENGURT E. KRAS, YAP, and obesity in pancreatic cancer: a signaling network with multiple loops[J]. Semin Cancer Biol, 2019, 54: 50-62. DOI:10.1016/j.semcancer.2017.10.007 |
| [26] |
CHEN M Y, WANG M, XU S M, et al. Upregulation of miR-181c contributes to chemoresistance in pancreatic cancer by inactivating the Hippo signaling pathway[J]. Oncotarget, 2015, 6(42): 44466-44479. DOI:10.18632/oncotarget.6298 |
| [27] |
ZHANG M T, ZHAO Y, ZHANG Y L, et al. LncRNA UCA1 promotes migration and invasion in pancreatic cancer cells via the Hippo pathway[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(5 Pt A): 1770-1782. DOI:10.1016/j.bbadis.2018.03.005 |
| [28] |
JIANG Z D, ZHOU CC, CHENG L, et al. Inhibiting YAP expression suppresses pancreatic cancer progression by disrupting tumor-stromal interactions[J]. J Exp Clin Cancer Res, 2018, 37(1): 69. DOI:10.1186/s13046-018-0740-4 |



