2. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:高原特需药品与器材研究室;
3. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:病理生理学教研室;
4. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:全军高原医学重点实验室;
5. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:极端环境医学教育部重点实验室
2. Institute of Medicine and Equipment for High Altitude Region, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Pathophysiology, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
4. Key Laboratory of High Altitude Medicine of PLA, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
5. Key Laboratory of Extreme Environmental Medicine of Ministry of Education, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
一氧化氮(NO)是体内重要的活性分子,能舒张血管、调节血管平滑肌细胞的增殖,是维持正常的血管压力和血管结构的重要分子。NO由一氧化氮合酶(nitric oxide synthetase, NOS)催化合成,其中分布在血管内皮细胞中的一氧化氮合酶(endothelial nitric oxide synthetase, eNOS)合成的NO是机体最主要的生理来源。机体内源性NO的生成减少,血浆NO水平降低,是心血管疾病发生、发展的重要促进因素[1]。缺氧是临床常见的病理过程,也是心血管疾病发生、发展的重要原因。缺氧导致eNOS基因转录及翻译水平降低是缺氧血管内皮细胞NO产生减少的重要机制[2]。但缺氧导致eNOS表达降低的机制尚不清楚。
丁酸(butyrate)是一种短链脂肪酸,既可作为结肠上皮细胞的能源物质,也是一类组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACi),通过干预核DNA的转录活性调节基因的表达,发挥抗肿瘤、抗炎及抗氧化等功能[3-6]。研究表明,丁酸可以激活非血管内皮细胞中eNOS基因,使其开放表达[7];我们前期的研究也发现,丁酸促进启动缺氧肺血管平滑肌细胞中eNOS的表达,并使平滑肌细胞中NO的产生增多[8]。那么,丁酸对缺氧血管内皮细胞中NO的产生有何影响?机制是什么?本研究以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为细胞模型,在分析缺氧HUVECs分泌NO降低的机制的基础上,初步探讨丁酸的干预作用。
1 材料与方法 1.1 材料HUVECs由陈德伟博士惠赠;市购材料:细胞培养基DMEM(HyClone,SH30243.01);一氧化氮(NO)测试盒(碧云天,S0021);放线菌酮(cycloheximide,CHX,北京华越洋,04190);Opti-MEM培养基(ThermoFisher,31985062);Lip2000(索莱宝,L7800);Protein A+G Agarose(碧云天,P2055);兔IgG(碧云天,A7016);抗eNOS抗体(Santa cruz,SC-654,兔多克隆抗体);抗HDAC3抗体(Abcam,ab32369,兔单克隆抗体);抗Ac-lys抗体(Abcam,ab80178,兔多克隆抗体);抗Actin抗体(Sigma,A5316,鼠单克隆抗体);辣根酶标山羊抗兔抗体(中杉金桥,ZB-2301);辣根酶标山羊抗鼠抗体(中杉金桥,ZB-2305);逆转录试剂盒(ThermoFisher,18080051);荧光标记引物及PCR扩增试剂盒(ThermoFisher,4370048),ECL显色液(ThermoFisher,34095)。
1.2 方法 1.2.1 实验分组及处理方法实验分为6组,分别是:①常氧组(21%O2,N)和缺氧组(1%O2,H);②缺氧+溶剂对照组(H+D)和缺氧+丁酸组(H+B);③缺氧+干扰对照组(H+Ci)和缺氧+siRNA干扰组(H+Si)。HUVECs细胞采用含10%血清的DMEM培养基常规培养。缺氧处理采用三气培养箱(1%O2,94%N2,5%CO2)培养,常氧组细胞在常规细胞培养箱(21%O2,5% CO2)中培养,到相应时间点行后续实验;在三气培养箱(1%O2,94%N2,5%CO2)中,缺氧+丁酸处理组细胞采用含10%血清以及丁酸(终浓度4 mmol/L)的DMEM培养基培养6 h,缺氧+溶剂对照组细胞的培养基中,不加入丁酸,加入等量的溶剂(不含血清的DMEM溶液)。siRNA干扰处理方法参见1.2.5。
1.2.2 硝酸还原法检测NO在实验处理后的相应时间点,收集细胞培养上清,按NO检测试剂盒说明书操作。收集各实验组的培养细胞,尿素裂解液提取细胞蛋白,BCA法测定蛋白浓度。用培养上清液中NO的含量与细胞蛋白含量的比值代表各组NO的相对水平。
1.2.3 荧光定量PCR检测目的基因转录水平采用TRIzol法提取细胞总RNA。取1 μg总RNA,采用Superscript Ⅲ Third-Strand Synthesis Kit (Invitrogen)进行逆转录获得cDNA。取cDNA产物梯度稀释,采用实时荧光定量PCR试剂盒进行扩增,Step One Plus Real-time System测定扩增产物荧光值,绘制标准曲线,以β-actin为内参,计算目的基因的mRNA相对水平。eNOS的上游引物为5′-TGGCAGCCCTAAGACCTATG-3′,下游引物为5′-AGTCCGAAAATGTCCTCG-TG-3′;β-actin的上游引物为5′-TCATGAAGTGTGAC-GTTGACATCCGT-3′,下游引物为5′-CCTAGAAGCAT-TTGCGGTGCAGGATG-3′。反应程序:94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,重复36个循环。
1.2.4 蛋白半衰期检测实验前1 d接种细胞。细胞贴壁生长后,行常氧和缺氧处理。在实验处理后的相应时间点,分别加入放线菌酮(CHX,终浓度为10 μmol/L),继续在相应处理条件下分别培养1、2 h和4 h,收集细胞,提取总蛋白,同时收集未加入CHX的细胞,提取总蛋白冻存备用。采用免疫印迹技术检测eNOS蛋白水平(参见1.2.6),以β-actin为内参照,计算不同时间点eNOS蛋白相对量,计算蛋白半衰期。
1.2.5 siRNA干扰实验将0.1 nmoL siRNA加入200 μL Opti-MEM培养基,加入5 μL Lip2000,轻柔混匀,室温静置20 min。将siRNA/Lip2000复合物加入细胞密度约80%的细胞培养皿,常氧培养6 h后更换为含10%血清的DMEM培养基,常氧培养24 h后,更换培养基,置于三气培养箱(1%O2,94%N2,5%CO2)中进行缺氧处理。其中转染无关siRNA的细胞分组为缺氧+干扰对照组,转染靶向HDAC3的siRNA的细胞分组为缺氧+siRNA干扰组。缺氧6 h后检测HDAC3和eNOS的蛋白水平。
1.2.6 免疫印迹技术检测蛋白表达在实验处理后的相应时间点,低温收集各实验组的细胞,尿素裂解液提取细胞蛋白,BCA法测定蛋白浓度。取20 μg蛋白样品,加入蛋白上样缓冲液,100 ℃,5 min,离心收集上清,行SDS聚丙烯酰胺凝胶电泳。采用湿转法转膜后,用含5%脱脂牛奶的TBST溶液室温封闭1 h。TBST洗膜后,分别加入抗eNOS抗体(1 :500)、抗HDAC3抗体(1 :1 000)、抗Ac-lys抗体(1 :1 000)、抗Actin抗体(1 :2 000),4 ℃孵育过夜。TBST洗涤3次后,加入辣根酶标山羊抗兔抗体(1 :2 000)或辣根酶标山羊抗鼠抗体(1 :2 000),室温孵育1 h,TBST洗涤3次,ECL显色,Bio-Rad凝胶成像仪显影照相。
1.2.7 免疫共沉淀技术(CO-IP)检测HDAC3和eNOS相互作用采用碧云天公司IP裂解液提取细胞总蛋白,按试剂盒说明操作。取500 μL细胞裂解液,加入10 μL普通兔IgG和20 μL Protein A+G agarose,4 ℃混匀孵育30 min,10 000 ×g离心5 min,取上清。加入10 μL抗eNOS或抗HDAC3抗体,4 ℃混匀孵育过夜,加入40 μL充分重悬的Protein A+G agarose,4 ℃混匀孵育2 h。10 000×g离心5 min,吸除上清,加入500 μL预冷PBS洗涤沉淀3次,加蛋白上样缓冲液重悬沉淀,100 ℃煮沸10 min,10 000×g离心5 min,收集上清,行SDS聚丙烯酰胺凝胶电泳,免疫印迹技术检测HDAC3蛋白、eNOS蛋白、乙酰化赖氨酸的水平。
1.3 统计学分析采用SPSS 13.0统计软件进行分析,实验数据以x±s表示,组间采用独立样本t检验,检验水准:α=0.05。
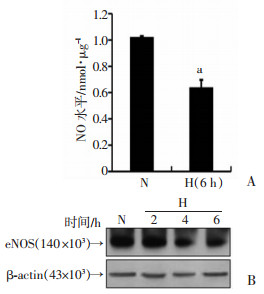
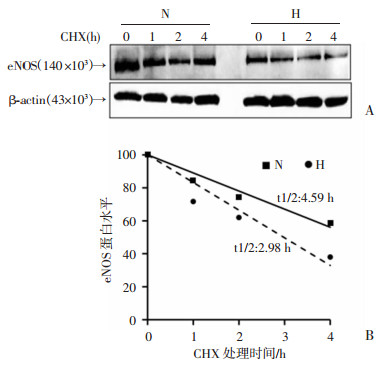
2 结果 2.1 缺氧对HUVECs中NO分泌和eNOS表达的影响缺氧(1%O2,H)6 h时,HUVECs培养上清中NO水平降低,与常氧组(21%O2,N)相比,差异具有统计学意义(P < 0.05, 图 1A)。与常氧组细胞相比,缺氧HUVECs中eNOS的mRNA水平没有显著变化[(0.46±0.035) vs (0.51±0.043),P>0.05],但eNOS的蛋白水平在缺氧6 h内持续降低(图 1B)。在缺氧处理6 h后,用放线菌酮(CHX)与HUVECs共培养,阻断细胞内蛋白翻译,用Western blot检测加入CHX不同时间点eNOS蛋白水平,作图并计算蛋白半衰期。结果显示,常氧组eNOS蛋白半衰期为4.59 h,缺氧组半衰期为2.98 h(图 2A、B)。
|
| A:硝酸还原法检测培养上清NO水平 N为常氧组;H为缺氧组;a:P < 0.05,与常氧组(N)比较; B:Western blot检测eNOS蛋白水平 N为常氧组(缺氧0 h);H(2、4、6)分别为缺氧2、4、6 h 图 1 缺氧对HUVECs中NO分泌、eNOS蛋白表达的影响 |
|
| A:Western blot检测eNOS蛋白水平 N为常氧组;H为缺氧组;0~4分别为放线菌酮(CHX)处理后的培养时间(h); B:半定量分析eNOS蛋白半衰期 图 2 缺氧对HUVECs中eNOS蛋白半衰期的影响 |
2.2 HDAC3对缺氧HUVECs中eNOS蛋白表达的影响
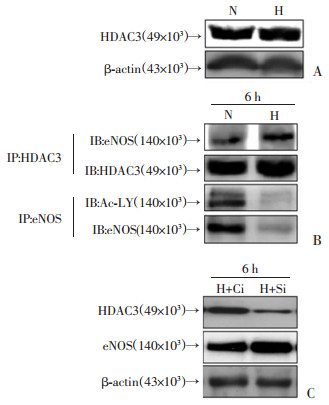
与常氧组(21%O2,N)相比,缺氧(1%O2,H)6 h时,HUVECs中HDAC3的蛋白水平没有变化(图 3A),而CO-IP的研究结果显示,缺氧HUVECs中,HDAC3与eNOS的结合增加,乙酰化的eNOS水平下降,eNOS蛋白水平下降(图 3B)。与缺氧+干扰对照组(H+Ci)相比,干扰HDAC3表达(H+Si)后,HUVECs中HDAC3蛋白水平下降,eNOS蛋白水平升高(P < 0.05,图 3C)。
|
| A:Western blot检测HDAC3蛋白水平 N为常氧组;H为缺氧组; B:CO-IP检测HDAC3和eNOS结合水平以及eNOS乙酰化水平 N为常氧组;H为缺氧组; C: Western blot检测干扰HDAC3后eNOS的蛋白水平 H+Ci为缺氧+干扰对照组;H+Si为缺氧+siRNA干扰组 图 3 HDAC3对缺氧对HUVECs中eNOS蛋白表达的影响 |
2.3 丁酸对缺氧HUVECs中NO分泌和eNOS蛋白表达的影响
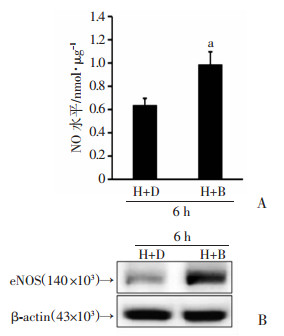
缺氧+丁酸(Bur 4 mmol/L)组(H+B)细胞中,培养上清的NO水平显著升高,与缺氧+溶剂对照组(Bur 0 mmol/L,H+D)相比,差异具有统计学意义(P < 0.05, 图 4A);同时,缺氧+丁酸(Bur 4 mmol/L)组(H+B)HUVECs中,eNOS的蛋白水平升高(图 4B)。
|
| A:硝酸还原法检测培养上清NO水平 H+D为缺氧+溶剂对照组;H+B为缺氧+丁酸组;a:P < 0.05,与缺氧+溶剂对照组(H+D)比较; B:Western blot检测eNOS蛋白水平H+D为缺氧+溶剂对照组;H+B为缺氧+丁酸组 图 4 丁酸对缺氧HUVECs中NO分泌和eNOS蛋白表达的影响 |
2.4 丁酸对缺氧HUVECs中HDAC3表达及其与eNOS结合的影响
与缺氧+溶剂对照组(Bur 0 mmol/L,H+D)相比,缺氧+丁酸(Bur, 4 mmol/L)处理组HUVECs中,HDAC3的蛋白水平没有变化,但eNOS蛋白水平升高(图 5A);Co-IP的实验结果显示,与缺氧+溶剂对照组(Bur 0 mmol/L,H+D)相比,缺氧+丁酸(Bur, 4 mmol/L)处理组HUVECs中,与HDAC3结合的eNOS蛋白水平下降,乙酰化eNOS蛋白水平升高(P < 0.05,图 5B)。

|
| A:Western blot检测HDAC3和eNOS蛋白水平 H+D为缺氧+溶剂对照组;H+B为缺氧+丁酸组; B:CO-IP检测HDAC3和eNOS结合水平以及eNOS乙酰化水平 H+D为缺氧+溶剂对照组;H+B为缺氧+丁酸组 图 5 丁酸对缺氧HUVECs中HDAC3表达及其与eNOS结合的影响 |
3 讨论
本研究发现,eNOS蛋白水平降低是缺氧导致血管内皮细胞NO分泌下降的主要原因,而HDAC3与eNOS的结合增加,eNOS蛋白的乙酰化修饰下降,稳定性降低,可能是缺氧导致eNOS蛋白水平下降的重要机制。丁酸可以抑制HDAC3-eNOS的结合,可能通过抑制eNOS的去乙酰化,增加缺氧条件下eNOS的乙酰化修饰水平,提高eNOS蛋白的稳定性,促进缺氧血管内皮细胞中NO的分泌。本研究从蛋白乙酰化修饰和蛋白稳定性调节的角度,提示缺氧抑制血管内皮细胞中eNOS蛋白表达的机制,同时也为丁酸防治缺氧引起的血管内皮细胞NO分泌失衡提供了理论依据。
血管内皮细胞位于血管壁的最内层,是机体感应微环境变化的第一道防线,通过合成和分泌多种活性物质、调节血管张力、参与免疫、炎症反应等,在维持血液循环、内环境稳定中发挥重要作用。血管内皮细胞对缺氧十分敏感,缺氧导致血管内皮细胞损伤和功能紊乱是诸多疾病的始动因素。NO是血管内皮细胞产生的重要活性分子,通过扩张血管、抑制炎症、调节细胞增殖凋亡等,维持血管结构和功能的稳定。缺氧抑制血管内皮细胞中NO的分泌,引起血管收缩、血管炎症,是肺动脉高压、动脉粥样硬化的重要机制[9-11]。本研究证实缺氧导致eNOS蛋白稳定性降低是血管内皮细胞NO分泌下降的主要原因。以往的研究通过转染eNOS基因到干细胞、平滑肌细胞、脂肪细胞中,可以激活eNOS表达,促进NO的分泌[12-15]。但本研究发现,缺氧并不影响eNOS的mRNA表达。基于血管内皮细胞功能紊乱和细胞损伤,如何维护缺氧条件下eNOS源性NO的分泌尚缺乏有效措施。本研究发现,提高eNOS蛋白水平可能是干预缺氧引起血管内皮细胞NO分泌减少的有效措施。因此,深入研究缺氧引起血管内皮细胞eNOS蛋白稳定性下降的机制,并探讨干预措施有重要的意义。
蛋白水平上的调节主要包括翻译合成的效率、蛋白降解的速度等。研究表明,eNOS的乙酰化修饰能维持其蛋白稳定性和活性。一方面乙酰化修饰的赖氨酸(Lys)基团可保护蛋白质免于泛素化修饰,从而抑制蛋白的泛素化降解[16-17],另一方面,eNOS的乙酰化可促进eNOS和钙调蛋白的结合,增加eNOS的酶活性。组蛋白去乙酰化酶HDAC3在eNOS蛋白的乙酰化与去乙酰化调控中发挥重要作用。本研究发现,缺氧并不影响HDAC3的表达,但抑制缺氧HUVECs中HDAC3的表达后,eNOS的蛋白水平显著增加。同时,在缺氧HUVECs中,HDAC3与eNOS结合增加,eNOS的乙酰化修饰下降。以往研究证实,eNOS的610位Lys乙酰化可促进eNOS与钙调蛋白结合,增加eNOS生物活性,而HDAC3可去除610位Lys乙酰化,抑制eNOS活性[18]。本研究进一步发现,缺氧可通过促进HDAC3与eNOS的相互作用,参与调节eNOS的乙酰化,同时也提示,HDAC3介导的eNOS去乙酰化可能与eNOS稳定性下降有关。因此,从干预HDAC3与eNOS结合的角度,维持eNOS蛋白的稳定性,促进缺氧血管内皮细胞中eNOS源性NO的分泌,值得深入探讨。
丁酸是一种可由膳食纤维分解产生的短链脂肪酸。丁酸在线粒体中进行氧化生成乙酰CoA,在参与提供能量物质和脂质合成的同时,也为蛋白乙酰化基团提供了重要来源[19]。以往的研究表明,丁酸可以通过组蛋白H3超乙酰化,活化eNOS基因,促进非内皮细胞eNOS表达[7]。更为重要的是,丁酸能抑制HDAC3的去乙酰化酶活性[20]。那么,丁酸是否可以通过HDAC3影响缺氧HUVECs中NO的分泌呢?本研究发现,丁酸可上调缺氧HUVECs中NO的分泌,促进缺氧HUVECs中eNOS蛋白的表达。虽然丁酸不影响缺氧HUVECs中HDAC3的蛋白表达,但丁酸能抑制缺氧条件下HDAC3与eNOS的结合,增加乙酰化eNOS蛋白的水平。本研究结果为运用丁酸干预HDAC3-eNOS相互作用,提高缺氧HUVECs中eNOS蛋白稳定性提供了实验依据。
本研究发现,缺氧并不影响eNOS的mRNA表达。研究表明,非内皮细胞不表达eNOS是因为DNA甲基化和组蛋白去乙酰化,HDACs被募集到与甲基化启动子结合的转录抑制子MeCP2,导致基因转录被抑制,丁酸可使组蛋白H3超乙酰化而活化染色质,也可抑制HDACs募集到eNOS启动子上的构成性转录因子Sp1,启动eNOS在非内皮细胞中的表达[7]。在内皮细胞中eNOS近端启动子DNA几乎不被甲基化,且组蛋白H3乙酰化水平高,因此eNOS在内皮细胞中表达。
综上,本研究初步阐述了丁酸促进缺氧血管内皮细胞NO分泌的分子机制,为丁酸用于调节缺氧血管内皮细胞NO分泌功能提供了实验依据,提示丁酸的应用可能成为预防和治疗缺氧相关的血管疾病的有效措施。
| [1] |
GODO S, SHIMOKAWA H. Divergent roles of endothelial nitric oxide synthases system in maintaining cardiovascular homeostasis[J]. Free Radic Biol Med, 2017, 109: 4-10. DOI:10.1016/j.freeradbiomed.2016.12.019 |
| [2] |
史清海, 葛迪, 伏建峰. 缺氧与血管内皮eNOS基因转录调控的研究进展[J]. 解放军医药杂志, 2019, 31(9): 108-111, 116. SHI Q H, GE D, FU J F. Hypoxia and regulation of eNOS gene transcription in vascular endothelium[J]. Med Pharm J Chin PLA, 2019, 31(9): 108-111, 116. |
| [3] |
WANG C C, WU H, LIN F H, et al. Sodium butyrate enhances intestinal integrity, inhibits mast cell activation, inflammatory mediator production and JNK signaling pathway in weaned pigs[J]. Innate Immun, 2018, 24(1): 40-46. DOI:10.1177/1753425917741970 |
| [4] |
MATHEW O P, RANGANNA K, MILTON S G. Involvement of the antioxidant effect and anti-inflammatory response in butyrate-inhibited vascular smooth muscle cell proliferation[J]. Pharmaceuticals (Basel), 2014, 7(11): 1008-1027. DOI:10.3390/ph7111008 |
| [5] |
FALKENBERG K J, JOHNSTONE R W. Histone deacetylases and their inhibitors in cancer, neurological diseases and immune disorders[J]. Nat Rev Drug Discov, 2014, 13(9): 673-691. DOI:10.1038/nrd4360 |
| [6] |
向仕权, 谭小玲, 冯岚, 等. 丁酸钠抑制缺氧致人脐静脉内皮细胞通透性增加及机制[J]. 第三军医大学学报, 2016, 38(14): 1609-1614. XIANG S Q, TAN X L, FENG L, et al. Butyrate suppresses hypoxia-induced hyperpermeability in human umbelical vein endothelial cells[J]. J Third Mil Med Univ, 2016, 38(14): 1609-1614. DOI:10.16016/j.1000-5404.20151118 |
| [7] |
GAN Y H, SHEN Y H, WANG J, et al. Role of histone deacetylation in cell-specific expression of endothelial nitric-oxide synthase[J]. J Biol Chem, 2005, 280(16): 16467-16475. DOI:10.1074/jbc.M412960200 |
| [8] |
TAN X L, FENG L, HUANG X Y, et al. Histone deacetylase inhibitors promote Enos expression in vascular smooth muscle cells and suppress hypoxia-induced cell growth[J]. J Cell Mol Med, 2017, 21(9): 2022-2035. DOI:10.1111/jcmm.13122 |
| [9] |
MORAGA F A, MIRANDA G, LÓPEZ V, et al. Chronic intermittent hypobaric hypoxia (4600 M) attenuates pulmonary vasodilation induced by acetylcholine or sodium nitroprusside[J]. High Alt Med Biol, 2018, 19(2): 149-155. DOI:10.1089/ham.2017.0012 |
| [10] |
冯恩志, 黄宁侠, 杨生岳, 等. 高原低氧性肺动脉高压与肺血管内皮功能的相关性研究[J]. 中华肺部疾病杂志(电子版), 2016, 9(3): 248-251. FENG E Z, HUANG N X, YANG S Y, et al. Investigate the relationship between the hypoxia pulmonary artery hypertension and pulmonary vascular endothelial function at high altitude[J]. Chin J Lung Dis Electron Ed, 2016, 9(3): 248-251. DOI:10.3877/cma.j.issn.1674-6902.2016.03.003 |
| [11] |
ROTH L, VAN DER DONCKT C, EMINI VESELI B, et al. Nitric oxide donor molsidomine favors features of atherosclerotic plaque stability and reduces myocardial infarction in mice[J]. Vascul Pharmacol, 2019, 118/119: 106561. DOI:10.1016/j.vph.2019.05.001 |
| [12] |
MCILHENNY S, ZHANG P, TULENKO T, et al. Enos transfection of adipose-derived stem cells yields bioactive nitric oxide production and improved results in vascular tissue engineering[J]. J Tissue Eng Regen Med, 2015, 9(11): 1277-1285. DOI:10.1002/term.1645 |
| [13] |
D'SOUZA F M, SPARKS R L, CHEN H Y, et al. Mechanism of Enos gene transfer inhibition of vascular smooth muscle cell proliferation[J]. Am J Physiol, Cell Physiol, 2003, 284(1): C191-C199. DOI:10.1152/ajpcell.00179.2002 |
| [14] |
KULLO I J, SCHWARTZ R S, POMPILI V J, et al. Expression and function of recombinant endothelial NO synthase in coronary artery smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 1997, 17(11): 2405-2412. DOI:10.1161/01.atv.17.11.2405 |
| [15] |
SATO J, NAIR K, HIDDINGA J, et al. Enos gene transfer to vascular smooth muscle cells inhibits cell proliferation via upregulation of p27 and p21 and not apoptosis[J]. Cardiovasc Res, 2000, 47(4): 697-706. DOI:10.1016/s0008-6363(00)00137-1 |
| [16] |
YANG F, ZHU B, LIU J, et al. The effect of acetylation on the protein stability of BmApoLp-Ⅲ in the silkworm, Bombyx mori[J]. Insect Mol Biol, 2020, 29(1): 104-111. DOI:10.1111/imb.12613 |
| [17] |
GUO L, GUO Y Y, LI B Y, et al. Enhanced acetylation of ATP-citrate lyase promotes the progression of nonalcoholic fatty liver disease[J]. J Biol Chem, 2019, 294(31): 11805-11816. DOI:10.1074/jbc.RA119.008708 |
| [18] |
HEISS E H, DIRSCH V M. Regulation of Enos enzyme activity by posttranslational modification[J]. Curr Pharm Des, 2014, 20(22): 3503-3513. DOI:10.2174/13816128113196660745 |
| [19] |
GONÇALVES P, MARTEL F. Butyrate and colorectal cancer: the role of butyrate transport[J]. Curr Drug Metab, 2013, 14(9): 994-1008. DOI:10.2174/1389200211314090006 |
| [20] |
STELIOU K, BOOSALIS M S, PERRINE S P, et al. Butyrate histone deacetylase inhibitors[J]. Biores Open Access, 2012, 1(4): 192-198. DOI:10.1089/biores.2012.0223 |



