肺癌是癌症死亡的主要原因,占癌症总死亡人数的18.4%,其中约15%是小细胞肺癌(small cell lung cancer,SCLC)[1]。SCLC具有高度侵袭性,目前的治疗方案预后不佳,患者的整体5年生存率仍不足8%[2]。出现脑转移的SCLC患者其生存期更短,确诊时即伴有脑转移的患者中位生存期仅为4.9个月[3],确诊时无脑转移的广泛期SCLC患者,在疾病过程中,1年内脑转移的累积风险可达到40.4%[4]。目前化疗仍然是SCLC患者的标准一线治疗选择,NCCN指南推荐伊立替康或者依托泊苷联合铂类均为SCLC的一线化疗方案。伊立替康是喜树碱类似物,能抑制核拓扑异构酶Ⅰ,从而干扰DNA的合成和影响有丝分裂,其能一定程度穿过血-脑屏障[5]。研究发现,在SCLC的二线治疗中,伊立替康单一疗法可以显著延长SCLC脑转移患者的生存时间[6-7]。为了更进一步了解伊立替康对SCLC患者脑转移的影响,本研究回顾性分析了2011年11月至2018年7月收治的126例确诊时无脑转移的SCLC患者一线使用伊立替康或者依托泊苷联合铂类化疗后疗效和脑转移的情况。
1 资料与方法 1.1 病例资料2011年11月至2018年7月本院收治的SCLC患者为研究对象。纳入标准:①初治患者,临床病理确诊为小细胞肺癌,且确诊时无脑转移;②一线采用伊立替康或者依托泊苷联合铂类化疗,且至少化疗2周期;③有完整的影像学随访资料。排除标准:①一线化疗后进行了手术的患者;②预期生存期≤3个月;③在一线PFS出现之前存在方案交叉或者更改其他化疗方案的患者。
1.2 治疗方法① 伊立替康组(IP组):伊立替康注射液(商品名艾力,江苏恒瑞医药股份有限公司,100 mg/支)175 mg/m2,静脉滴注,D1;②依托泊苷组(EP组):依托泊苷注射液(商品名足叶乙甙,齐鲁制药有限公司,0.1 g/支)100 mg/m2,静脉滴注,D1~D3。各组均以21 d为1个周期。
1.3 评定标准和随访参照RECIST 1.1版标准进行随访和近期疗效评估,疗效评定分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD);以CR+PR计算客观缓解率(ORR),CR+PR+SD计算疾病控制率(DCR)。无进展生存期(PFS)指从治疗之日起至首次观察到疾病进展之日或死亡的日期。中枢神经系统肿瘤进展时间(CNS TTP)指从治疗开始到出现脑转移的持续时间。通过患者在本院就诊以及电话随访患者进展情况(进展时间及部位)和生存状态,末次随访时间为2019年6月,中位随访时间为6.85个月。
1.4 倾向性配对使用EmpowerStats软件,根据患者的性别、年龄、吸烟史、美国退伍军人肺癌协会(VALG)分期、TNM分期、转移灶位置(分为肝转移、骨转移、其他转移)按照1 :2配对原则进行配对。
1.5 统计学分析使用SPSS 20.0统计软件进行分析。计数资料采用χ2检验,计量资料采用t检验。使用Kaplan-Meier方法进行生存分析,COX回归估算风险比(HR)。使用EmpowerStats软件计算中枢神经系统进展、非中枢神经系统进展的累积发生率(CIR)。P < 0.05表示差异有统计学意义。
2 结果 2.1 两组基线特征及组间均衡性检验共纳入225例SCLC患者,根据患者基线时的性别、年龄、吸烟史、VALG分期、TNM分期、转移灶位置(分为肝转移、骨转移、其他转移、无转移)进行1 :2配对,最后共有126例患者纳入研究,其中IP组84例,EP组42例。两组患者的性别、年龄、吸烟史、VALG分期、远处转移等资料差异无统计学意义(P>0.05,表 1),具有可比性。
| 特性 | EP组(n=42) | IP组(n=84) | P值 |
| 性别 | 0.527 | ||
| 男 | 35 | 66 | |
| 女 | 7 | 18 | |
| 年龄/岁 | 56.21±9.60 | 55.64±9.53 | 0.752 |
| 吸烟史 | 0.765 | ||
| 有 | 33 | 64 | |
| 无 | 9 | 20 | |
| VALG分期 | 0.801 | ||
| 广泛期 | 20 | 42 | |
| 局限期 | 22 | 42 | |
| 有无远处转移 | 1.000 | ||
| 有 | 20 | 40 | |
| 无 | 22 | 44 | |
| 骨转移 | 0.418 | ||
| 有 | 4 | 14 | |
| 无 | 38 | 70 | |
| 肝转移 | 0.714 | ||
| 有 | 4 | 5 | |
| 无 | 38 | 79 | |
| 放疗史 | 0.052 | ||
| 有 | 11 | 37 | |
| 无 | 31 | 47 | |
| 化疗周期(个) | 3.98±1.35 | 4.08±1.67 | 0.719 |
2.2 小细胞肺癌患者不同化疗方案近期疗效 2.2.1 两组客观缓解率和疾病控制率
IP组和EP组的ORR分别为79.8%、76.2%,两者差异无统计学意义(P=0.645),DCR分别为89.3%、92.9%,差异也无统计学意义(P=0.748,表 2)。亚组分析显示,两组在局限期以及广泛期的ORR、DCR差异均无统计学意义(P>0.05)。
| 化疗方案 | CR+PR | SD | PD | ORR | DCR |
| IP组(n=84) | 67 | 8 | 9 | 0.798 | 0.893 |
| EP组(n=42) | 32 | 7 | 3 | 0.762 | 0.929 |
| P值 | 0.645 | 0.748 |
2.2.2 两组治疗后中位PFS
IP组中位PFS为7.500±0.779(5.974~9.026)个月,EP组中位PFS为5.500±0.648(4.230~6.770)个月,两者差异有统计学意义(P=0.015)。亚组分析显示,两组广泛期的中位PFS分别为6.9、4.6个月,差异无统计学意义(P= 0.222),而局限期的中位PFS分别为8.6、5.9个月,差异有统计学意义(P=0.024)。同时分析局限期SCLC患者一线化疗联合原发灶放疗与单纯化疗两组中位PFS分别为(9.500±0.863)、(5.500±0.758)个月,两者差异有统计学意义(P=0.008,图 1)。对局限期患者的性别、年龄、吸烟史、TNM分期、放疗史、治疗方式等进行多因素COX回归分析,结果显示联合放疗和使用伊立替康是患者中位PFS延长的独立影响因素(图 2)。
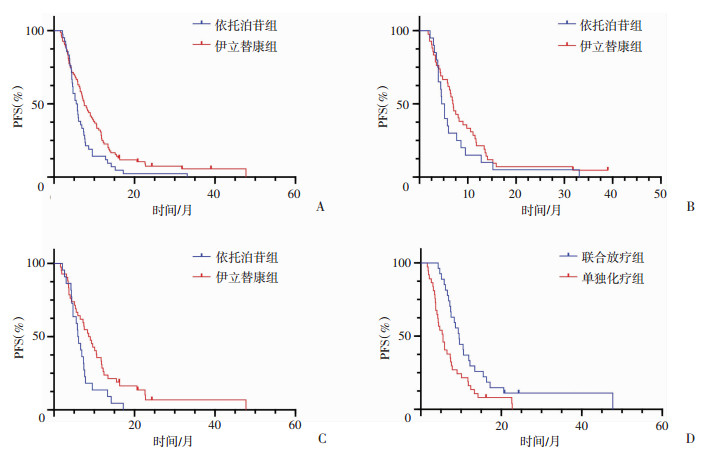
|
| A:所有患者两种方案对比;B:广泛期患者两种方案对比;C:局限期患者两种方案对比;D:局限期患者是否联合放疗对比 图 1 不同治疗方案对SCLC患者PFS的影响 |
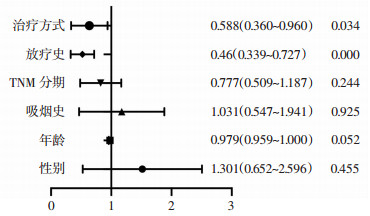
|
| 图 2 局限期SCLC患者中位PFS的多因素分析 |
2.3 不同化疗方案对小细胞肺癌患者脑转移的影响 2.3.1 CNS TTP
随访期内,IP组有19人出现脑转移,EP组有13人出现脑转移。Kaplan-Meier分析显示,随访期内IP组的中位CNS TTP未出现,EP组的中位CNS TTP为9.500±1.638(6.290~12.710)个月,两组差异有统计学意义(P=0.035)。亚组分析显示,广泛期和局限期IP组的中位CNS TTP均未出现,而EP组的广泛期和局限期中位CNS TTP分别为8.6个月和9.5个月,两组在广泛期差异无统计学意义(P=0.490),而在局限期差异有统计学意义(P=0.017)。同时分析局限期SCLC患者一线化疗联合原发灶放疗与单纯化疗两组中位CNS TTP,差异无统计学意义(P=0.994,图 3)。对局限期患者的性别、年龄、吸烟史、TNM分期、放疗史、治疗方式等进行多因素COX回归分析,结果显示使用伊立替康是患者中位CNS TTP延长的独立影响因素(HR 0.270,95%CI:0.096~0.760;P=0.013)。
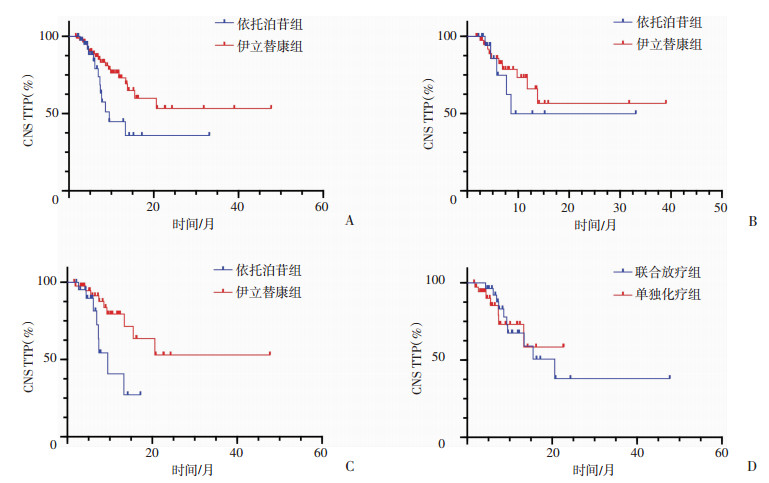
|
| A:所有患者两种方案对比;B:广泛期患者两种方案对比;C:局限期患者两种方案对比;D:局限期患者是否联合放疗对比 图 3 不同治疗方案对SCLC患者CNS TTP的影响 |
2.3.2 脑转移累积发生率
IP组和EP组患者的3个月脑转移CIR均为2.4%,半年的脑转移CIR分别为9.5%、11.9%,1年的脑转移CIR分别为17.9%、28.6%。亚组分析显示,局限期患者从第3个月开始IP组的脑转移CIR均低于EP组,IP组和EP组的3个月脑转移CIR分别为2.4%、4.6%,半年的脑转移CIR分别为7.1%、13.6%,1年的脑转移CIR分别为14.3%、31.8%。在广泛期患者无类似发现,其他进展(包括原发灶、肝转移、骨转移等)也无类似发现(图 4)。
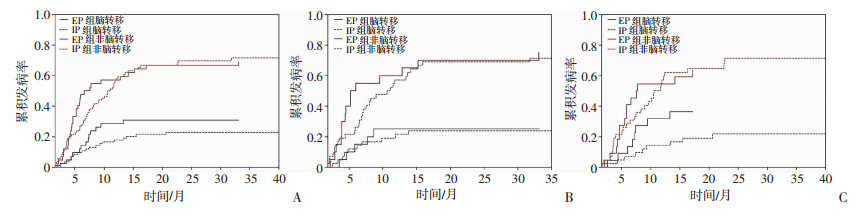
|
| A:所有患者;B:广泛期患者;C:局限期患者 图 4 两组患者脑转移、非脑转移的累积发病率 |
3 讨论
自1992年发现伊立替康后线化疗对SCLC有效以来,Noda等通过一项多中心、随机、三期研究发现伊立替康加顺铂一线治疗东亚人群广泛期SCLC的中位生存期(OS)比依托泊苷加顺铂的中位生存期长(12.8 vs 9.4个月)[8],随后的多项一线治疗广泛期SCLC的三期临床研究均发现IP组的中位PFS不劣于EP组,IP组和EP组的中位无进展时间范围分别为4.1~9个月、4.6~6个月[9-13]。陈玉洁等[14]进一步网状Meta分析也发现伊立替康较依托泊苷治疗广泛期SCLC有更好的客观反应率(ORR)。本研究显示,不管是广泛期还是局限期,IP组ORR均较EP组稍高,但两者差异无统计学意义,与既往的研究结果类似。IP组的总体中位PFS较EP组长,差异有统计学意义(7.500 vs 5.500个月,P=0.015),但亚组分析发现其在广泛期未见明显差异(P=0.222),而在局限期差异显著(P=0.024)。局限期患者一线化疗联合原发灶放疗与单纯化疗患者中位PFS分别为(9.500±0.863)、(5.500±0.758)个月,两者差异有统计学意义(P=0.008)。既往研究并未得出IP组与EP组在PFS上的统计学差异,可能与入组患者多为广泛期患者有关。本研究发现,对局限期小细胞肺癌,一线伊立替康联合铂类化疗可能会获得更好的效果,同时在一线化疗基础上联合原发灶放疗可以明显提高中位无进展时间。
脑转移是小细胞肺癌(SCLC)常见的远处转移方式之一,脑转移后患者的预后更差。虽然伊立替康和依托泊苷均能部分通过血脑屏障[5, 15],但既往有研究发现对已存在脑转移的SCLC,伊立替康联合铂类的CNS ORR(65%)大于依托泊苷联合铂类(37%)[16],且伊立替康可以显著提高SCLC脑转移患者的生存时间[6]。本研究发现,对于基线确诊时无脑转移的SCLC患者,IP组与EP组相比,局限期和广泛期小细胞肺癌患者的脑转移风险比分别为0.270(95%CI:0.096~0.760;P=0.013)和0.914(95%CI:0.281~2.973;P=0.881)。治疗3个月后,IP组的局限期患者脑转移累积发病率均低于依托泊苷组的局限期患者,其1年的脑转移累计发生率分别为14.3%、31.8%。结果显示,相对于EP方案,IP方案对基线无脑转移的SCLC患者中枢神经系统转移有一定的保护作用,进一步亚组分析发现,其对局限期SCLC患者的作用更明显,而对广泛期SCLC患者作用较小,既往很少有类似的报道。
总之,本研究表明,IP方案对基线无脑转移的初治SCLC患者中枢神经系统有保护作用,可防止或者推迟脑转移的发生。特别是对于局限期的SCLC,其作用更加明显,值得进一步深入研究。本研究属于回顾性研究,且使用依托泊苷的患者相对较少。因此,存在一定的局限性,未来需要大样本的前瞻性研究进一步证实以上观点。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
LU T, YANG X D, HUANG Y W, et al. Trends in the incidence, treatment, and survival of patients with lung cancer in the last four decades[J]. Cancer Manag Res, 2019, 11: 943-953. DOI:10.2147/CMAR.S187317 |
| [3] |
LUKAS R V, GONDI V, KAMSON D O, et al. State-of-the-art considerations in small cell lung cancer brain metastases[J]. Oncotarget, 2017, 8(41): 71223-71233. DOI:10.18632/oncotarget.19333 |
| [4] |
SCHILD S E, SIO T T, DANIELS T B, et al. Prophylactic cranial irradiation for extensive small-cell lung cancer[J]. J Oncol Pract, 2017, 13(11): 732-738. DOI:10.1200/JOP.2017.026765 |
| [5] |
MOHAMMAD A S, GRIFFITH J I, ADKINS C E, et al. Liposomal irinotecan accumulates in metastatic lesions, crosses the blood-tumor barrier (BTB), and prolongs survival in an experimental model of brain metastases of triple negative breast cancer[J]. Pharm Res, 2018, 35(2): 31. DOI:10.1007/s11095-017-2278-0 |
| [6] |
SEVINC A, KALENDER M E, ALTINBAS M, et al. Irinotecan as a second-line monotherapy for small cell lung cancer[J]. Asian Pac J Cancer Prev, 2011, 12(4): 1055-1059. DOI:10.1097/01.cad.0000390767.85658.83 |
| [7] |
ABDEL KARIM N, BHATT A, CHIEC L, et al. Systemic chemotherapy for progression of brain metastases in extensive-stage small cell lung cancer[J]. Case Rep Oncol Med, 2015, 2015: 620582. DOI:10.1155/2015/620582 |
| [8] |
NODA K, NISHIWAKI Y, KAWAHARA M, et al. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J]. N Engl J Med, 2002, 346(2): 85-91. DOI:10.1056/NEJMoa003034 |
| [9] |
HANNA N, BUNN P A Jr, LANGER C, et al. Randomized phase Ⅲ trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J]. J Clin Oncol, 2006, 24(13): 2038-2043. DOI:10.1200/JCO.2005.04.8595 |
| [10] |
LARA P N Jr, NATALE R, CROWLEY J, et al. Phase Ⅲ trial of irinotecan/cisplatin compared with etoposide/cisplatin in extensive-stage small-cell lung cancer: clinical and pharmacogenomic results from SWOG S0124[J]. J Clin Oncol, 2009, 27(15): 2530-2535. DOI:10.1200/JCO.2008.20.1061 |
| [11] |
SCHMITTEL A, SEBASTIAN M, FISCHER VON WEIKERSTHAL L, et al. A German multicenter, randomized phase Ⅲ trial comparing irinotecan-carboplatin with etoposide-carboplatin as first-line therapy for extensive-disease small-cell lung cancer[J]. Ann Oncol, 2011, 22(8): 1798-1804. DOI:10.1093/annonc/mdq652 |
| [12] |
SCHMITTEL A, FISCHER VON WEIKERSTHAL L, SEBASTIAN M, et al. A randomized phase Ⅱ trial of irinotecan plus carboplatin versus etoposide plus carboplatin treatment in patients with extended disease small-cell lung cancer[J]. Ann Oncol, 2006, 17(4): 663-667. DOI:10.1093/annonc/mdj137 |
| [13] |
KIM D W, KIM H G, KIM J H, et al. Randomized phase Ⅲ trial of irinotecan plus cisplatin versus etoposide plus cisplatin in chemotherapy-naïve Korean patients with extensive-disease small cell lung cancer[J]. Cancer Res Treat, 2019, 51(1): 119-127. DOI:10.4143/crt.2018.019 |
| [14] |
陈玉洁, 陈凌霄, 钟殿胜, 等. 一线化疗方案治疗广泛期小细胞肺癌的网状meta分析[J]. 中国肺癌杂志, 2016, 19(4): 184-191. CHEN Y J, CHEN L X, ZHONG D S, et al. First-line chemotherapy for extensive-disease small cell lung cancer: A network meta-analysis[J]. Chin J Lung Cancer, 2016, 19(4): 184-191. DOI:10.3779/j.issn.1009-3419.2016.04.02 |
| [15] |
KUO Y C, CHANG Y H, RAJESH R. Targeted delivery of etoposide, carmustine and doxorubicin to human glioblastoma cells using methoxy poly(ethylene glycol)-poly(ε caprolactone) nanoparticles conjugated with wheat germ agglutinin and folic acid[J]. Mater Sci Eng C Mater Biol Appl, 2019, 96: 114-128. DOI:10.1016/j.msec.2018.10.094 |
| [16] |
SUN Y W, XU J, ZHOU J, et al. Targeted drugs for systemic therapy of lung cancer with brain metastases[J]. Oncotarget, 2018, 9(4): 5459-5472. DOI:10.18632/oncotarget.23616 |



