乙型肝炎病毒(hepatitis B virus, HBV)是我国肝癌发生的主要危险因素之一,在原发性肝癌(hepatocellular carcinoma,HCC)的发生、发展中起重要作用。HCC居全球癌症死亡率第2位,在中国也是排名前三的恶性肿瘤之一[1]。流行病学调查显示,HBV携带者患HCC的危险性比非携带者高出100倍以上,但其致癌机制尚未完全阐明。已有证据表明,乙型肝炎病毒X(hepatitis B virus X,HBx)基因及其编码的蛋白质是导致HCC发生、发展的重要因素[2]。所以,对HBx基因功能以及致癌机制的研究对HCC的治疗有着重要意义。
HIPPO信号通路的核心因子YAP可通过激活或抑制下游靶基因的转录因子,参与细胞增殖、组织增长,由此控制器官大小和形状[3],在肝癌的发生、发展中起到重要作用。但HBx能否通过影响HIPPO信号通路从而诱导肝癌的发生尚不明确。本研究将课题组前期构建的动物模型常规饲养360 d后,有部分小鼠发生肝癌;在此基础上检测与增殖、凋亡相关的HIPPO信号通路相关因子在致癌过程不同阶段的表达,研究HBx诱导肝癌发生、发展中HIPPO信号通路的变化情况,探究HBx诱导肝癌发生的机制,为HBx致肝癌的早期预防、诊断和治疗奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞与动物永生化小鼠肝前体细胞株14-19由美国芝加哥大学分子肿瘤研究中心馈赠,EGFP-14-19和HBx-EGFP-14-19稳定转染慢病毒细胞株由本课题组前期构建并保存。无特殊病原体(specific pathogen free, SPF)级昆明小鼠由重庆医科大学实验动物中心提供并代为饲养。
1.1.2 主要试剂FBS胎牛血清购自CELL BOX公司,细胞培养基DMEM(高糖)购自HyClone公司,TRIzol总RNA提取试剂盒购自北京康为世纪生物科技有限公司,逆转录试剂盒和TB Green Premix Ex TaqTM实时荧光定量试剂盒购自TaKaRa公司,HBx抗体购自Abcam公司,GAPDH抗体和YAP1抗体购自万类生物科技有限公司,p-YAP1抗体购自Cell Signaling Technology公司,MST1抗体及p-MST1抗体均购自北京博奥森生物技术有限公司,SDS-PAGE凝胶配置试剂盒购自碧云天生物技术公司,ECL显影液购自Advansta公司,DAB显色液及免疫组化S-P试剂盒购自北京中山金桥生物技术有限公司。
1.2 方法 1.2.1 细胞复苏及培养复苏小鼠肝前体细胞株14-19、EGFP-14-19和HBx-EGFP-14-19,于含有12%胎牛血清和1%双抗的DMEM(高糖)培养基中培养,培养箱温度37 ℃,CO2浓度5%,待细胞长至80%以上,进行常规冻存、传代及后续试验。
1.2.2 动物模型的构建及分组45只6~8周龄、体质量(20±2)g的雄性昆明小鼠随机分为生理盐水(normal saline group, NS)组、EGFP-14-19组和HBx-EGFP-14-19组。建模参考文献[4]方法:小鼠术前禁食1 d,麻醉后于腹部酒精消毒,剑突下行2 cm左右纵向切口使肝脏暴露,找到肝脏后方的肝门静脉,轻柔挑起,于门静脉远端用血管夹夹毕,近端缓慢注射生理盐水200 μL、EGFP-14-19或HBx-EGFP-14-19细胞悬液(200 μL含5×105细胞的PBS溶液),注射完毕后以干棉球按压止血,待血止住后缝合腹腔。手术后分别于30、90、180、360 d处死小鼠,收取肝脏组织,一部分浸泡于4%多聚甲醛,其余组织储存于液氮罐中用于后续实验。
1.2.3 免疫组化法取小鼠新鲜肝脏浸泡于4%多聚甲醛48 h后,常规石蜡包埋切片。后续按S-P法说明书进行操作,200倍光学显微镜观察并拍照。
1.2.4 HE染色组织切片脱蜡后常规流程染色,中性树脂封片,于光学显微镜观察并拍照。
1.2.5 RT-PCR检测总RNA提取试剂盒分别提取各组小鼠RNA,将RNA按照逆转录试剂盒的操作说明转录为cDNA,无酶水将cDNA稀释10倍(测HBx不稀释),采用10 μL体系的SYBRGreen法进行检测(样本cDNA 2 μL,上下引物稀释100倍后各0.5 μL,SYBR 5 μL,加无酶水补齐至10 μL),每组各3个复孔,实验重复3次,引物见表 1。采用2-ΔΔCt法进行目标基因相对表达量计算分析。
| 基因 | 引物序列 | 产物长度/bp |
| GAPDH | 上游:5′-CTCGTCCCGTAGACAAAATGGT-3′ 下游:5′-GAGGTCAATGAAGGGGTCGTT-3′ |
131 |
| HBx | 上游:5′-TGCGGACGACCCTTCTCGGG -3′ 下游:5′-GGGCAACATTCGGTGGGCGT-3′ |
195 |
| MST1 | 上游:5′-CTTCCACTACAACATGAGCAGC-3′ 下游:5′-TGCAGGTCCGCACATAATCTT-3′ |
128 |
| YAP1 | 上游:5′-ACCCTCGTTTTGCCATGAAC-3′ 下游:5′-TGTGCTGGGATTGATATTCCGTA-3′ |
221 |
1.2.6 Western blot检测
取适量小鼠肝脏组织于液氮研磨,加入适量预配好的裂解液(RIPA:PMSF:蛋白磷酸酶抑制剂=100:1:2),超声10 s后冰上裂解40 min,每隔10 min需振荡1次,使蛋白裂解更充分,裂解完毕后于4 ℃,12 000 r/min离心10 min,小心吸取上清液,储存于做好标记的EP管中,用BCA法测上清液中蛋白浓度,剩余上清液加入蛋白上样缓冲液,100 ℃变性5 min,放至室温后于-20 ℃保存。10%SDS-PAGE胶电泳至溴酚蓝染料前沿到胶底部,250 mA恒流电转蛋白至PVDF膜上,5%脱脂奶粉室温封闭2 h,4℃摇床一抗敷育过夜,TBST洗除膜上多余的一抗后二抗敷育2 h,ECL显色法显色。Image Lab软件测量各目的条带的灰度值。
1.3 统计学分析采用SPSS 21.0统计软件,数据以x±s表示,采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 14-19、EGFP-14-19与HBx-EGFP-14-19细胞株HBx的鉴定Western blot与RT-PCR检测结果显示,14-19及EGFP-14-19细胞组均无HBx表达,而HBx-EGFP-14-19细胞组中有HBx特异性表达(P < 0.01,图 1),表明HBx基因在HBx-EGFP-14-19细胞中转染成功。
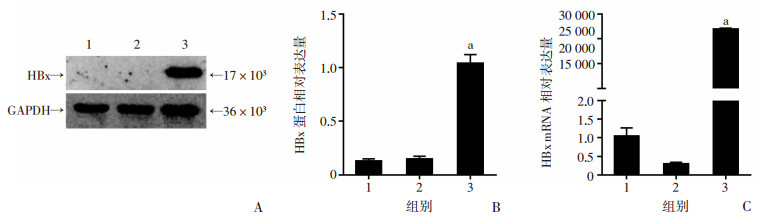
|
|
1:14-19细胞组;2:EGFP-14-19细胞组;3:HBx-EGFP-14-19细胞组;a:P < 0.01,与14-19细胞组、EGFP-14-19细胞组比较 A、B:Western blot检测细胞HBx蛋白表达及半定量分析;C:RT-PCR检测3种细胞HBx mRNA的表达 图 1 细胞株HBx的鉴定 |
2.2 小鼠肝脏组织HBx的表达鉴定
Western blot与RT-PCR检测结果显示,与NS组和EGFP-14-19组比较,HBx-EGFP-14-19组的小鼠在30、90、180、360 d时均能稳定表达HBx(P < 0.01,图 2A~C)。免疫组化法结果显示HBx-EGFP-14-19组在30、90、180、360 d的肝脏组织中均有HBx阳性表达,而NS组和EGFP-14-19组没有HBx阳性表达(图 2D),表明HBx能在小鼠肝脏中长期稳定的表达。
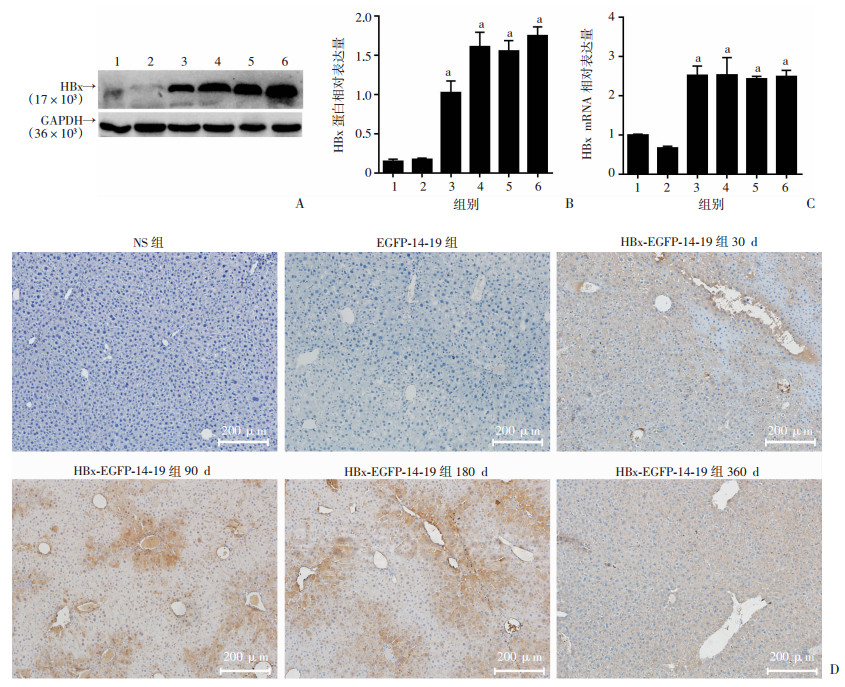
|
|
1:NS组;2:EGFP-14-19组;3~6:分别为30、90、180、360 d的HBx-EGFP-14-19组;a:P < 0.01,与14-19组、EGFP-14-19组比较 A:Western blot检测各组小鼠肝脏组织HBx蛋白表达;B:小鼠肝脏HBx蛋白相对表达量;C:RT-PCR检测各组小鼠肝脏组织HBx mRNA的表达;D:免疫组化法检测小鼠肝脏组织HBx蛋白的表达(S-P) 图 2 小鼠肝脏组织HBx的表达鉴定 |
2.3 小鼠肝脏组织肿瘤的鉴定
HBx组小鼠在处理360 d时发现有部分小鼠发生肝癌,肉眼可见结节性病灶突出于肝脏表面,直径约1 cm(图 3A)。HE染色可见癌细胞分化程度高,大小不一,异型性明显,肝小叶结构基本消失(图 3B、C)。
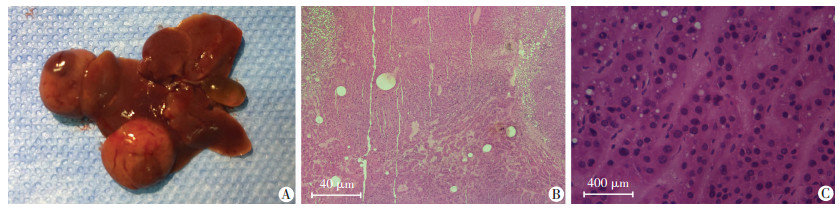
|
| A:360 d小鼠肝脏肿瘤大体观;B:低倍显微镜观察小鼠肝脏肿瘤组织(HE);C:高倍显微镜观察小鼠肝脏肿瘤组织(HE) 图 3 小鼠肝脏肿瘤组织的鉴定 |
2.4 小鼠肝脏组织感染HBx不同时期HIPPO信号通路相关因子表达变化
Western blot与RT-PCR检测小鼠肝脏组织不同时期HIPPO信号通路相关因子MST1、YAP1的表达水平,结果显示,在小鼠感染了HBx后的不同时间点,MST1的表达量持续下调(P < 0.01,图 4A、C、D),YAP1的表达持续上调(P < 0.01,图 4B、F、G)。Western blot检测磷酸化蛋白p-MST1、p-YAP1的表达水平,结果显示,p-MST1表达量持续上调(P < 0.05,图 4C、E),p-YAP1表达量持续下调(P < 0.05,图 4F、H),差异有统计学意义。表明HBx进入小鼠体内后长期抑制HIPPO信号通路上游MST1的表达,但是促进其下游效应分子YAP1的表达。
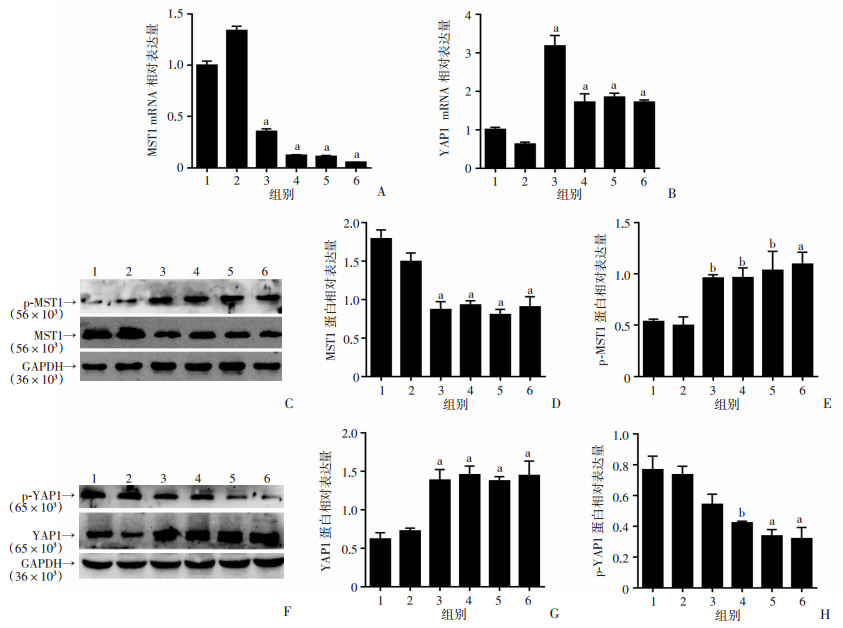
|
|
1:NS组;2:EGFP-14-19组;3~6:分别为30、90、180、360 d的HBx-EGFP-14-19组;a:P < 0.01,b:P < 0.05,与NS组、EGFP-14-19组比较 A、B:分别为小鼠肝脏组织中MST1、YAP1 mRNA的表达;C~E:Western blot检测MST1和p-MST1蛋白的表达及半定量分析;F~H:Western blot检测YAP1和p-YAP1蛋白表达及半定量分析 图 4 小鼠感染HBx后MST1、YAP1 mRNA的表达变化 |
3 讨论
HBx是HBV中高度保守的一个多功能蛋白质,可以通过与多种导致HCC发生、发展的因子直接或间接作用,调节多种细胞过程,在病毒性肝癌的发病机制中起着至关重要的作用[2]。虽然HBx通常被认为具有致癌潜力,但其是直接致癌还是仅仅作为HCC发展的辅助因子还有待研究[5-7]。并且近年来,肿瘤相关机制的研究多是在癌细胞或癌症组织中进行,所得结果究竟是导致肿瘤发生的原因还是肿瘤发生后为了维持恶性增殖状态而产生的结果却无法确定。
HIPPO信号通路最初在果蝇中发现,与细胞的增殖、凋亡和器官大小的调控相关,其核心因子MST1/2、LATS1/2、Sav和MOB1均为抑癌基因,主要效应因子YAP为癌基因。研究表明,YAP在肝癌患者中呈现高表达[8]。细胞与动物实验也证实用siRNA降低YAP表达后,肝癌细胞迅速停止增殖,并获得了肝细胞分化特征;而敲除WW45后,YAP表达量增多,肝脏体积增大,逐渐发展成为肝混合肿瘤[9-10],表明YAP表达量的增加,能导致肿瘤的发生。MST1作为YAP1上游的调节因子,主要通过磷酸化YAP1使其不能进入细胞核从而失去活性,但本研究发现,p-MST1呈现上调的趋势。其原因可能是MST1的磷酸化受到多种因子的调节,如表皮生长因子、肿瘤坏死因子、过氧化物等。在这些因子的刺激下,MST1可通过多个磷酸化位点发生磷酸化作用,而这些因子大多在肿瘤中高表达[11-13],因而p-MST1呈现上调的趋势。研究表明,MST1过表达可以促进肝癌细胞HepG2的凋亡,从而抑制肝癌细胞的生长;而敲除MST1基因会导致小鼠肝癌的发生,表明MST1表达下调也可能与肿瘤的发生密切相关[14-15]。而在ZHOU等[16]的研究中,MST1缺失后直到肝癌发生,p-YAP1表达急剧下降而YAP1蛋白表达升高。这些结果显示MST1表达量的降低,也会导致YAP1表达量的增加。可见,HIPPO信号通路被影响,在肝癌的发生中起了重要作用。ZHANG等[17]在转染了HBx的肝癌细胞系以及HBx转基因小鼠的肝癌组织中发现YAP的表达量显著上升,陈琰琰等[18]将HBx及其突变体转入人正常肝细胞系L02中,发现MST1表达下调,p-MST1/2表达上升,YAP表达上升,p-YAP表达下调。这些结果也证实了HBx可能对HIPPO信号通路产生影响,为HBV致肝癌的机制研究提供了新的依据。
本课题组的前期研究发现,小鼠成功感染HBx后肝细胞凋亡率降低,抗凋亡蛋白Bcl-2、Mcl-1表达量增高,促凋亡蛋白Bax的表达量降低[19-20]。说明HBx能抑制小鼠肝脏组织的凋亡,而抑制细胞凋亡又是肿瘤发生的重要原因之一[21]。HIPPO信号通路中YAP1可在核内与多个转录因子如TEAD家族等结合,调控细胞的增殖与凋亡;MST1的活化不仅可以促进YAP1的磷酸化,还能促进Caspase-3的活化[8]。本研究发现,HBX在进入小鼠体内30 d时即抑制了抑癌基因MST1的表达,促进了癌基因YAP1的表达,并且使其长期处于异常状态,表明HBx可能通过持续影响HIPPO信号通路,使肝脏细胞处于长期凋亡抑制状态,进而导致HCC的发生。结果提示HBx导致的HIPPO信号通路的改变很可能是HCC发生的原因,可能为HCC的早期诊断提供新的依据。
本研究通过给免疫状态完好的小鼠注射转染HBx的肝前体细胞,构建了能长期稳定表达HBx的小鼠模型,并在无其他干扰因素的情况下生成肿瘤,是比较接近自然状态的动物感染模型;通过对该模型的研究,可了解HBx在进入小鼠体内至肝癌发生过程中不同时间的作用,而在肿瘤发生前期持续存在的一些改变则很可能是导致肿瘤发生的真正原因。这为阐明HBx诱导肝癌发生、发展的机制奠定了基础,也为研究肝癌的预防、早期诊断及治疗提供了条件。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ALI A, ABDEL-HAFIZ H, SUHAIL M, et al. Hepatitis B virus, HBx mutants and their role in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(30): 10238-10248. DOI:10.3748/wjg.v20.i30.10238 |
| [3] |
ZYGULSKA A L, KRZEMIENIECKI K, PIERZCHALSKI P. Hippo pathway-brief overview of its relevance in cancer[J]. J Physiol Pharmacol, 2017, 68(3): 311-335. |
| [4] |
刘梦楠, 张婷, 刘洁, 等. 感染HBVx的肝前体细胞的小鼠体内稳定表达模型构建[J]. 基因组学与应用生物学, 2017, 36(4): 1318-1324. LIU M N, ZHANG T, LIU J, et al. Construction of stable expression model for hepatic progenitor cells infected with HBVx in mice[J]. Genom Appl Biol, 2017, 36(4): 1318-1324. DOI:10.13417/j.gab.036.001318 |
| [5] |
KENG V W, TSCHIDA B R, BELL J B, et al. Modeling hepatitis B virus X-induced hepatocellular carcinoma in mice with the Sleeping Beauty transposon system[J]. Hepatology, 2011, 53(3): 781-790. DOI:10.1002/hep.24091 |
| [6] |
MADDEN C R, FINEGOLD M J, SLAGLE B L. Hepatitis B virus X protein acts as a tumor promoter in development of diethylnitrosamine-induced preneoplastic lesions[J]. J Virol, 2001, 75(8): 3851-3858. DOI:10.1128/JVI.75.8.3851-3858.2001 |
| [7] |
KIM C M, KOIKE K, SAITO I, et al. HBx gene of hepatitis B virus induces liver cancer in transgenic mice[J]. Nature, 1991, 351(6324): 317-320. DOI:10.1038/351317a0 |
| [8] |
XU M Z, YAO T J, LEE N P, et al. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma[J]. Cancer, 2009, 115(19): 4576-4585. DOI:10.1002/cncr.24495 |
| [9] |
LEE K P, LEE J H, KIM T S, et al. The Hippo-Salvador pathway restrains hepatic oval cell proliferation, liver size, and liver tumorigenesis[J]. Proc Natl Acad Sci USA, 2010, 107(18): 8248-8253. DOI:10.1073/pnas.0912203107 |
| [10] |
FITAMANT J, KOTTAKIS F, BENHAMOUCHE S, et al. YAP inhibition restores hepatocyte differentiation in advanced HCC, leading to tumor regression[J]. Cell Rep, 2015, 10(10): 1692-1707. DOI:10.1016/j.celrep.2015.02.027 |
| [11] |
CREASY C L, CHERNOFF J. Cloning and characterization of a member of the MST subfamily of Ste20-like kinases[J]. Gene, 1995, 167(1/2): 303-306. DOI:10.1016/0378-1119(95)00653-2 |
| [12] |
李彩东, 陈锡莲, 杨勇卫, 等. 乙肝相关肝癌患者抗-HBx及TNF-α、IL-4和IL-12表达水平及临床意义研究[J]. 国际检验医学杂志, 2017, 38(12): 1655-1657. LI C D, CHEN X L, YANG Y W, et al. Study on the expression and clinical significance of anti-HBx, TNF-α, IL-4 and IL-12 in patients with hepatitis B related liver cancer[J]. Int J Lab Med, 2017, 38(12): 1655-1657. DOI:10.3969/j.issn.1673-4130.2017.12.026 |
| [13] |
韩少静, 郭永泽, 李帆, 等. EGFR与慢性肝病、原发性肝癌的相关性[J]. 肝脏, 2018, 23(12): 1143-1144, 1152. HAN S J, GUO Y Z, LI F, et al. Correlation of EGFR with chronic liver disease and primary liver cancer[J]. Chin Hepatol, 2018, 23(12): 1143-1144, 1152. DOI:10.14000/j.cnki.issn.1008-1704.2018.12.032 |
| [14] |
XU C M, LIU C J, HUANG W, et al. Effect of Mst1 overexpression on the growth of human hepatocellular carcinoma HepG2 cells and the sensitivity to cisplatin in vitro[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(4): 268-279. DOI:10.1093/abbs/gmt006 |
| [15] |
SONG H, MAK K K, TOPOL L, et al. Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression[J]. Proc Natl Acad Sci USA, 2010, 107(4): 1431-1436. DOI:10.1073/pnas.0911409107 |
| [16] |
ZHOU D W, CONRAD C, XIA F, et al. Mst1 and Mst2 maintain hepatocyte quiescence and suppress hepatocellular carcinoma development through inactivation of the Yap1 oncogene[J]. Cancer Cell, 2009, 16(5): 425-438. DOI:10.1016/j.ccr.2009.09.026 |
| [17] |
ZHANG T, ZHANG J P, YOU X N, et al. Hepatitis B virus X protein modulates oncogene Yes-associated protein by CREB to promote growth of hepatoma cells[J]. Hepatology, 2012, 56(6): 2051-2059. DOI:10.1002/hep.25899 |
| [18] |
陈琰琰, 朱慧芬, 杨道锋, 等. HBx及其突变体X17-3对Hippo信号途径表达的影响[J]. 第三军医大学学报, 2013, 35(16): 1704-1707. CHEN Y Y, ZHU H F, YANG D F, et al. HBx and its mutant X17-3 regulates YAP through Hippo signaling pathway in human hepatic L02 cells[J]. J Third Mil Med Univ, 2013, 35(16): 1704-1707. DOI:10.16016/j.1000-5404.2013.16.031 |
| [19] |
霍本念, 刘洁, 王薛, 等. HBx基因抑制肝前体细胞凋亡与分化的小鼠体内研究[J]. 第三军医大学学报, 2018, 40(5): 406-414. HUO B N, LIU J, WANG X, et al. HBx gene inhibits apoptosis and differentiation of hepatic progenitor cells in mice[J]. J Third Mil Med Univ, 2018, 40(5): 406-414. DOI:10.16016/j.1000-5404.201710082 |
| [20] |
王薛, 霍本念, 刘洁, 等. HBx基因激活Akt/mTOR信号通路抑制肝脏细胞凋亡[J]. 第三军医大学学报, 2019, 41(10): 931-938. WANG X, HUO B N, LIU J, et al. Hepatitis B virus X gene inhibits hepatocyte apoptosis in mice via Akt/mTOR pathway[J]. J Third Mil Med Univ, 2019, 41(10): 931-938. |
| [21] |
齐伟, 徐扬, 邱实. 细胞凋亡与肿瘤微环境作用的研究进展[J]. 医学综述, 2017, 23(22): 4433-4437, 4442. QI W, XU Y, QIU S. Research progress in apoptosis and tumormicroenvironment[J]. Med Recapitul, 2017, 23(22): 4433-4437, 4442. DOI:10.3969/j.issn.1006-2084.2017.22.012 |



