2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系毒理学研究所
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肺癌是全世界发病率和死亡率最高的恶性肿瘤[1]。2018年2月,国家癌症中心发表最新统计数据显示,肺癌发病率在全国肿瘤发病前10位中占比20.55%[2]。肺癌主要分为非小细胞肺癌(non-small-cell carcinoma,NSCLC)约85%和小细胞肺癌约15%。肺腺癌发病率逐年增长,目前已成为NSCLC中最常见的亚型,约占非小细胞肺癌的70% [3]。肺腺癌对放化疗的敏感性差,且易发生血道转移,而大部分患者在临床就诊时已是中晚期,从而错过最佳诊治时间。因此,通过高通量筛选的方法找到早发现、早诊断、早治疗肺腺癌的生物标志物,对降低肺癌的发生率、死亡率并改善肺癌患者的预后具有重要的科学价值和临床意义。
课题组前期通过甲基化芯片筛选和表达谱芯片筛选分析发现,SMAD9基因在肺癌组织中甲基化水平较高且其表达下调,因此我们推测:肺腺癌中,SMAD9可能是一个候选的抑癌基因。SMAD9基因定位于人的13q13.3染色体,该基因编码的蛋白质是SMAD家族的一员,能通过TGF-β家族成员来传递信号,比如,通过骨形态发生蛋白2 (bone morphogenetic protein,BMP)激活并与SMAD4相互作用[4]等。既往研究表明SMAD家族基因与发育及肿瘤发生关系密切。SMAD1和SMAD8在哺乳动物中枢神经发育中发挥重要作用[5]。SMAD1和SMAD5缺失时促进肿瘤细胞发生转移[6]。SMAD1/5/8信号通过内胶质胞质结构域的ALK5磷酸化调节和丝氨酸相互作用蛋白来抑制内啡肽从而影响内皮素生成[7]。有研究表明,与SMAD9可能相关的疾病包括肺动脉高压[8]、胃癌[9]、胰腺癌[10]、非典型性髓性白血病[11]等,且其在不同肿瘤中发挥的作用也不尽相同,因此需要进一步深入研究。而目前还少见有关SMAD9基因在肺癌组织中的表达情况与临床意义关系的报道。为探讨该基因在肺腺癌患者中的表达水平是否可以作为肺腺癌早发现、早诊断、早治疗的生物标志物和术后生存的标志物,本研究结合肺腺癌组织样本、肺腺癌细胞株和3-甲基胆蒽(3-methylcholanthrene,3-MCA)诱导的HBE恶性转化细胞模型,同时利用肿瘤基因图谱(the Cancer Genome Atlas,TCGA)数据库中收集的数据,分析了该基因的表达与临床病理指标以及肺腺癌患者术后生存之间的相关性。
1 资料与方法 1.1 材料 1.1.1 细胞株正常肺上皮细胞株HBE、肺腺癌细胞株A549、SPC-A-1、LTEP-a-2、NCI-H1650、NCI-H358、NCI-H1975均从中国科学院上海细胞库购买。HBE细胞采用含10%胎牛血清的DMEM培养基,肺腺癌细胞株A549、SPC-A-1、LTEP-a-2、NCI-H1650、NCI-H358、NCI-H1975采用含10%胎牛血清的RPMI1640培养基。所有细胞均在5% CO2、37 ℃恒温的细胞培养箱中培养。在HBE细胞培养过程中,采用10 μg/L的3-MCA连续染毒培养至45代,对照组采用相同剂量的DMSO处理,分别在第5、15、25、35、45代收获细胞样品,命名为P5、P15、P25、P35、P45,并通过细胞增殖实验、软琼脂集落形成实验和裸鼠成瘤实验对细胞进行恶性程度检测。
1.1.2 临床样本收集2015年4-7月陆军军医大学(第三军医大学)第一附属医院胸外科20例肺腺癌患者,其中男性8例、女性12例;年龄(63.10±1.81)岁,< 60岁为6例、≥60岁为14例,符合正态分布;所有肺腺癌组织经过病理学验证,将距离肿瘤边缘5 cm以外的肺组织作为癌旁正常对照组。取出组织样本后立即置于液氮速冻,取回后保存于-80 ℃冰箱。本研究2015年3月经第三军医大学伦理委员会批准同意后进行采集。
1.1.3 数据库临床样本肺腺癌患者基因表达和临床资料数据从TCGA数据库获取(http://tcgadata.nci.nih.gov)。肺腺癌患者的SMAD9基因的表达的数据集ID为LUNG.sampleMap/HiSeqV2_PANCAN,肺腺癌患者相关临床病理指标的数据集ID为TCGA.LUNG.sampleMap/LUNG-clinicalMatrix。获得具有SMAD9基因表达数据且进行了手术治疗的肺腺癌患者的肺癌组织510例,并收集临床病理指标(年龄、性别、肿瘤分期、临床分期)和吸烟等资料。在510例肺腺癌患者中有59例肺腺癌患者具有癌旁正常组织标本。
1.1.4 引物设计根据GeneBank中的基因序列,采用Primer Premier 5.0软件设计qPCR引物,并由上海生工生物工程技术服务有限公司合成。引物序列信息见表 1。
| 基因 | 序列(5′→3′) | 产物长度/bp |
| SMAD9 | 正向:CTACCGTCTGCAAGATCCCC 反向:AGCACCCCAACCCTTAACAAA |
161 |
| ACTIN | 正向:CATGTACGTTGCTATCCAGGC 反向:CTCCTTAATGTCACGCACGAT |
250 |
1.2 方法 1.2.1 TCGA数据库分析
将从TCGA数据库下载的关于肺腺癌患者SMAD9基因表达的数据进行整理,并与其临床资料进行匹配合并,再根据数据库中SMAD9基因的表达的量,对510例肺腺癌患者取中位数进行分组,将高于中位数的病例定义为高表达组(255例),低于中位数的病例定义为低表达组(255例)。然后对肺癌组织、癌旁正常组织及临床指标进行分析。
1.2.2 细胞和组织总RNA提取细胞样品:在培养皿中加入2 mL PBS冲洗2次,加入1 mL TRIzol(美国Invitrogen)冲打下细胞。组织样品:取300~500 mg组织,放于预冷的研磨器中,加入1 mL TRIzol进行充分研磨。分别将悬液转移至新的1.5 mL EP管中,加入0.4 mL的氯仿,上下充分颠倒混匀。室温静置3 min后,12 000 r/min,15 min,4 ℃离心。取上清无色水相到新的1.5 mL EP管,然后加等体积4 ℃预冷的异丙醇,室温放置20 min。然后在12 000 r/min,15 min,4 ℃离心,弃掉上清,沉淀即为RNA。加1.0 mL 75%乙醇洗涤后,12 000 r/min,5 min,4 ℃离心。小心吸掉上清,室温放置10 min晾干乙醇,加入20~30 μL DEPC处理水溶解混匀后,测RNA的浓度值。
1.2.3 RNA反转录和qRT-PCR利用PrimeScript逆转录试剂盒(具体步骤参照美国Promega公司PrimeScriptTM RT reagent Kit with gDNA Eraser说明书),用1 μg的RNA为模板合成cDNA,用PCR仪(美国Bio-Rad)进行PCR扩增。反应体系为:上下引物各0.5 μL,cDNA为9 μL,Mix为10 μL,总体系20 μL。反应条件:第1步:95 ℃,40 s;第2步:95 ℃,40 s变性;60 ℃,40 s退火;72 ℃,50 s延伸;共45个循环;第3步:72 ℃,5 min;每个样本检测3个复孔,以Actin作为内参,采用2-△△Ct对PCR结果进行相对定量分析。
1.2.4 细胞和组织总蛋白提取细胞蛋白:倒掉培养基,每皿加2 mL PBS清洗2遍,倒掉PBS后置于冰上,加入600 μL蛋白裂解液(已加PMSF)摇晃裂解30 min,用刮板刮下置于1.5 mL离心管中,4 ℃,12 000 r/min离心20 min,移上清至新的1.5 mL离心管中于-80 ℃保存。
组织蛋白:取300~500 mg组织放入预冷的碾磨器中置于冰上,加入600 μL裂解液充分研磨后静置30 min,移至1.5 mL离心管中,12 000 r/min,4 ℃,离心20 min,取上清到新的1.5 mL离心管中,-80 ℃保存。
1.2.5 蛋白质浓度测定及Western blot检测使用BCA试剂盒(中国碧云天)进行浓度检测。根据蛋白量加适量Loading buffer混匀,加热变性后-20 ℃保存。配制SDS-PAGE凝胶,样品经电泳仪分离后4 ℃,80 V恒压转膜2 h,BSA室温封闭1 h,TBST洗3遍。4 ℃孵育一抗过夜,TBST洗膜3次,然后室温孵育二抗1 h,TBST同样条件洗3次。最后用曝光仪进行条带曝光。
1.2.6 ROC曲线分析通过对SMAD9基因mRNA表达数据和临床资料的合并整理,主要对肺腺癌患者的肿瘤组织和癌旁正常组织的基因表达以及肿瘤分期(Ⅰ~Ⅱ期和Ⅲ~Ⅳ期)的基因表达,进行ROC曲线模型分析,从而检测SMAD9基因表达在肺腺癌患者临床分子标志物筛查中的灵敏度。
1.2.7 Kaplan-Meier分析通过对SMAD9基因表达数据库的整理,同样,我们以SMAD9基因mRNA表达的中位数为界限值将肺腺癌患者(共457例,从510例肺癌患者中删除27例因没有生存时间和生存结局而无法进行生存分析的病例、24例肿瘤分期Ⅳ期的病例、2例肿瘤分期未知的病例)划分为低表达组(229例)与高表达组(228例),采用Kaplan-Meier的方法分析SMAD9基因的mRNA表达与肺腺癌患者术后生存之间的关系。统计分析结果显示差异有统计学意义`后,对肿瘤分期变量分为Ⅰ~Ⅱ期和Ⅲ期,然后分别对其使用Kaplan-Meier进行生存分析。所有患者以肺腺癌引起的死亡为结局标准。
1.2.8 细胞增殖实验构建SMAD9过表达及干扰载体(购自中国Sino Biological公司),选取SPC-A-1进行过表达实验,HBE进行干扰实验。将细胞按4 000/100 μL均匀铺于96孔板中,接种后24 h转染(转染试剂盒为美国的Promega),分别设对照组和实验组,每组设5个复孔,分别在转染后24、48、72、96 h后换液加入100 μL含有10% CCK-8(日本Dojindo)的培养基(Opti-MEM培养基为美国Gibco),37 ℃孵箱避光孵育1 h后采用酶标仪检测光密度值D(450),平行重复3次。
1.3 统计学分析采用SPSS 21.0统计软件对数据进行分析。用t检验分析SMAD9基因在肿瘤组织与癌旁正常组织中的表达差异,用方差分析检测SMAD9基因在临床肺腺癌组织与癌旁正常肺组织中、恶转细胞不同代数中的表达差异以及在不同肺腺癌细胞中的表达差异。用χ2检验分析SMAD9基因表达与不同肿瘤分期及临床分期中的差异,并分析该基因与临床基本病理指标及危险因素之间的相关性。采用Kaplan Meier方法及COX回归分析方法进行生存分析。通过ROC曲线模型分析SMAD9基因表达对患者临床分子标志物筛查的价值。检验水准α=0.05。
2 结果 2.1 SMAD9基因在肺腺癌患者癌旁正常组织和肿瘤组织的mRNA表达水平为了明确SMAD9基因在临床样本中的表达情况,我们利用GraphPad Prism软件分析了SMAD9基因在肿瘤组织(510例)中和癌旁正常组织(59例)中的表达情况,结果显示,SMAD9基因在肺腺癌组织中的表达量明显低于癌旁正常组织(t=3.551,P < 0.01,图 1A)。TCGA数据库中,在59例肿瘤组织及其配对的癌旁正常组织中也发现,SMAD9基因的表达在肿瘤组织中明显低于癌旁正常组织。两组之间的差异具有统计学意义(t=3.990,P < 0.01,图 1B)。

|
| A:TCGA数据库SMAD9基因在所有样本肿瘤组织及癌旁正常组织中的表达统计分析结果;B:TCGA数据库SMAD9基因在匹配样本肿瘤组织及癌旁正常组织中的表达统计分析结果 a:P < 0.01,与癌旁正常组织比较 图 1 SMAD9基因在肺腺癌患者的癌旁正常组织和肿瘤组织中的表达 |
2.2 SMAD9基因在肺腺癌患者组织样本、肺腺癌细胞以及3-MCA诱导HBE细胞恶性转化过程中mRNA及蛋白表达水平
我们采用qRT-PCR、Western blot方法检测该基因在不同肺腺癌细胞株、3-MCA诱导的HBE恶转细胞和腺癌患者组织样本中的mRNA和蛋白表达水平。结果显示:与HBE细胞比较,该基因在A549、SPC-A-1、LTEP-a-2、NCI-H1650、NCI-358、NCI-1975六株肺腺癌细胞中的mRNA及蛋白均是低表达(图 2A~C)。随着3-MCA诱导的HBE恶转细胞代数的不断增加,SMAD9基因的mRNA及蛋白表达呈现逐步下调趋势(图 2D~F)。肺腺癌患者肿瘤组织中SMAD9基因的mRNA及蛋白表达水平显著低于癌旁正常组织(图 2G~I)。

|
| A、B、C:分别为SMAD9基因在不同肺腺癌细胞株中的mRNA(A)表达水平、蛋白(B、C)表达水平 1: HBE; 2: A549; 3: SPC-A-1; 4: LTEP-a-2; 5: NCL-H460; 6: nCL-H358; 7: NCL-H1975;a:P < 0.05,b:P < 0.01,与HBE细胞株比较;D、E、F:分别为与DMSO对照组比较SMAD9基因在3-MCA诱导的HBE恶转细胞中的mRNA(D)表达水平、蛋白(E、F)表达水平 E: 1: DMSO; 2: 3-MCA;a:P < 0.05,b:P < 0.01,与DMSO组比较;G、H、I:分别为SMAD9基因在不同肺腺癌组织中的蛋白(I)表达水平以及代表性患者的mRNA(G)水平、蛋白(H)水平检测1: Nomal; 2: Tumor; b:P < 0.01,与癌旁正常组织比较 图 2 SMAD9基因在肺腺癌患者的肺组织、肺腺癌细胞株和3-MCA诱导HBE恶转细胞不同代数中的表达水平 |
2.3 SMAD9基因表达与肺腺癌患者临床指标和疾病危险因素之间的关系
为了判定该基因的表达情况与肺腺癌患者的临床病理指标以及疾病危险因素之间的关系,根据SMAD9基因mRNA表达的中位数对510例患者进行分组(高表达组255例,低表达组255例),然后对不同临床病理特征和不同危险因素进行统计学分析。结果显示,SMAD9基因的表达在肺腺癌N分期以及肿瘤分期中差异有统计学意义(P < 0.05),但与患者的年龄(65.37± 9.93岁,< 60岁135例、≥60岁356例)、性别(男性236例、女性274例)、是否吸烟等疾病危险因素差异无统计学意义(P>0.05,表 2)。
| 临床病理指标 及危险因素 |
n | SMAD9基因表达 | χ2 | P值 | |
| 高表达 | 低表达 | ||||
| 总人数 | 510 | 255 | 255 | ||
| 年龄 | |||||
| < 60岁 | 59 | 76 | 2.858 | 0.091 | |
| ≥60岁 | 186 | 170 | |||
| 未知 | 10 | 9 | |||
| 性别 | |||||
| 男性 | 119 | 117 | 0.032 | 0.859 | |
| 女性 | 136 | 138 | |||
| T分期 | |||||
| T1+ T2 | 227 | 215 | 2.508 | 0.113 | |
| T3+ T4 | 27 | 39 | |||
| 未知 | 1 | 1 | |||
| N分期 | |||||
| N0+ N1 | 218 | 205 | 4.613 | 0.032a | |
| N2+ N3 | 29 | 47 | |||
| NX | 7 | 3 | |||
| 未知 | 1 | 0 | |||
| M分期 | |||||
| M0 | 170 | 174 | 0.190 | 0.663 | |
| M1 | 14 | 12 | |||
| MX | 67 | 69 | |||
| 未知 | 4 | 0 | |||
| 肿瘤分期 | |||||
| Ⅰ+Ⅱ | 209 | 191 | 4.506 | 0.034b | |
| Ⅲ+ Ⅳ | 44 | 64 | |||
| 未知 | 2 | 0 | |||
| 吸烟 | |||||
| 是 | 176 | 172 | 0.145 | 0.704 | |
| 否 | 79 | 83 | |||
| 吸烟包数/年 | |||||
| 0~20 | 34 | 26 | 4.538 | 0.338 | |
| 20~40 | 59 | 55 | |||
| 40~60 | 44 | 60 | |||
| 60~80 | 19 | 15 | |||
| ≥80 | 20 | 16 | |||
| “NX、MX”分别为N、M分期不明确;“未知”为统计缺失值; a:P < 0.05,与N0+ N1相比;b:P < 0.05,与Ⅰ+ Ⅱ相比 | |||||
2.4 SMAD9基因表达在肺腺癌中的筛查价值
为了明确SMAD9基因mRNA的表达在肺腺癌分子标志物筛查中的价值,我们利用ROC曲线模型对它的表达情况进行了分析。结果显示,SMAD9基因表达在肺腺癌中(其中肿瘤组织样本483例,癌旁正常组织样本59例)具有较好的灵敏性,ROC曲线下面积AUC=0.904,95%CI=0.869~0.938,P < 0.001(图 3A)。在肿瘤Ⅰ~Ⅱ期(其中肿瘤组织379例,癌旁正常组织44例),ROC曲线下面积AUC=0.905,95%CI= 0.865~0.944,P < 0.001,图 3B);在肿瘤Ⅲ~Ⅳ期(其中肿瘤组织104例,癌旁正常组织15例),ROC曲线下面积(AUC=0.905,95%CI=0.836~0.975,P < 0.001,图 3C)。提示该基因可能是一个潜在的灵敏度较好的肺腺癌筛查标志物。
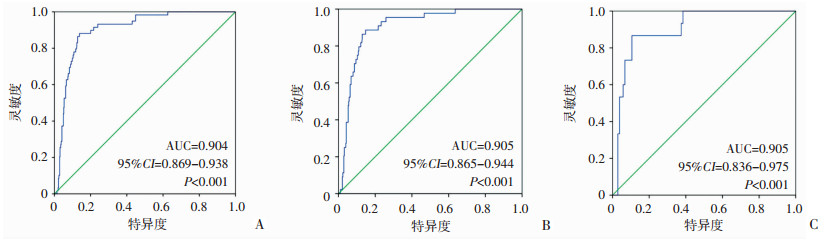
|
| A:肺腺癌患者;B:肺腺癌Ⅰ~Ⅱ期患者;C:肺腺癌Ⅲ~Ⅳ期患者 图 3 SMAD9基因表达在肺腺癌筛查中的ROC曲线 |
2.5 SMAD9基因表达与肺腺癌患者术后生存之间的关系
我们采用Kaplan-Meier的方法分析SMAD9基因表达与肺腺癌患者术后生存的关系。结果显示,SMAD9基因的表达与肺腺癌患者(删除Ⅳ期患者样本后,共457例)的术后生存之间有显著的相关性,SMAD9基因低表达患者(229例)的生存时间显著低于高表达患者(228例)的生存时间(P < 0.01,图 4A)。按肿瘤分期进行分类后,分析显示,在肺腺癌Ⅰ~Ⅱ期中,SMAD9基因低表达患者(180例)的生存时间与高表达(49例)的生存时间之间差异无统计学意义(P>0.05,图 4B),在肿瘤Ⅲ期的肺腺癌患者中,低表达患者(199例)的生存时间与高表达患者(29例)的生存时间之间差异无统计学意义(P>0.05,图 2C)。
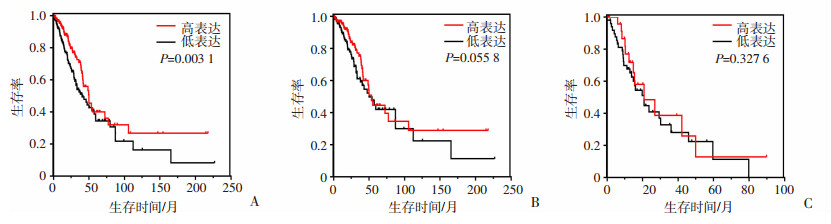
|
| A:肺腺癌Ⅰ~Ⅲ期患者;B:肺腺癌Ⅰ~Ⅱ期患者;C:肺腺癌Ⅲ期患者 图 4 SMAD9基因表达在肺腺癌患者中的Kaplan-Meier生存曲线分析 |
2.6 单因素及多因素COX回归分析
COX单因素分析结果显示,SMAD9表达水平与肺腺癌患者生存率显著相关(HR=0.870,95%CI=0.776~ 0.976,P < 0.05),说明SMAD9表达量是肺腺癌患者生存的保护因素;进一步对可能影响肺腺癌患者生存预后的临床特征进行单因素分析发现,T分期、N分期、肿瘤分期等因素均为其生存率的危险因素(P < 0.05,图 5);将以上所有单因素纳入COX多因素回归分析显示,肿瘤分期是肺腺癌患者的独立危险因素(P < 0.05),SMAD9表达量是肺腺癌患者的独立保护因素(P < 0.05,图 6)。
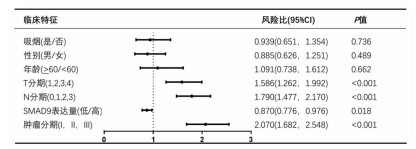
|
| 图 5 肺腺癌患者生存率预后因素的单因素COX回归分析 |
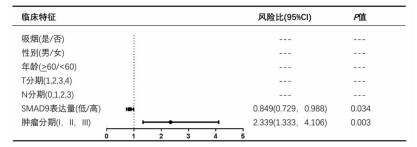
|
| 图 6 肺腺癌患者生存率预后因素的多因素COX回归分析 |
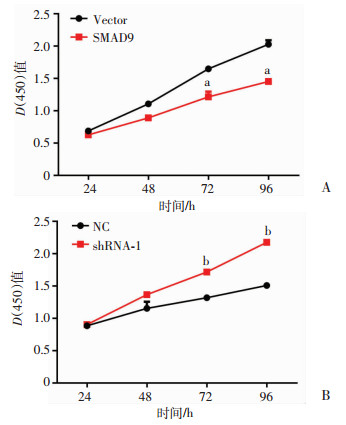
2.7 SMAD9基因过表达和干扰对肺腺癌细胞株增殖的影响
采用CCK-8进行细胞增殖检测结果显示:在转染72、96 h后,SPC-A-1基因过表达细胞的增殖水平显著低于对照组(P < 0.01,图 7A),而在HBE细胞中对SMAD9基因进行表达干扰后,干预组细胞的增殖水平显著高于对照组(P < 0.01,图 7B)。
|
| A:过表达SMAD9基因后SPC-A-1细胞相比对照组的增殖变化a:P < 0.05,b:P < 0.01,与SPC-A-1对照组比较;B:干扰SMAD9基因表达后HBE细胞相比对照组的增殖变化b:P < 0.01,与HBE对照组比较 图 7 过表达和干扰SMAD9基因后SPC-A-1细胞及HBE细胞增殖能力的变化 |
3 讨论
人SMAD9基因编码含有467个氨基酸的蛋白。它有2个编码不同亚型的转录变体,是一种独特的能通过骨形态发生蛋白4 1型受体激酶在丝氨酸上磷酸化来调节转录的受体调节型SMAD(receptor-regulated SMAD,R-SMAD)[13]。其致病相关途径包括Wnt/Hedgehog/Notch和GPCR的信号传导。SMAD9基因的表达水平可能与肺动脉高压[8]、胃癌[9]、骨髓增生性疾病[14]、甲状腺癌[15]等疾病的发生、发展有着密切的关系。研究表明,在肺组织中,SMAD9基因突变与肺动脉高压有关[8];骨髓增生性疾病中SMAD9基因的mRNA呈现低表达[14];与正常甲状腺组织相比,乳头状甲状腺癌和甲状腺滤泡腺瘤SMAD9基因的表达均下调。上述研究结果提示,SMAD9基因的表达水平可能与肿瘤密切相关。但是,目前SMAD9基因与肺癌的发生、发展、功能、机制方面的研究还较少,尤其是与患者临床术后生存及标志物筛查的研究还未见报道。
在本研究中,我们通过对TCGA大样本数据库进行分析发现,癌与癌旁正常组织相比,SMAD9基因在肺腺癌组织中显著下调。同时在不同肺腺癌细胞株以及3-MCA诱导的HBE恶转细胞中证实SMAD9基因的表达呈显著下调,且随着3-MCA诱导的HBE恶转细胞代数不断增加,该基因的表达呈现逐渐下调趋势,提示SMAD9基因可能参与了肺腺癌的发生、发展过程。另外,我们通过构建过表达和干扰载体进行细胞增殖实验发现,SMAD9基因过表达抑制肺腺癌细胞株生长,而干扰SMAD9基因后又促进肺腺癌细胞株生长,进一步提示我们SMAD9基因可能是肺腺癌中的候选抑癌基因。研究表明[9],与慢性胃炎患者的胃黏液相比,胃癌患者的肿瘤性胃黏液中SMAD9基因呈现显著高甲基化,采用去甲基化药物5-Aza-CdR和曲古抑菌素A处理8种胃癌细胞系后,该基因表达显著上调,提示SMAD9在胃癌中可能受甲基化调控。通过全转录组表达谱分析发现[16],与正常甲状腺组织相比,甲状腺癌组织中SMAD9基因的表达水平显著下调。进一步经过功能网络和路径分析发现,该分子与ECM1、KIT、VDR、NRCAM和RXRG等多个分子存在相互作用,提示SMAD9基因在甲状腺癌中可能是一个候选抑癌基因。而关于SMAD9可能产生抑癌表型的信号通路以及它可能调控的下游基因方面,目前还少见相关文献报道。但在SMAD家族其他基因的相关报道中发现,SMAD1和SMAD5的条件性缺失会导致小鼠性腺细胞转移瘤的发生,进一步研究发现其可能通过BMP/SMAD1/5信号通路影响性腺细胞分化,进而发挥抑癌作用[6]。在内皮素调节血管生成的机制研究中发现,内皮素胞质结构域ALK5磷酸化可激活SMAD1/5/8信号转导进而调节TGF-B1和BMP-9信号转导,从而抑制内皮细胞迁移[7]。结合本研究中TCGA数据库分析和细胞验证结果以及文献报道,我们推测,SMAD9基因在肺腺癌的发生、发展过程中的可能受甲基化或磷酸化、去磷酸化调控,进而通过与ALK、TGF、BMP或ECM1,KIT,VDR等多分子的相互作用发挥其抑癌作用。此外,我们通过生物信息学分析发现,该分子可能通过调节Wnt、Hedgehog、Notch以及GPCR信号传导的关键分子等发挥抑癌作用。
肺腺癌患者的ROC模型分析结果显示,SMAD9基因的表达在肺腺癌患者的筛查中具有较高的灵敏度(AUC=0.904,95%CI=0.869~0.938,P < 0.0001),在肿瘤Ⅰ~Ⅱ期中,AUC=0.905,95%CI=0.865~0.944,P < 0.01,这提示我们,SMAD9基因的mRNA表达水平对肺腺癌患者的初步筛查具有一定的参考价值。对患者术后生存的分析结果显示,SMAD9基因的表达与肺腺癌的肿瘤分期有着显著的相关性,该基因低表达患者的术后生存时间明显低于高表达患者。分析结果提示,SMAD9基因的表达水平与该肿瘤的分期有着密切的关系,且可能对肺腺癌患者术后生存的判断有一定的参考价值。单因素及多因素COX回归分析显示,肿瘤分期是肺腺癌患者的独立危险因素,SMAD9表达水平是肺腺癌患者的独立保护因素。有研究表明,SMAD9基因在有些肿瘤中可能发挥致癌作用,如在胰腺细胞中敲低endoglin后,观察到TGF-β受体2型(TGFBR2)和SMAD9基因的mRNA表达水平下调,且细胞形成球体的直径有减小的趋势,呈现促癌作用[10];在口腔鳞癌中,SMAD9基因的表达下调时原发性肿瘤的侵袭能力下降,同样呈现促癌作用[16],这可能与不同组织器官的分化发育、功能模式、肿瘤性质等有关。本研究的不足之处在于,因为目前我们只是在肺腺癌细胞中做了部分验证实验,以及单使用TCGA数据库表达的数据去做了一定分析,且收集的临床样本量也不够大,没有肿瘤组织与正常肺组织或良性病变组织的比较,所以该基因是否能作为肺腺癌分子筛查的生物标志物以及它的具体功能机制还需进一步研究验证。
综上,SMAD9基因在肺腺癌中可能是一个潜在的抑癌基因。SMAD9基因在肺腺癌中的表达与该肿瘤的发生、发展以及肺腺癌患者的术后生存有着非常密切的相关性,可作为一个重要的候选生物标志物。因此,有必要进一步对该基因在肺腺癌中的机制以及功能进行多层面研究,为全面掌握SMAD9基因在肿瘤中的作用以及肺腺癌的预防诊治提供更多依据。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. ZHENG R S, SUN K X, ZHANG S W, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
李祥春, 刘子玲, 丛晓凤, 等. 肺鳞状细胞癌基因靶点的研究进展[J]. 癌症进展, 2019, 17(8): 887-889, 904. LI X C, LIU Z L, CONG X F, et al. Advances in research on lung squamous cell oncogene targets[J]. Oncol Prog, 2019, 17(8): 887-889, 904. DOI:10.11877/j.issn.1672-1535.2019.17.08.05 |
| [4] |
PASERO M, GIOVARELLI M, BUCCI G, et al. Bone morphogenetic protein/SMAD signaling orients cell fate decision by impairing KSRP-dependent microRNA maturation[J]. Cell Rep, 2012, 2(5): 1159-1168. DOI:10.1016/j.celrep.2012.10.020 |
| [5] |
HESTER M, THOMPSON J C, MILLS J, et al. Smad1 and Smad8 function similarly in mammalian central nervous system development[J]. Mol Cell Biol, 2005, 25(11): 4683-4692. DOI:10.1128/MCB.25.11.4683-4692.2005 |
| [6] |
PANGAS S A, LI X H, UMANS L, et al. Conditional deletion of Smad1 and Smad5 in somatic cells of male and female gonads leads to metastatic tumor development in mice[J]. Mol Cell Biol, 2008, 28(1): 248-257. DOI:10.1128/MCB.01404-07 |
| [7] |
RAY B N, LEE N Y, HOW T, et al. ALK5 phosphorylation of the endoglin cytoplasmic domain regulates Smad1/5/8 signaling and endothelial cell migration[J]. Carcinogenesis, 2010, 31(3): 435-441. DOI:10.1093/carcin/bgp327 |
| [8] |
HUERTAS A, TU L, GUIGNABERT C. New targets for pulmonary arterial hypertension: going beyond the currently targeted three pathways[J]. Curr Opin Pulm Med, 2017, 23(5): 377-385. DOI:10.1097/MCP.0000000000000404 |
| [9] |
KANG G H, LEE S, CHO N Y, et al. DNA methylation profiles of gastric carcinoma characterized by quantitative DNA methylation analysis[J]. Lab Invest, 2008, 88(2): 161-170. DOI:10.1038/labinvest.3700707 |
| [10] |
KOKAJI E, SHIMOMURA A, MINAMISAKA T, et al. Endoglin (CD105) and SMAD4 regulate spheroid formation and the suppression of the invasive ability of human pancreatic cancer cells[J]. Int J Oncol, 2018, 52(3): 892-900. DOI:10.3892/ijo.2018.4262 |
| [11] |
ELSAFADI M, SHINWARI T, AL-MALKI S, et al. Convergence of TGFβ and BMP signaling in regulating human bone marrow stromal cell differentiation[J]. Sci Rep, 2019, 9(1): 4977. DOI:10.1038/s41598-019-41543-0 |
| [12] |
CHEN H Q, ZHAO J, LI Y, et al. Gene expression network regulated by DNA methylation and microRNA during microcystin-leucine arginine induced malignant transformation in human hepatocyte L02 cells[J]. Toxicol Lett, 2018, 289: 42-53. DOI:10.1016/j.toxlet.2018.03.003 |
| [13] |
KATAKAWA Y, FUNABA M, MURAKAMI M. Smad8/9 is regulated through the BMP pathway[J]. J Cell Biochem, 2016, 117(8): 1788-1796. DOI:10.1002/jcb.25478 |
| [14] |
SPINELLI R, PIROLA A, REDAELLI S, et al. Identification of novel point mutations in splicing sites integrating whole-exome and RNA-seq data in myeloproliferative diseases[J]. Mol Genet Genomic Med, 2013, 1(4): 246-259. DOI:10.1002/mgg3.23 |
| [15] |
SCHULTEN H J, AL-MANSOURI Z, BAGHALLAB I, et al. Comparison of microarray expression profiles between follicular variant of papillary thyroid carcinomas and follicular adenomas of the thyroid[J]. BMC Genomics, 2015, 16(Suppl 1): S7. DOI:10.1186/1471-2164-16-S1-S7 |
| [16] |
CHIBA T, ISHISAKI A, KYAKUMOTO S, et al. Transforming growth factor-β1 suppresses bone morphogenetic protein-2-induced mesenchymal-epithelial transition in HSC-4 human oral squamous cell carcinoma cells via Smad1/5/9 pathway suppression[J]. Oncol Rep, 2017, 37(2): 713-720. DOI:10.3892/or.2016.5338 |



