阴道萎缩(vagina atrophy, VA)是一种常见于绝经后女性的疾病, 其主要表现为阴道和泌尿道组织的退化, 症状包括阴道干涩、瘙痒及性交疼痛[1]。其主要原因是由于卵巢分泌雌激素大幅度减少, 而雌激素是维持阴道上皮厚度、弹性及正常阴道微生态环境的重要因素。雌激素水平的降低可使阴道出现代谢及萎缩性改变[2]。最初, 主要表现为非特异性症状, 比如潮热、盗汗、情绪波动等。随着时间的增加, 阴道壁的持续退化和炎症的不断刺激, 导致阴道壁弹性减弱、血管脆性增加表面散在出血点、局部分泌物减少, 相应的表现为阴道干涩、刺痛、性交痛等[3]。低雌激素状态同时也影响泌尿系统, 导致泌尿道的萎缩,表现为失禁、尿频、尿急和尿痛等, 即更年期泌尿生殖综合症(genitourinary syndrome of menopause,GSM)[4]。根据国际更年期协会的研究表明, 超过40%的绝经后女性有泌尿生殖系统症状, 其中大约只有20%的女性愿意寻求医疗帮助[5]。目前北美绝经学会推荐的主要治疗方法为补充雌激素及阴道润滑剂等。但由于雌激素长期应用的安全性和稳定性仍然有待进一步的观察[6], 导致许多女性不愿意接受雌激素的治疗, 因此寻找一种更好的治疗方式是必要的。
胶原蛋白, 作为细胞外基质(extracellular matrix, ECM)的主要成分之一, 参与维持组织结构的完整性, 有免疫、止血、机械力传递等特性, 拥有良好的生物降解性和生物相容性, 被广泛应用于损伤的修复和组织的再生[7]。其中由细胞分泌的胶原蛋白约占总人体蛋白质的30%以上。目前已经有21种类型的胶原蛋白被发现, 其中Ⅰ、Ⅱ、Ⅲ型胶原蛋白在人体含量最丰富, 约占总胶原蛋白的80%~90%。阴道组织主要含有Ⅰ、Ⅲ型胶原蛋白[8-9]。随着雌激素水平的降低, 阴道组织中胶原蛋白降解增加, 生成减少[10]。转化生长因子β1(transforming growth factor β1, TGF-β1)是一种重要的细胞外基质调节因子, 能够促进细胞外基质的增殖和分泌[11]。Smads蛋白作为TGF-β1受体下游基因的主要信号传导分子, 参与细胞的增殖生长、免疫反应等, 可以将TGF-β信号由细胞膜直接转到入细胞核内[12-13]。因此通过对TGF-β1/Smad通路的激活能够有效促进ECM的合成, 减少降解。目前暂时没有胶原蛋白对阴道作用的相关研究。本研究主要通过构建阴道萎缩大鼠模型, 探讨胶原蛋白对大鼠阴道萎缩的作用。
1 材料与方法 1.1 实验动物及主要材料6~8周龄SD雌性大鼠40只, 体质量220~260 g, 购买于重庆医科大学动物实验中心。胶原蛋白购买于山西锦波生物有限公司, 主要成分为类人源性Ⅲ型胶原蛋白, 结合雌激素乳膏购买于新疆新姿源生物制药有限公司。PCNA、TIMP-1、MMP-1、GADPH抗体购自博奥森公司, COL-Ⅰ、COL-Ⅲ、TGF-β1、Smad2/3、p-Smad2/3抗体购于英国Abcam公司。免疫组化试剂盒购于北京中杉金桥生物技术公司。反转录和定量qPCR试剂盒购于GeneCopoeia公司。所有引物均由上海生物工程有限公司合成。
1.2 实验方法 1.2.1 动物分组采用随机数字表法将40只大鼠随机分为假手术组、实验组。实验组又分模型组、胶原蛋白组(阴道涂抹胶原蛋白)、雌激素组(阴道涂抹雌激素),每组各10只。
1.2.2 动物模型的构建根据去势法构建大鼠阴道萎缩模型。采用乙醚吸入麻醉, 取仰卧位, 备皮碘伏消毒腹部, 沿腹直肌行正中切口, 以无齿镊暴露双侧卵巢, 分别结扎双侧子宫动脉后, 将双侧卵巢全部切除, 还纳双侧子宫, 逐步缝合消毒切口。术后3 d肌注青霉素。假手术组, 打开腹腔暴露于空气中30 min后关腹; 胶原蛋白组于术后第28天, 每日阴道给予胶原蛋白0.5 mL, 连续每日给药14 d; 雌激素组于术后第28天起, 每日阴道给予雌激素0.5 mL, 连续每日给药14 d。记录大鼠去势前及去势术后第28天体质量变化。
1.2.3 阴道涂片及pH值测定从去势术后第5天起, 于早上8:00-10:00连续对每只大鼠进行阴道涂片检查, 美蓝染色15 min, 于显微镜下观察。实验组阴道上皮无动情周期变化提示大鼠去势完全。分别于卵巢切除术后及给药结束后, 连续3 d检测阴道pH值。用眼科镊将pH试纸放置于大鼠阴道内, 5 s后取出与标准色板对比。
1.2.4 标本取材处理及组织学检查在阴道给药后第4天, 予以每只大鼠腹腔麻醉后, 取出每只的大鼠阴道组织。实验完毕后用高浓度二氧化碳及大剂量3%戊巴比妥钠腹腔麻醉处死大鼠。每组分别取4只大鼠阴道组织置于液氮中保存, 3只大鼠组织于PCR保存液中保存, 剩余组织用多聚甲醛固定后包埋, 行HE染色。取出双侧子宫, 将周围组织剔尽, 称量。
1.2.5 免疫组织化学检测烤片过夜, 二甲苯浸泡40 min后, 进行梯度酒精脱水。微波炉抗原修复后冷却至常温, PBS洗片5 min, 3次。滴加内源性过氧化物酶阻断剂37 ℃孵育10 min, PBS冲洗3次。血清封闭20 min, 滴加一抗4 ℃过夜。次日37 ℃复温30 min, PBS洗片3次后加入二抗, 37 ℃孵育20 min, 再用PBS冲洗5 min, 3次后滴入辣根酶标记链霉卵白素。PBS冲洗3次, 加入DAB显色3 min, 苏木精复染1 min, 盐酸酒精分化2 s, 碳酸锂返蓝后自来水冲洗20 min。梯度酒精脱水、透明, 最后树脂封片。
1.2.6 qPCR检测mRNA表达将组织放置于TRIzol中, 组织研磨器匀浆, 按照试剂盒说明书提取总RNA并反转录为cDNA。采用qPCR检测组织中相关基因的表达水平.具体引物序列如表 1所示, 选择GAPDH作为内参, 每个样本设计3个复孔。结果用2-ΔΔCt表示。
| 基因 | 正义链 | 反义链 | 产物长度/bp |
| COL-Ⅰ | 5′-TACAGCACGCTTGTGGATG-3′ | 5′-TTGAGTTTGGGTTGTTGGTC-3′ | 256 |
| COL-Ⅲ | 5′-GGAACAACTGATGGTGCTACTG-3′ | 5′-CCAAAATAAGAGAGGGGTGAAG-3′ | 148 |
| TIMP-1 | 5′-TGCAACTCGGACCTGGTTAT-3′ | 5′-GAGCAGGGCTCAGATTATGC-3′ | 298 |
| MMP-1 | 5′-CAGGTGCAACAACACCACAT-3′ | 5′-GCTCAGCTTCTGGCATGAAC-3′ | 132 |
| TGF-β1 | 5′-TACAGCACGGTATGCAAGCC-3′ | 5′-GCAACCGATCTAGCTCACAGAG-3′ | 112 |
| GAPDH | 5′-TCAACGGGGGACATAAAAGT-3′ | 5′-TGCATTGTTTTACCAGTGTCAA-3′ | 132 |
1.2.7 Western blot检测
分别在每组组织中加入1 mL RIPA和10 μL PMSF的裂解液, 用组织剪剪碎后在组织研磨器下匀浆。冰上静置5 min后, 低温离心机13 000 r/min离心15 min。取上清液, 然后BCA试剂盒测定蛋白浓度后, 配平加入总体积1/4的上样缓冲液, 加热煮沸使蛋白失活。将蛋白在10%的凝胶上进行电泳并转膜, 脱脂奶粉室温封闭后, 一抗4 ℃孵育过夜, TBST洗膜3次后二抗孵育, 显影。
1.3 统计学分析所有数据均使用SPSS 20.0统计软件分析, 数据以x±s表示, 采用单因素方差分析和t检验。
2 结果 2.1 各组大鼠体质量测定结果通过对大鼠体质量测定, 去势术后大鼠体质量较假手术组明显增加, 差异有统计学意义(表 2,P < 0.05)。
| 组别 | 去势术后1 d | 去势术后28 d |
| 假手术组 | 265.26±5.88 | 304.81±7.19 |
| 实验组 | 264.53±2.53 | 370.56±10.07a |
| a: P < 0.05, 与假手术组比较 | ||
2.2 各组大鼠阴道pH值及子宫质量测定
根据对阴道pH值的评估, 治疗后的胶原蛋白组和雌激素组pH值有下降趋势(表 3), 与治疗前相比差异有统计学意义(P < 0.05)。大鼠子宫质量测定结果显示, 与假手术组相比, 模型组、胶原蛋白组的子宫质量明显减低(P < 0.05);与模型组、胶原蛋白组相比较, 雌激素组的子宫质量明显增加(表 4,P < 0.05)。
| 组别 | 0周 | 4周 |
| 假手术组 | 5.2±0.2 | 5.5±0.2 |
| 模型组 | 6.6±0.2 | 7.9±0.3 |
| 胶原蛋白组 | 6.8±0.1 | 5.9±0.2a |
| 雌激素组 | 6.7±0.1 | 6.1±0.2b |
| a: P < 0.05, 与0周比较 | ||
| 组别 | 子宫质量/g | 阴道上皮厚度/μm |
| 假手术组 | 1.012±0.19 | 98.26±4.27 |
| 模型组 | 0.153±0.02ab | 22.08±2.33 |
| 胶原蛋白组 | 0.187±0.02 ab | 89.94±3.95c |
| 雌激素组 | 1.125±0.17 | 112.5±5.13 c |
| a: P < 0.05, 与假手术组比较; b: P < 0.05, 与雌激素组比较;c: P < 0.001, 与模型组比较 | ||
2.3 各组大鼠阴道组织形态学变化
模型组的阴道上皮主要由几层扁平细胞组成, 阴道上皮可见明显的萎缩, 固有层有少量血管和结缔组织, 细胞多样性低。假手术组、胶原蛋白组和雌激素组均由较厚的复层鳞状上皮覆盖, 固有层结缔组织中富含血管。同时, 相比较于模型组, 胶原蛋白组、雌激素阴道上皮厚度增加(表 4), 阴道壁显著厚于模型组(P < 0.001,图 1)。

|
| A:假手术组; B:模型组; C:胶原蛋白组; D:雌激素组 图 1 各组大鼠阴道组织病理学变化(HE×200) |
2.4 各组大鼠阴道组织中胶原蛋白能够促进上皮增殖及细胞外基质的合成, 抑制降解
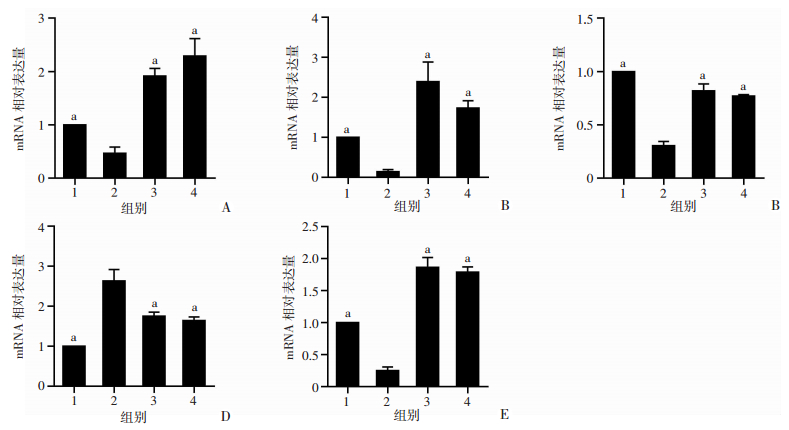
免疫组化检测结果(图 2、3)和qPCR检测结果(图 4)显示: TIMP-1作为细胞外基质合成相关因子, 在假手术组、胶原蛋白组和雌激素组的表达均高于模型组(P < 0.05);MMP-1作为细胞外基质的降解相关因子, 在模型组中表达最高(P < 0.05)。相比于模型组, CoL-Ⅰ、CoL-Ⅲ在其余组阴道组织中表达增加, Ⅰ、Ⅲ型胶原蛋白含量增多(P < 0.05)。TGF-β1在假手术组、胶原蛋白组、雌激素组的表达量均高于模型组(P < 0.05)。PCNA在假手术组、胶原蛋白组和雌激素组的表达明显高于模型组, 上皮细胞增殖情况明显(P < 0.05)。

|
| A:免疫组化检测结果;B:TIMP-1免疫组化评分结果;C:MMP-1免疫组化评分结果;D:COL-1免疫组化评分结果;E:COL-Ⅰ免疫组化评分结果;COL-Ⅲ免疫组化评分结果(n=10, x±s); a: P < 0.05,与模型组比较1:假手术组; 2:模型组; 3:胶原蛋白组; 4:雌激素组 图 2 各组大鼠阴道组织中TIMP、MMP-1、COL-Ⅰ、COL-Ⅲ的表达与评分结果 |

|
| A:免疫组化检测结果;B:TGF-β1免疫组化评分结果;C:PCNA免疫组化评分结果(n=10, x±s) 1:假手术组; 2:模型组; 3:胶原蛋白组; 4:雌激素组 图 3 各组大鼠阴道组织中TGF-β1、PCNA的表达与评分结果 |
|
| 1:假手术组; 2:模型组; 3:胶原蛋白组; 4:雌激素组(n=10, x±s), a: P < 0.05, 与模型组比较 图 4 qPCR检测各组大鼠阴道组织中COL-Ⅰ(A)、COL-Ⅲ(B)、TIMP-1(C)、MMP-1(D)、TGF-β1(E)的mRNA的表达 |
2.5 Western blot检测各组大鼠阴道组织中TGF-β1、Smad2/3、p-Smad2/3的蛋白的表达
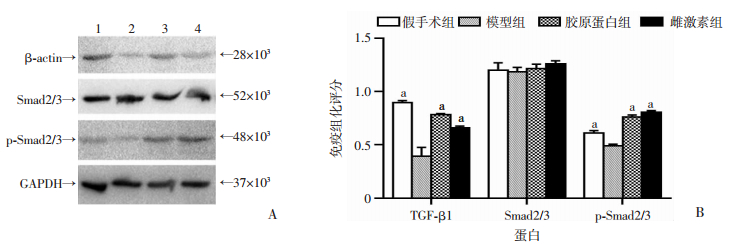
Western blot检测结果(图 5)显示, 相比较于假手术组、胶原蛋白组、雌激素组, 模型组磷酸化Smad2/3蛋白表达量降低(P < 0.05), TGF-β1的蛋白表达量降低(P < 0.05), Smad2/3表达水平差异无统计学意义。
|
| 1:假手术组; 2:模型组; 3:胶原蛋白组; 4:雌激素组A:Western blot检测结果;B:半定量分析a: P < 0.05, 与模型组比较 图 5 Western blot检测各组大鼠阴道组织中TGF-β1、Smad2/3、p-Smad2/3的蛋白的表达 |
3 讨论
阴道萎缩作为一种绝经后女性的常见主诉, 主要是由于雌激素的急剧减少, 导致上皮形态变化, 血流量及分泌减少; 同时上皮细胞糖原合成减少, 阴道乳酸杆菌减少, pH值上升, 阴道微生态被破坏; 结缔组织增生, 弹性纤维片段被破坏, 胶原蛋白蛋白呈玻璃样变[14-17]。围绝经期及绝经后, 以血管舒缩症状为典型起始症状, 但无论是否治疗与否, 这些症状一般会随着时间延长减轻。而其他的生殖泌尿系统症状会随着时间的延长无明显减轻或者加重, 严重影响生活质量[18-19]。目前的主要治疗手段为激素及非激素制剂的应用, 激素虽然能够有效缓解症状, 但部分患有激素依赖疾病的女性使用激素也存在较高的风险, 且不少女性因为担心激素的副反应而拒绝使用[20]; 而非激素类制剂如阴道保湿剂及润滑剂能够缓解部分患者的症状, 但对某些症状严重患者的治疗效果依然较差。因此需要一种能够让大多数女性接受, 并且安全有效的治疗方式来帮助有相关症状的女性更好的缓解不适, 提高生活品质。
胶原蛋白是存在于所有哺乳动物中的纤维状、大分子蛋白质, 主要与维持组织结构的完整性相关。作为细胞外基质的主要组成成分, 能够起支撑和维持弹性的作用, 发挥生物力学的相关特性[21]。
本研究发现, 在大鼠去势后, 体质量增加明显, 阴道涂片无明显动情周期变化。阴道pH是评估阴道上皮情况和监测治疗效果的经济有效方法。正常情况下, 阴道上皮细胞中的糖原由阴道杆菌分解生成的乳酸使阴道内呈酸性, 有效的维持阴道内环境抵御微生物的侵袭。pH值升高佐证了由于衰老萎缩引起的阴道微生态的破坏。通过胶原蛋白治疗后, pH值明显降低, 说明胶原蛋白的治疗可能有助于阴道内环境的恢复。PCNA作为一个参与细胞DNA修复和复制的主要因子, 在胶原蛋白处理后的阴道上皮中可见其广泛分布, 同时阴道上皮的厚度与假手术组接近表明胶原蛋白能够有效促进上皮的修复和增殖。根据WONG[22]和HAN等[23], 相比于正常女性, 绝经后女性盆底阴道壁组织细胞外基质含量出现严重的减少。因此, 绝经后女性的泌尿生殖系统症状可能与细胞外基质的合成降解失衡有关。胶原蛋白且能够促进ECM的合成, 抑制其降解。组织中Ⅰ/Ⅲ型胶原蛋白的含量增加表明胶原蛋白良好的生物相容性, 可能改善阴道组织的弹性, 促进组织的重构, 改善阴道相关症状。TGF-β是ECM的一类生物活性分子, 与大多数胶原代谢息息相关, 在胶原蛋白治疗后, 其表达明显多于模型组。通过蛋白层面的结果表明, 磷酸化Smad2/3在治疗组和假手术组中均高于模型组。根据结果我们推测胶原蛋白对阴道上皮的作用可能是与激活TGF-β1/Smad信号通路相关, 通过活化相关基因蛋白的活性有关能够促进ECM的合成, 抑制其降解, 进而发挥相关作用。同时本研究发现, 通过子宫质量测定结果显示胶原蛋白治疗安全性明显优于雌激素组。经雌激素治疗后, 子宫相对于模型组出现明显增粗, 增厚; 而胶原蛋白组子宫未见明显变粗、增重。仍需要进一步观察胶原蛋白对阴道萎缩的持续改善作用。
总之, 本研究通过阴道上皮细胞的增殖、细胞外基质的增加及TGF-β1/Smad蛋白表达, 揭示了胶原蛋白在改善阴道萎缩相关症状的潜在用途。这些表明胶原蛋白治疗可作为一种新型的方法来治疗阴道萎缩。
| [1] |
SUCKLING J1, LETHABY A, KENNEDY R. Local oestrogen for vaginal atrophy in postmenopausal women[J]. Cochrane Database Syst Rev, 2003(4): CD001500. DOI:10.1002/14651858.CD001500 |
| [2] |
CARMIGNANI L O, PEDRO A O, MONTEMOR E B, et al. Effects of a soy-based dietary supplement compared with low-dose hormone therapy on the urogenital system: a randomized, double-blind, controlled clinical trial[J]. Menopause, 2015, 22(7): 741-749. DOI:10.1097/GME.0000000000000380 |
| [3] |
SOCIETY OF OBSTETRICIANS AND GYNAECOLOGISTS OF CANADA. SOGC clinical practice guidelines. The detection and management of vaginal atrophy. Number 145, May 2004[J]. Int J Gynaecol Obstet, 2005, 88(2): 222-228. DOI:10.1016/j.ijgo.2004.11.003 |
| [4] |
PORTMAN D J, GASS M L, VULVOVAGINAL ATROPHY TERMINOLOGY CONSENSUS CONFERENCE PANEL. Genitourinary syndrome of menopause: new terminology forvulvovaginal atrophy from the international society for the study of women's sexual health and the North American menopause society[J]. Maturitas, 2014, 79(3): 349-354. DOI:10.1016/j.maturitas.2014.07.013 |
| [5] |
WILLS S, RAVIPATI A, VENUTURUMILLI P, et al. Effects of vaginal estrogens on serum estradiol levels in postmenopausal breast cancer survivors and women at risk of breast cancer taking an aromatase inhibitor or a selective estrogen receptormodulator[J]. J Oncol Pract, 2012, 8(3): 144-148. DOI:10.1200/JOP.2011.000352 |
| [6] |
The 2017 hormone therapy position statement of the North American menopausesociety. Menopause, 2018, 25(11): 1362-1387. DOI: 10.1097/GME.0000000000001241.
|
| [7] |
SORUSHANOVA A, DELGADO L M, WU Z N, et al. The collagensuprafamily: from biosynthesis to advanced biomaterial development[J]. Adv Mater Weinheim, 2019, 31(1): e1801651. DOI:10.1002/adma.201801651 |
| [8] |
SHOULDERS M D, RAINES R T. Collagen structure andstability[J]. Annu Rev Biochem, 2009, 78: 929-958. DOI:10.1146/annurev.biochem.77.032207.120833 |
| [9] |
RICARD-BLUM S. The collagenfamily[J]. Cold Spring Harb Perspect Biol, 2011, 3(1): a004978. DOI:10.1101/cshperspect.a004978 |
| [10] |
CASTELO-BRANCO C, CANCELO M J, VILLERO J, et al. Management of post-menopausal vaginal atrophy and atrophic vaginitis[J]. Maturitas, 2005, 52(Suppl 1): S46-S52. DOI:10.1016/j.maturitas.2005.06.014 |
| [11] |
ROBERTS A B, MCCUNE B K, SPORN M B. TGF-beta: regulation of extracellularmatrix[J]. Kidney Int, 1992, 41(3): 557-559. DOI:10.1038/ki.1992.81 |
| [12] |
DERYNCK R, ZHANG Y G. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958): 577-584. DOI:10.1038/nature02006 |
| [13] |
SHI Y G, MASSAGUÉ J. Mechanisms of TGF-β signaling from cell membrane to thenucleus[J]. Cell, 2003, 113(6): 685-700. DOI:10.1016/s0092-8674(03)00432-x |
| [14] |
STURDEE D W, PANAY N, INTERNATIONAL MENOPAUSE SOCIETY WRITING GROUP. Recommendations for the management of postmenopausal vaginalatrophy[J]. Climacteric, 2010, 13(6): 509-522. DOI:10.3109/13697137.2010.522875 |
| [15] |
North American Menopause Society. The 2012 hormone therapy position statement of: The North American Menopause Society[J]. Menopause, 2012, 19(3): 257-271. DOI:10.1097/gme.0b013e31824b970a |
| [16] |
ARCHER D F. Efficacy and tolerability of local estrogen therapy for urogenitalatrophy[J]. Menopause, 2010, 17(1): 194-203. DOI:10.1097/gme.0b013e3181a95581 |
| [17] |
NELSON H D, HANEY E, HUMPHREY L, et al. Management of menopause-relatedsymptoms[J]. Evid Rep Technol Assess (Summ), 2005(120): 1-6. |
| [18] |
JIN J. Vaginal and urinary symptoms ofmenopause[J]. JAMA, 2017, 317(13): 1388. DOI:10.1001/jama.2017.0833 |
| [19] |
MANSON J E, KAUNITZ A M. Menopause management: getting clinical care back ontrack[J]. N Engl J Med, 2016, 374(9): 803-806. DOI:10.1056/NEJMp1514242 |
| [20] |
BEDELL S, NACHTIGALL M, NAFTOLIN F. The pros and cons of plant estrogens formenopause[J]. J Steroid Biochem Mol Biol, 2014, 139: 225-236. DOI:10.1016/j.jsbmb.2012.12.004 |
| [21] |
GORDON M K, HAHN R A. Collagens[J]. Cell Tissue Res, 2010, 339(1): 247-257. DOI:10.1007/s00441-009-0844-4 |
| [22] |
WONG M Y, HARMANLI O H, AGAR M, et al. Collagen content of nonsupport tissue in pelvic organ prolapse and stress urinaryincontinence[J]. Am J Obstet Gynecol, 2003, 189(6): 1597-1599. DOI:10.1016/j.ajog.2003.09.043 |
| [23] |
HAN L Y, WANG L, WANG Q, et al. Association between pelvic organ prolapse and stress urinary incontinence withcollagen[J]. Exp Ther Med, 2014, 7(5): 1337-1341. DOI:10.3892/etm.2014.1563 |



