脊髓损伤(spinal cord injury, SCI)是目前世界范围内常见的且破坏性极强的神经系统疾病,年发病率为15/100万~52/100万,且近年来发病率呈逐年升高趋势[1-2]。其主要包括原发性损伤和继发性损伤[3-4],导致感觉缺失和运动功能障碍。原发性损伤是突然发生且通常不可逆,继发性损伤是原发性SCI后数小时后出现的,其部分病理改变可以逆转,其损伤机制与神经源性休克、血管损伤、微循环障碍、细胞凋亡等机制相互作用有关[5]。目前临床上脊髓损伤主要通过手术减压固定、营养神经类药物及激素、干细胞移植及高压氧等治疗方式[6],来保护损伤部位脊髓组织,促进神经功能的恢复。但这些治疗方法均未取得满意效果,因此,寻找新的脊髓损伤治疗方法十分必要。
由于SCI后主要的病理改变为微循环障碍和细胞凋亡[5],故改善脊髓损伤部位的缺血有助于损伤部位脊髓的修复,同时可以抑制缺血所致细胞凋亡,从而达到保护神经功能的目的。因此,具备这些效应的药物将是理想治疗药物。曲克芦丁,也称维生素P4,主要分布于水果、蔬菜和谷物中[7];已被证明有抑制红细胞和血小板聚集、抑制凋亡[8]、保护神经[9]、改善微循环、增加血中氧的含量、促进血管生成[10]等作用。目前曲克芦丁在临床上主要用于急性脑梗死及脑动脉栓塞、颅脑损伤等疾病的治疗,但在治疗SCI中的潜在功效从未被发现。
因此,本研究用曲克芦丁治疗SCI大鼠模型,通过Basso-Beattie-Bresnehan(BBB)评分监测大鼠运动功能的恢复,病理学检查脊髓损伤部位血管生成和神经修复的作用,对SCI后用曲克芦丁治疗的大鼠进行转录组分析,并验证测序筛选到的凋亡基因表达情况,为临床曲克芦丁治疗脊髓损伤提供科学依据。
1 材料与方法 1.1 实验动物及分组60只8周龄SD雄性大鼠,体质量250~300 g,由重庆医科大学动物中心提供。采用随机数字表的方法分为3组:Sham组、SCI组和曲克芦丁组,每组20只。Sham组:只做椎板切除,没有脊髓损伤。SCI组:参照Allen’s打击法建立脊髓损伤模型[11-13]。曲克芦丁组:在脊髓损伤后30 min尾静脉注射曲克芦丁注射液,6 mg/kg,每天1次,连续注射4周。SCI组及Sham组给予等量0.9%氯化钠注射液尾静脉注射,每天1次,连续4周。大鼠饲养环境:室内温度20~22 ℃,常规饮食,自由进食及饮水。实验按照动物伦理学标准对SD大鼠进行处理,处置方法符合伦理学要求。
1.2 BBB评分通过使用BBB[14]运动评定量表在手术后1、2、4周进行大鼠后肢运动功能评估。BBB评分总分为21分,总分0分表示完全瘫痪,21分表示完全正常活动。在评估期间分析大鼠的后肢运动,躯干位置,稳定性,踩踏,协调,爪子放置,脚趾间隙和尾部位置。两名熟悉评分标准的专业技术人员,在不了解实验分组和进程,独立评分后,取其平均值作为行为学评分结果。
1.3 HE染色脊髓损伤用药4周后,在最后1次给药结束后12 h,大鼠按25 mg/kg戊巴比妥钠腹腔注射麻醉,4%多聚甲醛心脏灌注,取出损伤部位脊髓前后各量取0.5 cm,在4%多聚甲醛放置24 h,脱水,用石蜡包埋,沿纵轴连续切片,厚度为5 μm;按照HE染色试剂盒说明书对脊髓组织切片进行染色,用光学显微镜观察并拍片。
1.4 转录组测序及生物信息学分析RNA-seq由北京元莘生物公司完成。曲克芦丁治疗脊髓损伤大鼠后4周,收集SCI对照组及曲克芦丁组损伤处脊髓组织送公司进行转录组测序。在Hiseq X Ten测序平台,进行转录组测序。为了确保结果的可重复性和可靠性,在分析的不同阶段有针对性地应用质量控制检查。原始读数的质量控制包括序列质量、GC含量、适配器的存在和低质量读数的分析。edgeR软件用于差异表达基因的筛选,go_enrichment软件用于差异表达基因GO功能及KEGG通路富集分析。差异基因筛选的标准为:|log2FC|>1且Pvalue<0.05。
1.5 Western blot检测收集完成各组脊髓组织后取出放入裂解液和蛋白酶抑制剂混合液中。经过研磨、低温离心、取上清液等过程,最后BCA试剂盒测蛋白浓度后,进行电泳、转膜、封闭。在4 ℃孵育一抗12 h,在室温下孵育二抗2 h;曝光仪曝光并用Image J分析各组条带灰度值。
1.6 统计学分析采用GraphPad Prism 7.0软件进行分析;Image Lab软件对各目的蛋白灰度进行分析。结果数据表示为x±s,组间统计学差异采用单因素方差分析或t检验,检验水准α=0.05。
2 结果 2.1 曲克芦丁对脊髓运动功能的影响术前3组大鼠BBB评分均为21分;术后Sham组BBB评分与术前相同,任意观察时间点BBB评分均显著高于其余两组。术后用药第1周,SCI对照组与曲克芦丁组BBB评分无统计学意义。术后用药第2、4周BBB评分显示,曲克芦丁组大鼠下肢运动功能明显好于SCI组(P < 0.05,图 1)。
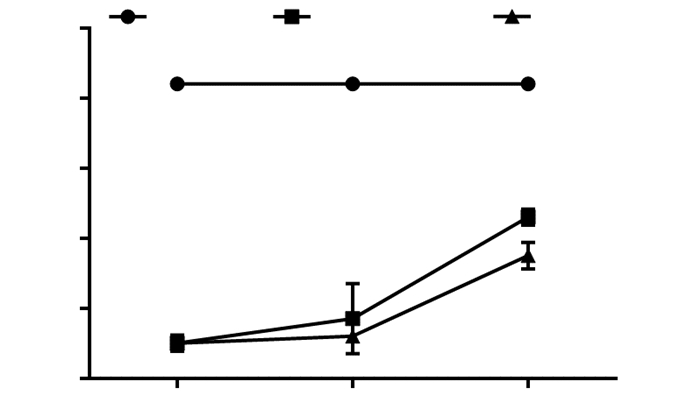
|
| a: P < 0.05, 与SCI对照组比较 图 1 不同时间点各组大鼠BBB评分比较(n=3,x±s) |
2.2 曲克芦丁促进血管生成
取损伤大鼠脊髓组织以及正常对照大鼠脊髓组织进行病理学分析。HE染色结果显示,Sham组大鼠脊髓组织形态结构完整,细胞形态完整,分布均匀;SCI组脊髓内有大量空泡,部分神经元溶解,周围可见少量炎症细胞浸润,脊髓结构排列紊乱,胶质瘢痕生成;曲克芦丁组脊髓组织空泡减少,同时可见损伤部位血管增生(图 2)。
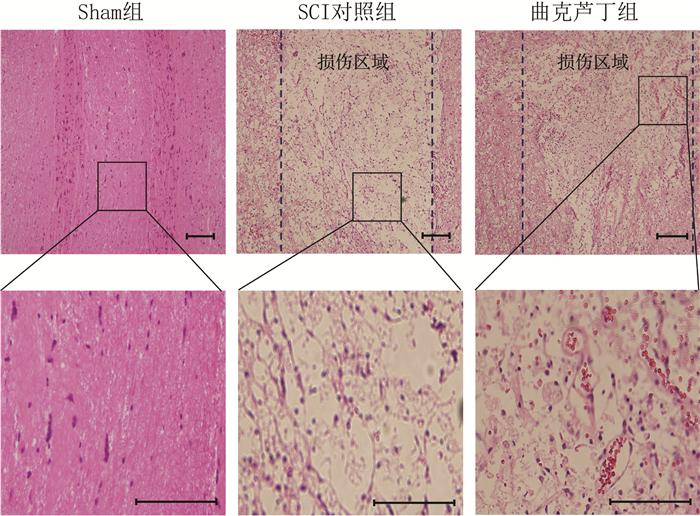
|
| 虚线之间区域代表损伤区;下排图为上图方框区域放大 图 2 各组大鼠脊髓组织HE染色观察 |
2.3 转录组测序及生物信息学分析 2.3.1 数据质量控制
对于RNA-seq,鉴于序列的随机性打断和G/C、A/T含量分别相等的原则,理论上每个测序循环上的GC含量相等、AT含量相等并且在整个测序过程基本稳定不变,呈水平线,而由于高通量测序技术中,反转录成cDNA时所用的6 bp的随机引物会引起前几个位置的核苷酸组成存在一定的偏好性,导致曲线初始在正常范围内波动。因此A、C、G、T在起始端会有所波动,但后面会趋于稳定。模糊碱基N所占比例越低,说明未知碱基越少,测序样本受系统AT偏好影响越小。从图 3可知,该文库碱基分布均匀,N%在合理范围之内;符合后续的分析要求。
|
| 横坐标是reads碱基坐标,坐标表示reads上依次从5’到3’端的碱基排列;纵坐标是所有reads在该测序位置(如第1个测序碱基)A、C、G、T碱基分别所占的百分比,不同碱基用不同颜色表示;SCI组和曲克芦丁组各3个标本 图 3 各组碱基含量分布检测结果 |
2.3.2 曲克芦丁显著改变损伤脊髓的基因表达
为了检测曲克芦丁对脊髓损伤的保护作用的分子机制,曲克芦丁治疗脊髓损伤大鼠后4周,收集SCI对照组及曲克芦丁组损伤处脊髓组织进行转录组测序。曲克芦丁治疗4周后,曲克芦丁组差异基因mRNA水平的表达显著升高(P < 0.05)。与SCI组相比,曲克芦丁组有261个差异表达基因,其中上调217个,下调44个。表 1显示了排名前10位的上调和下调的差异表达基因。
| 基因 | 基因全称描述 | 差异倍数 | P |
| Myot | Myotilin | 2.802 275 458 | 0.000 308 38 |
| Scn10a | Sodium Voltage-Gated Channel Alpha Subunit 10 | 2.629 438 354 | 0.000 117 072 |
| Ednra | Endothelin Receptor Type A | 2.559 208 568 | 0.001 376 526 |
| Ddi2 | DNA Damage Inducible 1 Homolog 2 | 2.529 496 045 | 0.002 052 787 |
| Aldh1a2 | Aldehyde Dehydrogenase 1 Family Member A2 | 2.352 950 426 | 0.000 489 416 |
| Acpp | Acid Phosphatase, Prostate | 2.325 111 328 | 0.002 102 865 |
| Bmp7 | Bone morphogenetic protein 7 | 2.264 675 389 | 0.001 320 607 |
| Dhrs9 | Dehydrogenase/Reductase 9 | 2.188 012 628 | 0.003 238 956 |
| Foxc2 | Forkhead Box C2 | 2.174 175 126 | 0.002 335 723 |
| Msln | Mesothelin | 2.149 022 644 | 0.006 042 208 |
| Impad1 | Inositol Monophosphatase Domain Containing 1 | -7.427 068 162 | 0.000 109 715 |
| Mboat7 | Membrane Bound O-Acyltransferase Domain Containing 7 | -6.832 496 798 | 0.003 442 238 |
| Serpinb1b | Serpin Family B Member 1 | -4.618 249 852 | 0.000 113 795 |
| Casp6 | Caspase 6 | -4.116 476 02 | 0.001 623 272 |
| Nfasc | Neurofascin | -3.823 245 408 | 0.000 839 129 |
| Col2a1 | Collagen Type II Alpha 1 Chain | -3.722 721 719 | 0.000 416 191 |
| Mpo | Myeloperoxidase | -3.625 844 793 | 0.008 954 226 |
| Defa5 | Defensin Alpha 5 | -3.595 069 561 | 0.006 235 442 |
| Hoxd10 | Homeobox D10 | -3.111 447 649 | 0.006 366 732 |
| Thbs1 | Throm-bospondin | -2.911 951 207 | 0.002 067 575 |
2.3.3 差异表达基因GO和KEGG通路富集分析
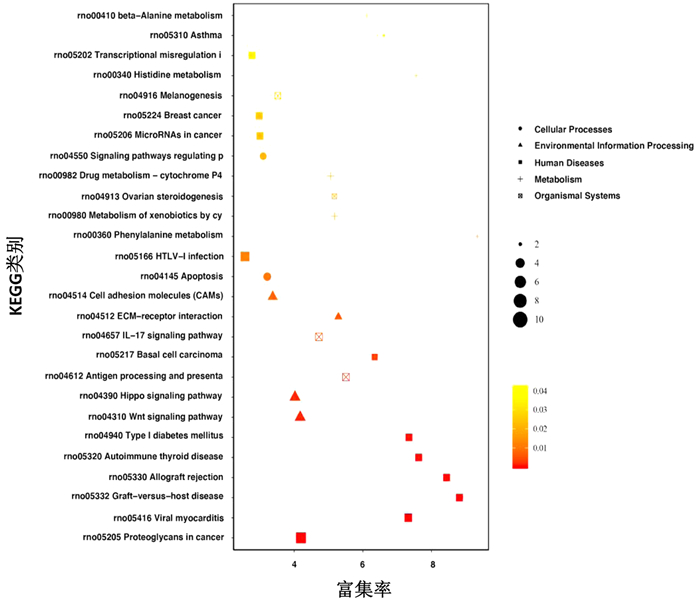
差异基因GO富集气泡图可直观地反映出在生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)富集的GO term上差异基因的个数分布情况。本实验通过GO和KEGG数据库对261个DEGs进行功能注释,发现曲克芦丁治疗损伤脊髓后富集与血管和神经相关的GO的通路有骨骼系统发育、血管系统发育和对外界刺激的反应(图 4);曲克芦丁治疗脊髓损伤与富集有意义的KEGG通路有Wnt、Hippo和Apoptosis等信号通路(图 5)。
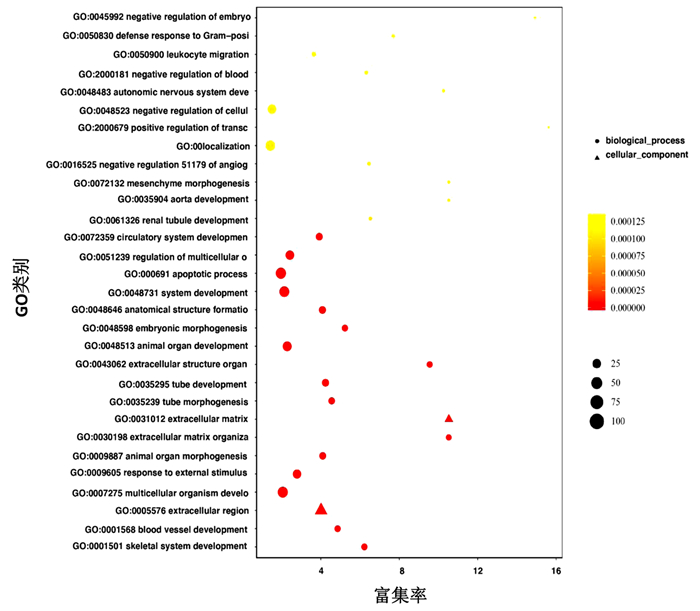
|
| 图中每个图形为一个GO term,纵坐标表示GO的名称,所属分类描述如右侧Class图例信息;横坐标表示为富集率,计算公式: (Enrich_factor=GeneRatio/BgRatio);图形越大表示差异表达基因的数目越多;颜色表示富集的显著性(P值),颜色越深表示该GO term越显著富集,右侧颜色梯度表示P值大小 图 4 差异表达基因GO功能富集散点图 |
|
| 图中每个图形为一个KEGG通路,纵坐标表示KEGG的通路名称,所属分类描述如右侧Class图例信息;横坐标表示为富集率;图形越大表示差异表达基因的数目越多;颜色表示富集的显著性即P值,颜色越深表示该通路越显著富集,右侧颜色梯度表示P值大小 图 5 差异表达基因KEGG通路富集分析散点图 |
2.4 曲克芦丁降低脊髓细胞凋亡
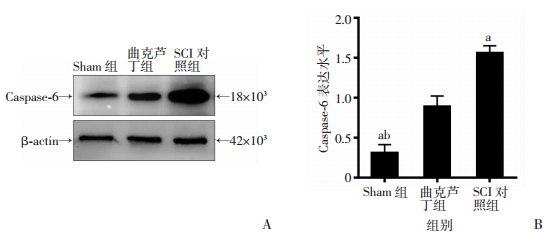
在曲克芦丁用药4周后检测caspase 6的表达,以判定曲克芦丁是否具有通过降低受损脊髓细胞凋亡介导的细胞死亡作用。Western blot检测结果显示,SCI组caspase 6的表达量最高,曲克芦丁组caspase 6蛋白表达较SCI组表达显著下降(P < 0.05),但仍高于Sham组(图 6)。
|
| A: Western blot检测各组caspase 6蛋白表达;B:各组caspase 6表达量变化的统计学分析(n=3, x±s);a:P < 0.05,与曲克芦丁组比较;b:P < 0.01,与SCI组比较 图 6 Western blot检测大鼠损伤脊髓组织caspase 6蛋白表达 |
3 讨论
脊髓损伤是一种严重的致残疾病,目前尚无完全治愈的方法[15]。脊髓损伤常伴血管内皮细胞损伤,血管内皮细胞释放血管舒张因子,活性血小板,具有促进血小板血栓的形成[16]。曲克芦丁具有抑制红细胞、血小板聚集、防止血栓形成等作用[17]。但是,曲克芦丁治疗SCI的作用机制尚不清楚。
在本研究中,我们通过mRNA测序的差异基因分析,发现与SCI组相比,曲克芦丁组有261个差异表达基因,其中上调差异基因有217个,下调差异基因有44个。GO和KEGG富集分析示,曲克芦丁主要富集在Wnt、Hippo和TGF-β、Apoptosis等信号通路,这些信号通路主要与细胞凋亡、血管生成、神经元的形成、脉管系统的发展、横纹肌的收缩、细胞的黏附有关;最终筛选到与曲克芦丁对脊髓具有保护作用的基因包括Bmp7、Nfasc、Caspase 6、Myotilin、Ednra、Impad1、Scn10a、Ddi2、Dhrs9、Aldh1a2、Acpp、Foxc2、Msln、Mboat7、Serpinb1b、Col2a1、Mpo、Thbs1等基因。这些基因涉及Wnt、Hippo、TGF-β和Apoptosis信号通路,提示曲克芦丁对SCI的保护作用机制比较广泛。
在排名前十位的差异基因中,我们发现Foxc2基因显著高表达于曲克芦丁组。既往研究发现,Foxc2是在血管生成和淋巴结形成过程中的关键调节基因。在肾脏缺血/再灌注后的缺氧中,Foxc2的表达由于缺氧而升高,其促进血管发育并调节多种血管生成因子,如Mmp2、Pdgfb和Vegf[18]。脊髓损伤恢复过程中,微血管的再生是个重要的环节。新生血管网的形成、完整血屏障的建立,可以为损伤局部细胞提供营养,有助于神经功能的恢复[19]。本研究HE染色发现曲克芦丁组脊髓组织内空泡明显减少,同时可见损伤部位血管增生,这可能与曲克芦丁具有促进血管增生的作用有关,从而改善局部微循环,达到促进运动功能恢复的作用。另外,还有研究发现,曲克芦丁在痔疮疾病治疗中,可通过保护内皮细胞并改善局部微循环来治疗痔疮[20],与本研究结果相一致,提示曲克芦丁在促进微循环重建中具有重要作用。
在排名前十位的差异基因中,我们发现曲克芦丁治疗可降低细胞凋亡基因caspase 6的表达。本研究Western blot结果也证实了其表达降低,在曲克芦丁治疗4周后,曲克芦丁组caspase 6蛋白表达较SCI组表达显著下降。结果提示曲克芦丁可通过抑制细胞凋亡途径,减少凋亡蛋白酶caspase 6的表达,从而达到促进脊髓损伤的恢复作用。凋亡在脊髓损伤过程中起着重要的作用,脊髓损伤后因脊髓缺血、缺氧可导致局部内环境失衡、细胞坏死、诱导细胞凋亡,从而导致损伤范围扩大,损伤程度加重。缺血、缺氧均可激活半胱氨酸蛋白水解酶caspase 6,蛋白酶水解活化后,接受内质网、线粒体等细胞器传递来的信号,引发凋亡的级联反应,最终使细胞程序性死亡[21]。故通过抑制神经细胞的凋亡途径可对脊髓损伤引起的运动功能损伤产生保护作用[22-24]。
本研究通过对大鼠下肢运动功能BBB评分,我们发现在曲克芦丁治疗2周后,曲克芦丁组大鼠BBB评分高于SCI组,治疗4周后差异更明显,这可能与曲克芦丁在脊髓损伤后的慢性期,促进损伤区域血管增生,改善脊髓损伤部位的微循环、降低凋亡因子的表达有关,从而达到保护神经的作用。
综上所述,曲克芦丁对脊髓损伤所致的凋亡相关基因的表达有明显的抑制作用,进而有效缓解脊髓损伤所致的神经元凋亡,这是曲克芦丁对脊髓损伤发挥的保护途径之一。曲克芦丁还通过调节促血管生成的相关基因的表达,促进损伤部位的血管增生,达到改善损伤部位脊髓组织微循环的作用,进而达到促进运动功能恢复的作用。本研究结果为曲克芦丁在脊髓损伤的潜在临床应用提供了一定的实验基础。
| [1] |
ALKABIE S, BOILEAU A J. The role of therapeutic hypothermia after traumatic spinal cord injury--a systematic review[J]. World Neurosurg, 2016, 86: 432-449. DOI:10.1016/j.wneu.2015.09.079 |
| [2] |
CHENG C, LI X, GAO S F, et al. Expression of CAPON after spinal cord injury in rats[J]. J Mol Neurosci, 2008, 34(2): 109-119. DOI:10.1007/s12031-007-9019-5 |
| [3] |
PIRAN S, SCHULMAN S. Incidence and risk factors for venous thromboembolism in patients with acute spinal cord injury: a retrospective study[J]. Thromb Res, 2016, 147: 97-101. DOI:10.1016/j.thromres.2016.09.030 |
| [4] |
KWON B K, TETZLAFF W, GRAUER J N, et al. Pathophysiology and pharmacologic treatment of acute spinal cord injury[J]. Spine J, 2004, 4(4): 451-464. DOI:10.1016/j.spinee.2003.07.007 |
| [5] |
齐英娜, 王威, 吴鑫杰, 等. 脊髓损伤后微循环的变化及微循环障碍的药物治疗进展[J]. 中医正骨, 2017, 29(10): 47-49. QI Y N, WANG W, WU X J, et al. Changes of microcirculation after spinal cord injury and drug treatment progress of microcirculation disorders[J]. J Trad Chin Orthop Trauma, 2017, 29(10): 47-49. DOI:10.3969/j.issn.1001-6015.2017.10.009 |
| [6] |
JIA X F, KOWALSKI R G, SCIUBBA D M, et al. Critical care of traumatic spinal cord injury[J]. J Intens Care Med, 2013, 28(1): 12-23. DOI:10.1177/0885066611403270 |
| [7] |
LU J, WU D M, ZHENG Z H, et al. Troxerutin protects against high cholesterol-induced cognitive deficits in mice[J]. Brain, 2011, 134(Pt 3): 783-797. DOI:10.1093/brain/awq376 |
| [8] |
QADIRI A, MIRZAEI BAVIL F, HAMIDIAN G, et al. Administration of troxerutin improves testicular function and structure in type-1 diabetic adult rats by reduction of apoptosis[J]. Avicenna J Phytomed, 2019, 9(4): 374-385. |
| [9] |
JAMALI-RAEUFY N, KARDGAR S, BALUCHNEJADMOJARAD T, et al. Troxerutin exerts neuroprotection against lipopolysaccharide (LPS) induced oxidative stress and neuroinflammation through targeting SIRT1/SIRT3 signaling pathway[J]. Metab Brain Dis, 2019, 34(5): 1505-1513. DOI:10.1007/s11011-019-00454-9 |
| [10] |
曹婉鑫, 唐瑶, 陈洋. 曲克芦丁药理作用的研究进展[J]. 中国食物与营养, 2015, 21(9): 73-75. CAO W X, TANG Y, CHEN Y. Research advancement of pharmacological function of troxerutin[J]. Food Nutr China, 2015, 21(9): 73-75. DOI:10.3969/j.issn.1006-9577.2015.09.020 |
| [11] |
程素利, 徐家淳, 王剑歌, 等. 急性脊髓损伤大鼠Allen's造模方法的改良及行为学评价[J]. 四川中医, 2015, 33(10): 43-45. CHENG S L, XU J C, WANG J G, et al. Improvement of Allen's modeling method in rats with acute spinal cord injury and Behavioral evaluation[J]. J Sichuan Tradit Chin Med, 2015, 33(10): 43-45. |
| [12] |
BYRNES K R, STOICA B A, FRICKE S, et al. Cell cycle activation contributes to post-mitotic cell death and secondary damage after spinal cord injury[J]. Brain, 2007, 130(Pt 11): 2977-2992. DOI:10.1093/brain/awm179 |
| [13] |
GROSSMAN S D, WOLFE B B, YASUDA R P, et al. Alterations in AMPA receptor subunit expression after experimental spinal cord contusion injury[J]. J Neurosci, 1999, 19(14): 5711-5720. |
| [14] |
BASSO D M, BEATTIE M S, BRESNAHAN J C. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21. DOI:10.1089/neu.1995.12.1 |
| [15] |
National Spinal Cord Injury Statistical Center. Spinal cord injury facts and figures at a glance[J]. J Spinal Cord Med, 2014, 37(3): 355-356. |
| [16] |
杨盛林, 罗春山. 脊髓缺血再灌注损伤后脊髓微循环的血流动力学改变[J]. 哈尔滨医药, 2019, 39(3): 293-295. YANG S L, LUO C S. The hemodynamic changes of spinal cord microcirculation after spinal cord ischemic reperfusion injury[J]. Harbin Med J, 2019, 39(3): 293-295. |
| [17] |
曾静, 王茹, 李丹丹, 等. 曲克芦丁脑蛋白水解物对大脑中动脉栓塞后大鼠神经血管单元的保护作用[J]. 中国卒中杂志, 2017, 12(12): 1097-1103. ZENG J, WANG R, LI D D, et al. Protective effect of troxerutin and cerebroprotein hydrolysate on neurovascular unit in rats after middle cerebral artery occlusion[J]. Chin J Stroke, 2017, 12(12): 1097-1103. DOI:10.3969/j.issn.1673-5765.2017.12.006 |
| [18] |
WANG T, ZHENG L, WANG Q, et al. Emerging roles and mechanisms of FOXC2 in cancer[J]. Clin Chim Acta, 2018, 479: 84-93. DOI:10.1016/j.cca.2018.01.019 |
| [19] |
LIN R Z, MELERO-MARTIN J M. Fibroblast growth factor-2 facilitates rapid anastomosis formation between bioengineered human vascular networks and living vasculature[J]. Methods, 2012, 56(3): 440-451. DOI:10.1016/j.ymeth.2012.01.006 |
| [20] |
ZHAO H, LIU Y, ZENG J, et al. Troxerutin and cerebroprotein hydrolysate injection protects neurovascular units from oxygen-glucose deprivation and reoxygenation-induced injury in vitro[J]. Evid Based Complement Alternat Med, 2018, 2018: 9859672. DOI:10.1155/2018/9859672 |
| [21] |
刘春华, 刘捷. 神经元凋亡与Caspase家族及细胞周期研究进展[J]. 人民军医, 2018, 61(7): 641-644. LIU C H, LIU J. Research progress on neuronal apoptosis, caspase family and cell cycle[J]. People Mil Surg, 2018, 61(7): 641-644. |
| [22] |
GAO K, SHEN Z L, YUAN Y J, et al. Simvastatin inhibits neural cell apoptosis and promotes locomotor recovery via activation of Wnt/β-catenin signaling pathway after spinal cord injury[J]. J Neurochem, 2016, 138(1): 139-149. DOI:10.1111/jnc.13382 |
| [23] |
SUMIDA Y, KAMEI N, SUGA N, et al. The endoplasmic Reticulum stress transducer old astrocyte specifically induced substance positively regulates glial scar formation in spinal cord injury[J]. Neuroreport, 2018, 29(17): 1443-1448. DOI:10.1097/WNR.0000000000001128 |
| [24] |
江玲军, 陈之瑜, 叶嘉靖, 等. 丁苯酞对脊髓损伤大鼠神经运动功能的保护作用及机制研究[J]. 中国临床药理学杂志, 2019, 35(16): 1765-1769. JIANG L J, CHEN Z Y, YE J J, et al. Protective effect and mechanism of butylphthalide on spinal cord injury rats[J]. Chin J Clin Pharmacol, 2019, 35(16): 1765-1769. DOI:10.13699/j.cnki.1001-6821.2019.16.013 |



