缺氧是多种心脑血管疾病(如心肌缺血[1]、脑出血[2]、失血性休克[3]等)和肠道疾病(如肠系膜缺血[4]、结肠癌[5]、肠扭转等)病程发生、发展的共同通路。严重缺氧和持续缺氧会引起器官功能紊乱或障碍,甚至危及生命。在缺氧状态下,细胞的生物合成、生物降解、氧化还原等一系列需氧生化过程都会受到影响,严重时可造成细胞水肿、结构破坏,甚至变性坏死。线粒体作为对氧浓度变化最敏感的细胞器,在线粒体部位氧分压降到临界点0.1 kPa时,可出现肿胀、嵴崩解、外膜破裂等病变[6]。而Drp1(mitochondrial dynamin-related protein 1)作为重要的线粒体动力相关蛋白,其活性改变在缺氧后线粒体功能调节中具有重要意义[7]。近年研究显示:在神经退行性变和心肌梗死等疾病中,Drp1可以与多种蛋白(如LRRK2、Filamin A等)通过蛋白互作的方式影响神经元的发育以及心肌细胞的衰老[8-9]。但是,这种Drp1蛋白互作模式是否参与了缺氧后多器官线粒体功能障碍的调节,目前尚不清楚。为此,本研究通过观察缺氧后多种细胞类型中Drp1活性变化、Drp1蛋白互作情况以及线粒体损伤情况,初步探究Drp1蛋白互作是否参与缺氧,多器官线粒体损伤过程;同时,利用点突变干预Drp1蛋白互作后观察缺氧后线粒体呼吸等功能指标,深入探究其调控机制,为探讨缺氧后线粒体损伤提供实验数据。
1 材料与方法 1.1 主要试剂和仪器心肌细胞系(H9C2)、血管平滑肌细胞系(vascular smooth muscle cells,VSMC)、肠上皮细胞系(intestinal epithelial cells,IEC)来源于中国科学院上海细胞库,传代并液氮保存于本室。Drp1抗体、LRRK2抗体、JC-1荧光探针检测试剂盒均购于美国Abcam公司;Thr磷酸化(p-Thr)修饰抗体、线粒体染料(MitoTracker Deep Red FM)均购于美国Cell signaling公司;免疫共沉淀试剂盒购于美国Sino Biological公司;乳酸含量检测试剂盒、ATP含量检测试剂盒均购于北京索莱宝公司。Drp1点突变质粒(Drp1 T595A)由上海和元生物科技有限公司协助设计包装。Drp1蛋白互作模型建立由广州殷赋信息科技有限公司和天津智盖生物科技有限公司协助完成。共聚焦显微镜(Leica TCS SP5,美国);双色红外荧光成像系统(Odyssey,美国)。
1.2 细胞缺氧处理将细胞接种在培养皿中,待贴壁完全、细胞覆盖率在70%以上后,置于37 ℃密封罐中,进行缺氧处理。缺氧步骤为先通入缺氧气体(95%氮气和5%二氧化碳)15 min后,关闭通气阀,10 min后重新开启通入缺氧气体,重复4次直到密封罐内氧气浓度低于0.2%,并维持缺氧状态4 h后取出进行观察或处理。
1.3 免疫共沉淀实验取50 μL protein A/G免疫磁珠加入1.5 mL离心管,置于磁力架上,待磁珠贴壁后吸去上清。用200 μL PBST稀释10 μg的Drp1抗体装入带有免疫磁珠的离心管中,室温孵育10 min后,置于磁力架上待磁珠贴壁后吸去上清。再用200 μL PBST洗涤磁珠3次。然后加入1 000 μL的含有细胞裂解液的细胞悬液,用移液器吹打混匀。37 ℃孵育15 min使抗原和结合有抗体的免疫磁珠结合后置于磁力架上待磁珠贴壁后吸去上清。用200 μL PBS洗涤免疫磁珠-抗体-抗原复合物3次。洗涤完后用100 μL PBS重悬磁珠,进行后续的免疫印迹验证与Drp1结合的p-Thr或者LRRK2的表达量。
1.4 免疫荧光观察线粒体形态将细胞接种在共聚焦培养皿中,待贴壁完全细胞覆盖率在50%左右时,用PBS清洗3次后,加入用无血清培养基稀释Mitotracker Deep Red FM染料(1 :10 000),37 ℃孵育30 min,然后用无钙台式液清洗3次后,在共聚焦显微镜下观察细胞中线粒体形态。红色荧光激发波为633 nm,可见范围为655~670 nm。
1.5 ZDOCK蛋白互作建模采用SWISS-MODEL服务器(https://swissmodel.expasy.org/)的同源模建方法构建LRRK2(1900-2090)和Drp1蛋白的三维结构。通过序列比对,分别为LRRK2和Drp1找到模板蛋白1FVR(同源性37.08%)和4BEJ(同源性98.69%)。两蛋白均选择A链进行建模,构建了目标蛋白的三维结构。采用ZDOCK 3.0.2预测LRRK2和DRP1蛋白复合物结构。LRRK2定义为配体,Drp1定义为受体,输出最多50个模型。根据能量打分,选取第1个模型在UCSF Chimera中进行进一步能量优化。最后采用PyMOL程序作图分析[10-11]。
1.6 线粒体膜电位检测将细胞接种在共聚焦培养皿中,贴壁后干预处理。PBS洗涤后,加入0.1%的JC-1染色工作液,37 ℃孵育30 min。孵育结束后用PBS重复洗涤3次后,将培养皿置于共聚焦显微镜下观察。正常情况下JC-1多以复合体形式存在呈现红色荧光,激发波为633 nm;JC-1单体形式呈现绿色荧光,激发波为488 nm。
1.7 统计学分析使用SPSS 17.0统计软件。定量资料以x ± s表示,两组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,当方差分析结果有统计学意义时,再采用SNK法或者LSD法进行多重比较。P < 0.05为差异有统计学意义。
2 结果 2.1 缺氧后Drp1的Thr活性变化与线粒体损伤的关系对多种组织类型细胞进行缺氧处理后,利用免疫共沉淀将Drp1蛋白抽提取出来, 观察其活性改变,主要关注p-Thr修饰变化(图 1A)。结果显示:缺氧后心肌细胞中Drp1的Thr磷酸化水平提高了80%(P < 0.05),血管平滑肌细胞中Drp1的Thr磷酸化水平提高3倍(P < 0.05),肠上皮细胞中Drp1的Thr磷酸化水平提高近2倍(P < 0.05),提示缺氧会引起多种器官中线粒体Drp1的Thr磷酸化水平明显增高(图 1B)。利用共聚焦显微镜观察缺氧后多种细胞类型中线粒体形态变化,发现缺氧后线粒体损伤明显,线粒体碎片化程度与Drp1的Thr活化程度呈正相关(R2=0.941,P < 0.05),提示缺氧后Drp1的Thr磷酸化水平增高可能参与了缺氧后多器官线粒体损伤(图 1C)。
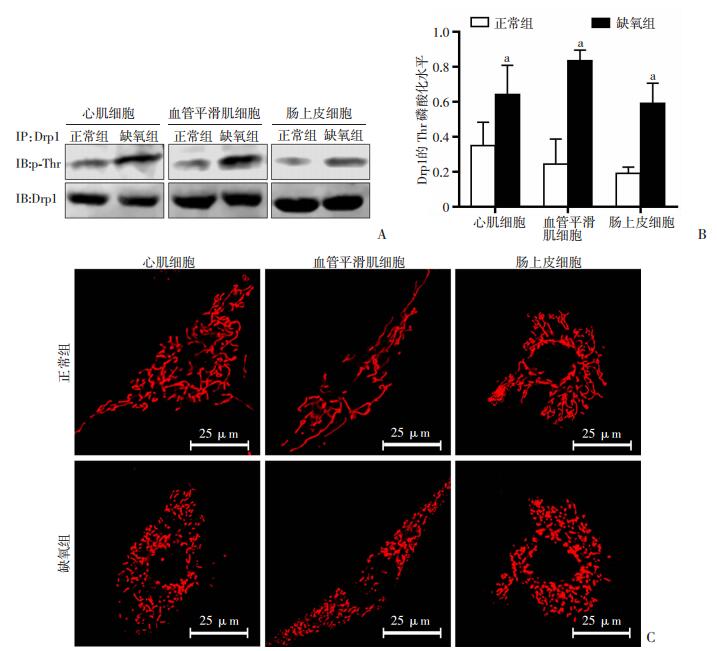
|
| A:免疫共沉淀检测缺氧后多种细胞类型线粒体Drp1的Thr磷酸化水平; B: A图灰度扫描统计分析(n=3) a:P < 0.05,与正常组比较; C:共聚焦显微镜观察缺氧后多种细胞类型线粒体形态变化 图 1 缺氧后多种细胞类型中Drp1的Thr活性变化和线粒体损伤情况 |
2.2 缺氧后活化Drp1与LRRK2的偶联情况
利用ZDOCK技术对缺氧情况下Drp1与其他蛋白如LRRK2的蛋白互作情况进行建模(图 2A)。从程序输出的前10个模型中选取第1个(即打分最好的)模型进行分析研究(表 1)。结果表明:缺氧后Drp1蛋白和LRRK2蛋白正面区域残基间存在大量氢键结合,其中Drp1 T595位点和LRRK2 G2019位点的结合最为显著。邻近界面的残基间也存在氢键相互作用,如Lys594D-Glu2033L、Lys594D-Ser2032L、Met592D-Thr2035L、Ala598D-Lys1906L和Glu599D-Lys1906L。这些残基大部分位于环区,很好地相互契合(图 2B)。在背面区域,两蛋白间也存在大量氢键,包括Phe2003L与Lys635D、Glu1902L与Arg634D和Lys635D、Ser1951L与Arg634D、Lys635D和Asn624D、Lys1952L与Ser616 D、Leu626 D和Asp627D等(图 2C),提示缺氧后活化Drp1与LRRK2存在偶联。以血管平滑肌细胞为代表,进一步通过免疫共沉淀方法验证缺氧后Drp1与LRRK2的结合情况,结果显示:缺氧后Drp1与LRRK2的结合力是正常情况的10倍(P < 0.05,图 2D、E),提示缺氧后活化Drp1与LRRK2的蛋白互作可能参与了缺氧后多器官线粒体损伤调节。
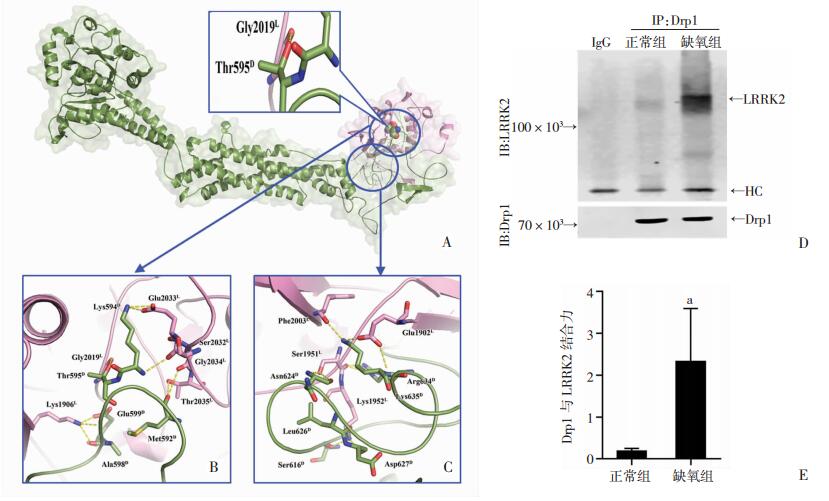
|
| A:ZDOCK蛋白互作模型模拟缺氧后Drp1与LRRK2结合情况,LRRK2以粉色表示,Drp1以泥绿色表示,关键残基以相应颜色棒状表示,黄色虚线表示氢键相互作用;B:缺氧后Drp1与LRRK2蛋白界面残基间氢键结合正面图;C:缺氧后Drp1与LRRK2蛋白界面残基间氢键结合背面图;D:免疫共沉淀检测缺氧后Drp1与LRRK2结合情况;E:D图灰度扫描统计结果(n=3) a: P < 0.05,与正常组比较 图 2 缺氧后活化Drp1与LRRK2的蛋白互作情况 |
| 模型 | ZDOCK打分 |
| 1 | 1 330.963 |
| 2 | 1 313.107 |
| 3 | 1 306.986 |
| 4 | 1 303.910 |
| 5 | 1 302.771 |
| 6 | 1 292.298 |
| 7 | 1 285.426 |
| 8 | 1 281.605 |
| 9 | 1 241.610 |
| 10 | 1 239.095 |
2.3 缺氧后Drp1-LRRK2偶联对线粒体能量代谢的影响
为了探究缺氧后活化Drp1与LRRK2的结合对于线粒体损伤的具体影响,通过点突变Drp1与LRRK2的结合位点(Drp1 T595A),破坏缺氧后活化Drp1与LRRK2的偶联(图 3A)。免疫共沉淀结果显示:与野生型对照组(Drp1WT)相比,点突变Drp1 T595A会导致缺氧后Drp1与LRRK2结合力减少75%(P < 0.05),证实了点突变Drp1对于缺氧后Drp1-LRRK2偶联的破坏作用(图 3B)。同时,在缺氧过程中发现:在缺氧组和野生型对照组的细胞培养基中,观察到培养基的强酸化(呈黄色),但是正常组和点突变Drp1组(Drp1T595A)并未出现同等情况(图 3C)。进一步对细胞外的乳酸生成进行了定量测定,结果表明:正常情况下检测细胞外乳酸含量为(14.13±6.02)nmol/mL,缺氧后细胞外乳酸含量明显升高[(32.14±9.83) nmol/mL, P < 0.05],野生型对照组乳酸生成量与缺氧组比较差异无统计学意义,而点突变Drp1组细胞外乳酸含量明显改善[(19.14±6.64) nmol/mL, P < 0.05, 图 3D]。上述结果表明:缺氧后Drp1-LRRK2偶联可加速缺氧后糖酵解的乳酸生成过程。
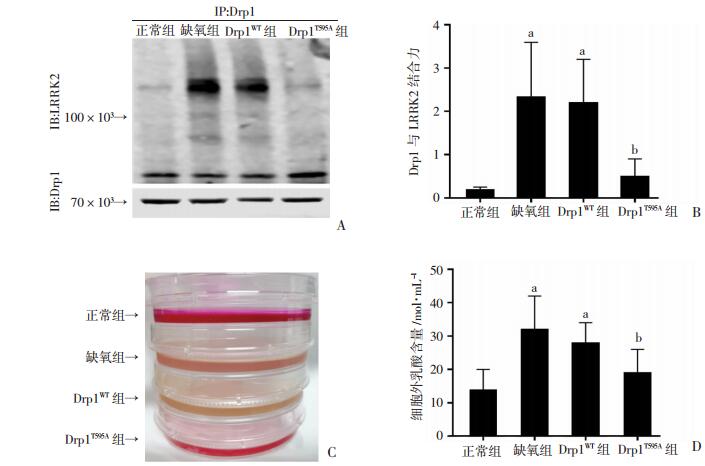
|
|
a: P < 0.05,与正常组比较;b: P < 0.05, 与缺氧组比较 A:免疫共沉淀检测点突变Drp1对缺氧后Drp1-LRRK2偶联的影响; B: A图灰度扫描统计结果(n=3); C:培养基酸化实验结果;D:细胞外乳酸测定结果(n=3) 图 3 破坏缺氧后Drp1-LRRK2偶联可抑制缺氧后糖酵解的乳酸生成 |
2.4 缺氧后Drp1-LRRK2偶联对线粒体有氧呼吸的影响
利用JC-1荧光复合探针检测点突变Drp1后线粒体膜电位变化(图 4A),结果显示:正常情况下JC-1多以复合体形式存在,而缺氧后JC-1多以单体形式存在,提示缺氧后线粒体膜电位明显减低(P < 0.05)。野生型对照组(Drp1WT)乳酸生成量与缺氧组比较差异无统计学意义,而点突变Drp1组(Drp1T595A)的JC-1复合体/单体的比例是缺氧组的2.5倍(P < 0.05,图 4B),提示破坏缺氧后Drp1-LRRK2的偶联可明显改善缺氧后线粒体膜电位。进一步对细胞有氧呼吸指标进行测定,结果显示:缺氧后ATP生成减少了53%,而点突变Drp1破坏Drp1-LRRK2偶联后,ATP产生量提高43%(图 4C)。上述结果表明缺氧后Drp1-LRRK2的偶联降低了线粒体氧化磷酸化水平、抑制了线粒体的有氧呼吸。
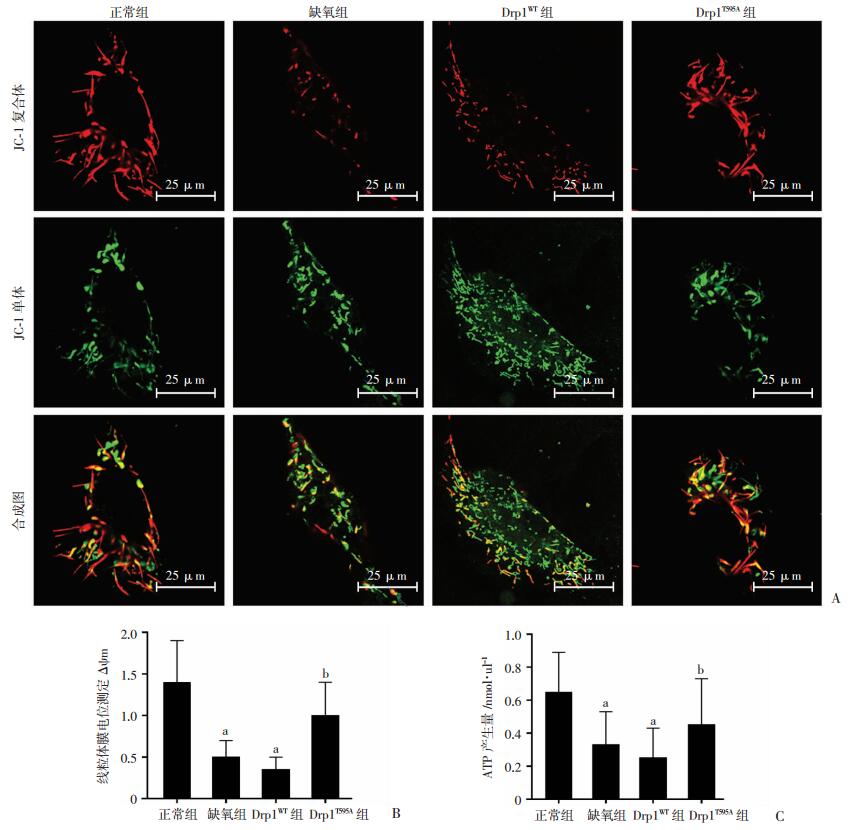
|
|
a: P < 0.05, 与正常组比较;b: P < 0.05,与缺氧组比较 A:共聚焦显微镜观察线粒体膜电位JC-1荧光探针变化; B: A图灰度扫描统计分析(n=3); C: ATP生成量检测(n=3) 图 4 破坏缺氧后Drp1-LRRK2偶联可改善缺氧后线粒体有氧呼吸 |
3 讨论
缺氧是多种危重症的共同通路,与肿瘤、糖尿病、炎症和多器官功能障碍等多种疾病的发生、发展密切相关。破坏缺氧后Drp1-LRRK2的偶联会导致糖酵解过程受抑制,这可能与细胞有氧呼吸过程受到保护有关[12],而线粒体膜电位(ΔΨm)是细胞进行正常能量代谢、产生ATP、维持氧化磷酸化的重要基础[13]。过去几十年的研究强调了缺氧对线粒体和线粒体代谢的影响[14],包括线粒体分裂和融合、线粒体自噬[15]、线粒体氧化磷酸化(OXPHOS)以及相关的信号转导机制。但是对于“线粒体在功能、结构和代谢等方面如何应对急性和/或慢性缺氧”及“如何通过替换呼吸链复合体上不同蛋白质产生适应性调节的机制[6]”方面还需要深入探究。本研究发现缺氧后线粒体相关蛋白Drp1发生Thr活化,并通过与LRRK2激酶的蛋白互作效应抑制线粒体的有氧呼吸功能,加速糖酵解过程中乳酸的生成,进而加重多器官线粒体功能损伤。
以往研究显示Drp1的活性改变在多种细胞类型的线粒体功能调节中具有重要意义。在缺血再灌注损伤的心肌细胞中,Drp1 Ser616磷酸化水平的上调和Ser637磷酸化水平的减低会引起ROS产生增加和线粒体过度分裂[16]。在高血糖(hyperglycemia)刺激下的内皮细胞中,Drp1 Ser600磷酸化水平上调会引起Drp1的线粒体转位[17]。此外,Drp1的其他修饰变化还包括:亚硝基化(S-nitrosylation)、苏木化(SUMOylation)、泛素化(ubiquitination)、糖基化(O-GlcNAcylation)[18]。研究显示Drp1泛素化可以促进细胞分裂后的线粒体网的重建,当泛素化受到抑制时,细胞因子合成减少,线粒体分布迅速不均匀[19]。Drp1苏木化(SUMOylation)可以促进Drp1与线粒体外膜的结合,同时影响线粒体与内质网之间的钙交换、线粒体嵴的重构以及细胞色素C的释放[20]。本研究发现缺氧后Drp1的Thr磷酸化修饰可以调节线粒体呼吸功能,这可能与Drp1可以受多种Ser/Thr激酶调控有关。ZHANG等[21]在神经退行性变的研究中发现:PKA(protein kinase A)作为一种Ser/Thr激酶可以通过与线粒体支架锚定蛋白APAP121形成复合物导致Drp1磷酸化,对维持线粒体稳态和神经元的发育至关重要。JIN等[22]在前列腺癌的研究中发现:干预Drp1招募蛋白INF2的Thr序列可以影响Drp1到线粒体和内质网的定植。LIU等[23]在帕金森疾病中的研究发现:同样作为线粒体Ser/Thr激酶的PINK1可以通过调节Drp1导致线粒体呼吸链组装异常,影响能量代谢。本研究进一步证实了Drp1的活性改变在线粒体功能调控中的重要作用,同时对于缺氧后Drp1发生转录后修饰变化的磷酸化位点提供了更多的实验依据。
此外,本研究还发现缺氧后Drp1的Thr位点不仅发生磷酸化,可以在Thr 595位点与同样含有GTPase结构域的同源激酶LRRK2产生偶联反应,形成Drp1-LRRK2蛋白互作。对于Drp1与其他蛋白的结合情况,以往也有一定研究。NISHIMURA等[8]在心肌梗死的研究中发现:缺氧后Drp1的GTPase结构域可以与肌动蛋白细胞骨架Filamin A相互作用,并以肌动蛋白结合依赖的方式增加Drp1的活性,加速了心肌梗死后心脏的脆弱性和心肌细胞的衰老。WANG等[9]在帕金森疾病中同样发现了Drp1与LRRK2的结合作用,并且使用线粒体分裂抑制剂P110可以阻断LRRK2诱导的线粒体碎片化、线粒体功能障碍以及神经元毒性。与本研究在缺氧模型中点突变Drp1蛋白互作位点后观察到的现象一致。
线粒体膜电位是维持线粒体进行氧化磷酸化和产生ATP的先决条件,膜电位的稳定有利于维持细胞的正常生理功能[24]。细胞在不同刺激作用下导致线粒体电子传递链组装异常时,线粒体膜电位也会出现不同程度的下降,因此,线粒体膜电位常被作为反映线粒体有氧呼吸功能的指标之一[25]。本研究发现缺氧后Drp1-LRRK2的偶联会影响线粒体复合体的组装、改变氧化磷酸化过程中电子传递的速率,线粒体膜电位和ATP生成都明显降低,说明细胞有氧呼吸受到了极大的破坏。而与此同时,细胞外培养基酸化程度明显,乳酸含量显著升高,提示缺氧后Drp1-LRRK2的偶联反应可能会通过影响复合体组装和氧化磷酸化系统使得细胞能量代谢从OXPHOS转向糖酵解。
综上所述,本研究发现缺氧后Drp1的Thr活化位点可以与LRRK2发生偶联反应,通过影响线粒体电子传递链复合体的组成,使得细胞能量代谢从OXPHOS转向糖酵解,乳酸生成增高,破坏线粒体能量代谢,加重多器官组织线粒体损伤。本研究进一步证实了缺氧条件下线粒体动力相关蛋白Drp1会发生明显改变,同时初步阐明了Drp1调控线粒体功能尤其是线粒体呼吸过程的相关机制。至于缺氧后活化Drp1如何调节电子传递链复合体组成和影响线粒体代谢变化,还需要后续深入研究。
| [1] |
DUAN C Y, CAO Z Z, TANG F Q, et al. MiRNA-mRNA crosstalk in myocardial ischemia induced by calcified aortic valve stenosis[J]. Aging (Albany NY), 2019, 11(2): 448-466. DOI:10.18632/aging.101751 |
| [2] |
LIU Z Q, ZENG X, DUAN C Y. Neuropsychological rehabilitation and psychotherapy of adult traumatic brain injury patients with depression: a systematic review and meta-analysis[J]. J Neurosurg Sci, 2018, 62(1): 24-35. DOI:10.23736/S0390-5616.17.03953-4 |
| [3] |
DUAN C Y, CHEN K, YANG G M, et al. HIF-1α regulates Cx40-dependent vasodilatation following hemorrhagic shock in rats[J]. Am J Transl Res, 2017, 9(3): 1277-1286. |
| [4] |
DUAN C Y, YANG G M, LI T, et al. Advances in vascularhyporeactivity after shock: the mechanisms and managements[J]. Shock, 2015, 44(6): 524-534. DOI:10.1097/SHK.0000000000000457 |
| [5] |
MEI Z B, DUAN C Y, LI C B, et al. Prognostic role of tumor PIK3CA mutation in colorectal cancer: a systematic review and meta-analysis[J]. Ann Oncol, 2016, 27(10): 1836-1848. DOI:10.1093/annonc/mdw264 |
| [6] |
FUHRMANN D C, BRÜNE B. Mitochondrial composition and function under the control of hypoxia[J]. Redox Biol, 2017, 12: 208-215. DOI:10.1016/j.redox.2017.02.012 |
| [7] |
MARSBOOM G, TOTH P T, RYAN J J, et al. Dynamin-related protein 1-mediated mitochondrial mitotic fission permits hyperproliferation of vascular smooth muscle cells and offers a novel therapeutic target in pulmonary hypertension[J]. Circ Res, 2012, 110(11): 1484-1497. DOI:10.1161/CIRCRESAHA.111.263848 |
| [8] |
NISHIMURA A, SHIMAUCHI T, TANAKA T, et al. Hypoxia- induced interaction offilamin with Drp1 causes mitochondrial hyperfission-associated myocardial senescence[J]. Sci Signal, 2018, 11(556): eaat5185. DOI:10.1126/scisignal.aat5185 |
| [9] |
WANG X L, YAN M H, FUJIOKA H, et al. LRRK2 regulates mitochondrial dynamics and function through direct interaction with DLP1[J]. Hum Mol Genet, 2012, 21(9): 1931-1944. DOI:10.1093/hmg/dds003 |
| [10] |
DILIP A, LEŠNIK S, ŠTULAR T, et al. Ligand-based virtual screening interface between PyMOL and LiSiCA[J]. J Cheminform, 2016, 8(1): 46. DOI:10.1186/s13321-016-0157-z |
| [11] |
PIERCE B G, HOURAI Y, WENG Z P. Accelerating protein docking in ZDOCK using an advanced 3D convolution library[J]. PLoS ONE, 2011, 6(9): e24657. DOI:10.1371/journal.pone.0024657 |
| [12] |
YAN X, SHI Z F, XU L X, et al. Glutamate impairs mitochondria aerobic respiration capacity and enhances glycolysis in cultured rat astrocytes[J]. Biomed Environ Sci, 2017, 30(1): 44-51. DOI:10.3967/bes2017.005 |
| [13] |
TORRES M J, KEW K A, RYAN T E, et al. 17β-estradiol directly lowers mitochondrial membranemicroviscosity and improves bioenergetic function in skeletal muscle[J]. Cell Metab, 2018, 27(1): 167-179. DOI:10.1016/j.cmet.2017.10.003 |
| [14] |
段晨阳, 向鑫明, 匡磊, 等. 活化Drp1介导谷胱甘肽代谢调节失血性休克后线粒体功能的研究[J]. 第三军医大学学报, 2020, 42(1): 50-58. DUAN C Y, XIANG X M, KUANG L, et al. Role of activated dynamin-related protein 1-mediated glutathione metabolism in regulation of mitochondrial dysfunction after hemorrhagic shock[J]. J Third Mil Med Univ, 2020, 42(1): 50-58. DOI:10.16016/j.1000-5404.201907139 |
| [15] |
FUHRMANN D C, WITTIG I, HEIDE H, et al. Chronic hypoxia alters mitochondrial composition in human macrophages[J]. Biochim Biophys Acta, 2013, 1834(12): 2750-2760. DOI:10.1016/j.bbapap.2013.09.023 |
| [16] |
ZAJA I, BAI X W, LIU Y N, et al. Cdk1, PKCδ and calcineurin-mediated Drp1 pathway contributes to mitochondrial fission-induced cardiomyocyte death[J]. Biochem Biophys Res Commun, 2014, 453(4): 710-721. DOI:10.1016/j.bbrc.2014.09.144 |
| [17] |
WANG W J, WANG Y, LONG J Y, et al. Mitochondrial fission triggered by hyperglycemia is mediated by ROCK1 activation inpodocytes and endothelial cells[J]. Cell Metab, 2012, 15(2): 186-200. DOI:10.1016/j.cmet.2012.01.009 |
| [18] |
HU C X, HUANG Y, LI L J. Drp1-dependent mitochondrial fission plays critical roles in physiological and pathological progresses in mammals[J]. Int J Mol Sci, 2017, 18(1): E144. DOI:10.3390/ijms18010144 |
| [19] |
HORN S R, THOMENIUS M J, JOHNSON E S, et al. Regulation of mitochondrial morphology by APC/CCdh1-mediated control of Drp1 stability[J]. Mol Biol Cell, 2011, 22(8): 1207-1216. DOI:10.1091/mbc.E10-07-0567 |
| [20] |
PRUDENT J, ZUNINO R, SUGIURA A, et al. MAPL SUMOylation of Drp1 stabilizes an ER/mitochondrial platform required for cell death[J]. Mol Cell, 2015, 59(6): 941-955. DOI:10.1016/j.molcel.2015.08.001 |
| [21] |
ZHANG J D, FENG J C, MA D, et al. Neuroprotective mitochondrial remodeling by AKAP121/PKA protects HT22 cell from glutamate-induced oxidative stress[J]. Mol Neurobiol, 2019, 56(8): 5586-5607. DOI:10.1007/s12035-018-1464-3 |
| [22] |
JIN X F, WANG J, GAO K, et al. Dysregulation of INF2-mediated mitochondrial fission in SPOP-mutated prostate cancer[J]. PLoS Genet, 2017, 13(4): e1006748. DOI:10.1371/journal.pgen.1006748 |
| [23] |
LIU W, ACIN-PEREZ R, GEGHMAN K D, et al. Pink1 regulates the oxidative phosphorylation machinery via mitochondrial fission[J]. Proc Natl Acad Sci U S A, 2011, 108(31): 12920-12924. DOI:10.1073/pnas.1107332108 |
| [24] |
杨玲, 刘若兰, 牛欢, 等. 低表达线粒体蛋白ISCA2对线粒体功能影响的机制研究[J]. 中国细胞生物学学报, 2018, 40(7): 1120-1129. YANG L, LIU R L, NIU H, et al. Elucidation of roles of protein ISCA2 in the control of mitochondrial function[J]. Chin J Cell Biol, 2018, 40(7): 1120-1129. |
| [25] |
SUMI C, OKAMOTO A, TANAKA H, et al. Propofol induces a metabolic switch to glycolysis and cell death in a mitochondrial electron transport chain-dependent manner[J]. PLoS ONE, 2018, 13(2): e0192796. DOI:10.1371/journal.pone.0192796 |



