2. 264005 山东 烟台,烟台大学分子药理和药物评价教育部重点实验室
2. Key Laboratory of Molecular Pharmacology and Drug Evaluation of Ministry of Education, Yantai University, Yantai, Shangdong Province, 264005, China
肝脏纤维化是一种继发于肝炎病毒或寄生虫感染、脂肪肝、胆汁淤积、自身免疫等因素所致慢性肝脏损伤及炎症的共同反应,是肝硬化发生的关键病理环节[1]。据世界卫生组织估计,2019年全球约有3.28亿病毒性肝炎患者(仅指乙肝和丙肝患者),而中国约占三分之一[2]。中商情报大健康数据显示:随着国民生活水平的不断提高,我国脂肪性肝病的发病人数于2015年超过3亿。预计2020年,我国乙肝、丙肝和脂肪性慢性肝病患者将达到4.47亿。有效防治慢性肝病患者的肝脏纤维化,是阻止病情由慢性肝炎进一步发展为肝硬化和肝癌的重要途径。然而,目前世界各国尚无有效药物上市用于肝脏纤维化的防治。因此,寻找有效防治肝纤维化的药物,日益紧迫。
肝脏星状细胞(hepatic stellate cells, HSCs)是肝脏非实质细胞之一,位于肝细胞和肝血窦内皮细胞之间的狄氏腔内。肝星状细胞的活化是慢性肝炎发生肝脏纤维化的主要原因。正常状态下,HSCs处于静息状态,即非活化状态,具有储存维生素A和脂滴的功能;在肝脏炎症微环境的因素刺激下,肝星状细胞增殖加快,迁移至肝细胞受损伤处,被激活、分化为肌成纤维细胞,细胞内α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等基因表达显著升高,其细胞外基质(extracellular matrix, ECM)分泌也明显增加[3]。研究发现:脂多糖(lipopolysaccharide, LPS)通过激活NF-κB信号通路能够强化HSCs的增殖、迁移能力,并使其活化;而阻断HSCs内NF-κB信号可以实现抑制细胞的活化[4-5]。表明通过调控炎症信号途径的激活以抑制肝星状细胞的活化,可能是防治肝纤维化的一个有效策略。
连翘苷(phillyrin, PHI)是木犀科植物连翘干燥果实的有效成分之一,具有抗炎、抗氧化等[6-9]广泛的药理学作用。据报道,连翘在中医上被广泛应用于清热、解毒、散结和消肿等,有较好的安全性与药物疗效[10]。连翘的提取物能够明显改善四氯化碳(CCl4)诱导小鼠的肝脏损伤、减轻肝脏纤维化[11]。研究表明:PHI通过抑制LPS诱导的炎症反应能够显著性缓解小鼠的急性肺损伤[8];在体外,通过抑制LPS诱导巨噬细胞内氧自由基(ROS)的产生,PHI也可明显抑制细胞的氧化应激和炎症反应[9]。然而,迄今PHI对HSCs活化的调节作用尚不清楚。因此,本研究以大鼠肝星状细胞HSC-T6为研究对象,观察PHI对LPS诱导肝星状细胞活化的影响,并探讨其作用机制,旨在为寻找有效抑制肝星状细胞活化的药物提供实验依据和有益线索。
1 材料与方法 1.1 材料PHI(纯度大于98%)购自成都瑞芬思科技有限公司;HSC-T6细胞来源于北京北纳生物科技有限公司;DMEM细胞培养基、胰酶购自美国Hyclone公司;胎牛血清购自以色列BI公司;LPS、MTT购自美国Sigma公司;ELISA试剂盒购自武汉博士德公司;磷酸化NF-κB p65(Ser536)(93H1)兔单克隆抗体、NF-κB p65(D14E12)XP©兔单克隆抗体、α-SMA(D4K9N) XP©兔单克隆抗体均购自美国CST公司;β-actin小鼠单克隆抗体购自南京金斯瑞生物科技公司;ROS检测试剂盒、辣根过氧化物酶标记山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)均购自上海碧云天生物技术有限公司;细胞培养瓶、培养板和Transwell小室购自美国康宁公司。
1.2 方法 1.2.1 细胞复苏及培养从液氮中取出冻存的HSC-T6细胞悬液后,迅速放置于37 ℃水浴中,待细胞悬液完全融化,转移至有5 mL DMEM培养基的离心管中,1 200 r/min离心5 min。弃上清培养基,用含有10%FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基重悬细胞,并转移至培养瓶中。于37 ℃、5%CO2的细胞孵箱中培养。
1.2.2 MTT检测利用胰酶消化处于对数生长期的HSC-T6细胞,制成细胞悬液,调整细胞数为4×104/mL。将细胞悬液接种于96孔培养板,每孔100 μL。培养箱中放置过夜后,弃上清,用DMEM完全培养基配制不同浓度的PHI溶液,加入有细胞的96孔培养板中,每孔100 μL。培养箱中孵育2 h后,每孔再加入100 μL不含或含有2 μg/mL LPS的培养基稀释液,使LPS的终浓度为1 μg/mL。设空白对照组、LPS(1 μg/mL)处理组、1 μmol/L PHI+ LPS处理组和10 μmol/L PHI+ LPS处理组,每组6个复孔。培养箱中继续培养24 h后,每孔加入5 mg/mL的MTT溶液20 μL,37 ℃孵育4 h。弃上清,每孔加入100 μL DMSO使紫色结晶完全溶解,振板混匀15 min,采用酶标仪检测波长570 nm处的光密度值D(570)。
1.2.3 Transwell迁移试验取对数生长期的HSC-T6细胞,胰酶消化,用无血清培养基制成细胞悬液并调整细胞数为4×105/mL。实验分4组:空白对照组、LPS处理组、1 μmol/L PHI+LPS处理组、10 μmol/L PHI+LPS处理组。下室均先加入500 μL无血清培养基,空白对照组和LPS处理组加100 μL无血清培养基于上室,2个PHI+LPS处理组分别加入100 μL含有2、20 μmol/L PHI的培养基,各组再加入100 μL细胞悬液,37 ℃孵育2 h。将上室分别轻轻转移至另一下室中,空白对照组下室为500 μL无血清DMEM培养基,LPS处理组的下室为500 μL含1 μg/mL LPS的DMEM培养基,2个PHI+LPS处理组分别为含有500 μL 1 μmol/L和10 μmol/L PHI以及1 μg/mL LPS的DMEM培养基。继续培养6 h后,4%中性多聚甲醛室温固定30 min,用棉签轻轻擦去上室膜上侧的细胞,0.1%结晶紫室温染色30 min,常温PBS洗3次,显微镜下随机选取6个视野,拍照,采用Image J软件统计每个视野中的细胞数。
1.2.4 ELISA检测取对数生长期的细胞,按照每孔4×104/500 μL接种于12孔培养板中,培养过夜。弃上清,分别加入不含或含有化合物的培养基400 μL,于37 ℃处理2 h,实验分4组:空白对照组、LPS处理组、1 μmol/L PHI+ LPS处理组、10 μmol/L PHI+ LPS处理组,每组4个复孔。除空白对照组正常培养外,其余3组再加入2 μg/mL的LPS 400 μL,继续培养24 h后收集上清500 μL,按照ELISA试剂盒说明书操作。
1.2.5 ROS检测按照1.2.4步骤处理细胞后,用PBS洗涤细胞2次,用无血清DMEM培养基配制DCFH-DA探针(10 μmol/L),加入细胞后37 ℃孵育30 min。弃掉培养基,再用PBS洗涤细胞2次,胰酶消化细胞,1 200 r/min离心5 min。弃上清,使用200 μL的PBS重悬细胞,采用流式细胞仪检测荧光强度(激发波长500 nm,发射波长525 nm)。
1.2.6 Western blot检测取对数生长期的HSC-T6细胞,按照1×105/mL接种于6孔培养板中,培养箱中培养过夜。弃上清,分别加入含PHI的培养基(每孔500 μL),37 ℃孵育2 h后,加入LPS,每孔500 μL,使PHI最终浓度为1 μmol/L和10 μmol/L,LPS终浓度为1 μg/mL。继续孵育24 h后,弃上清,用预冷PBS洗3次,每孔加入100 μL RIPA裂解液(含有PMSF、蛋白酶抑制剂、磷酸化蛋白酶抑制),置于冰上边刮边裂解,裂解20 min,12 000 r/min离心10 min。取上清溶液,采用BCA法测定蛋白质浓度。然后,加上样缓冲液,95 ℃煮10 min使蛋白变性。用10% SDS-PAGE电泳分离;200 mA转膜2 h;37 ℃,5%BSA封闭2 h;一抗4 ℃处理过夜,TBST洗3次,二抗孵育2 h,TBST洗3次,加ECL发光液进行曝光。
1.3 统计学分析采用SPSS 24.0统计软件,数据以x ± s表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,相关性分析采用斯伯尔曼检验法。P < 0.05表示差异具有统计学意义。
2 结果 2.1 PHI对肝星状细胞及LPS刺激肝星状细胞增殖的影响采用MTT法检测肝脏星状细胞的增殖情况。结果显示:24 h内1 ~100 μmol/L PHI对HSC-T6细胞增殖无影响(图 1A)。浓度为1 μg/mL的LPS刺激HSC-T6细胞24 h,与空白对照组比较,LPS处理组D(570)值增加37.73%,细胞增殖明显(P < 0.05);与LPS刺激细胞相比,1 μmol/L和10 μmol/L PHI处理能显著抑制LPS刺激所引起的细胞增殖,其D(570)值分别降低16.13%和17.14% (图 1B)。结果表明:PHI能够抑制LPS刺激肝星状细胞的增殖。
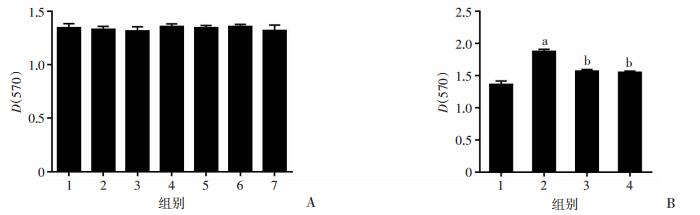
|
| A:PHI对HSC-T6细胞增殖的影响 1:空白对照组;2:0.1%DMSO对照组;3~7:分别为1、3、10、30、100 μmol/L PHI组;B:PHI对LPS诱导HSC-T6细胞增殖的影响 1~4:分别为空白对照组、LPS处理组、1 μmol/L PHI + LPS处理组、10 μmol/L PHI + LPS处理组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 图 1 MTT检测24 h内PHI对HSC-T6细胞增殖的影响 (n=6) |
2.2 PHI对LPS诱导肝星状细胞迁移的抑制作用
采用Transwell实验分析肝星状细胞的迁移能力。结果显示:1 μg/mL LPS明显诱导HSC-T6细胞跨膜迁移,与空白对照组比较,LPS处理组的细胞迁移数增加6.57倍(P < 0.05);与LPS处理组比较,加用1 μmol/L和10 μmol/L PHI后能明显减少跨膜迁移的细胞数,分别减少48.99%和58.86% (图 2)。结果表明:PHI可以显著抑制肝星状细胞的迁移。
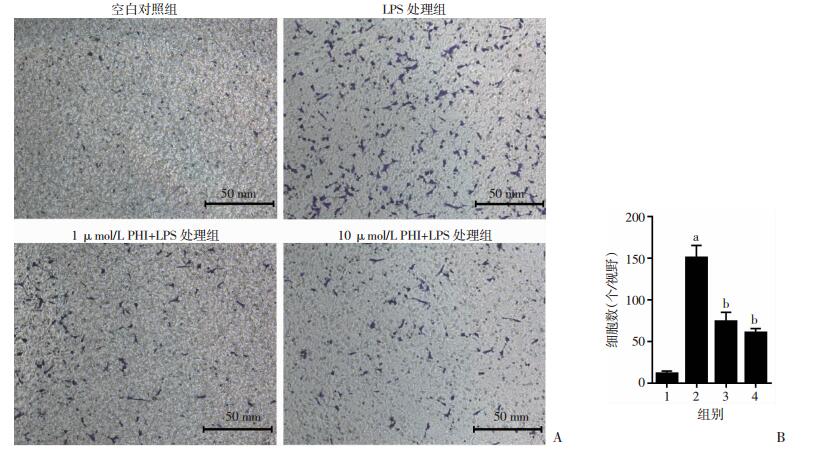
|
| A:Transwell检测细胞迁移;B:各组迁移细胞数分析(n=6) 1:空白对照组;2:LPS处理组;3:1 μmol/L PHI + LPS处理组;4:10 μmol/L PHI + LPS处理组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 图 2 PHI对LPS诱导HSC-T6细胞迁移的抑制作用 |
2.3 PHI对LPS诱导肝星状细胞表达α-SMA蛋白的抑制作用
为了分析肝星状细胞的活化程度,采用Western blot检测细胞内α-SMA蛋白的表达。结果显示:1 μg/mL LPS处理HSC-T6细胞24 h,细胞内α-SMA蛋白表达较空白对照组升高1倍(P < 0.05),加用1 μmol/L和10 μmol/L PHI处理细胞后降低HSC-T6细胞内α-SMA蛋白的表达(分别降低11.82%和27.33%),10 μmol/L PHI处理组较LPS组明显降低(P < 0.05,图 3)。结果表明:PHI能够明显抑制肝星状细胞的活化。
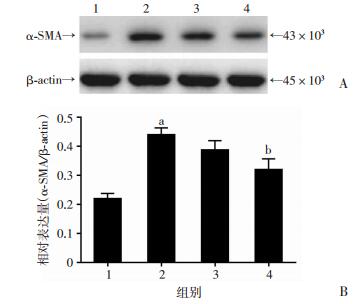
|
|
1:空白对照组;2:LPS处理组;3:1 μmol/L PHI + LPS处理组;4:10 μmol/L PHI + LPS处理组 A:Western blot检测;B:半定量分析(n=5) a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 图 3 PHI对LPS诱导HSC-T6细胞内α-SMA蛋白表达的抑制作用 |
2.4 PHI对LPS诱导肝星状细胞内ROS水平的作用
为了探索PHI抑制肝星状细胞活化的机制,采用流式细胞仪分析PHI对细胞内ROS含量的影响。与空白对照组相比,1 μg/mL LPS处理HSC-T6细胞24 h,使细胞内ROS含量显著升高1.25倍(P < 0.05),而加用1 μmol/L和10 μmol/L PHI处理后细胞内的ROS含量明显降低,分别降低30.03%和51.26%(图 4)。结果表明:PHI可明显降低LPS诱导肝星状细胞内产生的ROS含量。
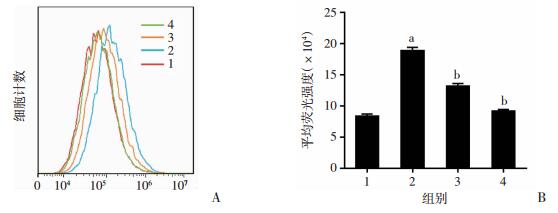
|
|
1:空白对照组;2:LPS处理组;3:1 μmol/L PHI + LPS处理组;4:10 μmol/L PHI + LPS处理组 A:流式细胞仪检测结果;B:ROS含量分析(n=3) a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 图 4 PHI对LPS诱导HSC-T6细胞内ROS的抑制作用 |
2.5 PHI对LPS诱导HSC-T6细胞分泌炎症因子的影响
采用ELISA试剂盒检测细胞培养基上清中TNF-α、白介素-6(IL-6)和白介素-1β(IL-1β)的含量。与空白对照组比较,1 μg/mL LPS刺激HSC-T6细胞24 h,细胞培养基上清中3种炎症因子的浓度均显著升高,分别升高19.66、34.54、31.29倍。与LPS处理组比较,加用1 μmol/L和10 μmol/L PHI处理后,细胞上清中炎症因子的浓度分别降低25.16%和39.51%、36.57%和43.75%、58.99%和73.01% (图 5)。结果表明:PHI能够有效抑制LPS诱导肝星状细胞分泌炎症因子。
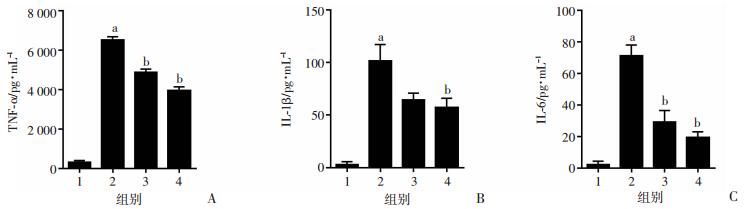
|
|
1:空白对照组;2:LPS处理组;3:1 μmol/L PHI + LPS处理组;4:10 μmol/L PHI + LPS处理组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 A:细胞上清中TNF-α的浓度;B:细胞上清中IL-6的浓度;C:细胞上清中IL-1β的浓度 图 5 PHI对LPS诱导HSC-T6细胞分泌炎症因子的影响 (n=4) |
2.6 PHI降低LPS诱导HSC-T6细胞内NF-κB p65蛋白磷酸化
为了探索PHI抑制肝星状细胞活化的机制,采用Western blot分析细胞内NF-κB p65蛋白磷酸化水平。结果显示:与空白对照组相比,1 μg/mL LPS刺激HSC-T6细胞24 h,细胞内NF-κB p65蛋白磷酸化水平增加31.38% (P < 0.05),而加用1 μmol/L和10 μmol/L PHI处理后,HSC-T6细胞内NF-κB p65蛋白磷酸化水平分别降低13.90%和24.96%,10 μmol/L PHI处理组较LPS处理组显著降低(P < 0.05,图 6)。表明PHI可以抑制LPS诱导肝星状细胞内NF-κB p65蛋白的磷酸化。
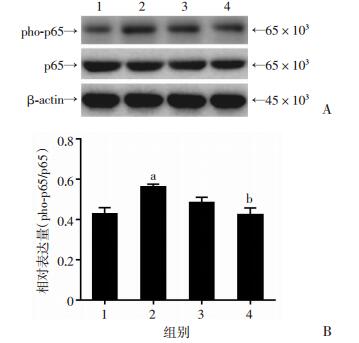
|
|
1:空白对照组;2:LPS处理组;3:1 μmol/L PHI+LPS处理组;4:10 μmol/L PHI + LPS处理组 A:Western blot检测HSC-T6细胞内NF-κB p65的表达及磷酸化水平;B:NF-κB p65磷酸化统计分析(n=5) a:P < 0.05,与空白对照组比较;b:P < 0.05,与LPS处理组比较 图 6 PHI对LPS诱导HSC-T6细胞内NF-κB p65蛋白磷酸化的影响 |
2.7 相关性分析
应用斯伯尔曼等级相关性分析进行统计推断,肝星状细胞α-SMA的表达与ROS的含量、炎症因子(IL-1β、TNF-α)的浓度、NF-κB p65蛋白磷酸化水平成正相关(相关系数分别为0.865、0.863、0.709、0.697,P < 0.05);PHI处理肝星状细胞后,PHI降低P65磷酸化蛋白、ROS、炎症因子(IL-1β、TNF-α)的能力与其抑制α-SMA(肝星状细胞活化标志物)的表达能力显著正相关(相关系数分别为0.853、0.685、0.709、0.661,P < 0.05)。表明NF-κB介导的炎症反应是LPS诱导肝星状细胞的活化的重要原因,而PHI抑制LPS诱导肝星状细胞活化的机制与其抑制NF-κB介导的炎症反应有关。
3 讨论肝星状细胞的活化是肝脏纤维化发生的关键步骤,抑制肝星状细胞活化被认为是防治肝脏纤维化的有效途径[12]。本研究建立体外炎症刺激物诱导肝星状细胞活化的细胞模型,发现天然产物PHI能够有效抑制LPS诱导的肝星状细胞增殖和迁移、显著性地抑制细胞内α-SMA蛋白的表达。进一步研究发现:PHI明显降低肝星状细胞内ROS水平、减少炎症因子分泌,可以有效抑制NF-κB p65的磷酸化。上述结果表明:PHI可以通过降低LPS诱导肝星状细胞的炎症反应而抑制细胞的活化。
异常增殖、迁移及高表达α-SMA蛋白是肝星状细胞活化的重要特征和细胞表型[13]。研究显示:采用LPS刺激可以促进细胞增殖[4]和迁移[14]。α-SMA的表达是肝星状细胞活化、分化的早期标志[15],且随着肝脏纤维化程度的不断加重,其表达量也不断增加[16]。本研究发现:PHI不仅可以抑制LPS刺激肝星状细胞的增殖和迁移,还能明显抑制LPS诱导肝星状细胞表达α-SMA蛋白。研究结果表明:PHI对LPS诱导的肝星状细胞活化具有很明确的抑制作用。
氧化自由基的产生在HSCs活化及肝纤维化的发生过程中扮演着重要的角色。ROS不仅可以通过刺激免疫细胞,释放促纤维化因子,还能够直接活化HSCs细胞,引发或加重肝脏纤维化[17]。据报道,通过腹腔注射LPS可使小鼠发生氧化应激型肝脏损伤[18]。本研究发现体外利用LPS直接处理HSC-T6细胞,能引起细胞内ROS含量升高;而PHI可明显降低细胞内LPS诱导产生的ROS。此结果说明PHI对LPS诱导肝星状细胞内的ROS含量也具有明显的降低作用。这与研究报道的PHI抗氧化作用一致[9]。
促炎性细胞因子,主要包括TNF-α、IL-6、IL-1β,在慢性肝脏炎症的发生和HSCs细胞活化的过程中也起着重要作用[19]。LPS可以直接通过与HSCs细胞上的TLR4等受体结合,诱导细胞分泌促炎细胞因子,激活HSCs细胞[20]。本研究数据显示:PHI可显著性地降低LPS诱导所致HSCs细胞分泌的促炎细胞因子。这说明PHI对LPS诱导肝星状细胞炎症反应具有抑制作用。
NF-κB是LPS诱导炎症发生信号途径中一个重要的转录因子。LPS通过调节NF-κB p65的磷酸化,激活NF-κB信号通路,促进HSCs细胞的活化[21-22]。本研究发现PHI可以明显抑制LPS诱导HSC-T6细胞内NF-κB p65蛋白磷酸化。表明PHI对LPS诱导肝星状细胞内NF-κB信号途径激活也具有明显的抑制作用。
采用斯伯尔曼等级相关性分析法对PHI抑制LPS诱导肝星状细胞活化和炎症的指标进行相关性分析,发现肝星状细胞内α-SMA表达的增加与LPS诱导细胞内ROS含量、细胞上清中炎症因子(IL-1β、TNF-α)和细胞内NF-κB p65蛋白磷酸化水平的增加呈正相关,而PHI处理后α-SMA的表达水平与ROS含量、炎症因子浓度和NF-κB p65蛋白磷酸化水平降低的趋势一致。据文献报道,ROS可以通过抑制IκBα蛋白磷酸化,或抑制IKK蛋白磷酸化,或干扰IκB蛋白的泛素化而活化NF-κB信号途径;同时,NF-κB信号的活化又可以通过上调抗氧化蛋白酶的表达,抑制ROS的含量[23]。此外,细胞NF-κB信号的活化,促进IL-1β、TNF-α等因子的表达上调;TNF-α等又可以通过与其受体结合,激活受体下游的NF-κB信号途径[24]。然而,NF-κB信号途径活化又促进TGF-β1的表达,促使肝星状细胞活化,继而表现出增殖、迁移、α-SMA蛋白表达增加的特性[25-27]。本研究的相关性分析与文献报道一致。表明PHI抑制LPS诱导肝星状细胞的活化的作用机制与其抑制NF-κB信号通路及细胞炎症反应密切相关。但仍有待需要通过定量蛋白组学等技术手段,进一步明确鉴定与PHI相互作用的蛋白质,以期发现可以调控炎症、抑制肝星状细胞活化的新药靶点。
综上所述,LPS直接通过激活细胞内在的炎症反应,促进肝星状细胞增殖、迁移和活化。天然产物PHI能够显著性地抑制LPS诱导的炎症反应,从而降低肝星状细胞增殖和迁移的能力,抑制细胞活化。尽管PHI抑制肝星状细胞活化的机制有待深入研究,但PHI通过直接抑制炎症刺激物诱导的信号途径,达到抑制肝星状细胞活化的作用,为开发防治肝脏纤维化有效药物提供了有益思路。
| [1] |
PAROLA M, PINZANI M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues[J]. Mol Aspects Med, 2019, 65: 37-55. DOI:10.1016/j.mam.2018.09.002 |
| [2] |
HOWELL J, PEDRANA A, COWIE B C, et al. Aiming for the elimination of viral hepatitis in Australia, New Zealand, and the Pacific Islands and Territories: where are we now and barriers to meeting world health organization targets by 2030[J]. J Gastroenterol Hepatol, 2019, 34(1): 40-48. DOI:10.1111/jgh.14457 |
| [3] |
HIGASHI T, FRIEDMAN S L, HOSHIDA Y. Hepatic stellate cells as key target in liver fibrosis[J]. Adv Drug Deliv Rev, 2017, 121: 27-42. DOI:10.1016/j.addr.2017.05.007 |
| [4] |
CHEN Y H, WU Z F, YUAN B Y, et al. MicroRNA-146a-5p attenuates irradiation-induced and LPS-induced hepatic stellate cell activation and hepatocyte apoptosis through inhibition of TLR4 pathway[J]. Cell Death Dis, 2018, 9(2): 22. DOI:10.1038/s41419-017-0038-z |
| [5] |
SHI H T, DONG L, DANG X Y, et al. Effect of chlorogenic acid on LPS-induced proinflammatory signaling in hepatic stellate cells[J]. Inflamm Res, 2013, 62(6): 581-587. DOI:10.1007/s00011-013-0610-7 |
| [6] |
QU H H, ZHANG Y M, WANG Y, et al. Antioxidant and antibacterial activity of two compounds (forsythiaside and forsythin) isolated from Forsythia suspensa[J]. J Pharm Pharmacol, 2008, 60(2): 261-266. DOI:10.1211/jpp.60.2.0016 |
| [7] |
WEI T, TIAN W L, YAN H Y, et al. Protective effects of phillyrin on H2O 2-induced oxidative stress and apoptosis in PC12 cells[J]. Cell Mol Neurobiol, 2014, 34(8): 1165-1173. DOI:10.1007/s10571-014-0091-4 |
| [8] |
ZHONG W T, WU Y C, XIE X X, et al. Phillyrin attenuates LPS-induced pulmonary inflammation via suppression of MAPK and NF-κB activation in acute lung injury mice[J]. Fitoterapia, 2013, 90: 132-139. DOI:10.1016/j.fitote.2013.06.003 |
| [9] |
PAN X L, CAO X, LI N, et al. Forsythin inhibits lipopolysaccharide-induced inflammation by suppressing JAK-STAT and p38 MAPK signalings and ROS production[J]. Inflamm Res, 2014, 63(7): 597-608. DOI:10.1007/s00011-014-0731-7 |
| [10] |
王小芸, 赵怀舟, 倪艳. 连翘应用源流初考[J]. 中医文献杂志, 2016, 34(5): 21-24. WANG X Y, ZHAO H Z, NI Y. Preliminary historical research on application of lianqiao[J]. J Tradit Chin Med Lit, 2016, 34(5): 21-24. DOI:10.3969/j.issn.1006-4737.2016.05.007 |
| [11] |
ZHANG Y, MIAO H, YAN H Y, et al. Hepatoprotective effect of Forsythiae Fructus water extract against carbon tetrachloride-induced liver fibrosis in mice[J]. J Ethnopharmacol, 2018, 218: 27-34. DOI:10.1016/j.jep.2018.02.033 |
| [12] |
EZHILARASAN D, SOKAL E, NAJIMI M. Hepatic fibrosis: It is time to go with hepatic stellate cell-specific therapeutic targets[J]. Hepatobil Pancreati Dis Int, 2018, 17(3): 192-197. DOI:10.1016/j.hbpd.2018.04.003 |
| [13] |
PUCHE J E, SAIMAN Y, FRIEDMAN S L. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol, 2013, 3(4): 1473-1492. DOI:10.1002/cphy.c120035 |
| [14] |
CHEN H J, LIANG T M, LEE I J, et al. Scutellariae radix suppresses LPS-induced liver endothelial cell activation and inhibits hepatic stellate cell migration[J]. J Ethnopharmacol, 2013, 150(3): 835-842. DOI:10.1016/j.jep.2013.08.049 |
| [15] |
ATZORI L, POLI G, PERRA A. Hepatic stellate cell: a star cell in the liver[J]. Int J Biochem Cell Biol, 2009, 41(8/9): 1639-1642. DOI:10.1016/j.biocel.2009.03.001 |
| [16] |
LAN T, LI C Z, YANG G Z, et al. Sphingosine kinase 1 promotes liver fibrosis by preventing miR-19b-3p-mediated inhibition of CCR2[J]. Hepatology, 2018, 68(3): 1070-1086. DOI:10.1002/hep.29885 |
| [17] |
SÁNCHEZ-VALLE V, CHÁVEZ-TAPIA N C, URIBE M, et al. Role of oxidative stress and molecular changes in liver fibrosis: a review[J]. Curr Med Chem, 2012, 19(28): 4850-4860. DOI:10.2174/092986712803341520 |
| [18] |
ZHONG W H, QIAN K J, XIONG J B, et al. Curcumin alleviates lipopolysaccharide induced Sepsis and liver failure by suppression of oxidative stress-related inflammation via PI3K/AKT and NF-κB related signaling[J]. Biomed Pharmacother, 2016, 83: 302-313. DOI:10.1016/j.biopha.2016.06.036 |
| [19] |
TSUCHIDA T, FRIEDMAN S L. Mechanisms of hepatic stellate cell activation[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(7): 397-411. DOI:10.1038/nrgastro.2017.38 |
| [20] |
CHEN Y H, ZENG Z C, SHEN X Y, et al. MicroRNA-146a-5p negatively regulates pro-inflammatory cytokine secretion and cellactivation in lipopolysaccharide stimulated human hepatic stellate cells through inhibition of toll-like receptor 4 signaling pathways[J]. Int J Mol Sci, 2016, 17(7): E1076. DOI:10.3390/ijms17071076 |
| [21] |
GAN F, LIU Q, LIU Y H, et al. Lycium barbarum polysaccharides improve CCl4-induced liver fibrosis, inflammatory response and TLRs/NF-kB signaling pathway expression in wistar rats[J]. Life Sci, 2018, 192: 205-212. DOI:10.1016/j.lfs.2017.11.047 |
| [22] |
LUEDDE T, SCHWABE R F. NF-κB in the liver: linking injury, fibrosis and hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(2): 108-118. DOI:10.1038/nrgastro.2010.213 |
| [23] |
ZHANG J X, WANG X L, VIKASH V, et al. ROS and ROS-mediated cellular signaling[J]. Oxidative Med Cell Longev, 2016, 2016: 1-18. DOI:10.1155/2016/4350965 |
| [24] |
LIU T, ZHANG L Y, JOO D, et al. NF-κB signaling in inflammation[J]. Sig Transduct Target Ther, 2017, 2: 17023. DOI:10.1038/sigtrans.2017.23 |
| [25] |
PAIK Y H, KIM J, AOYAMA T, et al. Role of NADPH oxidases in liver fibrosis[J]. Antioxid Redox Signal, 2014, 20(17): 2854-2872. DOI:10.1089/ars.2013.5619 |
| [26] |
KOYAMA Y, BRENNER D A. Liver inflammation and fibrosis[J]. J Clin Investig, 2017, 127(1): 55-64. DOI:10.1172/jci88881 |
| [27] |
LI X, JIN Q, WU Y L, et al. Tetrandrine regulates hepatic stellate cell activationvia TAK1 and NF-κB signaling[J]. Int Immunopharmacol, 2016, 36: 263-270. DOI:10.1016/j.intimp.2016.04.039 |



