根据2019年美国癌症报告,肺癌在男性、女性恶性肿瘤中发病率均居第二,且死亡率居第一[1];在中国,肺癌发病率和死亡率也居于恶性肿瘤首位[2]。其中,非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的85%,大多数患者确诊时为晚期[3-4]。
免疫治疗开启了肿瘤治疗的新时代,针对T细胞免疫逃逸的程序性死亡受体1(programmed cell death 1, PD-1)/程序性死亡受体配体1(programmed cell death ligand 1,PD-L1)的抑制剂在NSCLC治疗领域取得突破性的进展[5]。多项注册临床研究显示,免疫检测点抑制剂(immune checkpoint inhibitors,ICIs)较传统化疗有更长的总生存期(overall survival,OS),不良反应可接受[6-9]。PD-1/PD-L1单抗单药在二线治疗中的客观缓解率(objective response rate,ORR)不足20%[10];Keynote-189、IMpower150等研究中免疫检测点抑制剂联合化疗有更显著的ORR、缓解持续时间(duration of response,DoR)及OS的获益[11-12]。然而,这些Ⅲ期随机对照试验(randomized controlled trial,RCT)的入组条件多为EGFR/ALK野生型、PS评分0~1、器官功能良好、无脑转移或脑转移已控、无病毒感染及自身免疫性疾病的人群,难以满足复杂的临床决策和个体化诊疗,在临床实践中仅约10%的NSCLC患者符合入组条件。为了反映真实临床实践的治疗效应,真实世界研究(real world research, RWR)应运而生[13],其非随机实施,入排标准宽泛,受环境、并发症、合并用药及患者意愿的影响,更具有临床参考意义。
此外,RCT研究采用传统的实体瘤疗效反应的评价标准(response evaluation criteria in solid tumors, RECIST 1.1),可能错判免疫治疗的不典型反应,将患者出现的治疗有效现象(如假性进展)评为进展,导致患者错失治疗机会。因此,实体瘤免疫疗效评价标准(modified RECIST1.1 for immune based therapeutics, iRECIST)成为免疫治疗效果评价的重要工具,能更准确、真实地反映患者的获益情况[14]。
本研究旨在基于iRECIST标准获得NSCLC免疫治疗真实世界数据,对比RCT研究结果,为国内广大医师和患者提供真实世界中免疫治疗不同用药线数及联合方式的有效性和安全性。
1 资料与方法 1.1 研究设计按真实世界研究设计,纳入本院2016年8月10日至2019年7月10日接受免疫检查点抑制剂治疗的NSCLC患者。末次随访时间:2019年10月10日。纳入标准:①根据AJCC第8版肺癌TNM分期,经病理组织学诊断为鳞癌或非鳞癌的Ⅳ期NSCLC;②至少有1个可测量病灶;③有详细诊疗记录及影像资料。排除标准:①影像资料不全者;②仅用药一周期;③未定期复诊者。筛选过程详见图 1,NSCLC免疫治疗患者共80例,经纳入、排除标准筛选,最终纳入61例。研究分组:一线治疗指患者未接受全身性化疗;二线治疗指既往接受过全身性化疗出现疾病进展;联合用药指免疫检测点抑制剂治疗同时接受化疗、抗血管治疗、放射治疗的任意一种方式。根据治疗线数及是否联合用药,将入组患者分为4组:一线单药、一线联合、二线单药、二线联合。观察终点包括最佳应答(best overall response, bOR)、无进展生存时间(progression-free survival, PFS)、DoR及免疫相关不良反应(immue-related adverse events, irAEs)。
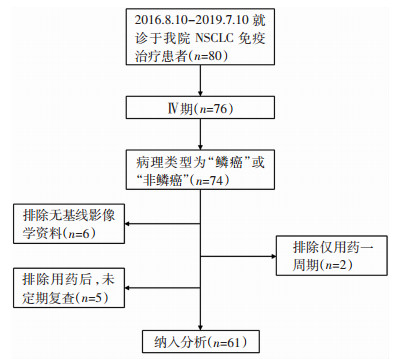
|
| 图 1 患者筛选流程图 |
1.2 治疗方案
患者接受免疫检查点抑制剂治疗(PD-1抑制剂:nivolumab、pembrolizumab、sintilimab、toripalimab;PD-L1抑制剂:durvalumab、atezolizumab)。输注方法:nivolumab每2周给予3 mg/kg,历时60 min静脉输注;pembrolizumab每3周给予2 mg/kg,历时30 min静脉输注;sintilimab每3周给予200 mg;toripalimab每2周1次3 mg/kg;durvalumab每2周给予10 mg/kg,历时60 min静脉输注;atezolizumab每3周给予1 200 mg,历时60 min静脉输注。
1.3 数据收集收集患者基线临床病理特征,包括:年龄、性别、体力状况评分(performance status, PS)、体质量指数(body mass index,BMI)、病理类型、吸烟情况、免疫治疗期间抗生素使用情况、TNM分期。
1.4 疗效及不良反应评价通过每8~12周进行胸部计算机断层扫描(CT)和转移病灶的影像学检查,根据iRECIST标准评估患者的疗效,分为免疫完全缓解(complete response,iCR)、免疫部分缓解(partial response, iPR)、免疫疾病稳定(stable disease, iSD)和免疫疾病进展(progression disease, iPD)。初次出现疾病进展定义为(iUPD),需4~8周再确认为疾病进展(iCPD)还是假性进展。PFS为首次免疫治疗至确认的疾病进展(iCPD)或任何原因死亡的时间;DoR为评估为iCR或iPR开始到疾病进展或任何原因死亡的时间;OS为首次免疫治疗至任何原因死亡的时间。bOR为首次免疫治疗至进展或任何原因死亡之间的最佳应答,包括iCR+iPR,疾病控制率(disease control rate,DCR)为iCR+iPR+iSD。
免疫相关不良反应(irAEs)的判定和分级参照2019年中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南,由临床主管医师判断与免疫检测点抑制剂有关而非化疗等其他治疗的不良反应。
1.5 统计学分析采用SPSS 23.0统计软件。通过描述性统计呈现患者临床特征,连续变量以中位数和范围表示,分类变量以例数和百分比表示。基线临床特征组间比较,计量资料采用t检验、计数资料采用卡方检验及Fisher确切概率法(Monte Carlo)。使用R软件(version 3.6.0),根据肿瘤反应情况作瀑布图;以PFS为终点作生存曲线,组间比较采用Log-rank检验。双侧检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 患者临床特征61例患者中位年龄58(34~81)岁,男性54例(88.5%),女性7例(11.5%);腺癌31例(50.8%),鳞癌30例(49.2%);分别使用免疫治疗药物:pembrolizumab 17例(27.9%), toripalimab 15例(24.6%),durvalumab 14例(23.0%),nivolumab 11例(18.0%),sintilimab 3例(4.9%),atezolizumab 1例(1.6%);中位BMI为23.1 kg/m2;在免疫治疗期间接受抗生素治疗21例(34.4%)。各组患者基线临床特征无统计学差异,详见表 1。
| 临床特征 | 一线 | P值 | 二线 | P值 | 总体 | P值 | 总计 | |||
| 单药(n=22) | 联合(n=17) | 单药(n=10) | 联合(n=12) | 一线(n=39) | 二线(n=22) | |||||
| 年龄/岁 | 63(34~81) | 58(41~68) | 0.308 | 58(42~76) | 56(40~77) | 0.822 | 61(34~81) | 57(40~77) | 0.733 | 58(34~81) |
| 性别 | 0.374 | 1.000 | 0.391 | |||||||
| 男 | 20(90.9) | 13(76.5) | 10(100.0) | 11(91.7) | 33(84.6) | 21(95.5) | 54(88.5) | |||
| 女 | 2(9.1) | 4(23.5) | 0(0.0) | 1(8.3) | 6(15.4) | 1(4.5) | 7(11.5) | |||
| PS评分 | 0.756 | 0.227 | 0.697 | |||||||
| 0 | 1(4.5) | 2(11.8) | 0(0) | 3(25.0) | 3(7.7) | 3(13.6) | 6(9.8) | |||
| 1 | 20(90.9) | 15(88.2) | 9(90.0) | 9(75.0) | 35(89.7) | 18(81.8) | 53(86.9) | |||
| 2 | 1(4.5) | 0(0.0) | 1(10.0) | 0(0.0) | 1(2.6) | 1(4.5) | 2(3.3) | |||
| BMI/kg·m-2 | 23.0(15.6~32.2) | 23.2(18.2~28.4) | 0.958 | 23.4(20.0~29.3) | 22.8(19.7~25.5) | 0.710 | 23.1(15.6~32.2) | 23.1(19.7~29.3) | 0.888 | 23.1(15.6~32.2) |
| 病理类型 | 1.000 | 1.000 | 0.133 | |||||||
| 腺癌 | 10(45.5) | 7(41.2) | 6(60.0) | 8(66.7) | 17(43.6) | 14(63.6) | 31(50.8) | |||
| 鳞癌 | 12(54.4) | 10(58.8) | 4(40.0) | 4(33.3) | 22(56.4) | 8(36.4) | 30(49.2) | |||
| 吸烟 | 0.314 | 0.381 | 0.747 | |||||||
| 否 | 6(27.3) | 8(47.1) | 2(20.0) | 5(41.7) | 14(35.9) | 7(31.8) | 21(34.4) | |||
| 是 | 16(72.7) | 9(52.9) | 8(80.0) | 7(58.3) | 25(64.1) | 15(68.2) | 40(65.6) | |||
| 抗生素 | 0.740 | 0.074 | 0.811 | |||||||
| 否 | 14(63.6) | 12(70.6) | 4(40.0) | 10(83.8) | 26(66.7) | 14(63.6) | 40(65.6) | |||
| 是 | 8(36.4) | 5(29.4) | 6(60.0) | 2(16.7) | 13(33.3) | 8(36.4) | 21(34.4) | |||
| T分期 | 0.278 | 0.470 | 0.637 | |||||||
| 1 | 0(0.0) | 1(5.9) | 0(0.0) | 1(8.3) | 1(2.6) | 1(4.5) | 2(3.3) | |||
| 2 | 11(50.0) | 4(23.5) | 4(40.0) | 2(16.7) | 15(38.5) | 6(27.3) | 21(34.4) | |||
| 3 | 4(18.2) | 4(23.5) | 2(20.0) | 5(41.7) | 8(20.5) | 7(31.8) | 15(24.6) | |||
| 4 | 7(31.8) | 8(47.1) | 4(40.0) | 4(33.3) | 15(38.5) | 8(36.4) | 23(37.7) | |||
| N分期 | 1.000 | 0.100 | 0.094 | |||||||
| 0 | 2(9.1) | 1(5.9) | 4(40.0) | 0(0.0) | 3(7.7) | 4(18.2) | 7(11.5) | |||
| 1 | 1(4.5) | 1(5.9) | 0(0.0) | 2(16.7) | 2(5.1) | 2(9.1) | 4(6.6) | |||
| 2 | 12(54.5) | 10(58.8) | 2(20.0) | 3(25.0) | 22(56.4) | 5(22.7) | 27(44.3) | |||
| 3 | 6(27.3) | 5(29.4) | 4(40.0) | 6(50.0) | 11(28.2) | 10(45.5) | 21(34.4) | |||
| X | 1(4.5) | 0(0.0) | 0(0.0) | 1(8.3) | 1(2.6) | 1(4.5) | 2(3.3) | |||
| M分期 | 0.616 | 0.761 | 0.118 | |||||||
| 1a | 9(40.9) | 10(58.8) | 2(20.0) | 4(33.3) | 19(48.7) | 6(27.3) | 25(41.0) | |||
| 1b | 4(18.2) | 2(11.8) | 4(40.0) | 4(33.3) | 6(15.4) | 8(36.4) | 14(23.0) | |||
| 1c | 9(40.9) | 5(29.4) | 4(40.0) | 4(33.3) | 14(35.9) | 8(36.4) | 22(36.0) | |||
| 连续变量以中位数和范围表示,分类变量以例(%)表示 | ||||||||||
2.2 患者疗效评价
61例患者bOR评价为iCR 1例(1.6%),iPR 21例(34.5%),iSD 33例(54.1%),iPD 6例(9.8%)。一线单药及一线联合bOR分别为27.3%与47.1%(P=0.314);二线单药及二线联合bOR分别为30.0%与41.7%(P=0.675);一线总体及二线总体bOR分别为35.9%与36.4%(P=0.971)。具体数据和肿瘤反应情况见图 2、表 2。
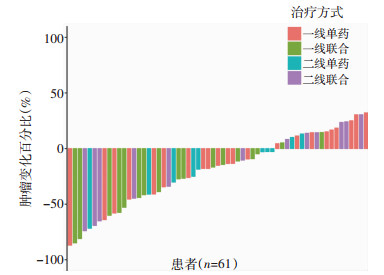
|
| 图 2 肿瘤反应情况 |
| 疗效评价 | 一线单药(n=22) | 一线联合(n=17) | P值 | 二线单药(n=10) | 二线联合(n=12) | P值 | 一线总体(n=39) | 二线总体(n=22) | P值 |
| iCR | 0(0.0) | 1(5.9) | 0.436 | 0(0.0) | 0(0.0) | - | 1(2.6) | 0(0.0) | 1.000 |
| iPR | 6(27.3) | 7(41.2) | 0.497 | 3(30.0) | 5(41.7) | 0.675 | 13(33.3) | 8(36.4) | 0.811 |
| iSD | 13(59.1) | 9(52.9) | 0.754 | 7(70.0) | 4(33.3) | 0.198 | 22(56.4) | 11(50.0) | 0.629 |
| iPD | 3(13.6) | 0(0.0) | 0.243 | 0(0.0) | 3(25.0) | 0.221 | 3(7.7) | 3(13.6) | 0.685 |
| bOR | 6(27.3) | 8(47.1) | 0.314 | 3(30.0) | 5(41.7) | 0.675 | 14(35.9) | 8(36.4) | 0.971 |
| DCR | 19(86.4) | 17(100.0) | 0.243 | 10(100.0) | 9(75.0) | 0.221 | 36(92.3) | 19(86.4) | 0.685 |
2.3 无进展生存时间
一线总体及二线总体中位PFS(mPFS)分别为11.8个月(95%CI: 4.9~18.7)与6.3个月(95%CI: 4.8~7.7;P=0.015)。一线单药组及一线联合组mPFS分别为11.8个月(95%CI: 3.9~19.7)与未达到(P=0.675);二线单药组及二线联合组mPFS分别为6.0个月(95%CI: 4.8~7.2)与未达到(P=0.963);各组患者PFS生存曲线见图 3。
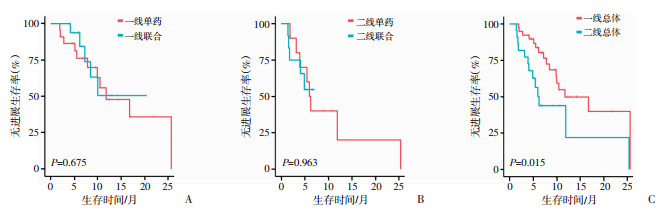
|
| A:一线单药及一线联合;B:二线单药及二线联合;C:一线总体及二线总体 图 3 不同用药方式的无进展生存时间 |
2.4 分层分析
根据《中国成人超重和肥胖症预防控制指南》,BMI≥24 kg/m2为超重,以之为分界,BMI<24 kg/m2与BMI≥24 kg/m2的患者bOR分别为27.5%和52.4%(P=0.055),mPFS分别为10.5个月和16.8个月(P=0.894);免疫治疗期间使用抗生素与未使用抗生素的患者bOR分别为14.3%和47.5%(P=0.010),前者mPFS 7.8个月,后者未达到(P=0.012)。见图 4、表 3。

|
| A:性别;B:BMI;C:病理类型;D:抗生素使用 图 4 不同临床特征的无进展生存时间 |
| 临床特征 | n | bOR[例(%)] | P值 | mPFS(95%CI) | P值 |
| 性别 | |||||
| 男 | 54 | 18(33.3) | 0.414 | 10.47(6.0~15.0) | 0.194 |
| 女 | 7 | 4(57.1) | NR | ||
| BMI/kg·m-2 | |||||
| <24 | 40 | 11(27.5) | 0.055 | 10.5(8.0~12.9) | 0.894 |
| ≥24 | 21 | 11(52.4) | 16.8(5.2~28.3) | ||
| 病理类型 | |||||
| 腺癌 | 31 | 12(38.7) | 0.662 | 10.5(6.6~14.3) | 0.961 |
| 鳞癌 | 30 | 10(33.3) | 11.8(5.7~17.9) | ||
| 抗生素 | |||||
| 否 | 40 | 19(47.5) | 0.010 | NR | 0.012 |
| 是 | 21 | 3(14.3) | 7.8(4.7~10.9) | ||
| NR:未达到 | |||||
2.5 缓解持续时间
免疫一线治疗的14例bOR患者中,无iPD患者,DoR中位数未达到,范围为1.2~11.5个月;二线治疗的8例bOR患者中,有2例iPD,DoR中位数未达到,范围为1.9~7.8个月。免疫一线较二线治疗患者DoR显著获益(P=0.003)。
2.6 免疫相关不良反应患者irAEs总体发生率为29.6%,严重irAEs发生率为3.3%。1~2级irAEs最常见为皮肤毒性5例(8.2%),其次为内分泌毒性表现为甲状腺功能紊乱4例(6.6%),肝脏毒性3例(4.9%),胰腺炎为2例(3.3%),肺炎为2例(3.3%)。3级irAEs包括肝脏毒性1例(1.6%)和肺炎1例(1.6%),停止免疫治疗予以激素处理后好转。无4级及以上irAEs发生。
2.7 进展模式共29例患者发生进展。仅原发灶进展8例(27.6%),仅转移灶进展7例(24.1%),原发灶与转移灶均进展14例(48.3%)。进展患者转移灶最常见器官为骨48.3%(14例),其次为肺41.4%(12例),脑24.1%(7例),肾上腺17.2%(5例),肝13.8%(4例)。3例患者出现新增病灶,均为新增骨转移。
3 讨论国内开展NSCLC免疫治疗较晚较少,临床实践缺乏足够的国人使用免疫治疗的疗效及安全性的参考数据。本研究根据iRECIST标准评估疗效,一线单药组bOR及mPFS分别为27.3%和11.8个月。一线单药研究中,Keynote-042显示PD-L1≥1%的患者ORR为27.3%,mPFS为5.3个月[9];CheckMate-026显示PD-L1≥5%的患者ORR为33%,mPFS为4.2个月[15]。本研究一线单药组mPFS更优,可能有以下原因:①部分患者接受了其他抗肿瘤治疗,如中药治疗;②部分患者接受了免疫增强剂(胸腺法新、胸腺五肽等)。
关于一线联合治疗Keynote-189、IMpower130、IMpower150研究中,ORR分别为47.6%、49.2%、56%,mPFS达7.0~8.8个月[11-12, 16]。本研究中一线联合治疗bOR为47.1%,与既往RCT研究相吻合,一线联合的mPFS未达到,从生存曲线中可以看出,联合用药较单药治疗,有PFS获益的趋势。
二线单药的研究(CheckMate-017、CheckMate-057、CheckMate-078、Keynote-010),ORR均不超过20.0%,mPFS为2.3~4.0个月[6-7, 17]。本研究中,二线单药组bOR为30%,mPFS为6.0个月,均优于上述研究。其原因可能为:①二线单药样本量不足,数据可能有所偏倚;②部分患者有使用中药、免疫增强剂等,与临床试验人群有所不同。
根据美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南,NSCLC二线免疫治疗仅推荐单药。目前尚无免疫检测点抑制剂二线联合的临床研究报道,更无中国人群二线联合的相关数据。我们在临床实践中,综合考虑患者PS评分、PD-L1及肿瘤突变负荷等,在充分知情同意下,可能选择联合化疗、抗血管治疗等。本研究显示二线联合的bOR 41.7%和mPFS未达到,均优于二线单药的研究数据[6-7, 17],达到了预期目的。
肥胖在免疫治疗中预示着更佳的疗效及生存,BMI高于30 kg/m2的患者PFS及OS均显著提高[18]。本研究中,以中国成人超重(BMI 24 kg/m2)为界,BMI≥24 kg/m2患者较BMI<24 kg/m2 bOR提升近1倍,mPFS稍升高。
本研究以免疫治疗期间是否使用抗生素进行分层,发现抗生素使用会导致bOR及PFS显著降低。ROUTY等[19]研究显示相似的结果,在免疫治疗前后2个月内使用抗生素,可能通过影响肠道菌群,导致PFS和OS显著缩短;GOPALAKRISHNAN等[20]也证实肠道菌群差异能独立影响免疫治疗效果。
本研究还包括一些RCT排除的“特殊人群”,比如PS评分=2、超高龄患者等。PS评分=2的患者2例,一线单药和二线单药各1例,PFS分别为1.9个月和3.2个月;≥75岁患者3例,有2例评价为iPR,DoR分别为10.7个月和12.4个月,随访截止时未进展。本研究表明真实世界中这类特殊患者仍然能从免疫检测点抑制剂中获益。
本研究采用iRECIST标准,2例患者出现iUPD后继续用药最终证实为假性进展,1例在后续治疗达到iPR持续缓解中,另1例在后续治疗为iSD,存活已达21.9个月。
免疫治疗相比于化疗的主要优势在于更优的DoR和OS数据。根据CA209-003研究,使用nivolumab单药2线及以上治疗的患者5年OS率约为16%,其中75%的患者在免疫治疗后5年没有接受后续治疗,仍表现出持续缓解,未出现疾病进展[21];CheckMate-017、CheckMate-057研究显示nivolumab组也有持续的OS获益[22]。POPLAR、OAK研究中,虽然atezolizumab组较多西他赛组在PFS上无明显获益,但是在DoR和OS方面,atezolizumab组显著优于化疗组[23-24]。因此,免疫治疗显著改善DoR和OS,从而表现为拖尾效应。本研究的DoR和OS尚未成熟,6例iCPD患者生活质量尚好,属于缓慢进展或局部进展,免疫治疗仍在维持中,或增加局部治疗,OS范围为8.8~29.2个月,仅1例患者死亡(OS: 13.7个月)。此外,关于免疫检测点抑制剂的irAEs,本真实世界研究即使包含一些特殊人群,也没有发现新的irAEs类型,总体耐受性良好,安全性可控。
本研究的不足:为回顾性分析,难免存在基线不平、分组不均的缺陷;样本量较少、分层分析较难进行统计分析;OS成熟度不够,有待进一步随访观察;部分患者由于经济原因在充分知情同意下选择国产sintilimab、toripalimab,本组数据显示仍有较好临床疗效,但需要前瞻性研究来证实。
综上所述,本研究通过iRECIST标准评估疗效,与RCT研究相比,NSCLC患者免疫治疗一线单药、一线联合、二线单药的mPFS获益更优;二线联合用药可以带来bOR及PFS的显著提升;“非优质人群”的irAEs可控;假性进展、缓慢进展或局部进展的患者,继续免疫治疗可持续临床获益。这为广大医师和患者提供参考。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. ZHENG R S, SUN K X, ZHANG S W, et al. Report of epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
CHEN Z, FILLMORE C M, HAMMERMAN P S, et al. Non-small-cell lung cancers: a heterogeneous set of diseases[J]. Nat Rev Cancer, 2014, 14(8): 535-546. DOI:10.1038/nrc3775 |
| [4] |
NOONE AM, HOWLADER N, KRAPCHO M, et al. SEER Cancer Statistics Review, 1975-2015[EB/OL]. Bethesda, MD: National Cancer Institute.[2018-04-30]. |
| [5] |
BUCHBINDER E I, DESAI A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition[J]. Am J Clin Oncol, 2016, 39(1): 98-106. DOI:10.1097/COC.0000000000000239 |
| [6] |
BRAHMER J, RECKAMP K L, BAAS P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627 |
| [7] |
BORGHAEI H, PAZ-ARES L, HORN L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643 |
| [8] |
RECK M, RODRÍGUEZ-ABREU D, ROBINSON A G, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/NEJMoa1606774 |
| [9] |
MOK T S K, WU Y L, KUDABA I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [10] |
SHARMA P, HU-LIESKOVAN S, WARGO J A, et al. Primary, adaptive, and acquired resistance to cancer immunotherapy[J]. Cell, 2017, 168(4): 707-723. DOI:10.1016/j.cell.2017.01.017 |
| [11] |
GANDHI L, RODRÍGUEZ-ABREU D, GADGEEL S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med, 2018, 378(22): 2078-2092. DOI:10.1056/NEJMoa1801005 |
| [12] |
SOCINSKI M A, JOTTE R M, CAPPUZZO F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301. DOI:10.1056/nejmoa1716948 |
| [13] |
SHERMAN R E, ANDERSON S A, DAL PAN G J, et al. Real-world evidence—what is it and what can it tell us?[J]. N Engl J Med, 2016, 375(23): 2293-2297. DOI:10.1056/NEJMsb1609216 |
| [14] |
FERTÉ C, MARABELLE A. iRECIST: A clarification of tumour response assessment in the immunotherapy era[J]. Eur J Cancer, 2017, 77: 165-167. DOI:10.1016/j.ejca.2017.02.015 |
| [15] |
CARBONE D P, RECK M, PAZ-ARES L, et al. First-line nivolumab in stage Ⅳ or recurrent non-small-cell lung cancer[J]. N Engl J Med, 2017, 376(25): 2415-2426. DOI:10.1056/NEJMoa1613493 |
| [16] |
WEST H, MCCLEOD M, HUSSEIN M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2019, 20(7): 924-937. DOI:10.1016/S1470-2045(19)30167-6 |
| [17] |
HERBST R S, BAAS P, KIM D W, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer(KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [18] |
MURPHY W J, LONGO D L. The surprisingly positive association between obesity and cancer immunotherapy efficacy[J]. JAMA, 2019, 321(13): 1247-1248. DOI:10.1001/jama.2019.0463 |
| [19] |
ROUTY B, LE CHATELIER E, DEROSA L, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359(6371): 91-97. DOI:10.1126/science.aan3706 |
| [20] |
GOPALAKRISHNAN V, SPENCER C N, NEZI L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients[J]. Science, 2018, 359(6371): 97-103. DOI:10.1126/science.aan4236 |
| [21] |
GETTINGER S, HORN L, JACKMAN D, et al. Five-year follow-up of nivolumab in previously treated advanced non-small-cell lung cancer: results from the CA209-003 study[J]. J Clin Oncol, 2018, 36(17): 1675-1684. DOI:10.1200/JCO.2017.77.0412 |
| [22] |
VOKES E E, READY N, FELIP E, et al. Nivolumab versus docetaxel in previously treated advanced non-small-cell lung cancer(CheckMate 017 and CheckMate 057): 3-year update and outcomes in patients with liver metastases[J]. Ann Oncol, 2018, 29(4): 959-965. DOI:10.1093/annonc/mdy041 |
| [23] |
FEHRENBACHER L, SPIRA A, BALLINGER M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR): a multicentre, open-label, phase 2 randomised controlled trial[J]. Lancet, 2016, 387(10030): 1837-1846. DOI:10.1016/S0140-6736(16)00587-0 |
| [24] |
RITTMEYER A, BARLESI F, WATERKAMP D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK): a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/S0140-6736(16)32517-X |



