肥胖已成为全球性的重大公共卫生问题,而心血管疾病、糖尿病等肥胖相关性疾病则是当前导致人类死亡的主要原因[1]。脂肪细胞包括白色脂肪细胞、棕色脂肪细胞和米色脂肪细胞(brite/beige adipocytes)3种,其中前者负责储存机体过剩的能量进而导致肥胖,而后两种脂肪细胞的形态学特征和生理功能较为相似,均可通过代谢产热的方式来消耗脂肪从而防止肥胖[2]。白色脂肪细胞在寒冷、运动等刺激下可转化为米色脂肪细胞,这种现象称为“白色脂肪棕色化”(white adipose browning),调控白色脂肪棕色化已成为防治肥胖及其相关疾病的新策略[3]。虽然规律性运动可促进白色脂肪棕色化,但由于工作繁忙、身体因素限制等诸多原因导致大多数人不能坚持规律性运动,因而寻找能部分代替运动或增强运动诱导白色脂肪棕色化的措施具有重要的现实意义。白藜芦醇具有保护心血管、控制肥胖等多种健康保护效应[4],近几年研究发现白藜芦醇防治肥胖的作用与其调控白色脂肪棕色化有关[5-6]。紫檀芪(pterostilbene,PST)是白藜芦醇的二甲基化衍生物,主要存在于蓝莓、葡萄等食物中,由于紫檀芪较白藜芦醇具有更高的生物利用率、稳定性和生物活性,因而紫檀芪的潜在应用价值更受关注[7]。然而,紫檀芪对白色脂肪棕色化影响尚不清楚。本研究采用动物实验方法,观察紫檀芪和运动对大鼠白色脂肪棕色化的影响,并探讨其中的可能作用机制。
1 材料与方法 1.1 实验动物与分组8周龄雄性SPF级SD大鼠24只,体质量(324.46± 14.54)g。购自陆军军医大学实验动物中心[动物合格证号SCXK(渝)2012-0003],饲养于SPF级动物房,相对湿度50%~60%,室温(23±1)℃,明暗周期12 h,自由进食和饮水。实验遵守陆军军医大学动物保护与利用专业委员会的相关规定。适应性饲养1周后,采用随机数字表法将大鼠分为4组(n=6):安静对照组(C)、PST干预组(PST)、跑台运动组(EX)、跑台运动+PST干预组(EX+PST)。PST组和EX+PST组补充PST的剂量为50 mg/kg,混悬于2 mL蒸馏水中灌胃给予;SED组和EX组用等体积蒸馏水灌胃。每周检测大鼠的体质量和进食量。干预4周后进行相关指标检测。
1.2 运动干预方案干预前1周,EX组和EX+PST组大鼠在跑台上进行5 d的适应性训练(表 1)。第2周开始对大鼠进行运动干预,每周运动5 d,休息2 d,共计4周。跑台转速设为20 m/min,第1天运动训练时间为20 min/d,随后每天增加10~60 min/d并保持到干预结束。
1.3 主要试剂
包括:大鼠维持饲料(华阜康公司,北京);紫檀芪(纯度>98%,曼斯特公司,成都);UCP1、PRDM16抗体(Abcam公司,美国);p-AMPK、AMPK抗体(Cell Signaling Technology公司,美国);β-Actin抗体(贝博公司,上海);PCR提取试剂盒、反转录试剂盒及qRT-PCR试剂盒(TaKaRa公司,日本);PCR引物(生工公司,上海)。
1.4 腹股沟脂肪组织取材干预4周结束后,称量各组大鼠体质量,然后用戊巴比妥钠(40 mg/kg)麻醉后处死大鼠,解剖分离腹股沟白色脂肪(inguinal white adipose tissue,iWAT)并称质量,尔后取部分iWAT移入-80 ℃冰箱中冻存备用,另取部分iWAT置于10%中性福尔马林固定液中固定备用。计算iWAT指数:iWAT指数=iWAT质量(mg)/体质量(g)。
1.5 腹股沟脂肪组织HE染色将固定在10%中性福尔马林固定液中的iWAT取出,石蜡包埋、切片后,常规HE染色,正置显微镜下观察脂肪细胞的形态学特征。
1.6 荧光定量PCR检测mRNA表达按照RNA提取试剂盒说明书,取约0.1 g iWAT组织样品加入1 mL TRIzol裂解离心并收集上清,使用核酸蛋白仪测定RNA纯度和浓度。取500 ng RNA按照逆转录试剂盒说明书操作配置反应液,将反应液混匀后在定量PCR仪上进行逆转录反应。逆转录反应完成后按照实时定量试剂盒说明书配置反应体系,每个基因做3个平行,并在实时定量PCR仪上进行PCR反应。绘制溶解曲线并使用参照基因△Ct法计算mRNA表达,比值(参照/目的)=2△Ct(参照)-△Ct(目的),引物序列见表 2。
| 基因 | 上游引物(5'→3') | 下游引物(5'→3') | 产物长度/bp |
| UCP1 | GCCTAGCAGACATCATCACCT | GTTTCGGCAATCCTTCTGTC | 147 |
| CIDEA | GGAGACCGCCAGGGACTACG | AGGACGAGCAGGGTGTATGAGG | 106 |
| TMEM26 | CACTCGGCTGCTGTTCCTGTTG | GCCAGTAACGGTGCTCTTCCTTC | 80 |
| CD137 | CGCTGCTCCTGTTCCTGATCTTC | CTCGTAGCTTCCTCCTCCTCCTTC | 179 |
| CPT1A | TAGGACAGGCAGAAAATTGC | CAGTAGGAGCCGATTCAAAA | 181 |
| Cyto C | CCATGGTCTGTTTGGGCGGAAG | CAGGGTATCCTCTCCCCAGGTG | 97 |
| Sirt1 | TCCCGGACAGTTCCAGCCATC | ATTCCTGCAACCTGCTCCAAGG | 117 |
| PGC-1α | TGTTCCCGATCACCATATTCC | GTATTCATCCCTCTTGAGCCTTT | 219 |
| PRDM16 | CAAGGACTGCGAGCGGATGTTC | TCTGGTGGCGGATGAGGTTGG | 137 |
| β-Actin | CCACCATGTACCCAGGCATT | CGGACTCATCGTACTCCTGC | 189 |
1.7 Western blot检测蛋白水平
取iWAT组织约0.1 g,加入600 μL配置好的含有蛋白酶抑制剂组织裂解液,磁珠破碎后,冰上裂解30 min,离心后提取上清,采用BCA法测定蛋白浓度。配置10%的SDS-PAGE胶,按照40 μg蛋白/孔上样,电泳进行蛋白分离,并湿转至PVDF膜上。5%脱脂奶粉室温封闭2 h后,按照目的蛋白和β-actin分子量范围内的膜裁切下来,置于4 ℃孵育一抗过夜。PBST洗膜3次,室温孵育二抗1 h,PBST再次洗膜3次,使用VILBER Fusion FX7成像系统自动曝光。以β-Actin蛋白为内参照,采用Image J软件进行灰度值分析。
1.8 统计学分析采用SPSS 20.0统计软件,数据用x ± s表示。多组间比较使用双因素方差分析。以P < 0.05为差异具有统计学意义。使用GraphPad软件绘图。
2 结果 2.1 各组大鼠体质量和摄食量的变化与C组比较,各干预组大鼠的体质量增加值明显降低(P < 0.05);EX+PST组大鼠的体质量增加又显著低于PST组和EX组大鼠(P < 0.05,图 1A)。但各组大鼠的日均摄食量差异并无统计学意义(图 1B)。提示紫檀芪干预和运动均可有效控制大鼠体质量增加,且该效应并非通过降低能量摄入(摄食量)实现。

|
| A:各组大鼠体质量增加的变化a:P < 0.05,与C组比较;b: P < 0.05,与EX组、PST组比较;B:各组大鼠摄食量的变化 图 1 各组大鼠体质量增加及摄食量的变化 |
2.2 PST干预和运动对大鼠iWAT指数的影响
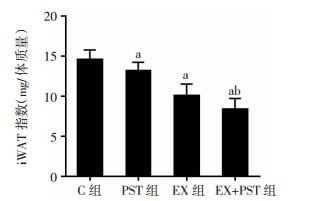
与C组比较,各干预组大鼠iWAT指数均显著下降(P < 0.05);EX+PST组大鼠iWAT指数又明显低于PST组和EX组大鼠(P < 0.05,图 2)。提示紫檀芪干预和运动均具有明显的抑制脂肪蓄积作用。
|
| a: P < 0.05,与C组比较;b: P < 0.05,与EX组、PST组比较 图 2 各组大鼠iWAT指数的变化 |
2.3 PST干预和运动对大鼠iWAT形态学的影响
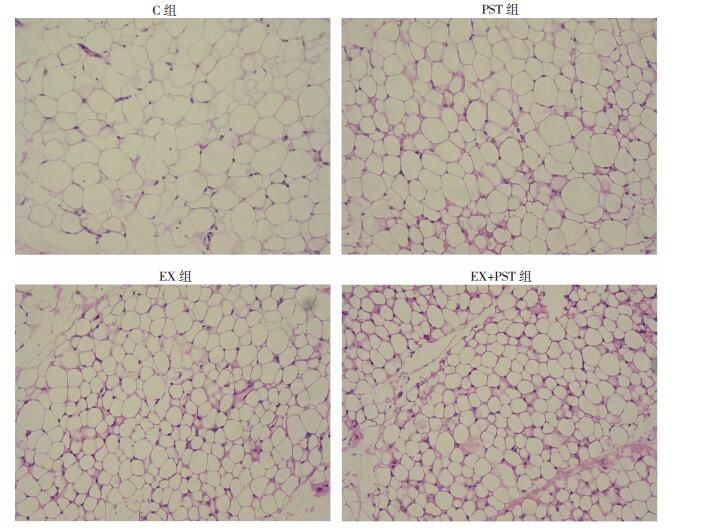
C组大鼠iWAT脂肪细胞呈空泡状,形状近似圆形;与C组相比,PST组、EX组大鼠iWAT中部分脂肪细胞变小、变圆,并伴有少量多室脂肪细胞(米色脂肪细胞)出现,具有棕色化的趋势;与PST组、EX组相比,EX+PST组大鼠iWAT脂肪细胞变小、变圆更为明显,多室脂肪细胞数量进一步增多,具有典型的棕色化特征(图 3)。提示紫檀芪干预和运动可诱导大鼠iWAT脂肪棕色化。
|
| 图 3 HE染色观察各组大鼠iWAT的形态学变化 (LM ×200) |
2.4 PST干预和运动对大鼠iWAT棕色化相关标志基因表达的影响
与C组相比,各干预组大鼠iWAT中脂肪棕色化的相关标志基因包括解偶联蛋白1(uncoupling protein 1, UCP1)、诱导细胞死亡DNA片断化因子α样效应因子A (cell death-inducing DNA fragmentation factor alpha-like effector A, CIDEA)、簇分化抗原137(cluster of differentiation 137, CD137)、跨膜蛋白26(transmembrane protein 26, TMEM26)、肉碱棕榈酰转移酶1A (carnitine palmitoyltransferase 1A, CPT1A)、细胞色素C(cytochrome c,cyto C)等mRNA表达明显增加(P < 0.05,图 4A),且仅表达于棕色脂肪细胞和米色脂肪细胞中的特异性标志基因UCP1的蛋白水平显著升高(图 4B、C)。从分子水平进一步明确了紫檀芪干预和运动对大鼠iWAT脂肪棕色化的诱导作用。

|
|
a: P < 0.05,与C组比较;b: P < 0.05,与PST组、EX组比较 A:各组大鼠iWAT中脂肪棕色化相关标志基因mRNA表达分析;B:Western blot检测各组大鼠iWAT中UCP1蛋白表达;C:各组大鼠iWAT中UCP1蛋白相对表达水平分析 图 4 各组大鼠iWAT中脂肪棕色化相关标志基因的表达 |
2.5 PST干预和运动对调控iWAT棕色化的相关信号分子表达的影响
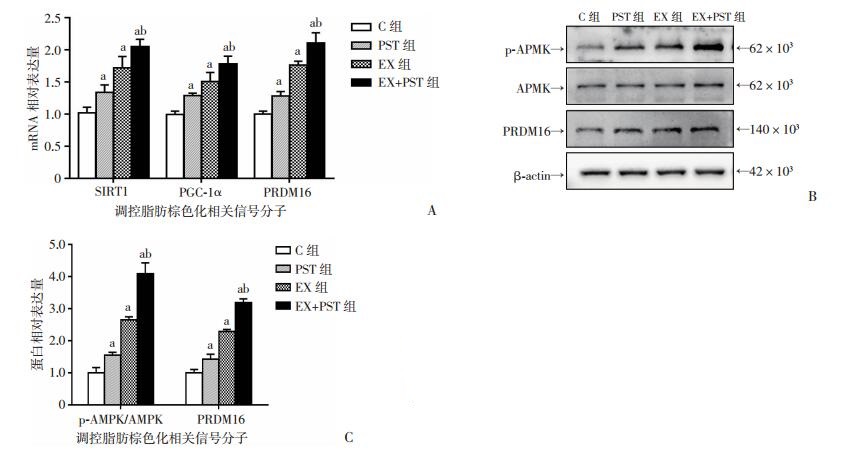
与C组相比,各干预组大鼠iWAT中调控脂肪棕色化的相关信号分子包括沉默信息调节因子1(silent information regulator 1, Sirt1)、过氧化物酶体增殖活化受体γ共激活因子1α(peroxisome proliferator activator receptor gamma coactivator 1 alpha,PGC-1α)、PR结构域蛋白16(PR domain-containing 16,PRDM16)等mRNA表达明显增加(P < 0.05,图 5A);磷酸化腺苷酸活化蛋白激酶(phosphorylated adenosine monophosphate activated protein kinase,p-AMPK)、PRDM16蛋白水平显著升高,p-AMPK/AMPK比值明显增加(P < 0.05,图 5B、C)。提示紫檀芪干预和运动诱导大鼠iWAT棕色化可能与其激活AMPK信号转导通路有关。
|
| a: P < 0.05, 与C组比较; b:P < 0.05, 与PST组、EX组比较A:各组大鼠iWAT中调控脂肪棕色化的相关信号分子mRNA表达分析; B:Westernblot检测各组大鼠iWAT中调控脂肪棕色化的相关信号分子蛋白水平; C:各组大鼠iWAT中p-AMPK/AMPK比值、PRDM16蛋白相对表达水平分析 图 5 各组大鼠iWAT中调控脂肪棕色化的相关信号分子mRNA和蛋白的表达 |
3 讨论
米色脂肪和棕色脂肪中脂肪酸代谢产热增加,进而消耗脂肪,故调控白色脂肪棕色化成为防治肥胖的新靶点。本研究发现紫檀芪补充和跑台运动单独或联合干预均可明显降低大鼠体质量增长和腹股沟白色脂肪指数,但不影响大鼠进食量,同时腹股沟白色脂肪发生棕色化,且二者的联合效应优于单一因素干预。表明紫檀芪和跑台运动均可通过诱导白色脂肪棕色化促进脂肪代谢产热、减少脂肪蓄积,进而控制体质量增长。本研究证实了紫檀芪具有诱导白色脂肪棕色化的作用,为其单独应用或联合运动干预控制肥胖奠定了理论基础。
肥胖是由于长期能量摄入过剩进而导致机体内脂肪蓄积过多的一种状态,由肥胖引发的心血管疾病、糖尿病等慢性疾病已成为当前严重威胁人类健康的全球性重大公共卫生问题[8]。传统观点认为哺乳动物的脂肪组织包括两种类型:白色脂肪组织和棕色脂肪组织,其中前者的重要功能是以脂肪的形式储存机体过剩的能量,而后者则可通过氧化脂肪产热的方式来消耗脂肪进而控制肥胖[9]。近年研究表明白色脂肪在受到低温、运动等刺激情况下会出现一种形态和功能都与棕色脂肪细胞非常相似的新型脂肪细胞——米色脂肪细胞(brite/beige adipocytes),这种现象被称为白色脂肪棕色化[10]。由于成年人体内棕色脂肪含量极少,但米色脂肪细胞具有类似于棕色脂肪细胞的氧化脂肪产热作用,因而调控白色脂肪棕色化的抗肥胖作用研究引起了国内外学者的极大兴趣[11]。除通过促进骨骼肌脂肪酸氧化代谢外,新近发现诱导白色脂肪棕色化进而增加白色脂肪代谢产热也在运动减肥中发挥了重要作用[12]。虽然运动是一种有效的健康减肥方法,但现实情况是大多数人不能很好地坚持规律性运动,因而寻找能部分代替运动或增强运动诱导白色脂肪棕色化的措施,对于控制肥胖具有重要的现实应用意义。
白藜芦醇的健康保护效应是近20年来备受关注的研究领域,业已证实白藜芦醇可通过包括诱导白色脂肪棕色化在内的多种途径发挥抗肥胖作用[13],但低生物利用率是制约白藜芦醇临床转化应用的关键问题[14]。紫檀芪是白藜芦醇的二甲基化衍生物,因首先被发现于紫檀木中而得名,蓝莓、葡萄、越橘等浆果中亦含有丰富的紫檀芪,其生物利用率、代谢稳定性和生物活性均优于白藜芦醇,故其转化应用前景更受关注[7]。本研究首先观察了紫檀芪(PST)和/或运动(EX)干预4周对成年SD大鼠摄食量、体质量和iWAT指数的影响,结果显示:各干预组与对照组的摄食量差异并无统计学意义,但各干预组的体质量增加值和iWAT指数均显著低于对照组,且紫檀芪联合运动干预组(PST+EX组)又明显低于单独干预组。进一步采用HE染色观察iWAT形态学变化,结果显示:PST组、EX组大鼠iWAT中部分脂肪细胞变小、变圆,并伴有少量多室脂肪细胞(米色脂肪细胞)出现,具有棕色化的趋势;PST+EX组大鼠iWAT中脂肪细胞变小、变圆更为明显,多室脂肪细胞数量增多,具有典型的棕色化特征。已有不少研究表明运动或其他因素诱导白色脂肪发生棕色化时,白色脂肪组织中UCP1、CIDEA、CD137、TMEM26、CPT1A、Cyto C等棕色化相关标志基因的表达水平升高,其中UCP1是仅表达于棕色脂肪和米色脂肪的特异性标志基因,由于UCP1的作用导致脂肪氧化代谢产热增加,进而减少脂肪蓄积、控制肥胖[15-18]。本研究结果显示:与对照组比较,各干预组大鼠iWAT中上述白色脂肪棕色化相关标志基因的表达水平显著升高,进一步从分子水平证实了紫檀芪和/或运动干预可诱导大鼠白色脂肪棕色化。白色脂肪作为蓄积机体过剩能量的组织,主要分布在皮下和内脏周围,其中腹股沟是皮下白色脂肪蓄积的主要场所之一。本研究结果提示紫檀芪和运动干预减少大鼠的体质量增加并不是通过影响能量摄入水平(摄食量)实现的,而是通过促进白色脂肪棕色化、降低脂肪蓄积,从而控制大鼠的体质量增加。
大量研究证实PGC-1α、PRDM16是调控UCP1表达的关键转录因子[19-20],而AMPK又可活化PGC-1α、PRDM16进而调控白色脂肪棕色化[21-22]。已有研究表明运动可通过AMPK/Sirt1通路激活PGC-1α影响骨骼肌线粒体生物合成进而调节能量代谢[23]。紫檀芪作为白藜芦醇的二甲基化衍生物,其生物学作用与白藜芦醇非常近似,而白藜芦醇的诸多生物学效应被证实是通过调控AMPK/Sirt1信号通路实现的[24-25]。此外,WANG等[5]研究发现白藜芦醇诱导白色脂肪棕色化依赖于AMPK信号途径的活化。本研究结果显示:紫檀芪和/或运动干预后,大鼠iWAT中Sirt1、PGC-1α、PRDM16等mRNA表达水平明显增加,p-AMPK、PRDM16蛋白水平显著升高,p-AMPK/AMPK比值明显增加,提示紫檀芪和运动可能都是通过活化AMPK信号通路上调PGC-1α、PRDM16表达,进而增加UCP1表达,诱导白色脂肪棕色化。
综上所述,本研究发现紫檀芪干预和跑台运动均可诱导大鼠iWAT发生棕色化,并降低脂肪蓄积和体质量增加,其机制可能与AMPK信号转导途径激活有关。本研究的主要局限性在于:一是未进一步检测iWAT发生棕色化后的功能变化,如脂肪酸代谢产热情况;二是未能深入阐明AMPK信号转导途径在紫檀芪诱导白色脂肪棕色化中的确切作用。下一步将利用3T3-L1前脂肪细胞分化模型对此开展深入研究。
| [1] |
SMITH K B, SMITH M S. Obesity statistics[J]. Prim Care, 2016, 43(1): 121-135. DOI:10.1016/j.pop.2015.10.001 |
| [2] |
CEDIKOVA M, KRIPNEROVÁ M, DVORAKOVA J, et al. Mitochondria in white, brown, and beige adipocytes[J]. Stem Cells Int, 2016, 2016: 6067349. DOI:10.1155/2016/6067349 |
| [3] |
MONTANARI T, POŠĆIĆ N, COLITTI M. Factors involved in white-to-brown adipose tissue conversion and in thermo genesis: a review[J]. Obes Rev, 2017, 18(5): 495-513. DOI:10.1111/obr.12520 |
| [4] |
SPRINGER M, MOCO S. Resveratrol and its human metabolites- effects on metabolic health and obesity[J]. Nutrients, 2019, 11(1): E143. DOI:10.3390/nu11010143 |
| [5] |
WANG S, LIANG X, YANG Q, et al. Resveratrol induces brown-like adipocyte formation in white fat through activation of AMP-activated protein kinase (AMPK) α1[J]. Int J Obes (Lond), 2015, 39(6): 967-976. DOI:10.1038/ijo.2015.23 |
| [6] |
LIAO W Y, YIN X H, LI Q R, et al. Resveratrol-induced white adipose tissue Browning in obese mice by remodeling fecal Microbiota[J]. Molecules, 2018, 23(12): E3356. DOI:10.3390/molecules23123356 |
| [7] |
WANG P, SANG S M. Metabolism and pharmacokinetics of resveratrol andpterostilbene[J]. Biofactors, 2018, 44(1): 16-25. DOI:10.1002/biof.1410 |
| [8] |
AYTON A, IBRAHIM A. Obesity is a public health emergency[J]. BMJ, 2019, 366: l5463. DOI:10.1136/bmj.l5463 |
| [9] |
CHECHI K, NEDERGAARD J, RICHARD D. Brown adipose tissue as an anti-obesity tissue in humans[J]. Obes Rev, 2014, 15(2): 92-106. DOI:10.1111/obr.12116 |
| [10] |
JANKOVIC A, OTASEVIC V, STANCIC A, et al. Physiological regulation and metabolic role of Browning in white adiposetissue[J]. Horm Mol Biol Clin Investig, 2017, 31(1).pii: /j/hmbci.2017.31.issue-/j/hmbci.2017.31.issu1/hmbci-2017-0034/hmbci-2017-0034.xml. DOI: 10.1515/hmbci-2017-0034.
|
| [11] |
THYAGARAJAN B, FOSTER M T.Beiging of white adipose tissue as a therapeutic strategy for weight loss in humans[J]. Horm Mol Biol Clin Investig, 2017, 31(2).pii: /j/hmbci.2017.31.issue-/j/hmbci.2017.31.issu2/hmbci-2017-0016/hmbci-2017-0016.xml. DOI: 10.1515/hmbci-2017-0016.
|
| [12] |
ALDISS P, BETTS J, SALE C, et al. Exercise-induced 'browning' of adipose tissues[J]. Metab Clin Exp, 2018, 81: 63-70. DOI:10.1016/j.metabol.2017.11.009 |
| [13] |
FERNÁNDEZ-QUINTELA A, MILTON-LASKIBAR I, GONZÁLEZ M, et al. Antiobesity effects of resveratrol: which tissues are involved?[J]. Ann N Y Acad Sci, 2017, 1403(1): 118-131. DOI:10.1111/nyas.13413 |
| [14] |
SMOLIGA J M, BLANCHARD O. Enhancing the delivery of resveratrol in humans: if low bioavailability is the problem, what is the solution?[J]. Molecules, 2014, 19(11): 17154-17172. DOI:10.3390/molecules191117154 |
| [15] |
DEWAL R S, STANFORD K I. Effects of exercise on brown and beigeadipocytes[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2019, 1864(1): 71-78. DOI:10.1016/j.bbalip.2018.04.013 |
| [16] |
CHEN L H, CHIEN Y W, LIANG C T, et al. Green tea extract induces genes related to Browning of white adipose tissue and limits weight-gain in high energy diet-fed rat[J]. Food Nutr Res, 2017, 61(1): 1347480. DOI:10.1080/16546628.2017.1347480 |
| [17] |
RODRIGUEZ LANZI C, PERDICARO D J, LANDA M S, et al. Grapepomace extract induced beige cells in white adipose tissue from rats and in 3T3-L1 adipocytes[J]. J Nutr Biochem, 2018, 56: 224-233. DOI:10.1016/j.jnutbio.2018.03.001 |
| [18] |
GUO YY, LI B Y, PENG W Q, et al. Taurine-mediated Browning of white adipose tissue is involved in its anti-obesity effect in mice[J]. J Biol Chem, 2019, 294(41): 15014-15024. DOI:10.1074/jbc.RA119.009936 |
| [19] |
BARGUT T C L, SOUZA-MELLO V, AGUILA M B, et al. Browning of white adipose tissue: lessons from experimentalmodels[J]. Horm Mol Biol Clin Investig, 2017, 31(1).pii: /j/hmbci.2017.31.issue-/j/hmbci.2017.31.issu1/hmbci-2016-0051/hmbci-2016-0051.xml. DOI: 10.1515/hmbci-2016-0051.
|
| [20] |
ZHANG J, WU H, MA S, et al. Transcription regulators and hormones involved in the development of brown fat and white fat Browning: transcriptional and hormonal control of brown/beige fat development[J]. Physiol Res, 2018, 67(3): 347-362. DOI:10.33549/physiolres.933650 |
| [21] |
YANG Q Y, LIANG X W, SUN X F, et al. AMPK/α-ketoglutarate axis dynamically mediates DNA demethylation in the Prdm16 promoter and brown adipogenesis[J]. Cell Metab, 2016, 24(4): 542-554. DOI:10.1016/j.cmet.2016.08.010 |
| [22] |
DESJARDINS E M, STEINBERG G R. Emerging role of AMPK in brown and beige adipose tissue (BAT): implications for obesity, insulin resistance, and type 2 diabetes[J]. Curr Diab Rep, 2018, 18(10): 80. DOI:10.1007/s11892-018-1049-6 |
| [23] |
THIRUPATHI A, DE SOUZA C T. Multi-regulatory network of ROS: the interconnection of ROS, PGC-1 alpha, and AMPK-SIRT1 duringexercise[J]. J Physiol Biochem, 2017, 73(4): 487-494. DOI:10.1007/s13105-017-0576-y |
| [24] |
WANG X H, ZHU L, HONG X, et al. Resveratrol attenuated TNF-α-induced MMP-3 expression in human nucleuspulposus cells by activating autophagy via AMPK/SIRT1 signaling pathway[J]. Exp Biol Med (Maywood), 2016, 241(8): 848-853. DOI:10.1177/1535370216637940 |
| [25] |
LI J, YU S P, YING J, et al. Resveratrol prevents ROS-induced apoptosis in high glucose-treated retinal capillary endothelial cells via the activation of AMPK/Sirt1/PGC-1α pathway[J]. Oxid Med Cell Longev, 2017, 2017: 7584691. DOI:10.1155/2017/7584691 |



