2. 100045 北京, 首都医科大学附属北京儿童医院新生儿中心
2. Neonatal Center, Beijing Children's Hospital Affiliated to Capital Medical University, Beijing, 100045, China
尽管新生儿窒息复苏技术得到越来越广泛的推广,但围产期窒息导致的新生儿缺氧缺血性脑损伤(Hypoxic-ischemia brain damage,HIBD)依然存在,特别是在医疗水平相对欠发达的地区更为突出。严重的HIBD可致新生儿期急性死亡,存活患儿中亦有一部患儿存在不同程度脑瘫、认知障碍等神经系统后遗症[1-2]。
大脑海马区是缺氧缺血(hypoxia ischemia, HI)选择性易损脑区之一,该区域的功能是通过海马结构的完整性和功能的可塑性来体现的[3-4]。既往研究表明,新生儿围产期HI可影响海马的结构和功能从而影响海马的可塑性[5]。Toll样受体4(Toll-like receptor 4, TLR4)是一种广泛表达于脑内神经细胞膜上、参与神经细胞免疫炎症反应的受体[6]。有研究报道在围产期HI条件下,海马区神经细胞膜上的TLR4被激活而导致多种炎症因子的瀑链式释放,产生神经细胞损伤的生物效应[7]。TAK-242是一种TLR4的选择性抑制剂,动物实验证明TAK-242对成年大鼠急性脑缺血再灌注损伤有保护作用[8-10],但其对新生大鼠HI后海马神经损伤是否也有类似的保护作用目前尚不明确。本研究拟从细胞形态学和分子学的角度探讨TLR4抑制剂TAK-242预处理对HI后新生大鼠青春期脑海马神经元和树突棘密度及结构影响,从而为阐明TLR4在HI所致海马可塑性变化中的作用提供新的实验证据。
1 材料和方法 1.1 动物和模型所有实验动物均来自中南大学动物管理中心并经中南大学湘雅三医院伦理委员会批准(NO:2016-S006)。怀孕16~18 d SD孕鼠由中南大学实验动物中心提供,动物许可证编号SYXK(湘)2015-0017。孕鼠单独饲养在12 h光照/12 h黑暗屏障环境中,允许自由饮水及进食。所有幼崽均经自然娩出、母乳喂养,生后7 d(P7)体质量在13~19 g之间的幼崽入选。生后22 d(P22)母婴分离断乳。按照Rice法建立新生大鼠HIBD模型[11],即动物经七氟烷(4%诱导,2%维持)吸入麻醉后固定,切开皮肤后显微镜下暴露左颈总动脉,5-0缝合线双结扎后中间处离断颈总动脉缝合。幼崽苏醒后放回母鼠窝内,1 h后放入恒温37.0 ℃水浴缺氧箱中,接8%O2/92%N2混合气体1.5 L/min,维持氧浓度(8.0±0.1)%,无水氯化钙吸收动物呼出CO2,缺氧2 h后放回母鼠处。对照组动物仅给予切开皮肤分离并暴露颈总动脉。
1.2 分组与给药75只新生7 d大鼠(P7)随机分成3组(雌雄不限):对照组、缺氧缺血组(HI组)及缺氧缺血+TLR4抑制剂TAK-242组(TAK-242组)。TAK-242(MCE, 美国)用1%二甲基亚砜(DMSO)溶解,后用生理盐水稀释至终浓度为0.1 mg/mL,缺氧缺血前半小时0.5 mg/kg腹腔内单次注射[12]。对照组和HI组均腹腔注射同体积DMSO-生理盐水溶液。
1.3 HE染色及尼氏染色新生大鼠缺氧缺血后21 d(P28)戊巴比妥麻醉(50 mg/kg),先后磷酸盐缓冲盐水(PBS)及4%多聚甲醛心脏灌注,冰上取出大脑速冻,根据大鼠脑立体定位解剖图谱修剪脑组织,放入样本托内,液氮中速冻3 min取出,-80 ℃保存。切片前-20 ℃冰箱复温2 h,低温恒冷切片机(徕卡,德国)上冠状面连续切片,厚度10 μm。部分脑片经固定、漂洗后苏木精-伊红染色,梯度脱水,中性树脂封片,光镜下观察。另一部分切片经固定、蒸馏水洗后加入1%硫堇染色处理30 min进行尼氏染色,梯度酒精脱水,二甲苯清洗,中性封片剂封片光镜下观察。每只动物取3张切片,每张切片随机选取3个视野,人工计数250 μm海马CA1区存活的锥体神经元平均值。
1.4 高尔基银染按照快速高尔基银染试剂盒使用说明(Kit PK401,美国)对脑片进行染色。新生大鼠缺氧缺血后21 d麻醉后迅速取全脑,取包含左侧海马的1 cm3脑组织浸泡在等份5 mL试剂盒溶液A和B的混合物中,在室温下孵育2周。首个24 h后更换浸泡液。随后将脑组织在4 ℃的溶液C中孵育至少72 h,首个24 h后换液,振动切片机(徕卡VT1000 s,德国)切取100 μm的脑冠状切片,在载玻片上用1%明胶/0.1%铬明矾的胶粘剂固定含溶液C脑片,按照说明书染色,脱水并树脂封片。TG TissueFAXS PLUS(奥地利)固定成像折叠厚度,100倍油镜下各组海马区神经元成像,人工计数神经元三级树突10 μm树突棘数量,每个神经元取3段三级树突,每只动物随机取3个神经元分析计数树突棘平均值。
1.5 免疫荧光检测切片固定后,在含0.25%Triton X-100液的5%BSA中室温孵育1 h,PBS洗涤后4 ℃下与兔多克隆anti-NR2A(Abcam, 1:200)、兔多克隆anti-NR2B(Abcam, 1:200)孵育过夜。次日组织切片PBS洗涤,室温避光与相应Alexa Fluor 488标记二抗(Jackson, 1:200)孵育1 h,防猝灭剂封片。每只动物随机选择3个视野,荧光显微镜下观察(Olympus FluoViewTM FV1000,日本)。
1.6 Western blot检测缺氧缺血后21 d(P28),大鼠麻醉后处死,冰上取出大脑并分离海马,-80 ℃保存。实验时左侧海马组织称重后加入RIPA裂解(Beyotime)和蛋白酶抑制剂(Sigma)混合液匀浆机匀浆后,4 ℃ 12 000 ×g离心10 min,收集上清液。BCA法蛋白浓度定量后,加入上样缓冲液,沸水浴5 min变性后-20 ℃保存。检测时制备8%及10%浓度分离胶,上样后80 V电压电泳20~30 min,蛋白分离后调整电压110 V继续电泳1.5 h,电泳后PVDF转膜、丽春红染色后5%脱脂牛奶封闭,一抗4 ℃孵育过夜,次日TBST常规洗涤后加辣根过氧化物酶标记的相应二抗室温孵育1 h,ECL显色,以β-actin为内参对照。胶片扫描后以Quantity OneTM4.2.2(Bio-Rad)软件分析条带。所用一抗包括兔多克隆anti-TLR4(Abcam, 1:2 000)、兔多克隆anti-NR2A(Abcam, 1:2 000)、兔多克隆anti-NR2B(Abcam, 1:2 000)和兔单克隆anti-β-actin(Abcam, 1:5 000)。
1.7 统计学方法应用SPSS 20.0统计软件。正态分布计量资料以x±s表示。体质量发育分析采用双因素重复测量方差分析,其余指标组间比较采用单因素方差分析,两两比较采用Bonferroni法。P < 0.05为差异有统计学意义。
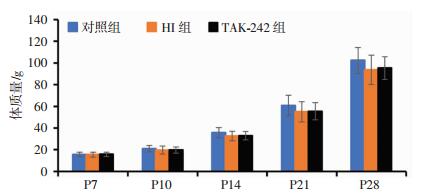
2 结果 2.1 新生大鼠缺氧缺血性损伤一般表现新生SD大鼠缺氧5~20 min时出现发绀、摇头晃尾、呼吸急促、夹尾、四肢抖动,抽搐等反应;20 min后出现反应差、嗜睡、呼吸不规则等现象持续至缺氧结束。双因素重复测量方差分析示组别与时间无交互作用[F(2,55)=0.633, P > 0.05],各组间新生大鼠体质量发育主效应无差异[F(2,55)=2.937, P > 0.05;图 1],然而可导致急性期死亡及远期左侧脑半球不同程度缺失(表 1)。
|
| 对照组:n=20,HI组、TAK-242组:n=19 图 1 各组存活动物体质量发育情况 |
2.2 TAK-242预处理能抑制缺氧缺血后新生大鼠海马TLR4表达
免疫印迹试验显示缺氧缺血后24 h,各组大鼠海马TLR4表达差异有统计学意义(F=44.608, P < 0.05);其中HI组及TAK-242组大鼠海马TLR4表达均较对照组升高[(0.796±0.049)vs(0.270±0.038), P < 0.05;(0.536±0.028)vs(0.270±0.038), P < 0.05],差异有统计学意义;TAK-242预处理能降低缺氧缺血24 h后TLR4表达增加[(0.536±0.028)vs(0.796±0.049), P < 0.05],差异有统计学意义(图 2)。

|
| 图 2 TAK-242预处理对缺氧缺血后新生大鼠的TLR4表达的影响 |
2.3 TAK-242预处理能降低缺氧缺血后青春期大鼠海马神经元缺失
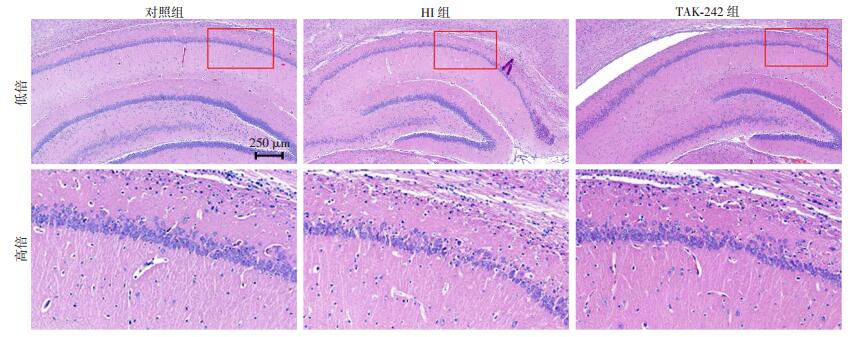
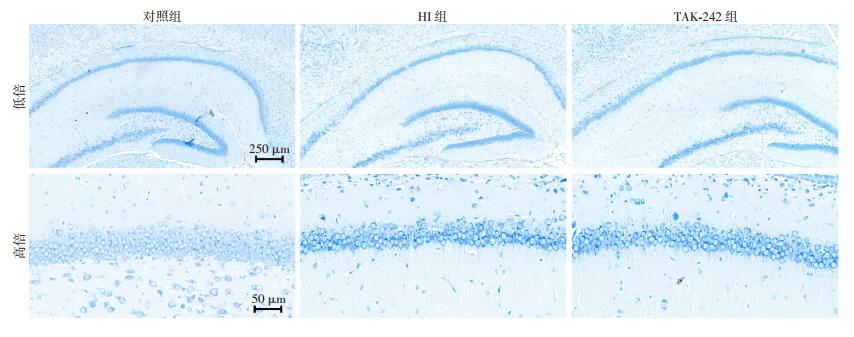
脑冠状切面HE染色显示缺氧缺血后青春期大鼠海马区神经元排列紊乱,有不同程度丢失,缺氧缺血前给予TAK-242处理,神经元丢失程度及细胞紊乱均有不同程度改善(图 3)。尼氏染色显示各组大鼠海马区神经元数量差异有统计学意义(F=29.883, P < 0.05);HI组及TAK-242组青春期大鼠海马区神经元数量均较对照组减少[(36.75±2.323)/250 μm vs (61.40±2.159) /250 μm, P < 0.05;(47.20±2.200) /250 μm vs (61.40±2.159) /250 μm, P < 0.05],差异有统计学意义;而TAK-242处理后,能改善缺氧缺血后海马区神经元数量下降[(47.20±2.200) /250μm vs (36.75±2.323) /250 μm, P < 0.05],差异有统计学意义(图 4)。
|
| 图 3 TAK-442预处理可改善缺氧缺血后青春期大鼠的神经元缺失及排列紊乱 |
|
| 图 4 TAK-442预处理可改善缺氧缺血后青春期大鼠神经元缺失 |
2.4 TAK-242预处理能改善缺氧缺血后青春期大鼠海马树突棘的密度
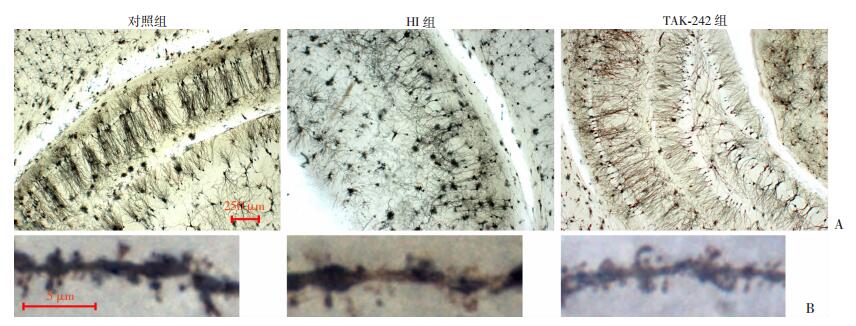
高尔基银染色显示缺氧缺血后大鼠青春期海马区神经元排列紊乱、缺失及神经胶质细胞数量增多(图 5A)。各组间海马神经元第三级树突上树突棘密度差异有统计学意义(F=22.174, P < 0.05);HI组及TAK-242组树突棘密度较对照组呈不同程度降低[(0.788±0.048)/μm vs (1.265±0.044)/μm, P < 0.05;(0.994±0.059)/μm vs (1.265±0.044) /μm, P < 0.05],差异有统计学意义;而早期TAK-242处理能改善这种降低[(0.994±0.059) /μm vs (0.788±0.048) /μm, P < 0.05],差异有统计学意义(图 5B、C)。
|
| A:低倍;B:高倍 图 5 TAK-242预处理可改善缺氧缺血后青春期大鼠树突棘密度降低(高尔基银染) |
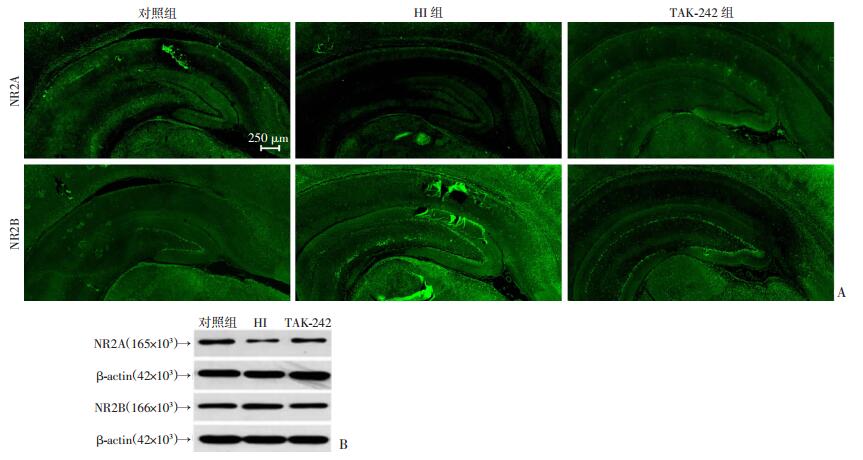
2.5 TAK-242预处理能改善缺氧缺血后青春期大鼠海马NR2A表达下降
免疫荧光显示缺氧缺血后青春期大鼠海马区NR2A表达下降,NR2B表达上升,TAK-242预处理能够减轻这种改变(图 6A)。Western blot结果显示各组NR2A表达差异有统计学意义(F=23.084, P < 0.05);缺氧缺血后HI组及TAK-242组大鼠海马组织NR2A表达较对照组下降[(0.243±0.022)vs(0.473±0.027), P < 0.05;(0.349±0.022)vs(0.473±0.027), P < 0.05],差异有统计学意义,但TAK-242处理能减轻缺氧缺血后青春期大鼠海马NR2A表达下降[(0.349±0.022)vs(0.243±0.022), P < 0.05],差异有统计学意义;对照组、HI组、TAK-242组NR2B表达的灰度值比值分别为(0.409±0.022)、(0.523±0.038)、(0.446±0.027),差异无统计学意义(F=4.012, P > 0.05,图 6B、C)。
|
| A:免疫荧光检测结果;B:Western blot检测结果 图 6 TAK-242预处理可改善缺氧缺血后青春期大鼠海马NR2A表达下降 |
3 讨论
本研究将关注点放在TLR4,是因为近年来神经炎症在脑远期损伤中的作用受到重视,而TLR4在神经炎症诱导和放大中起重要作用,TLR4介导的多种炎症反应与缺氧缺血性脑损伤后远期学习记忆功能障碍有关[6-7, 13]。由于TLR4的特异性抑制剂TAK-242可与TLR4的棒状/白介素-1受体(Toll/IL-1 receptor, TIR)结构域结合,破坏其与胞内信号分子相互作用,抑制下游信号通路激活[8],且有动物实验证明TAK-242对急性脑缺血再灌注及LPS介导的脑损伤有保护作用[9-10],因此本研究采用TAK-242在新生大鼠缺氧缺血前抑制TLR4表达,随后从形态学、细胞分子学角度探讨TLR4抑制剂对HIBD后新生大鼠远期海马神经元和树突棘数量及结构的影响。
神经元是神经系统发挥功能的基本单位,新生儿围产期缺氧缺血发生后,海马血供下降,神经元线粒体短期内能量衰竭,造成急性期细胞急性死亡;继发性神经元损伤一般被认为发生在缺氧缺血发生后6~72 h并持续很长时间,神经炎症参与各种细胞死亡机制,在急慢性神经损伤中发挥重要作用[14]。近年来多项研究发现TLR4在炎症反应的诱导和调节中起重要作用,例如脑卒中的动物及临床研究中发现,TLR4在缺血性脑损伤后表达迅速上调,与损伤模式分子高迁移率族蛋白B1(High mobility group box 1, HMGB1)等结合,导致多种炎症因子大量释放,介导神经元损伤[13, 15-16]。亦有研究报道缺氧后新生大鼠脑组织中TLR4表达升高[12],本研究发现HI后,新生大鼠海马组织TLR4表达升高,这与既往研究相符,提示TLR4参与了HIBD。同时我们发现缺氧缺血后大鼠存活到青春期后,海马区仍存在不同程度的神经元缺失及排列紊乱,而利用TAK-242抑制TLR4表达后,青春期海马神经元缺失及排列紊乱均有所改善,既往亦有研究表明抑制TLR4表达能改善缺血所致神经元损伤[17],从形态学角度提示针对TLR4进行的非特异性抗炎治疗可减轻缺氧缺血所致青春期神经元损伤。
树突棘是树突分支上的棘状突起,是神经元间形成突触的主要部位,其数量及形态结构的变化与神经系统发育及学习记忆功能密切相关[18]。有许多研究表明树突棘数量减少及形态结构畸变是许多神经退行性疾病发病的基础[19],亦有研究表明缺血性脑损伤可造成树突棘数量减少[20-21],小胶质细胞的直接吞噬作用及其表面的TLR4受体激活诱发的多种急慢性神经炎症在树突棘发育过程中起重要作用[22-23]。本研究亦发现新生大鼠HI后TLR4表达上升,且青春期海马树突棘密度下降,而早期抑制TLR4后树突棘密度下降有所改善,提示HI可能通过神经炎症致树突棘损伤从而在远期脑损伤中发挥作用,但其具体的机制仍需进一步研究。
N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)是神经突触膜上的一种离子通道型谷氨酸受体,其亚基NMDAR1(NR1)及NMDAR2(NR2)的活化或表达的改变, 可改变神经突触的可塑性,从而影响海马功能[22-23]。本课题组前期研究证实HIBD可造成神经突触膜上NMDAR骨架结构NR1亚基表达失调[24]。另一功能亚基NR2表达与脑学习记忆功能相关,既往有研究表明基因敲除NR2A近交系小鼠水迷宫表现差,抑制NR2B可短期内记忆受损[23, 25],本研究发现NR2B在三组中表达无明显差异,但免疫荧光及免疫印迹实验均显示缺氧缺血能造成海马区NR2A表达下降,而早期抑制TLR4能够减轻青春期大鼠突触上NR2A下降,表明HI导致的海马损伤可能不涉及NR2B而主要与NR2A有关,提示针对TLR4的治疗可能通过改善HI后NR2A表达下降从而达到改善突触功能的目的。
尽管本研究存在不足,比如仅从形态学和细胞分子学角度观察早期抑制TLR4能减轻HIBD新生大鼠青春期海马神经元及树突棘损伤,缺乏神经行为学论证,且未深入阐明具体机制。然而本研究借助新生大鼠HIBD动物模型,发现早期抑制TLR4表达可减轻HIBD后青春期大鼠海马神经元及树突棘损伤,提示TLR4可能成为进一步了解HIBD机制、改善HIBD远期预后的切入点。
| [1] |
DOUGLAS-ESCOBAR M, WEISS M D. Hypoxic-ischemic encephalopathy[J]. JAMA Pediatr, 2015, 169(4): 397. DOI:10.1001/jamapediatrics.2014.3269 |
| [2] |
EUNSON P. The long-term health, social, and financial burden of hypoxic-ischaemic encephalopathy[J]. Dev Med Child Neurol, 2015, 57(Suppl 3): 48-50. |
| [3] |
DEUKER L, BELLMUND J L, NAVARRO SCHRÖDER T, et al. An event map of memory space in the Hippocampus[J]. Elife, 2016, 5: e16534. DOI:10.7554/eLife.16534 |
| [4] |
EICHENBAUM H. The role of theHippocampus in navigation is memory[J]. J Neurophysiol, 2017, 117(4): 1785-1796. DOI:10.1152/jn.00005.2017 |
| [5] |
MILLAR L J, SHI L, HOERDER-SUABEDISSEN A, et al. Neonatal hypoxia ischaemia: mechanisms, models, and therapeutic challenges[J]. Front Cell Neurosci, 2017, 11: 78. DOI:10.3389/fncel.2017.00078 |
| [6] |
AKIRA S, TAKEDA K. Toll-like receptor signalling[J]. Nat Rev Immunol, 2004, 4(7): 499-511. DOI:10.1038/nri1391 |
| [7] |
HYAKKOKU K, HAMANAKA J, TSURUMA K, et al. Toll-like receptor 4 (TLR4), but not TLR3 or TLR9, knock-out mice have neuroprotective effects against focal cerebral ischemia[J]. Neuroscience, 2010, 171(1): 258-267. DOI:10.1016/j.neuroscience.2010.08.054 |
| [8] |
MATSUNAGA N, TSUCHIMORI N, MATSUMOTO T, et al. TAK-242 (resatorvid), a small-molecule inhibitor of Toll-like receptor (TLR) 4 signaling, binds selectively to TLR4 and interferes with interactions between TLR4 and its adaptor molecules[J]. Mol Pharmacol, 2011, 79(1): 34-41. DOI:10.1124/mol.110.068064 |
| [9] |
HUA F, TANG H L, WANG J, et al. TAK-242, an antagonist for Toll-like receptor 4, protects against acute cerebral ischemia/reperfusion injury in mice[J]. J Cereb Blood Flow Metab, 2015, 35(4): 536-542. DOI:10.1038/jcbfm.2014.240 |
| [10] |
WANG Y C, WANG P F, FANG H, et al. Toll-like receptor 4 antagonist attenuates intracerebral hemorrhage-induced brain injury[J]. Stroke, 2013, 44(9): 2545-2552. DOI:10.1161/STROKEAHA.113.001038 |
| [11] |
RICE J E 3rd, VANNUCCI R C, BRIERLEY J B. The influence of immaturity on hypoxic-ischemic brain damage in therat[J]. Ann Neurol, 1981, 9(2): 131-141. DOI:10.1002/ana.410090206 |
| [12] |
YAO LL, KAN E M, LU J, et al. Toll-like receptor 4 mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia: role of TLR4 in hypoxic microglia[J]. J Neuroinflam, 2013, 10: 23. DOI:10.1186/1742-2094-10-23 |
| [13] |
BREA D, BLANCO M, RAMOS-CABRER P, et al. Toll-like receptors 2 and 4 in ischemic stroke: outcome and therapeutic values[J]. J Cereb Blood Flow Metab, 2011, 31(6): 1424-1431. DOI:10.1038/jcbfm.2010.231 |
| [14] |
HAGBERG H, DAVID EDWARDS A, GROENENDAAL F. Perinatal brain damage: The terminfant[J]. Neurobiol Dis, 2016, 92: 102-112. DOI:10.1016/j.nbd.2015.09.011 |
| [15] |
KANG R, CHEN R C, ZHANG Q H, et al. HMGB1 in health and disease[J]. Mol Aspects Med, 2014, 40: 1-116. DOI:10.1016/j.mam.2014.05.001 |
| [16] |
LEE B S, JUNG E, LEE Y, et al. Hypothermia decreased the expression of heat shock proteins in neonatal rat model of hypoxic ischemic encephalopathy[J]. Cell Stress Chaperones, 2017, 22(3): 409-415. DOI:10.1007/s12192-017-0782-0 |
| [17] |
LIU T L, LIU M N, ZHANG T J, et al. Z-Guggulsterone attenuates astrocytes-mediated neuroinflammation after ischemia by inhibiting toll-like receptor 4 pathway[J]. J Neurochem, 2018, 147(6): 803-815. DOI:10.1111/jnc.14583 |
| [18] |
BOROVAC J, BOSCH M, OKAMOTO K. Regulation of actin dynamics during structural plasticity of dendritic spines: Signaling messengers and actin-binding proteins[J]. Mol Cell Neurosci, 2018, 91: 122-130. DOI:10.1016/j.mcn.2018.07.001 |
| [19] |
HERMS J, DOROSTKAR MM. Dendritic spine pathology in neurodegenerative diseases[J]. Annu Rev Pathol, 2016, 11: 221-250. DOI:10.1146/annurev-pathol-012615-044216 |
| [20] |
LIN R H, WU Y N, TAO J, et al. Electroacupuncture improves cognitive function through Rho GTPases and enhances dendritic spine plasticity in rats with cerebral ischemia-reperfusion[J]. Mol Med Rep, 2016, 13(3): 2655-2660. DOI:10.3892/mmr.2016.4870 |
| [21] |
MURPHY T H, LI P, BETTS K, et al. Two-photon imaging of stroke onset in vivo reveals that NMDA-receptor independent ischemic depolarization is the major cause of rapid reversible damage to dendrites and spines[J]. J Neurosci, 2008, 28(7): 1756-1772. DOI:10.1523/JNEUROSCI.5128-07.2008 |
| [22] |
HAGBERG H, MALLARD C, FERRIERO D M, et al. The role of inflammation in perinatal brain injury[J]. Nat Rev Neurol, 2015, 11(4): 192-208. DOI:10.1038/nrneurol.2015.13 |
| [23] |
KASHIMA D T, GRUETER B A. Toll-like receptor 4 deficiency alters nucleusaccumbens synaptic physiology and drug reward behavior[J]. Proc Natl Acad Sci USA, 2017, 114(33): 8865-8870. DOI:10.1073/pnas.1705974114 |
| [24] |
LOHMANN C, KESSELS H W. The developmental stages of synapticplasticity[J]. J Physiol (Lond), 2014, 592(1): 13-31. DOI:10.1113/jphysiol.2012.235119 |
| [25] |
CERCATO M C, VÁZQUEZ C A, KORNISIUK E, et al. GluN1 and GluN2A NMDA receptor subunits increase in the Hippocampus during memory consolidation in the rat[J]. Front Behav Neurosci, 2016, 10: 242. DOI:10.3389/fnbeh.2016.00242 |
| [26] |
HEI M Y, TAO H K, TANG Q, et al. Decreased levels of pNR1 S897 protein in the cortex of neonatal Sprague Dawley rats with hypoxic-ischemic or NMDA-induced brain damage[J]. Revista Brasileira De Pesquisas Med E Biol, 2012, 45(10): 962-967. DOI:10.1590/s0100-879x2012007500100 |
| [27] |
SHIPTON O A, PAULSEN O. GluN2A and GluN2B subunit-containing NMDA receptors in hippocampalplasticity[J]. Philos Trans R Soc Lond, B, Biol Sci, 2014, 369(1633): 20130163. DOI:10.1098/rstb.2013.0163 |



