2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院临床微生物学与免疫学教研室;
3. 基础医学院微生物学教研室
2. Department of Microbiology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Clinical Microbiology and Immunology, First Affiliated Hospital
金黄色葡萄球菌(Staphylococcus aureus, 简称金葡菌)是医院获得性感染和社区散发感染的重要病原菌,可导致皮肤软组织感染、创伤感染、肺炎、心内膜炎、脑脓肿、脓血症等疾病[1-2]。随着抗生素在临床上的广泛使用,耐甲氧西林金葡菌(methicillin-resistant S. aureus, MRSA)的出现及其耐药性的快速增长,给临床抗感染治疗带来了严峻挑战。万古霉素是临床上治疗MRSA感染的最后防线[3],然而,自1997年在日本首次分离出万古霉素中等耐药金葡菌(vancomycin-intermediate S. aureus, VISA)及2002年在美国分离出万古霉素完全耐药金葡菌(vancomycin-resistant S. aureus, VRSA)后,尽管VRSA的分离株极少,仅在美国、印度等少数国家有分离报道, 但VISA的分离率逐年升高,我国已有多起VISA感染的报道[4-6]。2017年3月,世界卫生组织(WHO)已将VISA列为12种超级细菌之一,引起了高度关注[7]。
美国临床实验室标准研究所(the Clinical Laboratory Standards Institute)将万古霉素最小抑菌浓度(minimal inhibitory concentration, MIC)为4~8 μg/mL的金葡菌分离株定义为VISA, 将MIC为2~4 μg/mL的金葡菌定义为异质性耐药金葡菌(hVISA)[8]。VISA和hVISA均为万古霉素中等耐药金葡菌,其感染常常导致临床上万古霉素治疗失败[3]。目前,对VISA形成的机理仍然不清[3]。对从同一患者体内分离的敏感菌(VSSA)和VISA菌进行全基因组测序和比较基因组学研究发现,金葡菌基因组上许多基因的突变与VISA的形成有关,多数突变发生在金葡菌的二元调控系统(two-component system,TCS)编码基因上,导致WalKR、GraRS、VraSR等TCSs的组分发生突变,影响了TCS的调控功能,再通过未知的特定代谢途径促进VISA形成[3, 9-10]。研究表明,细菌发生耐药需要付出适应性代价(fitness cost),随着细菌耐药性的升高,细菌的毒力会相应下降[11-12]。我们推测,金葡菌进化为VISA后,也会因适应性代价的存在而影响VISA的毒力。然而,这种毒力的改变是否与VISA形成的基因突变有关值得深入研究。
本课题组前期从一烧伤患者创口标本中分离鉴定出一株ST239型VISA菌株XN108,其万古霉素MIC为12 μg/mL[13]。全基因组测序和比较发现一个新的WalK(S221P)突变是XN108成为VISA的重要原因[14]。将XN108中WalK(S221P)突变回复后的菌株K65的万古霉素MIC降为4 μg/mL[15],表明WalK(S221P)突变在XN108耐药性中发挥重要作用。本研究首先对XN108及其回复突变株K65进行转录组测序,分析金葡菌毒力因子及调控因子编码基因的表达水平差异,再用溶血实验验证菌株溶血能力的变化; 进一步采用同源重组技术,将WalK(S221P)突变引入到强毒力MRSA菌株USA300中,观察菌株对万古霉素耐药性变化,检测毒力因子的表达水平差异及菌株溶血能力改变,揭示WalK(S221P)突变对USA300菌株耐药性及毒力影响。进一步利用生物信息学分析金葡菌毒力调控系统Agr启动子区潜在的WalR结合位点,采用EMSA实验证实WalKR对Agr活性的调控作用,阐明WalK(S221P)突变通过Agr影响VISA毒力的机制,对深入认识VISA菌的毒力调控机理有重要意义。
1 材料与方法 1.1 实验菌株、质粒与试剂VISA菌株XN108由本室分离并保存,WalK(S221P)突变回复菌株K65由本室构建。MRSA菌株USA300由上海交通大学李敏教授惠赠,大肠埃希菌-金葡菌穿梭质粒pBT2由中国科学技术大学孙宝林教授惠赠。大肠埃希菌DH5α购自北京天根(Tiangen)生物技术有限公司。总RNA提取试剂盒TRIzol、逆转录试剂盒购自北京天根公司,qPCR试剂盒购自Bio-Rad公司,质粒提取试剂盒购自Promega公司,E-test纸条购自法国梅里埃公司(BioMerieux); 哥伦比亚血琼脂平板购自庞通医疗,细菌培养基LB和TSB购自Oxoid公司, ATP购自中国同辐股份有限公司。WalK及WalR重组蛋白由本实验室制备并保存[14]。
1.2 转录组测序与分析转录组测序(RNA sequencing, RNA-seq)委托北京诺禾致源生物信息科技有限公司进行。XN108和K65菌株分别设置3个生物学重复样本,采用天根公司试剂盒按说明书提取细菌总RNA,由委托公司进行总RNA浓度、纯度和完整性检测,合格的样品用于建库,库检合格后,进行IlluminaHi Seq测序,获得原始测序序列(Sequenced Reads)。去除带接头的reads和低质量的reads,获得有效序列(clean reads)。以GenBank数据库中金葡菌TW20株基因组为参考序列(GenBank序列号:FN433596.1),进行生物信息学分析。采用DESeq2 R package分析不同样品间的基因表达差异,按校正P值Padj < 0.05的标准筛选差异基因,差异表达基因用log2FoldChange表示倍数改变,其中正值表示基因表达上调,负值表示基因表达下调,测序数据上传于RNA-seq公共数据库平台,获得GEO DataSets的ID号为GSE127706。毒力基因及调控基因的表达差异采用人工分析方法,按文献[16]报道的毒力基因种类进行遴选。
1.3 RT-qPCR根据RNA-seq结果遴选5个毒力基因(spa、fnbB、sbi、hla和isdA)和5个毒力调控基因(RNAⅢ、sigB、graR、rot和saeR),以XN108菌株的基因组序列(Gen Bank序列号:CP007447.1)为模板,设计荧光定量PCR引物(表 1)。分别提取XN108、K65、USA300、K-USA300、USA300ΔagrA、K-USA300ΔagrA等细菌的总RNA, 利用RevertAid第一链cDNA合成试剂盒进行逆转录,获得样本再用Bio-Rad公司Sso AdvancedTM Universal SYBRⓇ Green试剂盒进行qPCR检测,设置gyrB为内参基因。反应条件为:95 ℃预变性3 min; 再按照“95 ℃变性15 s; 56 ℃退火15 s; 72 ℃延伸20 s”扩增40个循环; 反应结束后用Bio-Rad CFX manager软件对数据进行分析。每个样品设置3个生物学重复,实验重复3次。
| 靶基因或引物名称 | 引物序列 | 用途 |
| spa | 上游:5′-CAGCAAACCATGCAGATGCTA-3′ | RT-qPCR |
| 下游:5′-GCTAATGATAATCCACCAAATACAGTTG-3′ | ||
| fnbB | 上游:5′-ACTGAAAGTAAAGCAAGCGAAACA-3′ | RT-qPCR |
| 下游:5′-TCCGATGGCAAATCAACTCG-3′ | ||
| sbi | 上游:5′-GGGGAAGCAAAAGCGAGTG-3′ | RT-qPCR |
| 下游:5′-TGCACGTTCTGGGTGTTCG-3′ | ||
| hla | 上游:5′-GTGGTTTAGCCTGGCCTTCA-3′ | RT-qPCR |
| 下游:5′-CGAAACATTTGCACCAATAAGG-3′ | ||
| isdA | 上游:5′-CGCAGACAGCCAACAAGTCA-3′ | RT-qPCR |
| 下游:5′-TGAAGAGCCATCTTTTTGCACT-3′ | ||
| RNAⅢ | 上游:5′-TTCACTGTGTCGATAATCCA-3′ | RT-qPCR |
| 下游:5′-GGAAGGAGTGATTTCAATGG-3′ | ||
| sigB | 上游:5′-CAGTTAAGTCATAATGGTCATCTTGTTGC-3′ | RT-qPCR |
| 下游:5′-GTGTTAGAAGCAATGGAAATGGGAC-3′ | ||
| graR | 上游:5′-TGGTATTGAAGATTTCGGCAAAGT-3′ | RT-qPCR |
| 下游:5′-CGCCAAGTTCCATACTCATCACT-3′ | ||
| rot | 上游:5′-TCAGCGAGATTGAAAGCGAATAC-3′ | RT-qPCR |
| 下游:5′-CTGTCCATTTCTTTAAGCGTCATAG-3′ | ||
| saeR | 上游:5′-CGCCTTAACTTTAGGTGCAGATGAC-3′ | RT-qPCR |
| 下游:5′-ACGCATAGGGACTTCGTGACCATT-3′ | ||
| gyrB | 上游:5′-CCAGGTAAATTAGCCGATTGC-3′ | RT-qPCR |
| 下游:5′-AAATCGCCTGCGTTCTAGAG-3′ | 内参 | |
| USA300-WalK-up | 5′-GCGCGAATTCATGAAGTGGCTAAAACAACTA-3′ | 突变引入左 |
| USA300-S221P-down | 5′-ATAGTTACCTCTGGGCATTTCGACCGTCTGGTTACG-3′ | 同源臂扩增 |
| USA300-S221P-up | 5′-AGACGGTCGAAATGCCCAGAGGTAACTATACGCAAC-3′ | 突变引入右 |
| USA300-WalK-down | 5′-CCGAGGATCCTTATTCATCCCAATCACCGTCT-3′ | 同源臂扩增 |
| USA300-Walk-外侧-5′ | 5′-GTACGTACGGTCGATGTAACGATT-3′ | 单交换左臂 |
| PBT2-down | 5′-GCTAACGCAGTCAGGCACC-3′ | 筛选 |
| PBT2-up | 5′-GAGAGTCATTACCCCAGGCGTT-3′ | 单交换右臂 |
| USA300-Walk-外侧-3′ | 5′-TTTGCAATATCAGGAGAAAAGTTCCAT-3′ | 筛选 |
| agr-p1-5′-biotin | 5′-TTAGTGAATTTGTTCACTGTGTCGATA-3′ | EMSA实验 |
| agr-p2M-3′ | 5′-GTTAAGAATAAAAACGACTAGTTAAGAAAAA-3′ | agr-PM |
| agr-p2-3′ | 5′-GTATTTAATATTTTAACATAAAAAAATTTACAGT-3 | agr-P |
1.4 溶血实验
取XN108、K65、USA300、K-USA300、USA300ΔagrA、K-USA300ΔagrA的过夜培养菌各1 μL,加入到装有99 μL无菌PBS的EP管中(1 :100稀释),涡旋震荡混匀。取10 μL稀释菌液滴入血平板上,置于37 ℃孵箱培养24 h,取出血平板转移至4 ℃冰箱,保存12 h后观察溶血情况并摄像。
1.5 突变菌株构建根据MRSA菌株USA300的基因组序列(GenBank序列登录号:CP014362.1),设计USA300-WalK-up/USA300-S221P-down和USA300-S221P-up/USA300-WalK-down引物对(序列见表 1),以USA300基因组DNA为模板,分别PCR扩增WalK(S221P)突变位点左、右同源臂,引入WalK(S221P)突变位点。将扩增片段进行overlap退火延伸,获得融合片段经酶切后,克隆至穿梭质粒pBT2上,转化大肠埃希菌DH5α感受态,涂布于含Amp(100 μg/mL)的LB平板,37 ℃培养过夜,次日挑选单菌落于LB液体培养基中培养,提取重组质粒进行酶切验证,并送测序进一步检测WalK(S221P)突变位点的存在。将验证正确的重组质粒pBT2-WalK(S221P)电转化入金葡菌RN4220感受态细胞中进行限制性修饰,涂布于氯霉素Cm(20 μg/mL)平板,次日挑取单菌落于TSB液体培养基中,30 ℃培养过夜,提取质粒进行酶切验证。能成功被酶切的质粒进一步电转化入金葡菌USA300感受态细胞,涂布氯霉素Cm(20 μg/mL)平板。次日挑取单菌落于TSB液体培养基中,30 ℃过夜培养,提取质粒再行酶切验证,获得成功转化菌。利用pBT2为温敏质粒的特性,将转化菌接种于含Cm的TSB培养基中,42 ℃过夜培养; 次日,取适量菌液三线法涂布TSB平板,置42 ℃培养过夜,挑取单菌落接种TSB液体培养基,37 ℃培养后提取基因组,用引物对USA300-Walk-外侧-5’/ PBT2-down和PBT2-up/USA300-Walk-外侧-3′(具体序列见表 1)进行PCR扩增,明确是左同源臂,还是右同源臂发生了重组的菌株。取重组菌于无抗生素的TSB液体培养基中,25 ℃培养24 h,三线法涂布于无抗TSB平板上,37 ℃孵育过夜,次日再挑取单菌落分别接种到含Cm(20 μg/mL)和无抗生素的TSB固体平板上,37 ℃过夜培养,在氯霉素平板上不生长,而在无抗平板上生长者,为可疑的引入了WalK(S221P)突变的重组菌,挑取可疑重组菌培养后提取基因组,使用外侧引物USA300-Walk-外侧-5′/USA300-Walk-外侧-3′进行PCR扩增,验证发生双交换的菌株,并将扩增产物送测序,将成功引入了WalK(S221P)突变的菌株命名为K-USA300。
K-USA300ΔagrA突变菌株的构建在实验室保存的USA300ΔagrA菌株的基础上进行,参照K-USA300构建的方法引入WalK(S221P)突变。
1.6 E-test实验取USA300、K-USA300、USA300ΔagrA、K-USA300ΔagrA的过夜培养菌以1 :100比例接种于新鲜的TSB培养基中,37 ℃培养6 h(细菌生长至对数生长中期),取出培养物离心,细菌沉淀用0.85%的无菌生理盐水悬浮并稀释至0.5麦氏浓度,取100 μL稀释菌液均匀涂布于无抗生素的TSB固体平板上,室温晾干; 在平板正中位置放入万古霉素E-test试纸条,置于37 ℃孵箱过夜培养,次日观察结果并摄像,依据试纸条上的读数及抑菌圈的大小判定MIC值。
1.7 EMSA实验根据USA300菌株基因组中agrB基因(P2启动子控制)及其上游调控区DNA序列,设计引物agr-p1-5′-biotin/agr-p2-3′和agr-p1-5′-biotin/agr-p2M-3′引物对(具体序列见表 1),分别PCR扩增包含预测WalR结合位点的P2启动子DNA片段agr-P和不含预测结合位点的片段agr-PM,作为DNA探针用于EMSA实验。
EMSA实验参照文献[14]进行。每个反应分别取2 μmol/L的WalK重组蛋白,用20 μmol/L的ATP进行体外激活,依次在4个反应管中加入0、0.5、1.0和2.0 μmol/L的WalR重组蛋白进行体外磷酸化(由激活的组氨酸激酶WalK完成),1 min后分别向各反应中加入20 fmol的DNA探针(agr-P或agr-PM),室温反应20 min,加入等体积的2×SDS loading buffer终止反应。配置6%的非变性聚丙烯酰胺凝胶(PAGE胶),100 V预电泳30 min,上样后100 V电泳1 h; 电泳结束后,将PAGE胶置于50 mL的1×TBE buffer中,加入3 μL的GoldView核酸染料,室温染色10 min,紫外灯光下观察结果并摄像。
1.8 统计学处理采用GraphPad prism 7.0软件对RT-qPCR数据进行统计处理,数据以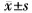
为探讨WalK(S221P)突变对VISA毒力的影响,我们对XN108及其WalK(S221P)突变回复菌株K65进行了RNA-seq。结果发现,K65与XN108相比有637个基因表达上调,715个基因表达下调,这些差异表达基因的聚类分析见图 1A所示,可见每个菌株的3个生物学重复样本的差异表达基因分布相一致。为验证转录组数据的可靠性,我们挑选了spa、fnbB、sbi、hla、isdA、RNAⅢ、sigB、graR、rot和saeR等10个基因进行RT-qPCR检测验证,结果显示它们在XN108和K65中的表达水平与RNA-seq测序结果的趋势一致,表明RNA-seq数据可靠,可用于后续差异表达基因的分析。

|
| A:差异表达基因的FPKM层次聚类分析热图红色表示高表达基因;蓝色表示低表达基因;颜色从红到蓝表示基因表达从高到低,具体见图中标尺所示; B:金葡菌毒力因子的表达差异分析,以毒力因子在XN108中的表达量为1,K65相对XN108的表达量以倍数表示1: SPA; 2: Hld; 3: Lipase; 4: Exotoxin; 5: FnbA; 6: SssA; 7: Hlg; 8: FnbB; 9: Collagen; 10: Thioredoxin; 11: Sbi; 12: Autolysin; 13: Coa; 14: Hla; 15: EssC; 16: EsxA; 17: SEL; 18: SEA; 19: SspB; 20: IsdF; 21: SspA; 22: Lipoprotein; 23: Lpl; C:金葡菌调控因子的表达差异分析,以调控因子在XN108中的表达量为1,K65相对XN108的表达量如图所示1: AgrC; 2: AgrA; 3: AgrB; 4: AgrD; 5: LysR; 6: Spx; 7: MarR; 8: SaeR; 9: RpiR; 10: SaeS; 11: PurR; 12: ArlR; 13: PhoP; 14: Walk; 15: MecA; 16: Sark; 17: SrrA; 18: SigB; 19: GraS; 20: PhoR; 21: Grak; 22: Vrak; 23: Vras 图 1 XN108及其WalK(S221P)突变回复菌株K65的转录组测序及差异表达基因分析 |
按照表达差异倍数(FoldChange)> 2.0且校正P值(Padj) < 0.05的遴选标准,K65与XN108相比共有193个差异表达基因,其中118个上调,75个下调。在这193个差异表达基因中,有58个功能未知,占30%。我们对差异表达的毒力因子基因进行分析,发现K65中的葡萄球菌A蛋白(SPA)、溶血素(包括δ-溶血素Hld, γ-溶血素Hlg和α-溶血素Hla)、脂酶、黏附分子(FnbA,FnbB)、葡萄球菌凝固酶等明显上调; 金葡菌分泌系统相关分子(EssC、EsxA)、肠毒素(SEL、SEA)、脂蛋白等表达下调(图 1B)。重要的是,与XN108相比,K65菌株的毒力调控系统Agr(包括AgrC、AgrA、AgrB和AgrD)、细菌自溶调控因子(LysR)的表达显著上调,而SigB、GraRS、VraSR等调控因子的表达水平下调(图 1C)。
2.2 WalK(S221P)突变回复后金葡菌溶血能力增强从转录组测序的结果可见,VISA菌XN108中的WalK(S221P)突变回复后,K65菌株的溶血素表达上调。采用血平板对XN108和K65溶血活性进行检测,结果如图 2所示,K65的溶血活性较XN108明显增强,提示WalK(S221P)突变回复后,VISA菌株的毒力也得以恢复。

|
| 图 2 XN108及其回复株K65的溶血活性检测结果 |
2.3 在强毒力MRSA菌株中引入WalK(S221P)突变后万古霉素耐药性升高
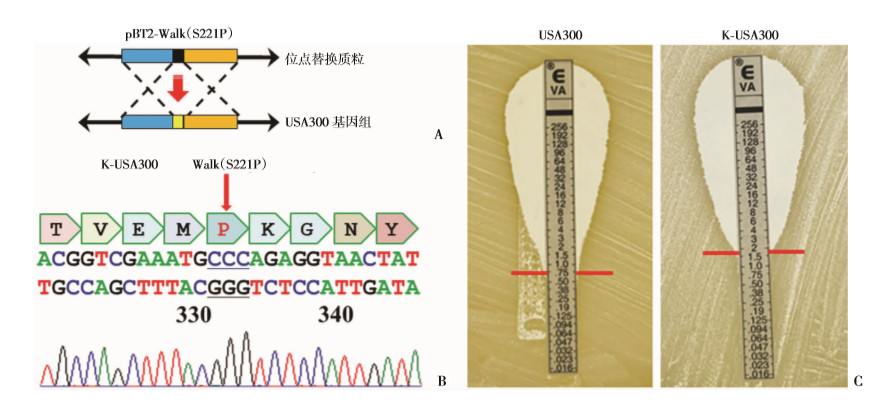
为探讨WalK(S221P)突变在其他遗传背景金葡菌中对耐药性及毒力的影响,我们将XN108中的WalK(S221P)突变基因通过同源重组技术替换强毒力菌株USA300中的walK基因,基因替换的原理示意图见图 3A所示。筛选到的替换菌株,提取基因组后PCR扩增其walK基因,测序表明已引入WalK(S221P)突变,替换菌株构建成功,命名为K-USA300(图 3B)。药敏试验(E-test)表明,WalK(S221P)突变后,K-USA300的万古霉素MIC从原来野生型USA300 0.75 μg/mL上升为超过1.5 μg/mL,升高了2倍多(图 3C),可见WalK(S221P)突变确实可以影响金葡菌的万古霉素耐药性。
|
| A:替换菌株构建原理示意图; B:替换菌株K-USA300中WalK(S221P)突变位点的测序验证; C: E-test检测替换菌株及其野生株对万古霉素的耐药性,红线示意MIC值 图 3 金葡菌USA300中引入WalK(S221P)突变后耐药性升高 |
2.4 引入WalK(S221P)突变后金葡菌毒力基因表达水平及溶血能力下降
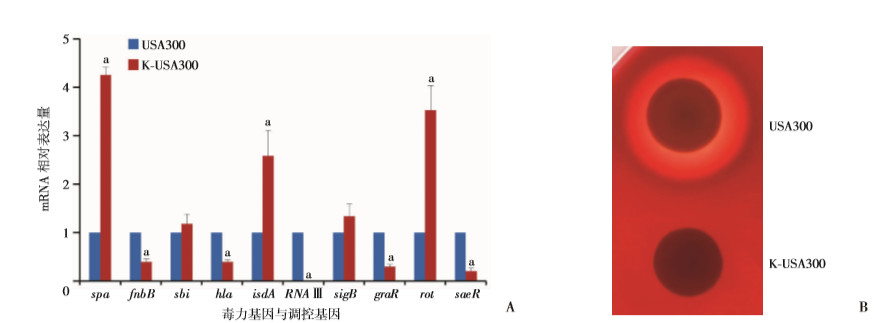
为研究引入WalK(S221P)突变对金葡菌毒力的影响,我们采用RT-qPCR检测了USA300和K-USA300中主要毒力因子和调控因子编码基因的表达变化,结果如图 4A所示。与野生株相比,携带WalK(S221P)突变的K-USA300的黏附分子fnbB、溶血素hla表达明显下降(P < 0.01),细菌表面蛋白SPA和铁调节表面蛋白IsdA基因表达显著升高(P < 0.01);相应地,RNAⅢ、GraR、SaeR等调控因子基因表达显著下降,rot显著升高(P < 0.01)。溶血实验进一步证实,引入WalK(S221P)突变后金葡菌K-USA300的溶血能力显著降低,表明WalK(S221P)突变可影响金葡菌的毒力。
|
| A: USA300及K-USA300中毒力因子及调控因子编码基因的RT-qPCR检测结果; a: P < 0.01, 与USA300比较; B:金葡菌USA300及K-USA300的溶血实验 图 4 金葡菌USA300中引入WalK(S221P)突变后毒力基因表达及溶血活性下降 |
2.5 WalKR对Agr具有直接调控作用
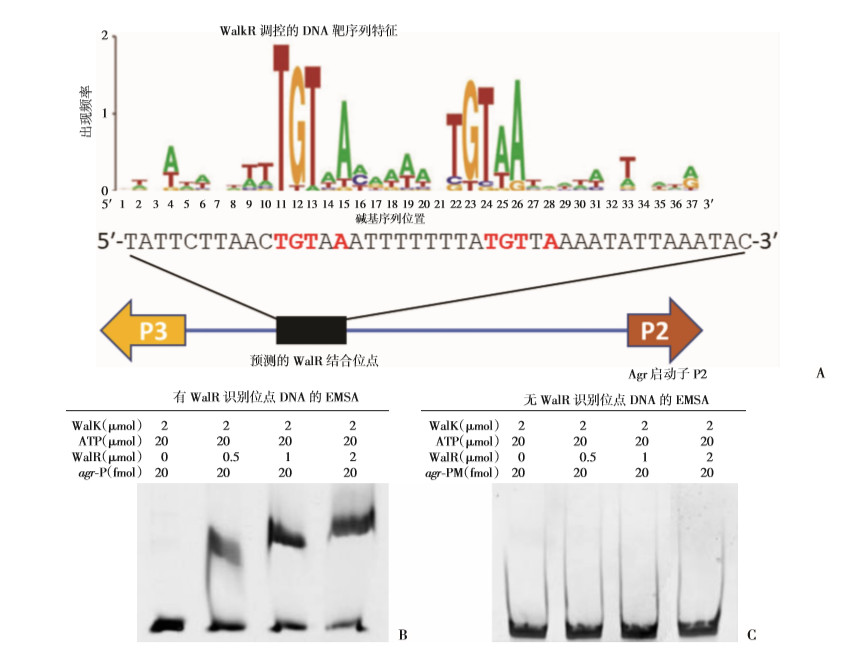
金葡菌拥有Agr、Sar、SaeSR等全局性毒力因子表达调控系统,在金葡菌毒力表达中发挥重要调控作用[17]。前述实验证实,在VISA菌XN108中回复WalK(S221P)突变,金葡菌毒力调控系统Agr的表达显著上调(P < 0.01),SaeSR表达轻度上调,SarR的表达下降(图 1C); 而在USA300中引入WalK(S221P)突变,RNAⅢ的表达显著下调(P < 0.01, 图 4A),由此推测WalK(S221P)突变可能影响Agr的活性。WalKR作为金葡菌唯一必需的TCS[3],其调控的靶基因之调控区存在典型的“5′-TGTWAH-N5-TGTWAH-3′,W, H, N为任意碱基”WalR识别基序。生物信息学分析发现,金葡菌Agr系统的P2启动子调控区存在一个可能的WalR识别基序(图 5A)。进一步我们扩增了正常的P2启动子区片段(agr-P)以及缺失了预测识别位点的DNA片段(agr-PM)作为探针,利用EMSA实验检测了体外ATP活化的重组蛋白WalK激活不同剂量的WalR对探针的结合能力变化,结果见图 5B,随着WalR浓度的升高,结合正常agr-P片段的能力增强,具有剂量依赖效应; 而缺失预测的WalR识别位点后,WalR结合agr-PM的能力无显著差异,表明WalK激活的WalR可直接结合金葡菌Agr的P2启动子区,调控Agr的表达。
|
| 金葡菌Agr系统的P2启动子区存在WalR的识别基序; B: EMSA实验(agr-P探针); C: EMSA实验(agr-PM探针) 图 5 金葡菌WalKR对毒力调控系统Agr具有直接调控作用 |
2.6 WalK(S221P)突变通过Agr影响VISA菌株的毒力
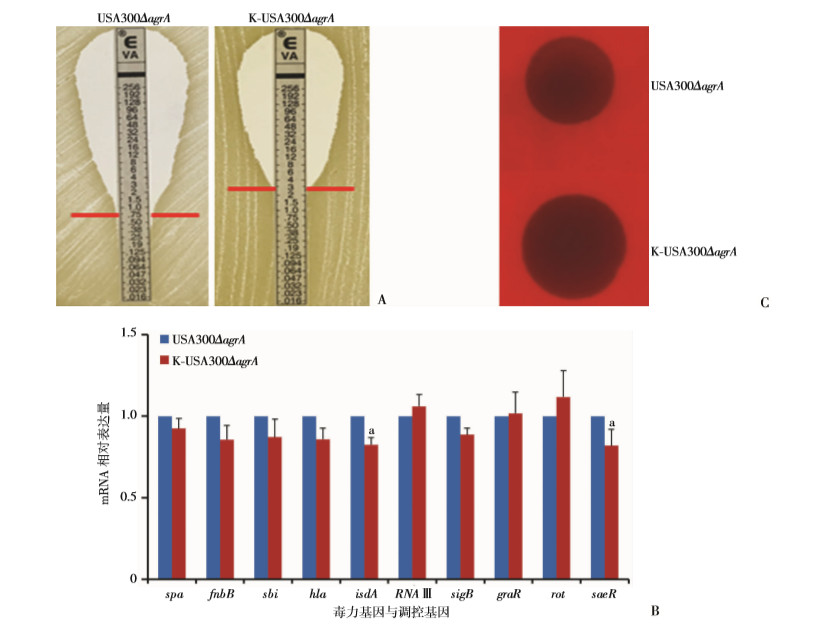
课题组以往的工作证实,WalK(S221P)突变后自身磷酸化的能力下降,导致其激活WalR的能力降低,调控靶基因的能力也降低[14]。本研究发现的WalK(S221P)突变影响VISA菌的毒力极有可能是通过Agr实现的,WalK(S221P)突变后对Agr的激活能力降低,导致Agr表达水平下降(P < 0.01),细菌表面蛋白表达升高,毒力因子表达降低(P < 0.01),进而引起细菌的毒力降低。为证实这一推测,我们在突变株USA300ΔagrA引入WalK(S221P)突变,发现USA300ΔagrA的万古霉素耐药性与野生株USA300一致,而K-USA300ΔagrA的耐药性仍然可以显著升高(图 6A),表明WalK(S221P)突变对金葡菌万古霉素耐药性的影响与Agr无关。进一步RT-qPCR检测毒力基因表达,发现agrA敲除后,无论是否存在WalK(S221P)突变,毒力基因(isdA, saeR除外)的表达水平变化不大(图 6B); 溶血实验也表明WalK(S221P)突变对USA300ΔagrA的溶血活性无影响。上述结果表明,只有Agr存在时,WalK(S221P)突变才能影响金葡菌的毒力,即WalK(S221P)突变影响VISA菌株的毒力是通过Agr实现的。
|
| A: WalK(S221P)突变使agrA敲除菌的万古霉素耐药性升高; B: USA300ΔagrA及K-USA300ΔagrA中毒力因子及调控因子编码基因的RT-qPCR检测结果;a: P < 0.05, 与USA300ΔagrA比较; C: USA300ΔagrA及K-USA300ΔagrA的溶血实验结果 图 6 WalK(S221P)通过Agr影响VISA的毒力 |
3 讨论
金葡菌是一种重要的人类感染病原菌[1-2]。据中国耐药监测网报告,我国临床分离菌中,金葡菌的分离率稳居革兰阳性细菌第一位,约占细菌总分离率的10%。金葡菌具有很强的环境适应能力,青霉素应用于临床不久,即出现了青霉素耐药的金葡菌,目前临床分离的金葡菌90%以上对青霉素耐药; MRSA和VISA的出现均是金葡菌在抗生素选择压力下迅速进化的结果[3-6]。此外,金葡菌还能产生数十种毒力因子参与致病,毒力因子的表达水平和数量直接影响菌株的毒力[16]。研究表明,细菌在获得耐药性的同时需要承担适应性代价,即耐药水平高的细菌毒力相对低下[11-12]。PELEG等[18]利用家蚕感染模型证实VISA菌较其万古霉素敏感的野生菌毒力降低;体外诱导的USA300来源的VISA突变菌引起小鼠脓肿及组织坏死的能力降低[19],这些研究都是利用实验室诱导的VISA菌株而开展的。在本研究中,我们利用从临床分离的VISA菌株XN108中存在的WalK(S221P)突变,在证实其参与VISA耐药性形成的基础上,系统研究了WalK(S221P)突变影响VISA毒力的作用与机制,对深入理解VISA菌株的毒力调控具有重要意义。
通过转录组测序,我们发现WalK(S221P)突变的回复株K65与XN108相比,有637个基因表达上调,715个基因表达下调,其中改变2倍以上的差异表达基因有193个,包括118个上调和75个下调基因。在上述差异表达基因中,编码免疫逃逸分子SPA,溶血素Hld、Hlg和Hla,黏附分子FnbA、FnbB等细菌毒力的基因明显上调; 而金葡菌分泌系统相关分子EssC、EsxA,肠毒素SEL、SEA,脂蛋白等基因表达下调。这些差异基因的表达变化与GARDETE等[19]报道的实验室诱导的VISA菌株的毒力基因改变模式有一定差异,这可能是菌株遗传背景的差异造成的。
利用同源重组技术,将WalK(S221P)突变引入到高毒力MRSA菌株USA300中,使得替换菌K-USA300的万古霉素MIC从原来的0.75 μg/mL升高至1.5 μg/mL,变化的幅度不如在XN108中回复WalK(S221P)突变对耐药性的影响(K65的MIC从野生株的12 μg/mL降低至4 μg/mL),表明同样的点突变在不同遗传背景菌株中对耐药性的影响程度可以不同。以往的研究也发现类似的现象,如WalK(G223D)突变可使JKD6009菌株的万古霉素MIC从1.5 μg/mL升高至3 μg/mL[9]; 而在MW2中,WalK(G223D)突变可使突变菌MIC从2 μg/mL升高至4 μg/mL[20]。尽管WalK(S221P)突变对高毒力MRSA菌株USA300的耐药性影响有限,但耐药趋势是升高的,且RT-qPCR检测和溶血实验证实WalK(S221P)突变使得K-USA300的毒力明显降低,这些现象背后的调控机制是一个值得探讨的科学问题。
值得我们注意的是,无论是在XN108中回复WalK(S221P)突变,还是在USA300中引入该突变,金葡菌毒力调控因子Agr的表达变化最显著。生物信息学发现,在金葡菌Agr编码区P2启动子上游存在WalR的可能结合位点,EMSA实验证实WalK激活的WalR可直接结合P2启动子区,表明WalKR可直接调控金葡菌Agr毒力系统的活性。我们在前期工作中证实,WalK(S221P)突变会导致WalK蛋白的自磷酸化水平降低,活化二元调控系统效应调控因子WalR的能力下降,调控靶基因表达的能力降低[15]。为进一步明确WalK(S221P)突变通过Agr影响VISA毒力,我们在Agr突变的USA300ΔagrA菌株中引入WalK(S221P),结果发现突变菌K-USA300ΔagrA的万古霉素耐药性仍然可以升高(MIC从USA300ΔagrA的0.75 μg/mL升高至3 μg/mL),但毒力因子的表达及溶血活性没有明显变化。这一结果表明WalK(S221P)突变所致的金葡菌万古霉素耐药性改变与Agr无关,而该突变影响VISA毒力需要Agr的存在,即WalK(S221P)突变影响VISA的毒力是通过Agr实现的。该机制的阐明对深入理解VISA菌的毒力调控有实际意义,为针对Agr功能分子设计控制VISA感染的新策略奠定了理论基础。
| [1] |
刘慧, 尚伟龙, 彭华刚, 等. SigB(Q225P)突变促进金黄色葡萄球菌生物被膜形成[J]. 第三军医大学学报, 2017, 39(8): 711-717. LIU H, SHANG W L, PENG H G, et al. SigB(Q225P) mutation promotes formation of Staphylococcus aureus biofilm[J]. J Third Mil Med Univ, 2017, 39(8): 711-717. DOI:10.16016/j.1000-5404.201610077 |
| [2] |
TOLEMAN M S, WATKINS E R, WILLIAMS T, et al. Investigation of a cluster of sequence type 22 methicillin-resistant Staphylococcus aureus transmission in a community setting[J]. Clin Infect Dis, 2017, 65(12): 2069-2077. DOI:10.1093/cid/cix539 |
| [3] |
HU Q W, PENG H G, RAO X C. Molecular events for promotion of vancomycin resistance in vancomycin intermediate Staphylococcus aureus[J]. Front Microbiol, 2016, 7: 1601. DOI:10.3389/fmicb.2016.01601 |
| [4] |
HIRAMATSU K, HANAKI H, INO T, et al. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility[J]. J Antimicrob Chemother, 1997, 40(1): 135-136. DOI:10.1093/jac/40.1.135 |
| [5] |
MORAVVEJ Z, ESTAJI F, ASKARI E, et al. Update on the global number of vancomycin-resistant Staphylococcus aureus (VRSA) strains[J]. Int J Antimicrob Agents, 2013, 42(4): 370-371. DOI:10.1016/j.ijantimicag.2013.06.004 |
| [6] |
RISHISHWAR L, KRAFT C S, JORDAN I K. Population genomics of reduced vancomycin susceptibility in Staphylococcus aureus[J]. mSphere, 2016, 1(4): e00094-e00016. DOI:10.1128/mSphere.00094-16 |
| [7] |
TACCONELLI E, CARRARA E, SAVOLDI A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant Bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327. DOI:10.1016/S1473-3099(17)30753-3 |
| [8] |
NCCLS News. M100-S11, Performance standards for antimicrobial susceptibility testing[J]. Clin Microbiol Newsl, 2001, 23(6): 49. DOI:10.1016/S0196-4399(01)88009-0 |
| [9] |
HOWDEN B P, MCEVOY C R, ALLEN D L, et al. Evolution of multidrug resistance during Staphylococcus aureus infection involves mutation of the essential two component regulator WalKR[J]. PLoS Pathog, 2011, 7(11): e1002359. DOI:10.1371/journal.ppat.1002359 |
| [10] |
WANG Y B, LI X L, JIANG L B, et al. Novel mutation sites in the development of vancomycin-intermediate resistance in Staphylococcus aureus[J]. Front Microbiol, 2016, 7: 2163. DOI:10.3389/fmicb.2016.02163 |
| [11] |
ANDERSSON D I, HUGHES D. Antibiotic resistance and its cost: is it possible to reverse resistance?[J]. Nat Rev Microbiol, 2010, 8(4): 260-271. DOI:10.1038/nrmicro2319 |
| [12] |
SHANG W L, HU Q W, YUAN W C, et al. Comparative fitness and determinants for the characteristic drug resistance of ST239-MRSA-Ⅲ-t030 and ST239-MRSA-Ⅲ-t037 strains isolated in China[J]. Microb Drug Resist, 2016, 22(3): 185-192. DOI:10.1089/mdr.2015.0226 |
| [13] |
ZHANG X, HU Q W, YUAN W C, et al. First report of a sequence type 239 vancomycin-intermediate Staphylococcus aureus isolate in mainland China[J]. Diagn Microbiol Infect Dis, 2013, 77(1): 64-68. DOI:10.1016/j.diagmicrobio.2013.06.008 |
| [14] |
PENG H G, HU Q W, SHANG W L, et al. WalK(S221P), a naturally occurring mutation, confers vancomycin resistance in VISA strain XN108[J]. J Antimicrob Chemother, 2017, 72(4): 1006-1013. DOI:10.1093/jac/dkw518 |
| [15] |
PENG H G, RAO Y F, YUAN W C, et al. Reconstruction of the vancomycin-susceptible Staphylococcus aureus phenotype from a vancomycin-intermediate S[J]. Front Microbiol, 2018, 9: 2955. DOI:10.3389/fmicb.2018.02955 |
| [16] |
ZECCONI A, SCALI F. Staphylococcus aureus virulence factors in evasion from innate immune defenses in human and animal diseases[J]. Immunol Lett, 2013, 150(1/2): 12-22. DOI:10.1016/j.imlet.2013.01.004 |
| [17] |
SHANG W L, RAO Y F, ZHENG Y, et al. Β-lactam antibiotics enhance the pathogenicity of methicillin-resistant Staphylococcus aureus via SarA-controlled lipoprotein-like cluster expression[J]. MBio, 2019, 10(3): e00880-e00819. DOI:10.1128/mBio.00880-19 |
| [18] |
PELEG A Y, MONGA D, PILLAI S, et al. Reduced susceptibility to vancomycin influences pathogenicity in Staphylococcus aureus infection[J]. J Infect Dis, 2009, 199(4): 532-536. DOI:10.1086/596511 |
| [19] |
GARDETE S, KIM C, HARTMANN B M, et al. Genetic pathway in acquisition and loss of vancomycin resistance in a methicillin resistant S[J]. Antimicrob Agents Chemother, 2011, 8(2): e1002505. DOI:10.1371/journal.ppat.1002505 |
| [20] |
HU J, ZHANG X, LIU X, et al. Mechanism of reduced vancomycin susceptibility conferred by walk mutation in community-acquired methicillin-resistant Staphylococcus aureus strain MW2[J]. Antimicrob Agents Chemother, 2015, 59(2): 1352-1355. DOI:10.1128/AAC.04290-14 |



