脑深部电刺激(deep brain stimulation, DBS)是目前治疗帕金森病(Parkinson’s disease, PD)有效的方法之一,能够明显改善PD患者症状[1]。丘脑底核(subthalamic nucleus, STN)是DBS常选用的核团,STN-DBS能明显改善帕金森患者运动障碍、强直、震颤等主要症状,提高患者生活质量[2-4]。对靶点核团的精确定位是DBS手术成功的关键,植入电极的位置是否准确与DBS术后的疗效密切相关。然而,许多因素(如脑脊液丢失和颅内积气造成的脑组织移位)会导致电极的实际位置与计划位置产生偏移[5-7],从而影响患者的治疗效果。目前相关研究结果观点不一,有学者认为,脑脊液丢失主要发生在DBS手术早期,手术第1侧和第2侧电极之间偏差无显著性差异[8]。亦有研究表明,颅内空气可能导致立体定向准确性的误差,尤其是在第2侧[9]。本研究旨在探究在帕金森病患者STN-DBS手术中,同期植入双侧电极时,其先后两侧的精确度是否有明显差异,并对其术后疗效做出评价,从而明确是否有必要延期植入第2侧电极。
1 资料与方法 1.1 一般资料收集本院2016-2018年接受双侧STN-DBS植入的患者,且均使用国产清华品驰刺激器。本研究获得重庆医科大学伦理委员会批准[2019年科研伦理(2019-259)号],获得患者及家属的知情同意。纳入标准:①原发性PD;②75岁以下,病程>4年(震颤为主者,病程>3年);③对左旋多巴药物有效或曾经有效;④系统药物治疗后,疗效逐渐下降,出现运动波动、异动症;⑤无痴呆、严重焦虑、抑郁等精神疾病相关并发症,术中可配合测试,术后可配合程控;⑥脑MRI检查基本正常,无器质性病变。排除标准:①患有帕金森综合征或帕金森叠加综合征;②患有消化系统疾病、代谢内分泌系统疾病等严重影响吸收代谢的消耗性疾病。
1.2 术前评估术前评估均由2名具有副高级及其以上职称的神经外科医师进行。所有患者接受统一帕金森病评分量表中的运动评分量表(the Unified Parkinson’s Disease Rating Scale Ⅲ,UPDRSⅢ)、简易精神状态量表评分(Mini-mental State Examination,MMSE)、帕金森患者生活质量问卷(Parkinson’s Disease Questionnaire,PDQ-39)、左旋多巴等效剂量进行评估。急性左旋多巴试验(acute levodopa challenge test,ALCT)试验前72 h停止服用多巴胺受体激动剂,24 h停用酶抑制剂,试验前12 h停止服用左旋多巴。在测试当日早上禁食,UPDRSⅢ评分作为基线。服用术前早上第1次服药时左旋多巴等效剂量1.5倍的左旋多巴后,每30分钟评分1次,直至疗效最佳。计算UPDRSⅢ评分的最大改善率[改善率(IR)=(服药前评分-服药后评分)/服药前评分×100%]。
1.3 手术过程选择国产清华品驰刺激器系统[10],刺激目标为双侧STN。将术前3T-MRI图像与手术当天戴有Leksell立体定向框架的CT图像融合[11]。采用Leksell surgiplan system手术计划系统设定穿刺靶点,避开血管、脑室脑沟等,设计穿刺路径。在局麻下根据计划的穿刺路径及靶点坐标植入微电极,利用微电极记录单个神经元的活动,确定STN,记录信号长度[12-14]。得到满意信号长度时,选择其为电极最终植入路径,植入电极。若多次调整仍未得到满意信号长度,则选择信号长度及强度最佳的1次为植入路径,植入电极。本次试验中,测试信号长度均在4 mm及以上。术中外接程控仪,通过测试性电刺激,评估患者的症状改善情况和副反应阈值。然后行术中CT检查,确定实际靶点位置,若无较大偏差,则在全麻下安装连接导线和脉冲发生器。
患者左右侧运动症状通常不对称,若左侧肢体症状较重,则先于右脑植入电极,再于左脑植入电极;反之亦然。若患者左右侧运动症状无明显差异,则先于左脑植入电极。出现以下情况时,需对穿刺道进行调整:①若MER实时监测提示信号长度小于4 mm;②给予测试性电刺激后,患者的症状改善不佳;③给予测试性电刺激后,患者出现明显的电刺激相关副作用。
1.4 术后随访术后1个月左右,启动脑深部电刺激器程序,程控过程按照《帕金森病脑深部电刺激疗法术后程控中国专家共识》[15]执行,并在术前及术后1、3、6、9个月对患者进行评估,采用UPDRSⅢ运动评分量表评价患者运动症状的改善情况,并记录抗帕金森病药物的剂量,并将其转换为等效剂量的左旋多巴。因患者症状多数在6个月达到稳定,故选用6个月为本次试验的随访时间(即分别记录急性左旋多巴冲击试验、术后6个月药物关期、术后6个月药物开期患者的UPDRSⅢ评分及药物剂量)。本试验包括总的改善情况和左右肢体单独的改善情况,肢体的改善主要为震颤(包括四肢的运动性震颤和静止性震颤)、僵直(主要为四肢僵直,不包括颈部僵直)和运动迟缓(四肢的运动情况,包括手指捏合,手的运动功能,手的快速交替运动以及膝关节屈曲状态下腿的灵活性),包括双侧大脑同时控制的症状(如语言、面部表情、姿势、步态、稳定性等)。
1.5 统计学分析采用SPSS 25.0统计软件。原始数据以x±s表示。实际电极位置与计划电极位置的偏差用欧式距离表示(计划坐标与实际坐标之间的三维矢量误差)。术前、术后各项指标的变化以改善率(%)表示,两组均数间比较行配对t检验,以P < 0.05表示有统计学意义。年龄、性别、起病年龄及病程长短分别与改善率及偏差之间的相关关系采用Pearson相关分析,以P < 0.05表示差异有统计学意义。
2 结果 2.1 一般资料本研究共纳入患者29例,其中1例因电极产生排异反应而拔除电极而未被纳入,1例因左脑做过核团毁损术而未被纳入统计,最终共纳入27例,随访时间为6个月至2年。患者年龄(60.1±8.3)岁;病程平均10.2(4~18)年。术前MMSE评分为(26.1±4.4)分;PDQ-39评分为(54.8±20.3)分;ALCT改善率为(66.40±15.22)%。
2.2 靶点坐标偏差27例患者共54侧电极,其中11例患者先行左侧电极植入,再行右侧电极植入;16例患者先行右侧电极植入,后行左侧电极植入。以前联合(anterior commissure, AC)后缘中点至后联合(posterior commissure, PC)前缘中点的连线(即AC-PC线)为参考线,据术中计算机断层扫描(intraoperative computed tomography,iCT)结果记录靶点实际坐标(Xn、Yn、Zn,n代表坐标调整次数),并与术前计划靶点坐标(X0、Y0、Z0)相对比,计算偏差(欧式距离),公式为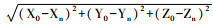
在ALCT、术后6个月药物关期、术后6个月药物开期的整体UPDRSⅢ改善率及震颤(动作性震颤和静止性震颤)、僵直(不包括颈部僵直)、运动迟缓的单项改善率见表 1。术后6个月药物关期患者改善率与ALCT比较差异无统计学意义(P>0.05),而术后6个月药物开期改善率与ALCT比较则表现出明显差异(P < 0.05, 表 1),说明在术后患者未服药情况下,仅有电刺激达到的效果与患者术前急性左旋多巴冲击试验最佳效果相当,而术后联合药物后,患者症状可以得到进一步的改善。除此之外,语言、面部表情、姿势障碍等亦得到明显改善,大部分患者可以生活自理。
| 时间 | 改善率(%) | 左旋多巴等效剂量/mg | |||
| 震颤(n=21) | 僵直(n=24) | 运动迟缓(n=27) | UPDRSⅢ(n=27) | ||
| 急性左旋多巴冲击试验 | 89.25±14.90 | 77.98±24.17 | 48.56±20.57 | 66.40±15.22 | 743.39±275.07 |
| 术后6个月药物关期 | 81.62±43.11 | 85.39±18.68 | 52.19±23.91 | 69.10±11.12 | - |
| 术后6个月药物开期 | 98.87±3.89a | 98.72±3.53a | 67.71±18.64a | 78.10±10.25a | 398.61±251.18a |
| a:P < 0.05,与急性左旋多巴冲击试验比较 | |||||
2.3.2 等效剂量的左旋多巴量
术后6个月,等效剂量的左旋多巴量由术前的(743.39±275.07)mg下降至(398.61±251.18)mg,其中有2例患者完全停药,减少率为100%,而有2例患者药物少许增加,总体来看,药物平均减少率约45.07%,与术前比较有明显差异(P < 0.05)。表明通过药物与电刺激的结合,不仅可以得到较好疗效,还可以减少药物量,从而减轻药物相关副作用。
2.3.3 并发症27例患者中,术前有严重的药物相关异动4例(14.81%);术后开机出现刺激相关异动(术前无异动)3例(11.11%),通过减少药物(主要减少美多芭及息宁)、采用双极模式、调整刺激靶点、刺激电压由低到高逐渐增加后,患者的异动症状在3~6个月左右消失。肢体一过性麻木5例(18.52%),精神症状1例(3.70%),通过更改刺激靶点或调整电压后,以上两种并发症在短时间内消失。构音障碍(表现为声音变小、吐词不清)3例(11.11%),通过更改刺激靶点和减小电压后,症状明显好转。所有患者均无明显永久副作用或并发症。
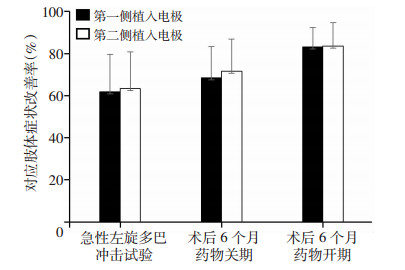
2.4 偏差与疗效的关系按电极植入的顺序(即第1侧与第2侧),分别对比其术前及术后6个月药物开关期对应肢体的震颤(动作性震颤和静止性震颤)、僵直(不包括颈部僵直)、运动迟缓三项的改善情况,发现第1侧与第2侧间症状均明显改善,两侧药物开期改善率均达80%以上,两侧之间的差异无统计学意义(P>0.05,图 1)。
|
| 图 1 术前、术后6个月第1侧与第2侧植入电极所对应肢体 |
症状改善情况
2.5 年龄、性别、起病年龄及病程长短分别与改善率和偏差之间的关系Pearson相关分析结果显示:年龄、性别、起病年龄及病程长短与改善率和偏差之间相关系数均接近于0,并且P值均大于0.05,表明年龄、性别、起病年龄及病程长短于改善率和偏差之间均没有相关关系(表 2)。
| 项目 | ALCT 改善率 |
术后6个月药物 关期改善率 |
术后6个月药物 开期改善率 |
第1侧 大脑偏差 |
第2侧 大脑偏差 |
| 年龄 | |||||
| r值 | -0.047 | 0.243 | 0.058 | 0.184 | 0.029 |
| P值 | 0.818 | 0.222 | 0.776 | 0.359 | 0.885 |
| 性别 | |||||
| r值 | -0.052 | -0.022 | 0.082 | 0.021 | -0.080 |
| P值 | 0.798 | 0.914 | 0.685 | 0.441 | 0.691 |
| 病程 | |||||
| r值 | 0.029 | -0.022 | -0.009 | 0.232 | 0.091 |
| P值 | 0.885 | 0.911 | 0.964 | 0.243 | 0.652 |
| 起病年龄 | |||||
| r值 | -0.047 | 0.198 | 0.048 | 0.059 | -0.010 |
| P值 | 0.816 | 0.323 | 0.811 | 0.771 | 0.959 |
3 讨论
众所周知,电极的放置位置是否准确是决定DBS疗效的关键因素之一,术中脑脊液丢失及颅内积气等均可能导致电极实际植入位置和计划位置发生偏差,从而影响电极位置的准确性。当硬脑膜打开后,随着手术时间的延长,脑脊液丢失和颅内积气都可能随之增加,有可能导致更加严重的脑组织移位。因此,在进行DBS手术时,后植入电极的一侧脑组织,其电极出现的偏差可能大于先植入电极的一侧脑组织。有学者对脑位移对第2侧电极植入精度的影响进行了研究[16-17],但结论尚存争议。在实际操作中,DBS手术多数为同期双侧电极植入,少数为分2次延期植入。因此, 双侧同期植入的电极之间精准度是否存在明显差异,以及术后疗效是否良好显得尤为重要。
本研究使用iCT技术来评估电极位置,需要将其与术前MRI融合,但融合结果无法纠正脑移位造成的误差,加之融合技术本身也存在一定缺陷,可能对电极位置的显示会有较大偏差。但以往的研究表明,与术中磁共振(intraoperative magnetic resonance imaging,iMRI)一样,iCT也可以用来评估靶点的准确性,且iCT和iMRI在DBS中判断靶点准确性的效果是相同的[18-21]。本研究也发现,iCT能够清楚显示电极的实际位置,通过与术前MRI再次融合,能够快速计算出偏差。因此,与iMRI相比,iCT更加经济、方便和快捷,更容易被局麻患者所接受。
本研究中,27例患者均为同期植入电极,54侧植入电极的偏差为(1.66±0.68)mm,其中最大的偏差为3.0 mm,这与近几年的相关研究类似[22-23]。第1侧植入电极与第2侧植入电极的偏差分别为(1.77±0.68)、(1.55±0.68)mm, 差异无统计学意义(P>0.05),甚至第2侧偏差小于第1侧偏差,并没有因为脑脊液的丢失而导致偏差增大。本研究结果表明:同时植入的两侧电极没有明显的差异,提示可以同时精准植入双侧电极,无需延期植入第2侧电极。
我们推测这可能与以下原因有关:①术前较为完备的手术计划:术前使用3T-MRI直接显示STN[24],并选择合适的靶点,利用术前MRI与CT融合,选择合适的穿刺道,制定好最佳的手术计划,选择从脑回进针,尽可能一次性穿刺成功,减少调整靶点带来的脑脊液丢失,并有利于加快手术进程,缩短手术时间;②术中严格控制脑脊液丢失:摆放体位时,尽量选取平卧位,或尽可能减少头部抬高角度,使脑组织下坠封闭蛛网膜下腔,从而减少脑脊液流失;打开硬脑膜时,尽量减少硬脑膜切口,置入微电极后,常规使用“三明治”式的方式防止和减少脑脊液流出,即先用明胶填塞硬膜切口,再使用棉片封堵骨孔并观察到无脑脊液从棉片上溢出为止,最后使用生物胶封住明胶及棉片与硬膜及骨孔的空隙。通过三层保护的方式尽可能地减少CSF丢失及颅内积气,从而减少脑组织移位的可能性。而且,有研究结果显示:即使脑组织产生了移位,其移位的多为位于半球的周边的脑组织,皮层下的脑位移非常有限,因此对电极置入时的影响也较小[25-26];③术中采用微电极记录(microelectrode recording,MER)实时监测穿刺过程中的电生理活动,并根据MER的提示及时调整穿刺道;置入刺激电极后进行的测试性电刺激也能够通过症状的改善程度,进一步验证电极置入的位置是否合适,减少电极位置偏移的可能性。
本研究对参与试验的所有患者的术后疗效进行了随访,患者运动症状都有明显改善,其中尤其以震颤、肌肉僵硬和运动迟缓的改善最为明显。当刺激器关闭时,上述运动症状立即出现,而当刺激器开启时,上述运动症状则明显改善。患者在术后未口服药物的情况下,改善率最高者可达85.7%,口服药物后改善率最高者则达到90%以上。从双侧偏差及肢体症状的改善情况来看,第1侧偏差(1.77±0.68)mm,术后开期对应肢体症状改善率为(83.15±9.16)%,第2侧偏差(1.55±0.68)mm,术后开期对应肢体症状改善率为(83.52±11.21)%,症状改善情况差别无统计学意义(P>0.05)。同时,在术后电刺激下达到症状稳定后,患者口服药物量均有不同程度的减少,与术前相比有明显差异(P < 0.05),其中2名患者甚至完全停止服药,仅依赖电刺激来控制症状。有少数患者出现术后并发症(刺激相关异动、肢体麻木、构音障碍、精神症状),均通过调整药物及刺激参数得到改善,无明显的永久副作用或并发症。随访患者的临床症状较为稳定,无明显的“开关”现象及“剂末”现象,生活质量也得到显著提升。我们认为:在DBS手术过程中不可避免存在一些误差,当误差在一定范围内时是可以接受的,可以结合术中MER结果及测试性电刺激来综合评估是否调整电极;在术中追求精确的同时,要避免“过度精确”,不能为了使最终靶点与目标靶点完全一致而过度穿刺,导致脑脊液过度丢失、术后低颅压、穿刺道出血等手术相关并发症的发生。
综上所述,同期植入双侧电极精确度并无较大差异,可以达到较好的临床效果。同时,通过术前和术中CT与MRI融合的方式,能够有效地验证并修正电极植入的位置。本研究是单中心的回顾性研究,仍需要扩大样本量,进行多中心研究,以对本研究结果进行进一步验证。
| [1] |
YU H, NEIMAT J S. The treatment of movement disorders by deep brain stimulation[J]. Neurotherapeutics, 2008, 5(1): 26-36. DOI:10.1016/j.nurt.2007.10.072 |
| [2] |
ODEKERKEN V J, VAN LAAR T, STAAL M J, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson's disease (NSTAPS study): a randomised controlled trial[J]. Lancet Neurol, 2013, 12(1): 37-44. DOI:10.1016/S1474-4422(12)70264-8 |
| [3] |
冼文彪, 裴中, 周旭毓, 等. 双侧丘脑底核脑深部电刺激术治疗帕金森病有效性和安全性的meta分析[J]. 中国神经精神疾病杂志, 2009, 35(5): 289-294. XIAN W B, PEI Z, ZHOU X Y, et al. Efficacy and safety of bilateral subthalamic nucleus deep brain stimulation for treating parkinson disease: a Meta-analysis[J]. Chin J Nerv Ment Dis, 2009, 35(5): 289-294. DOI:10.3969/j.issn.1002-0152.2009.05.009 |
| [4] |
GURIDI J, RODRÍGUEZ-OROZ M C, CLAVERO P, et al. Critical review of the subthalamic stimulation in Parkinson's disease[J]. Neurocirugia (Astur), 2009, 20(6): 521-532. |
| [5] |
ELIAS W J, FU K M, FRYSINGER R C. Cortical and subcortical brain shift during stereotactic procedures[J]. J Neuro- surg, 2007, 107(5): 983-988. DOI:10.3171/JNS-07/11/0983 |
| [6] |
MIYAGI Y, SHIMA F, SASAKI T. Brain shift: an error factor during implantation of deep brain stimulation electrodes[J]. J Neurosurg, 2007, 107(5): 989-997. DOI:10.3171/JNS-07/11/0989 |
| [7] |
IVAN M E, YARLAGADDA J, SAXENA A P, et al. Brain shift during bur hole-based procedures using interventional MRI[J]. J Neurosurg, 2014, 121(1): 149-160. DOI:10.3171/2014.3.JNS121312 |
| [8] |
SLOTTY P J, KAMP M A, WILLE C, et al. The impact of brain shift in deep brain stimulation surgery: observation and obviation[J]. Acta Neurochir (Wien), 2012, 154(11): 2063-2068. DOI:10.1007/s00701-012-1468-y |
| [9] |
AZMI H, MACHADO A, DEOGAONKAR M, et al. Intracranial air correlates with preoperative cerebral atrophy and stereotactic error during bilateral STN DBS Surgery for Parkinson's disease[J]. Stereotact Funct Neurosurg, 2011, 89(4): 246-252. DOI:10.1159/000327916 |
| [10] |
刘焕光, 刘德峰, 王慧敏, 等. 国产脑深部电刺激器治疗帕金森病的长期疗效观察[J]. 中华神经外科杂志, 2017, 33(11): 1133-1136. LIU H G, LIU D F, WANG H M, et al. Deep brain stimulation with a PINS device in Parkinson's disease: long-term follow-up[J]. Chin J Neurosurg, 2017, 33(11): 1133-1136. DOI:10.3760/cma.j.issn.1001-2346.2017.11.012 |
| [11] |
BENABID A L, KOUDSIE A, BENAZZOUZ A, et al. Imaging of subthalamic nucleus and ventralis intermedius of the thalamus[J]. Mov Disord, 2002, 17(Suppl 3): S123-S129. DOI:10.1002/mds.10153 |
| [12] |
胡小吾, 周晓平, 姜秀峰, 等. 帕金森病患者丘脑底核电极植入术中位置判断和调整[J]. 临床神经外科杂志, 2008, 5(3): 113-116. HU X W, ZHOU X P, JIANG X F, et al. Intraoperative verification and adjustment of subthalamic nucleus electrode placement in deep brain stimulation for Parkinson's disease[J]. J Clin Neurosurg, 2008, 5(3): 113-116. DOI:10.3969/j.issn.1672-7770.2008.03.001 |
| [13] |
MONTGOMERY E B Jr. Microelectrode targeting of the subthalamic nucleus for deep brain stimulation surgery[J]. Mov Disord, 2012, 27(11): 1387-1391. DOI:10.1002/mds.25000 |
| [14] |
BENAZZOUZ A, BREIT S, KOUDSIE A, et al. Intraoperative microrecordings of the subthalamic nucleus in Parkinson's disease[J]. Mov Disord, 2002, 17: S145-S149. DOI:10.1002/mds.10156 |
| [15] |
CHEN S D, GAO G D, FENG T, et al. Chinese expert consensus on programming deep brain stimulation for patients with Parkinson's disease[J]. Transl Neurodegener, 2018, 7: 11. DOI:10.1186/s40035-018-0116-x |
| [16] |
SASAKI T, AGARI T, KUWAHARA K, et al. Efficacy of dural sealant system for preventing brain shift and improving accuracy in deep brain stimulation surgery[J]. Neurol Med Chir (Tokyo), 2018, 58(5): 199-205. DOI:10.2176/nmc.oa.2017-0242 |
| [17] |
ONDO W G, BRONTE-STEWART H, DBS STUDY GROUP. The North American survey of placement and adjustment strategies for deep brain stimulation[J]. Stereotact Funct Neurosurg, 2005, 83(4): 142-147. DOI:10.1159/000088654 |
| [18] |
PEZESHKIAN P, DESALLES A A, GORGULHO A, et al. Accuracy of frame-based stereotactic magnetic resonance imaging vs frame-based stereotactic head computed tomography fused with recent magnetic resonance imaging for postimplantation deep brain Stimulator lead localization[J]. Neurosurgery, 2011, 69(6): 1299-1306. DOI:10.1227/NEU.0b013e31822b7069 |
| [19] |
SHAHLAIE K, LARSON P S, STARR P A. Intraoperative computed tomography for deep brain stimulation surgery: technique and accuracy assessment[J]. Neurosurgery, 2011, 68(1 Suppl Operative): 114-124. DOI:10.1227/NEU.0b013e31820781bc |
| [20] |
KREMER N I, OTERDOOM D L M, VAN LAAR P J, et al. Accuracy of intraoperative computed tomography in deep brain stimulation-A prospective noninferiority study[J]. Neuromodulation, 2019, 22(4): 472-477. DOI:10.1111/ner.12918 |
| [21] |
KOCHANSKI R B, KEROLUS M G, PAL G, et al. Use of intraoperative CT to predict the accuracy of microelectrode recording during deep brain stimulation surgery[J]. Clin Neurol Neurosurg, 2016, 150: 164-168. DOI:10.1016/j.clineuro.2016.09.014 |
| [22] |
BOT M, VAN DEN MUNCKHOF P, BAKAY R, et al. Accuracy of intraoperative computed tomography during deep brain stimulation procedures: comparison with postoperative magnetic resonance imaging[J]. Stereotact Funct Neurosurg, 2017, 95(3): 183-188. DOI:10.1159/000475672 |
| [23] |
GEEVARGHESE R, O'GORMAN TUURA R, LUMSDEN D E, et al. Registration accuracy of CT/MRI Fusion for localisation of deep brain stimulation electrode position: an imaging study and systematic review[J]. Stereotact Funct Neurosurg, 2016, 94(3): 159-163. DOI:10.1159/000446609 |
| [24] |
HAMID N A, MITCHELL R D, MOCROFT P, et al. Targeting the subthalamic nucleus for deep brain stimulation: technical approach and fusion of pre- and postoperative MR images to define accuracy of lead placement[J]. J Neurol Neurosurg Psychiatry, 2005, 76(3): 409-414. DOI:10.1136/jnnp.2003.032029 |
| [25] |
PETERSEN E A, HOLL E M, MARTINEZ-TORRES I, et al. Minimizing brain shift in stereotactic functional neurosurgery[J]. Neurosurgery, 2010, 67(3 Suppl Operative): ons213-221, discussion ons221. DOI: 10.1227/01.NEU.0000380991.23444.08.
|
| [26] |
MATIAS C M, FRIZON L A, ASFAHAN F, et al. Brain shift and pneumocephalus assessment during frame-based deep brain stimulation implantation with intraoperative magnetic resonance imaging[J]. Oper Neurosurg (Hagerstown), 2018, 14(6): 668-674. DOI:10.1093/ons/opx170 |



