2. 400038 重庆,陆军军医大学(第三军医大学)医学心理系:军人发展心理学教研室
2. Department of Military Developmental Psychology, Faculty of Medical Psychology, Army Medical University (Third Military Medical University), Chongqing, 400038, China
创伤后应激障碍(post-traumatic stress disorder,PTSD)是个体在遭遇重大创伤事件之后所产生的一种以恐惧记忆的闪回、噩梦和高警觉状态为主要症状的精神疾病[1]。促进恐惧记忆的消退是治疗PTSD的有效途径之一。暴露疗法以条件性恐惧消退范式为基础,在临床PTSD患者的治疗中取得了良好效果[2]。条件恐惧记忆的建立和消退过程都高度依赖于创伤产生的情景,海马是进行情景信息加工的重要脑区[3]。研究表明在恐惧记忆的建立和消退过程伴随着海马神经元树突棘的动态重塑[4]。恐惧消退可以逆转由于条件性恐惧建立导致的树突棘的增加[5]。然而调节机制尚待阐明。
瞬时受体电位阳离子通道(transient receptor potential canonical,TRPC)是TRP (transient receptor potential)基因超家族下的一个亚家族,主要包括TRPC1、TRPC2、TRPC3/6/7和TRPC4/5。由于大脑中与工作记忆有关的区域表现出持续的放电现象,而TRPC通道支持单个神经元的持续放电,且改善工作记忆的神经调质受体往往也会激活TRPC通道,所以TRPC通道被认为是构成工作记忆的基础之一,许多研究都报道了其亚型在学习记忆中的相关作用[6]。例如NEUNER等[7]的研究表明,干扰小鼠海马TRPC3蛋白的表达可以提高小鼠在情景恐惧记忆范式测试阶段的僵直行为百分比。TRPC6与TRPC3具有较高的序列相似性,且二者都可以被BDNF激活。TRPC6编码钙可通透的非选择性阳离子通道,主要位于海马神经元的树突棘部位。已有研究表明其可以正向调控海马神经元钙离子内流并引起树突棘的形成,进而增强空间学习记忆能力[8],提示TRPC6对依赖于海马的突触结构和记忆具有重要作用。然而TRPC6是否参与条件性恐惧记忆的建立和消退目前尚不清楚。因此,本研究采用腺相关病毒介导的RNA干扰抑制海马TRPC6的表达,探讨TRPC6在情景条件恐惧记忆建立和恐惧消退中的作用,旨在为治疗PTSD提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性成年(6~8周)C57BL/6J小鼠,体质量(22±2)g,购自陆军军医大学实验动物中心,由动物房专人饲养,光/暗周期为12 h/12 h,自由觅食和饮水。操作均符合陆军军医大学关于实验动物使用的管理和伦理规定。
1.1.2 主要仪器和试剂SuperMaze动物行为视频分析系统(XR-Xmaze,上海欣软信息科技有限公司);旷场实验分析系统(XR-XZ301,上海欣软信息科技有限公司);高架十字迷宫分析系统(XR-XG201,上海欣软信息科技有限公司);SuperFcs条件性恐惧实验系统(XR-XC404,上海欣软信息科技有限公司);TRPC6抑制腺相关病毒(AAV, 干扰靶点序列为:5′-TCGAGGACCAGCATACATG-3′)及对照腺相关病毒(和元生物技术有限公司);兔抗TRPC6(编号ACC-017,美国Alomone Lab公司);小鼠抗β-actin(编号AA128,上海碧云天生物有限公司)。
1.2 方法 1.2.1 实验分组使用随机数字表法将32只小鼠分为条件恐惧组和恐惧消退组,每组16只。条件恐惧组(立体定位注射后21 d进行条件恐惧的建立,22 d进行恐惧记忆的测试)分为空病毒对照组(Control)和病毒干扰组(sh-TRPC6),每组8只;恐惧消退组(立体定位注射后4 d进行条件恐惧的建立,21 d进行条件恐惧消退训练,22 d进行消退记忆的测试)分为空病毒对照组(Control)和病毒干扰组(sh-TRPC6),每组8只。
1.2.2 动物模型建立在行为学实验前24 h将小鼠移至行为学实验室内,以使其适应实验室环境。情景性条件恐惧的建立参考HAIT等[9]的方法:将小鼠放入条件恐惧箱,适应150 s后,给予5次不可逃避的足底电击(0.7 mA,2 s),每次电击间隔58 s,记录适应期和每次间隔期内的僵直行为百分比(Freezing%)。情景性条件恐惧消退训练参考NAGAYOSHI等[10]的方法:将小鼠放回条件恐惧箱,不施加任何刺激,进行30 min(共6试次,5 min/试次)的恐惧消退,记录每个试次内的僵直行为百分比(Freezing%)。以上实验数据由SuperFcs条件性恐惧实验系统记录并自动分析,小鼠僵直行为百分比超过50%即为建模成功[11]。每只小鼠在实验结束后送回动物房,并用75%酒精清除试验箱内残留气味。
1.2.3 立体定位注射腹腔注射4%水合氯醛麻醉小鼠后,将其固定在小鼠脑立体定位仪上,充分暴露颅骨表面,以前囟点为零点,使用我们之前已经验证过的坐标(AP:-1.8 mm,ML:+/-1.5 mm,DV:-1.7 mm)对小鼠两侧海马CA1区分别进行病毒注射,病毒滴度2.5×1012 V.G./mL,每侧注射0.9 μL,注射速率0.2 μL/min。对照组注射GFP标记的空病毒(Control),干扰组注射TRPC6的shRNA病毒(sh-TRPC6),注射完成后留针5 min再缓慢退针。
1.2.4 AAV-TRPC6转染位置的鉴定腺相关病毒注射20 d,取小鼠海马切片经PBS漂洗后用5%羊血清工作液室温孵育30 min,DAPI染核5 min,PBS漂洗3次后封片,用激光共聚焦显微镜(Leica,Germany)观察CA1区荧光表达并采集图像。
1.2.5 Western blot检测深度麻醉小鼠后快速断头取脑,冰上分离海马组织。1%PMSF(碧云天生物科技)及RIPA(碧云天生物科技)处理。BCA蛋白浓度测定试剂盒(碧云天生物科技)测定蛋白浓度。SDS-PAGE电泳后转膜至PVDF膜上。室温下5%脱脂奶TBST抗原封闭2 h,加入特异性一抗TRPC6(1 :500),4 ℃过夜。加入辣根酶标记山羊抗兔IgG(1 :2 000,中杉金桥公司)37 ℃孵育1.5 h后,ECL显色。Image-Pro Plus 6.0软件对目的条带的相对灰度值进行量化分析。
1.2.6 旷场实验旷场试验箱为50 cm×50 cm×30 cm医用有机板材制成的无盖盒状箱。将小鼠放入试验箱中心区域,允许其自由探索5 min。由配套的摄像头和系统记录并分析运动轨迹,计算其总移动距离(cm)和外周/中心活动度。
1.2.7 高架十字迷宫高架十字迷宫实验被广泛用于啮齿动物焦虑水平的检测,动物在开臂中停留时间的百分比和进入开臂的次数与焦虑程度呈负相关。旷场实验用于动物自发活动情况的检测。高架十字迷宫由2个开臂(35 cm×5 cm×15 cm)、2个闭臂(35 cm×5 cm×15 cm)和中心区域(5 cm×5 cm)组成。将小鼠放入高架十字迷宫中心区域,允许其自由探索5 min,由配套的摄像头和系统记录并分析运动轨迹,计算开放臂滞留时间占总时间百分比(%)和进出各臂次数总和。
1.3 统计学分析计量资料以x±s表示,使用SPSS 22.0统计分析。对于条件恐惧建立和消退过程中的Freezing%变化趋势,使用重复测量方差分析,其余检测指标均采用独立样本t检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 腺相关病毒注射后小鼠海马TRPC6的表达TRPC6病毒注射后20 d,取小鼠脑组织切片在荧光显微镜下观察,可见海马CA1区锥体细胞层GFP表达阳性,表明病毒成功转染进入锥体细胞胞体及突起,注射位置正确。Western blot结果显示:sh-TRPC6组海马的TRPC6表达显著低于Control组(t=17.56,P < 0.01, 图 1),表明AAV介导的RNA干扰病毒成功抑制了小鼠海马CA1区TRPC6的表达。

|
| A:免疫荧光检测病毒转染情况;B:Western blot检测TRPC6蛋白的表达及半定量分析a: P < 0.01,与Control组比较 图 1 TRPC6腺相关干扰病毒对海马CA1区TRPC6蛋白表达的影响 |
2.2 抑制海马TRPC6表达后小鼠焦虑水平和活动度的变化
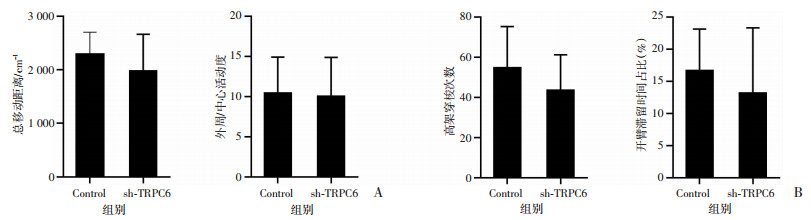
立体定位注射病毒后19 d,进行条件恐惧的建立之前,对条件恐惧组的Control组和sh-TRPC6组小鼠进行旷场实验,结果显示:两组小鼠的总移动距离(t=1.438,P=0.162)和外周/中心移动时间比(t=0.307,P=0.762)差异无统计学意义;立体定位注射病毒后20 d,高架十字迷宫实验结果显示:两组小鼠的高架穿梭次数(t=1.669,P=0.108)和开臂滞留时间占比(t=1.010,P=0.322)差异无统计学意义(图 2)。
|
| A:旷场实验两组总移动距离(左)和外周/中心活动度(右);B:高架十字迷宫穿梭次数(左)和开臂滞留时间占比(右) 图 2 抑制海马TRPC6表达后小鼠焦虑水平和活动度的变化 |
2.3 抑制海马TRPC6表达后对小鼠情景性条件恐惧建立的影响
立体定位注射病毒后21 d,对条件恐惧组的Control组和sh-TRPC6组小鼠进行情景性条件恐惧的建立,使用重复测量方差分析对两组小鼠在建立过程中不同时间点Freezing%水平进行检验,发现恐惧记忆的建立趋势与组别间存在交互作用(F=2.518,P < 0.05),与Control组小鼠相比,TRPC6组小鼠Freezing%水平上升趋势更为平缓;条件恐惧建立后24 h,进行条件恐惧记忆的检测,结果显示:sh-TRPC6组的小鼠Freezing%水平显著低于Control组小鼠(t=2.679,P < 0.05,图 3)。

|
| A:小鼠的僵直行为百分比变化;B:小鼠在恐惧记忆的检测阶段僵直行为百分比a:P < 0.05,与Control组比较 图 3 抑制海马TRPC6表达后小鼠情景性条件恐惧的建立 |
2.4 抑制海马TRPC6表达后对小鼠情景性条件恐惧消退的影响
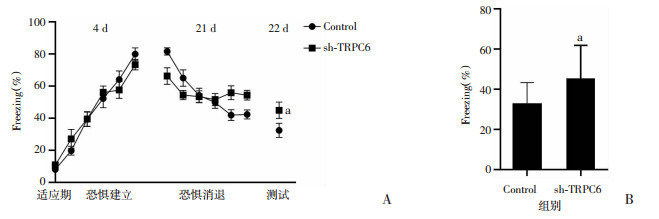
立体定位注射病毒后4 d对恐惧消退组的Control组和sh-TRPC6组小鼠进行情景性条件恐惧的建立,于21 d进行条件恐惧的消退训练,使用重复测量方差分析对两组小鼠在消退过程中不同时间点Freezing%水平进行检验,发现恐惧记忆的消退趋势与组别间存在交互作用(F=8.988,P < 0.05),与Control组相比,sh-TRPC6组的小鼠消退曲线更为平缓;消退训练后24 h进行消退记忆的检测,结果显示:sh-TRPC6组的小鼠Freezing%水平显著高于Control组小鼠(t=2.132,P < 0.05,图 4)。
|
| A:小鼠的僵直行为百分比变化;B:小鼠在消退记忆的检测阶段僵直行为百分比a:P < 0.05,与Control组比较 图 4 抑制海马TRPC6表达后对小鼠情景性条件恐惧消退的影响 |
3 讨论
近年来,由于现代高科技战争的巨大破坏力以及特殊战场环境对军人的巨大心理压力,加之社会公共突发事件和严重自然灾害事件的不断发生,导致PTSD发病率明显增高,人们逐渐认识到治疗PTSD在提高部队战斗力与维护社会安全稳定方面意义重大。由条件性恐惧模型中恐惧消退范式演化而来的暴露疗法在临床上常用于治疗PTSD。条件性恐惧模型在研究PTSD时使用广泛,该模型以经典的巴甫洛夫条件反射为基础,将1个条件化刺激(conditioned stimulus,CS,如情景)和1个非条件化刺激(unconditioned stimulus,US,如足底电击)进行配对,形成CS-US的联结,建立恐惧记忆;条件恐惧的消退并不是已建立恐惧记忆的“擦除”,而是形成新的消退记忆(CS-NO US)。这种新的消退记忆和原有的恐惧记忆形成竞争,进而抑制恐惧反应[12]。研究显示海马对于恐惧记忆的建立和消退是必需的,由海马产生的消退记忆和恐惧记忆间的竞争,决定了恐惧会复发还是抑制[13]。而依赖于海马的记忆形成过程与神经元突触结构密不可分。作为突触可塑性的关键因素,树突棘在记忆形成过程中的增多和扩大都伴随细胞内钙离子的增加,需要钙离子信号通路的调节[14]。
TRPC6作为钙离子通透的非选择性通道,在神经系统表达广泛,参与了神经发育、细胞生长、神经元保护、神经变性等功能[15]。近年来有报道:与对照小鼠相比,TRPC6转基因小鼠表现出更快的学习效率和更好的记忆效果[8],表明TRPC6在依赖于海马的学习记忆过程中发挥重要作用。为了检测TRPC6在情景恐惧记忆建立和消退中的作用,本研究首先通过在海马CA1区注射腺相关病毒介导的RNA干扰病毒,有效抑制小鼠海马CA1区锥体神经元TRPC6的表达。在情景性条件恐惧的建立阶段,抑制海马TRPC6表达后,我们发现小鼠建立恐惧记忆的速率减缓,并在24 h后检测不能形成长时恐惧记忆,表明抑制海马TRPC6会破坏情景恐惧记忆的形成。在情景条件恐惧的消退阶段,抑制海马TRPC6表达后,我们发现小鼠消退记忆的形成速率减缓;24 h后的消退记忆检测结果显示恐惧记忆的消退过程也受到了干扰,这与我们在情景性条件恐惧建立阶段观察到的结果一致。以上结果与MONTECINOS-OLIVA等[16]的报道具有相似性:在海马注射TRPC6激动剂IDN5706可以显著促进小鼠的空间学习记忆能力,而注射TRPC特异性阻断剂SKF96365则降低空间学习记忆效率。提示TRPC6对海马的学习记忆具有正向调节作用。
此外,由于条件恐惧模型是通过小鼠Freezing%水平来判断其恐惧记忆水平,因此小鼠的焦虑水平和运动功能往往会对这一指标产生影响。高架十字迷宫结果显示:sh-TRPC6组和Control组在开臂停留时间和进入开臂次数没有显著差异;旷场实验结果也显示:sh-TRPC6组和Control组在活动距离和中心活动时间没有显著差异,表明干扰病毒的表达并不会显著影响小鼠的原发焦虑水平和活动情况,抑制TRPC6产生的条件性恐惧行为的改变具有特异性。
既往研究表明:TRPC6对海马学习记忆的作用可能是通过调节海马神经元的突触可塑性来实现的。其中,树突棘结构的可塑性与突触功效、学习和记忆以及其他认知过程的变化有关。LEUNER等[17]发现TRPC6激动剂Hyperforin可以激活PC12细胞中TRPC6介导的电流和Ca2+的瞬变,诱导其分化,类似于神经保护因子BDNF的作用;用Hyperforin处理海马脑片可以显著增加锥体神经元成熟的粗短树突棘的数量,而RNA干扰TRPC6的表达后细长树突棘的数量显著减少。此外,突触蛋白的表达在突触形态变化过程中也发生相应的改变。ZHOU等[8]的研究表明在突触后膜TRPC6与PSD-95、GluR2/3有共表达,随后的研究结果也显示Hyperforin处理原代海马神经元会显著增加突触蛋白synapsin和PSD-95的水平,TRPC6通道激活同样可通过Ca2+内流激活RAS-MEK-ERK通路、RAS-PI3K-Akt通路以及CaMKIV通路,进而使CREB磷酸化[18]。另有研究也证实了过表达TRPC6引起的海马神经元树突棘的生长是通过激活CaMKIV-CREB信号通路介导的[19]。本研究通过构建腺相关病毒干扰小鼠海马CA1区锥体神经元TRPC6的表达,进而发现恐惧记忆的建立和消退受到了明显的干扰。这一行为的变化,是否由于干扰海马神经元TRPC6的水平后抑制了Ca2+-CaMKIV-CREB信号通路的激活,调节神经元树突棘的形态进而影响恐惧记忆的建立和消退过程,还需要进一步研究和探索。
综上所述,本研究证实TRPC6参与了恐惧记忆的建立和消退过程。这为通过调控TRPC6的表达以促进恐惧记忆的消退,进一步研究如何有效治疗PTSD提供了新的思路和药物靶点。
| [1] |
YEHUDA R, HOGE C W, MCFARLANE A C, et al. Post-traumatic stress disorder[J]. Nat Rev Dis Primers, 2015, 1: 15057. DOI:10.1038/nrdp.2015.57 |
| [2] |
DUNSMOOR J E, MURTY V P, DAVACHI L, et al. Emotional learning selectively and retroactively strengthens memories for related events[J]. Nature, 2015, 520(7547): 345-348. DOI:10.1038/nature14106 |
| [3] |
MAREN S, PHAN K L, LIBERZON I. The contextual brain: implications for fear conditioning, extinction and psychopathology[J]. Nat Rev Neurosci, 2013, 14(6): 417-428. DOI:10.1038/nrn3492 |
| [4] |
BENDER C L, GIACHERO M, COMAS-MUTIS R, et al. Stress influences the dynamics of hippocampal structural remodeling associated with fear memory extinction[J]. Neurobiol Learn Mem, 2018, 155: 412-421. DOI:10.1016/j.nlm.2018.09.002 |
| [5] |
LAI C S W, ADLER A, GAN W B. Fear extinction reverses dendritic spine formation induced by fear conditioning in the mouse auditory cortex[J]. Proc Natl Acad Sci USA, 2018, 115(37): 9306-9311. DOI:10.1073/pnas.1801504115 |
| [6] |
REBOREDA A, THEISSEN F M, VALERO-ARACAMA M J, et al. Do TRPC channels support working memory? Comparing modulations of TRPC channels and working memory through G-protein coupled receptors and neuromodulators[J]. Behav Brain Res, 2018, 354: 64-83. DOI:10.1016/j.bbr.2018.02.042 |
| [7] |
NEUNER S M, WILMOTT L A, HOPE K A, et al. TRPC3 channels critically regulate hippocampal excitability and contextual fear memory[J]. Behav Brain Res, 2015, 281: 69-77. DOI:10.1016/j.bbr.2014.12.018 |
| [8] |
ZHOU J, DU W L, ZHOU K C, et al. Critical role of TRPC6 channels in the formation of excitatory synapses[J]. Nat Neurosci, 2008, 11(7): 741-743. DOI:10.1038/nn.2127 |
| [9] |
HAIT N C, WISE L E, ALLEGOOD J C, et al. Active, phosphorylated fingolimod inhibits histone deacetylases and facilitates fear extinction memory[J]. Nat Neurosci, 2014, 17(7): 971-980. DOI:10.1038/nn.3728 |
| [10] |
NAGAYOSHI T, ISODA K, MAMIYA N, et al. Hippocampal calpain is required for the consolidation and reconsolidation but not extinction of contextual fear memory[J]. Mol Brain, 2017, 10(1): 61. DOI:10.1186/s13041-017-0341-8 |
| [11] |
SOTRES-BAYON F, BUSH D E, LEDOUX J E. Acquisition of fear extinction requires activation of NR2B-containing NMDA receptors in the lateral amygdala[J]. Neuropsychopharmacology, 2007, 32(9): 1929-1940. DOI:10.1038/sj.npp.1301316 |
| [12] |
MILAD M R, QUIRK G J. Fear extinction as a model for translational neuroscience: ten years of progress[J]. Annu Rev Psychol, 2012, 63: 129-151. DOI:10.1146/annurev.psych.121208.131631 |
| [13] |
LACAGNINA A F, BROCKWAY E T, CROVETTI C R, et al. Distinct hippocampal engrams control extinction and relapse of fear memory[J]. Nat Neurosci, 2019, 22(5): 753-761. DOI:10.1038/s41593-019-0361-z |
| [14] |
PAULA-LIMA A C, ADASME T, HIDALGO C. Contribution of Ca2+ release channels to hippocampal synaptic plasticity and spatial memory: potential redox modulation[J]. Antioxid Redox Signal, 2014, 21(6): 892-914. DOI:10.1089/ars.2013.5796 |
| [15] |
崔龙彪, 金晓航, 史娟. 中枢神经系统内的TRPC6离子通道[J]. 神经解剖学杂志, 2011, 27(5): 565-570. CUI L B, JIN X H, SHI J. TRPC6 channels in the central nervous system[J]. Chin J Neuroanat, 2011, 27(5): 565-570. |
| [16] |
MONTECINOS-OLIVA C, SCHULLER A, PARODI J, et al. Effects of tetrahydrohyperforin in mouse hippocampal slices: neuroprotection, long-term potentiation and TRPC channels[J]. Curr Med Chem, 2014, 21(30): 3494-3506. DOI:10.2174/0929867321666140716091229 |
| [17] |
LEUNER K, LI W, AMARAL M D, et al. Hyperforin modulates dendritic spine morphology in hippocampal pyramidal neurons by activating Ca2+ -permeable TRPC6 channels[J]. Hippocampus, 2013, 23(1): 40-52. DOI:10.1002/hipo.22052 |
| [18] |
HEISER J H, SCHUWALD A M, SILLANI G, et al. TRPC6 channel-mediated neurite outgrowth in PC12 cells and hippocampal neurons involves activation of RAS/MEK/ERK, PI3K, and CAMKIV signaling[J]. J Neurochem, 2013, 127(3): 303-313. DOI:10.1111/jnc.12376 |
| [19] |
TAI Y L, FENG S J, GE R L, et al. TRPC6 channels promote dendritic growth via the CaMKIV-CREB pathway[J]. J Cell Sci, 2008, 121(Pt 14): 2301-2307. DOI:10.1242/jcs.026906 |



