运动耐力是军事作业能力基础,是打赢战争至关重要的因素之一。现代高技术战争条件下,睡眠限制(sleep restriction,SR)已成为平、战时环境下的常见现象。SR是指将每日睡眠时间限制在比正常水平较低的水平,从而导致总睡眠时间减少。研究表明SR影响运动表现,是导致作战官兵发生疲劳衰竭、丧失战斗力、出现非战斗减员的重要原因之一,是军队在组织和进行持续作战、训练时必须考虑的重要军事医学问题[1-2]。因此,如何改善SR引起的耐力下降,已经引起越来越多的关注,迫切需要找到解决的方法。
紫檀芪(pterostilbene,PTE)是白藜芦醇(resveratrol,RSV)的二甲基化类似物,广泛存在于蓝莓、葡萄等食物中,具有与RSV相似的生物学作用,包括抗氧化、抗癌、抗炎等。PTE具有比RSV更高的口服生物利用度,而且在高剂量下也对人体无毒,因此更具实际应用前景[3-4]。已有研究证明RSV通过激活腺苷酸活化蛋白激酶[adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK]、沉默信息调节因子1(silent mating-type information regulation 2 homolog 1,SIRT1)和过氧化物酶体增殖物激活受体γ辅激活物1-α(peroxisome proliferator-actived receptor γ coactivator 1-α,PGC-1α)以提高线粒体生物合成能力,提高运动耐力[5]。据报道,PTE也可作用于AMPK和SIRT1以发挥其生物学作用,但其对运动耐力的有益影响尚少见研究涉及[6-7]。本研究采用睡眠剥夺仪构建小鼠睡眠限制模型,观察PTE对睡眠限制小鼠运动耐力的影响,探讨AMPK、SIRT1在其中可能的作用,为进一步研究PTE作为营养干预手段,应用于保障军人体能强健工作提供科学依据。
1 材料与方法 1.1 实验动物6~8周龄健康雄性C57BL/6小鼠30只,体质量(24.63±0.64)g,购于陆军军医大学大坪医院实验动物中心[动物合格证号:SCXK(京)2015-00169]。动物饲养于陆军军医大学实验动物中心,室温(22±2)℃,明暗周期12 h,并自由进食与饮水。实验正式开始前先适应性喂养1周,30只小鼠分为3组(n=10):对照组(CON)、睡眠限制组(SR)和睡眠限制加PTE 100 mg/(kg·d)组(SR+PTE)。干预结束时,每组随机抽取5只小鼠进行负重力竭游泳实验,剩余5只小鼠脱颈处死后迅速解剖分离骨骼肌组织。PTE用0.1% DMSO配制,根据给予光照时刻(zetigeber time,ZT)于每日ZT0(8:00给予光照即为ZT0)使用标准灌胃针灌胃完成,CON组和SR组给予相应体积的0.1%DMSO。
1.2 主要试剂PTE(纯度≥98%)购于成都曼斯特公司,PGC1α、NRF1、TFAM、SIRT1抗体购于美国Abcam公司,AMPK、p-AMPK、β-ACTIN抗体购于美国Cell signaling公司,ERRα抗体购于美国Bimake公司,qPCR转录试剂购于日本TaKaRa公司,DNA合成均来自上海生工生物工程股份有限公司。
1.3 睡眠限制模型构建采用睡眠剥夺仪(SA108,江苏赛昂斯公司)建立C57BL/6小鼠SR模型。通过可调节周期的剥夺杆来回扫描饲养笼底部,使小鼠在光照期的前8 h(ZT0~ZT8)被迫保持清醒状态,以达到SR的目的(图 1)。SR持续5 d,相当于模拟1个工作周。同时,CON组在相同条件下保持在不同的笼子中,但不进行睡眠干预。
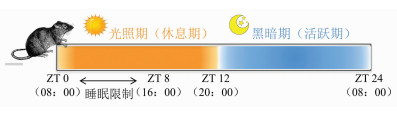
|
| 图 1 睡眠限制模式图 |
1.4 游泳训练
游泳训练在椭圆形塑料游泳池(50 cm×50 cm× 40 cm)中进行,水温(25±2)℃,水深(30±1) cm,使小鼠不能用四肢触碰池底。为了尽量减少小鼠的应激反应,各组小鼠于干预期间保持每日进行游泳训练15 min。
1.5 主要检测指标与方法 1.5.1 体质量指标使用陆军军医大学实验动物中心提供的EL303-IC电子天平,于干预开始和干预结束进行2次体质量称量。
1.5.2 负重力竭游泳实验干预结束时,每组选取5只小鼠,每只小鼠尾部负重10%体质量的铅皮,进行负重力竭游泳实验,并记录力竭游泳时间。力竭判定标准为:小鼠头部完全沉入水下并在8 s内未抬头[8]。
1.5.3 血清运动性疲劳生化指标检测各组小鼠负重力竭游泳实验结束后,眼球取血,4 ℃静置2 h后,1 100×g离心15 min,取上层血清,生理盐水稀释5倍后,送陆军军医大学第一附属医院检验科,使用贝克曼库尔特全自动生化分析仪测定乳酸脱氢酶(LDH)、肌酸激酶(CK)和血尿素氮(BUN)。
1.5.4 小鼠骨骼肌HE染色干预结束时,取各组未进行负重力竭游泳实验的小鼠,脱颈处死,固定于操作台上,纵向切开后肢皮肤,完整分离双侧骨骼肌组织(腓肠肌及比目鱼肌)。取小鼠左侧骨骼肌组织(厚度为4 μm),于4%多聚甲醛固定,石蜡包埋切片,进行HE染色,显微镜下观察。
1.5.5 实时PCR(Real Time-PCR,RT-PCR)检测各组小鼠骨骼肌中线粒体生物合成相关基因的表达按照试剂盒说明书要求,提取各组未进行负重力竭游泳实验的小鼠骨骼肌组织中总RNA,再反转录获得cDNA,而后配制RT-PCR反应体系,并在实时定量PCR仪上进行PCR反应。采用2-ΔΔCt计算方法比较各组cDNA的相对表达量。各引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 产物长度/bp |
| pgc-1α | 上游:GTCCTTCCTCCATGCCTGAC | 376 |
| 下游:GACTGCGGTTGTGTATGGGA | ||
| nrf-1 | 上游:CTTCATGGAGGAGCACGGAG | 289 |
| 下游:ATGAGGCCGTTTCCGTTTCT | ||
| errα | 上游:ATCTGCTGGTGGTTGAACCTG | 150 |
| 下游:AGAAGCCTGGGATGCTCTTG | ||
| tfam | 上游:TGGGGACCAGGGCAGCCATT | 301 |
| 下游:AGGGCTTGCTGCCCACACAT | ||
| ND1 | 上游:TCCCCTACCAATACCACACCC | 159 |
| 下游:ATTGTTTGGGCTACGGCTCG | ||
| β-actin | 上游:GTGACGTTGACATCCGTAAAGA | 245 |
| 下游:GCCGGACTCATCGTACTCC |
1.5.6 Western blot检测各组小鼠骨骼肌中线粒体生物合成相关蛋白及AMPK/SIRT1信号通路的表达
取各组未进行负重力竭游泳实验的小鼠骨骼肌组织30 mg,加入800 μL配制好的含蛋白酶抑制剂的组织裂解液,磁珠破碎后,冰上裂解30 min,离心提取上清液,用BCA法测定蛋白浓度,于沸水浴10 min。配制10% SDS-PAGE胶,蛋白上样(40 μg/孔)后,经过电泳、转膜、封闭后,添加一抗β-actin(1 :1 000)、AMPK(1 :1 000)、p-AMPK(1 :1 000)、SIRT1(1 :1 000)、PGC1α(1 :1 000)、NRF1(1 :1 000)、ERRα(1 :1 000)和TFAM(1 :1 000)于4 ℃孵育过夜。PBST洗膜3次,室温孵育二抗1 h,再次洗膜3次,使用分子成像仪成像。以β-actin为内参,采用IMAGE J软件分析条带灰度值。
1.5.7 骨骼肌组织中线粒体DNA含量检测使用试剂盒从各组未进行负重力竭游泳实验的小鼠骨骼肌组织中分离DNA。用分光光度法(260 nm)定量DNA并进行定量实时PCR。通过比较它们的扩增产物与ND1的扩增产物以获得mtDNA相对量。引物序列见表 1。
1.6 统计学分析采用GraphPad Prism 6.0软件进行数据分析,计量资料用x±s表示,多组间用单因素方差分析Turkey检验。检验水准:α=0.05。
2 结果 2.1 各组小鼠体质量变化干预期间,CON组活动偏好正常,SR组和SR+PTE组小鼠在睡眠限制期间(ZT0~ZT8)变得更加活泼。与CON组相比,SR组和SR+PTE组小鼠体质量在5 d干预期内显著下降,但SR组小鼠下降幅度更大(P < 0.05,图 2)。
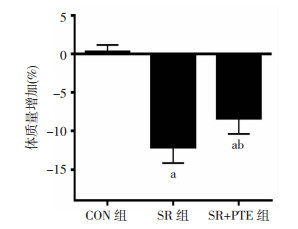
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 图 2 各组小鼠体质量的变化 (n=10, x±s) |
2.2 各组小鼠负重力竭游泳时间
CON组小鼠负重力竭游泳时间为(11.10±1.25)min,SR组小鼠为(7.60±1.42)min,力竭游泳时间较CON组明显缩短31.55%(P < 0.05),显示SR组小鼠更快达到力竭状态。SR+PTE组小鼠的力竭游泳时间为(10.71± 1.41)min,较SR组力竭游泳时间明显延长40.96%,与CON组比差异无统计学意义。
2.3 各组小鼠负重力竭游泳后血清运动性疲劳指标变化与CON组相比,SR组LDH、CK和BUN水平显著升高(P < 0.05);与SR组相比,SR+PTE组LDH和CK水平显著降低(P < 0.05),但BUN并无明显变化(表 2)。
| 组别 | LDH/IU·L-1 | CK/IU·L-1 | BUN/mmol·L-1 |
| CON组 | 177.36±28.09 | 573.00±49.50 | 7.44±1.09 |
| SR组 | 265.80±55.24a | 941.88±237.85a | 10.20±0.95a |
| SR+PTE组 | 187.44±25.43b | 649.20±130.50b | 8.76±0.86 |
| a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 | |||
2.4 各组小鼠骨骼肌组织病理学变化
小鼠骨骼肌组织HE染色结果显示:各组骨骼肌组织结构均显示正常,肌细胞排列紧密,着色均匀,界限清晰,胞核位于肌纤维边缘,肌细胞未见明显损伤,少量单个肌细胞聚集成束,肌束间隙未见炎性渗出物(图 3)。
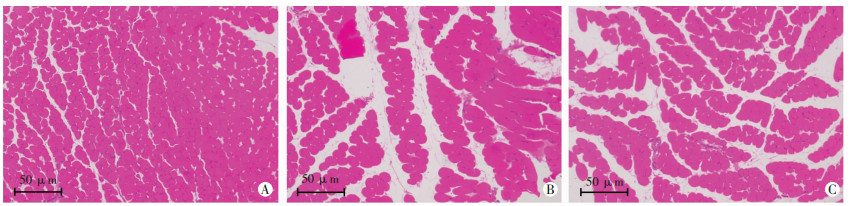
|
| A: CON组;B: SR组;C: SR+PTE组 图 3 各组小鼠骨骼肌组织HE染色观察 |
2.5 PTE对小鼠mtDNA含量的影响
与CON组相比,SR组小鼠骨骼肌mtDNA含量显著降低(P < 0.05);与SR组相比,SR+PTE组小鼠骨骼肌mtDNA含量明显升高(P < 0.05,图 4),且与CON组比较差异无统计学意义。
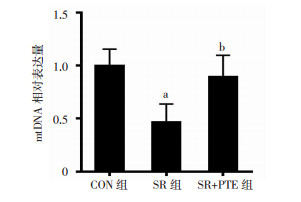
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 图 4 RT-PCR检测各组小鼠骨骼肌mtDNA相对表达量 (n=5) |
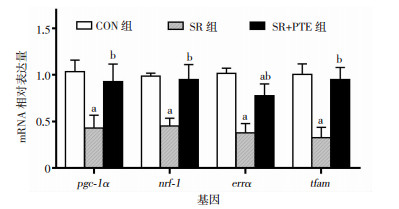
2.6 PTE对小鼠骨骼肌组织中线粒体生物合成相关基因mRNA表达的影响
与CON组相比,SR组线粒体生物合成相关基因pgc-1α、nrf-1、errα和tfam的mRNA表达显著降低(P < 0.05);与SR组相比,SR+PTE组中上述各mRNA表达显著增高(P < 0.05),其中pgc-1α、nrf-1和tfam的表达与CON组相比差异无统计学意义,但errα的表达明显低于CON组(P < 0.05,图 5)。
|
| a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 图 5 RT-PCR检测各组小鼠骨骼肌线粒体生物合成相关基因表达 (n=5) |
2.7 PTE对小鼠骨骼肌组织中线粒体生物合成相关蛋白水平的影响
与CON组相比,SR组线粒体生物合成相关基因PGC-1α、NRF-1、ERRα和TFAM的蛋白水平显著降低(P < 0.05);与SR组相比,SR+PTE组上述各蛋白水平显著增高(P < 0.05),其中PGC-1α和TFAM的表达水平与CON组相比差异无统计学意义,但NRF-1和ERRα的表达水平明显低于CON组(P < 0.05,图 6)。

|
| A: Western blot检测PGC-1α、NRF-1、ERRα和TFAM蛋白的表达;B:蛋白相对表达量分析 a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 图 6 Western blot检测各组小鼠骨骼肌线粒体生物合成相关蛋白的表达 (n=5) |
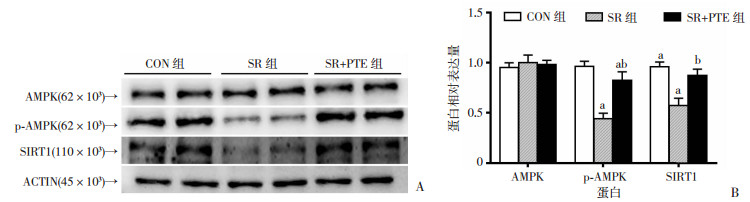
2.8 PTE对小鼠骨骼肌组织中AMPK、SIRT1蛋白水平的影响
各组小鼠骨骼肌组织中AMPK水平无明显变化;与CON组比较,SR组小鼠骨骼肌组织中p-AMPK和SIRT1水平显著降低(P < 0.05);与SR组比较,SR+PTE组中p-AMPK和SIRT1表达显著增加(P < 0.05),其中SIRT1的表达与CON组相比差异无统计学意义,但p-AMPK的表达明显低于CON组(P < 0.05,图 7)。
|
| A: Western blot检测AMPK、p-AMPK和SIRT1蛋白的表达;B:蛋白相对表达量分析 a: P < 0.05,与CON组比较;b: P < 0.05,与SR组比较 图 7 Western blot检测各组小鼠骨骼肌AMPK和SIRT1蛋白的表达 (n=5) |
3 讨论
随着现代生活节奏的加快,全球有数百万人处于SR或潜在SR状态,尤其是对于特殊作业的部队官兵而言,SR已成为常态化[9]。大量研究表明SR会影响神经、免疫、内分泌、心血管及运动等系统正常生理功能,并扰乱机体内能量代谢平衡[10-11]。
多酚类植物化合物具有抗氧化、抗炎、抗肿瘤和降血压、降血糖等广泛的健康效应[12-13]。PTE来源于葡萄等浆果,通过甲氧基取代RSV苯环的3位和5位羟基,从而增加分子代谢稳定性,显示出比RSV更高的生物活性,因此更具有实际应用价值[14]。目前有关研究多集中在抗氧化、抗肿瘤功能等方面,对其抗疲劳活性研究鲜有报道[15-16]。既往研究多采用转笼法或改良多平台法构建实验动物SR模型,通过连续强迫运动来剥夺睡眠,而且仪器噪音大,实验动物往往处于高应激状态,严重干扰实验结果[17-18]。本研究采用新型睡眠剥夺仪,通过调节饲养笼内可调节周期的剥夺杆来回扫描饲养笼底部从而剥夺小鼠睡眠,有效消除强迫运动带来的影响。结果显示:PTE干预可部分缓解SR导致的小鼠体质量下降。通过负重力竭游泳实验建立小鼠运动疲劳模型,进一步观察PTE对SR小鼠运动耐力的影响,发现PTE可有效延长SR小鼠的负重力竭游泳时间,增强SR小鼠的运动耐力。为进一步反映小鼠疲劳的真实状态并评估PTE的抗疲劳活性,检测了血清运动性疲劳相关生化指标。剧烈运动时会产生大量乳酸,乳酸堆积使血液pH值降低,神经肌肉兴奋传递受阻,最终导致肌肉收缩能力下降。LDH是促进丙酮酸生成乳酸的一种糖酵解酶,是反映机体能量代谢的重要指标[19]。CK是血清中机体肌肉特异性损伤指标,而骨骼肌损伤与机体运动耐力下降直接相关[20]。BUN是蛋白质和氨基酸代谢的主要产物。当碳水化合物和脂肪不足以为机体提供足够的能量时,通过增强蛋白质分解代谢来补偿能量需求,这将导致产生更多的BUN[21]。因此,BUN含量的升高通常代表肌肉收缩力的下降和疲劳程度。本研究发现PTE可不同程度的减少SR小鼠力竭游泳后血清中LDH、CK和BUN水平,加速清除体内疲劳代谢产物的堆积,有抗疲劳活性。
线粒体广泛存在于机体内各大代谢活跃组织中,产生ATP供机体运动所需。本研究发现SR小鼠骨骼肌组织mtDNA含量显著减少,而PTE干预后能明显恢复,提示SR导致小鼠骨骼肌线粒体功能障碍,进而引起运动耐力下降,而PTE有效改善了线粒体功能障碍。大量研究表明线粒体生物合成能力减弱会导致线粒体功能发生障碍[22-23]。线粒体生物发生由与核编码蛋白的表达密切相关的多个过程组成,这些过程是维持mtDNA复制所必需的。PGC-1α是调控线粒体生物合成的关键调节因子,活化后可与NRF-1、ERRα相互作用,其中NRF-1靶向激活TFAM和ERRα以介导线粒体生物发生[24]。本研究采用RT-PCR和Western blot等方法进行分析,发现SR后小鼠骨骼肌组织中4种线粒体生物发生调控基因PGC-1α、NRF-1、ERRα和TFAM的转录和翻译水平下降,提示SR可通过下调线粒体核转录因子,影响mtDNA复制和转录,干扰线粒体生物合成,影响线粒体功能,而PTE能有效拮抗此效应。AMPK、SIRT1是体内重要的能量感受器,通过感受机体能量代谢状态,调控下游分子的表达,调节机体能量代谢过程。研究表明AMPK/SIRT1信号通路可通过磷酸化、去乙酰化调节PGC-1α,参与线粒体功能和生物合成[25-26]。PTE已被证明可以激活AMPK和SIRT1,调节其活性发挥生物学作用[6-7]。本研究检测了SR小鼠骨骼肌组织中AMPK/SIRT1信号通路的表达情况,结果显示SR导致活化的AMPK即p-AMPK和SIRT1蛋白表达显著降低;SR期间同时给予PTE [100 mg/(kg·d)]干预可明显抑制上述变化,p-AMPK和SIRT1蛋白表达显著升高。该结果提示:PTE对SR小鼠运动耐力的改善作用可能与其调节AMPK/SIRT1信号通路有关。
运动耐力与持续作战能力紧密联系。无论是现代局部战争还是未来具有高科技特征的“多位一体”战争,单兵持续作战能力都将是决定战争胜负的重要作战力量。因此,如何纠正SR引起的耐力下降已经成为军事卫勤保障工作的重大课题之一。过去的几十年里,研究人员致力于寻找天然活性物质和人工合成化学物质,以增强体质,延缓疲劳,然而许多活性产物由于存在副作用使其应用受到了极大的限制[27-28]。本研究发现:PTE不仅可以改善运动耐力,加速消除疲劳产物的堆积。因此,研究PTE对SR导致的运动耐力的影响,对持续作战以及非战争军事行动时保障官兵作战能力将起到重要作用,其可望成为防治SR引起的运动耐力下降的一种新选择。
综上所述,本研究通过构建SR小鼠模型,发现PTE可改善SR小鼠运动耐力,具有抗疲劳活性,其作用机制与提高线粒体生物合成能力有关,并可能通过激活AMPK/SIRT1信号通路来发挥作用。本研究的局限性在于没有考虑SR导致的昼夜节律紊乱对骨骼肌组织(外周时钟器官)的影响,以及未对PTE调节AMPK/SIRT1信号通路的上/下游分子机制进行深入探讨,
| [1] |
OLIVER S J, COSTA R J, LAING S J, et al. One night of sleep deprivation decreases treadmill endurance performance[J]. Eur J Appl Physiol, 2009, 107(2): 155-161. DOI:10.1007/s00421-009-1103-9 |
| [2] |
GRANDOU C, WALLACE L, FULLAGAR H H K, et al. The effects of sleep loss on military physical performance[J]. Sports Med, 2019, 49(8): 1159-1172. DOI:10.1007/s40279-019-01123-8 |
| [3] |
KAPETANOVIC I M, MUZZIO M, HUANG Z H, et al. Pharmacokinetics, oral bioavailability, and metabolic profile of resveratrol and its dimethylether analog, pterostilbene, in rats[J]. Cancer Chemother Pharmacol, 2011, 68(3): 593-601. DOI:10.1007/s00280-010-1525-4 |
| [4] |
RICHE D M, MCEWEN C L, RICHE K D, et al. Analysis of safety from a human clinical trial with pterostilbene[J]. J Toxicol, 2013, 2013: 1-5. DOI:10.1155/2013/463595 |
| [5] |
LAGOUGE M, ARGMANN C, GERHART-HINES Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha[J]. Cell, 2006, 127(6): 1109-1122. DOI:10.1016/j.cell.2006.11.013 |
| [6] |
MEI H L, XIANG Y, MEI H, et al. Pterostilbene inhibits nutrient metabolism and induces apoptosis through AMPK activation in multiple myeloma cells[J]. Int J Mol Med, 2018, 42(5): 2676-2688. DOI:10.3892/ijmm.2018.3857 |
| [7] |
CHENG Y D, DI S Y, FAN C X, et al. SIRT1 activation by pterostilbene attenuates the skeletal muscle oxidative stress injury and mitochondrial dysfunction induced by ischemia reperfusion injury[J]. Apoptosis, 2016, 21(8): 905-916. DOI:10.1007/s10495-016-1258-x |
| [8] |
DUAN F F, GUO Y, LI J W, et al. Antifatigue effect of luteolin-6-C-neohesperidoside on oxidative stress injury induced by forced swimming of rats through modulation of Nrf2/ARE signaling pathways[J]. Oxid Med Cell Longev, 2017, 2017: 3159358. DOI:10.1155/2017/3159358 |
| [9] |
CHOU H W, TZENG W C, CHOU Y C, et al. Stress, sleep and depressive symptoms in active duty military personnel[J]. Am J Med Sci, 2016, 352(2): 146-153. DOI:10.1016/j.amjms.2016.05.013 |
| [10] |
李晨, 刘康, 陈涛. 急性睡眠剥夺时程对青年男性军人脑认知功能的影响[J]. 中国健康心理学杂志, 2017, 25(2): 195-199. LI C, LIU K, CHEN T. Effects of acute sleep deprivation on brain cognitive function in young male military volunteer[J]. China J Heal Psychol, 2017, 25(2): 195-199. DOI:10.13342/j.cnki.cjhp.2017.02.011 |
| [11] |
VENANCIO D P, SUCHECKI D. Prolonged REM sleep restriction induces metabolic syndrome-related changes: Mediation by pro-inflammatory cytokines[J]. Brain Behav Immun, 2015, 47: 109-117. DOI:10.1016/j.bbi.2014.12.002 |
| [12] |
ABBASZADEH H, KEIKHAEI B, MOTTAGHI S. A review of molecular mechanisms involved in anticancer and antiangiogenic effects of natural polyphenolic compounds[J]. Phytother Res, 2019, 33(8): 2002-2014. DOI:10.1002/ptr.6403 |
| [13] |
ALIM A, LI T, NISAR T, et al. Antioxidant, antimicrobial, and antiproliferative activity-based comparative study of peel and flesh polyphenols from Actinidia chinensis[J]. Food Nutr Res, 2019, 26: 63. DOI:10.29219/fnr.v63.1577.eCollection2019 |
| [14] |
BOWTELL J, KELLY V. Fruit-derived polyphenol supplementation for athlete recovery and performance[J]. Sports Med, 2019, 49(Suppl 1): 3-23. DOI:10.1007/s40279-018-0998-x |
| [15] |
CHATTERJEE K, ALSHARIF D, MAZZA C, et al. Resveratrol and pterostilbene exhibit anticancer properties involving the downregulation of HPV oncoprotein E6 in cervical cancer cells[J]. Nutrients, 2018, 10(2): E243. DOI:10.3390/nu10020243 |
| [16] |
NAGAO K, JINNOUCHI T, KAI S, et al. Pterostilbene, a dimethylated analog of resveratrol, promotes energy metabolism in obese rats[J]. J Nutr Biochem, 2017, 43: 151-155. DOI:10.1016/j.jnutbio.2017.02.009 |
| [17] |
佘美华, 蒋文艳, 杨升华, 等. 新型褪黑素受体激动剂Neu-P11改善慢性睡眠限制大鼠胰岛素敏感性[J]. 中国药理学通报, 2013, 29(11): 1506-1506. SHE M H, JIANG W Y, YANG S H, et al. Neu-P11, a novel melatonin receptor agonist, improves insulin sensitivity in chronic sleep restricted rats[J]. Chin Pharmacol Bull, 2013, 29(11): 1506-1506. DOI:10.3969/j.issn.1001-1978.2013.11.008 |
| [18] |
温朝玲, 刘春红, 孙雯雯, 等. 黑果枸杞花色苷对部分睡眠剥夺大鼠心肌损伤的保护作用[J]. 皖南医学院学报, 2018, 37(6): 523-526. WEN C L, LIU C H, SUN W W, et al. Protective effect of Lycium ruthenicum Murray anthocyanin extracts on myocardial injury in partial sleep deprived rats[J]. Acta Acad Med Wannan, 2018, 37(6): 523-526. |
| [19] |
ZHAO X N, LIANG J L, CHEN H B, et al. Anti-fatigue and antioxidant activity of the polysaccharides isolated from millettiae speciosae champ. Leguminosae[J]. Nutrients, 2015, 7(10): 8657-8669. DOI:10.3390/nu7105422 |
| [20] |
LIU R, WU L, DU Q, et al. Small molecule oligopeptides isolated from walnut (Juglans regia L.) and their anti-fatigue effects in mice[J]. Molecules, 2018, 24(1): E45. DOI:10.3390/molecules24010045 |
| [21] |
ANAND T, PHANI KUMAR G, PANDAREESH M D, et al. Effect of bacoside extract from Bacopa monniera on physical fatigue induced by forced swimming[J]. Phytother Res, 2012, 26(4): 587-593. DOI:10.1002/ptr.3611 |
| [22] |
BOOTH F W, RUEGSEGGER G N, TOEDEBUSCH R G, et al. Endurance exercise and the regulation of skeletal muscle metabolism[J]. Prog Mol Biol Transl Sci, 2015, 135: 129-151. DOI:10.1016/bs.pmbts.2015.07.016 |
| [23] |
DAVIS J M, MURPHY E A, CARMICHAEL M D, et al. Quercetin increases brain and muscle mitochondrial biogenesis and exercise tolerance[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 296(4): R1071-R1077. DOI:10.1152/ajpregu.90925.2008 |
| [24] |
SCARPULLA R C, VEGA R B, KELLY D P. Transcriptional integration of mitochondrial biogenesis[J]. Trends Endocrinol Metab, 2012, 23(9): 459-466. DOI:10.1016/j.tem.2012.06.006 |
| [25] |
MARCINKO K, STEINBERG G R. The role of AMPK in controlling metabolism and mitochondrial biogenesis during exercise[J]. Exp Physiol, 2014, 99(12): 1581-1585. DOI:10.1113/expphysiol.2014.082255 |
| [26] |
CANTÓ C, AUWERX J. PGC-1α, SIRT1 and AMPK, an energy sensing network that controls energy expenditure[J]. Curr Opin Lipidol, 2009, 20(2): 98-105. DOI:10.1097/mol.0b013e328328d0a4 |
| [27] |
WEI W, LI Z P, ZHU T, et al. Anti-fatigue effects of the unique polysaccharide marker of Dendrobium officinale on BALB/c mice[J]. Molecules, 2017, 22(1): E155. DOI:10.3390/molecules22010155 |
| [28] |
CHEN J H, WANG X F, CAI Y Q, et al. Bioactivity-guided fractionation of physical fatigue-attenuating components from Rubus parvifolius L[J]. Molecules, 2013, 18(9): 11624-11638. DOI:10.3390/molecules180911624 |



